Method Article
新しい治療戦略を開発するための膵臓癌幹細胞特性を研究
要約
Pancreatic cancer stem cells (CSCs) can be expanded in vitro using the anchorage-independent sphere culture technique, which represents a powerful tool to study CSC biology and can serve as the first step to develop novel CSC-targeting therapies. Here the methodology for expanding, analyzing and targeting of pancreatic CSCs is provided.
要約
膵管腺癌(PDAC)は、放射性および化学療法に対する腫瘍の開始、転移および抵抗を駆動することが示されている排他的に腫瘍形成性癌幹細胞(CSCを)のサブセットが含まれています。ここでは、足場非依存性の条件で腫瘍球のような主要なヒト膵臓のCSCを培養するための具体的な方法論を説明します。細胞は、それらのより分化した子孫が生存し、単一の細胞の播種以下の初期段階の間に増殖しないながらのCSCを濃縮するために、無血清、非付着条件下で増殖させます。このアッセイは、腫瘍細胞の集団に存在するのCSCの割合を推定することができます。 (35から250マイクロメートルの範囲とすることができる)サイズと形成された腫瘍球の数の両方が培養された癌細胞または新たに採取し、消化された腫瘍1,2のバルク集団のいずれかに抱いCSC活動を表します。このアッセイを使用して、我々は最近、メトホルミンが選択pancreatを切除することがわかりましたICのCSC;その後、さらに多能性関連遺伝子/表面マーカーの発現が減少を示すことによって裏付けとメトホルミンで処理した細胞の生体内腫瘍形成性に減少した発見。前臨床開発のための最後のステップとして、我々は、メトホルミンとの確立した腫瘍を有するマウスを処置し、大幅に生存期間の延長を発見しました。 PDACを有する患者において、メトホルミンの使用をテストする臨床試験が現在進行中である( 例えば、NCT01210911、NCT01167738、およびNCT01488552)。機構的に、我々は、メトホルミンは、反応性酸素種(ROS)の産生を増強し、ミトコンドリアの膜電位を低下させることによってのCSCにおける致命的なエネルギー危機を誘発することがわかりました。対照的に、非のCSCは、メトホルミン治療によって排除ではなく、可逆的な細胞周期の停止を受けていませんでした。したがって、我々の研究は、潜在的にCSCを標的とする化合物を同定するためのスクリーニングツールとしてインビトロ球形成の可能性のための成功例として機能しますsが、この技術は、偽発見を排除するために、in vitroおよびin vivoの検証にさらに必要となります。
概要
膵管腺癌(PDAC)は最も積極的な固形腫瘍の一つです。これは、現在西洋社会における4 番目の最も一般的な癌関連死であると(〜全世界で年間40万人が死亡)、次の10年以内に2 番目の最も多い原因に存在する患者の診断、90%の3 .AT時間を増加すると予測されています5%未満の5年生存率を有する進行性疾患を有します。この生存率はがっかりするほど、ますます集中的な研究活動にもかかわらず、4、過去50年間で変化していません。外科的切除を介して潜在的に「硬化性」病を有する患者の残りの10%のうち、80%は5年以内に再発から死亡します。長年の間、進行した疾患のためのケアの標準は、ゲムシタビン単独療法となっているが、これはわずかしか生存優位5を付与する。添加することによって達成されている短期生存率の小さな改善エルロチニブ6またはカペシタビン7の、しかし生存利益は、全生存期間の中央値はまだ〜6ヶ月に数週間程度です。最近では、より多くの有望な結果は、ゲムシタビン/ NAB -パクリタキセル8とFOLFIRINOXの組み合わせ政権9,10のために浮上しています。これらの治療はそれぞれ控えめ2と4ヶ月の生存期間中央値は改善されますが、非常に毒性と長期生存者はまだまれな例外されています。治療は改善の可能性を提供していますが、これらは多くの患者が応答のみ、全体的な生存率の漸進的な改善を示していないために有毒な制度です。その結果、現在の治療法を補完すると、新規な、最も可能性の高いマルチモーダル治療アプローチを開発することが急務です。
腫瘍の不均一性
これは、癌の不均一のみの異なる進化のサブクローンのwithiに限定されないことがますます明らかになってきていますnは各腫瘍11だけでなく、各サブクローン12内の表現型および機能的不均一性および可塑性によって駆動されます。いわゆる癌幹細胞(CSCの)または腫瘍促進細胞はクローン内の異質13-16を担当しています。具体的には、CSCが、彼 らはそれぞれの癌サブクローン17内のすべての分化子孫を生じさせることにより、疾患のルートを表していることを、私たちと他の人が単一のセルに至るまで、決定的な証拠を提供しているために、癌細胞のサブセットを表します。さらに重要なことは、これらの細胞が転移挙動のために不可欠であり、またしても初期の腫瘍退縮( 例えば、NAB -パクリタキセル)15,18-20を誘導することができる、比較的効果的な薬で、治療後の疾患再発のための重要な供給源を表します。これは、CSCを、必ずしも善意の幹細胞を表すものではありません、また、彼らは多くの場合、組織幹細胞から生じるないことに留意することが重要であるが、むしろ彼らが持っているACQ幹細胞の特定の機能をuired。これらのほとんどは、機能的に定義されている、例えばCSCが無期限の自己再生能力は、従来の化学療法にそれらを耐性作りを装備し、転移活性を促進増加侵襲性を示しています。
機能性がん幹細胞の表現型
のCSCの機能的表現型を、それぞれシリアル球形成及びコロニー形成アッセイを用いてインビトロで試験することができる自己再生する能力に基づいています。さらに重要なこと、好ましくは排他的な長期的な腫瘍形成性を示す連続移植の際に、究極の機能読み出しとしてin vivoアッセイ希釈を制限することによってテストすることができ、インビボ腫瘍形成能で自己再生クマが可能なのCSC。また、CSCの区画内の不均一性がないだけで、その転移を生じる排他的な能力を有するのCSCの異なる亜集団であり、インビボ腫瘍形成能での排他の直接の結果。実際、metastastiticのCSCは、原発腫瘍を回避アノイキスを生き残るためには、最終的に移行してセカンダリサイトをシードする能力を獲得します。これらの高度な機能的能力を改変浸潤アッセイを用いてインビトロで試験し、 インビボでの転移アッセイを使用することができます。
癌幹細胞を標的
CSC-ターゲティング戦略21と組み合わせない限り、私たちと他の人は治療があっても、間質ターゲティング剤と組み合わせて、分化したPDAC細胞のバルク腫瘍に焦点を当てていることを説得力のある証拠を提供した、腫瘍の進行およびその後の結果に大きな影響を持っていません、 22。このように、疾患の進行および治療 に対する抵抗のCSCをの重要な機能に基づいて、これらの細胞は、任意の新たな治療法18,20のための必須の成分を意味する必要がありますが、Oはるかに十分な理解が必要になりますのCSCの調節機構F。 CSCおよびそれらのより分化した子孫が遺伝的変化に対して同一の遺伝的基底状態を負担するが、CSCが明確なので、後成的に決定された遺伝子発現は、多能性幹細胞とその共有モジュールをプロファイル示します。生成誘導多能性幹細胞(Nanogの、のOct3 / 4、Klf4の、Sox2の)に関与する遺伝子の大部分は、癌に関連していないが、その発現はほとんどのCSCの区画に制限されています。また、CSCををターゲットにするための遺伝子ツールを使用して、機能喪失実験によるのCSCの機能的関連性は今しっかりと、いくつかの癌タイプ23-25 用CSCの概念を確立しています。これらのアプローチの多くはマウスモデルに基づいて容易にクリニックに譲渡されていないが、それらは、バルク腫瘍細胞との組み合わせでのCSCを標的とする潜在的な臨床的関連のための概念実証を提供しません。
VIにがん幹細胞の研究彼らのアキレス腱を識別するために、TRO
のCSCを標的とする新規かつ臨床的に適用可能な方法を識別するために、それらの特徴は、定期的に、インビトロで研究され、球体形成が広く、この文脈で使用されます。もともと自己再生および分化能を含む正常な幹細胞生物学を研究するために開発され、このアッセイは後にin vitroでのCSCを研究するために適合され、PDAC 20から単離したCSCを調査するために使用されています。したがって、我々は、彼らが善意の膵臓のCSC 21を含んで示す、一次ヒトPDAC細胞から形成された腫瘍球がのCSCのすべての明確な特徴を負担することを見出しました。したがって、腫瘍球アッセイは、 インビトロでより効果的な治療法をスクリーニングするための強力なツールを表すが、結果は、in vivoアッセイにおいて 、より厳格に評価する必要があります。実際、このin vitroアッセイで生成されたデータは、目として大きな慎重に扱われるべきですEアッセイは、大きな誤差を受けることができます。形成された球体の自動化された計数を含む高度に標準化されたプロトコルは、再現性と予測データを確実にするために確立されるべきです。
この文脈において、我々は最近、初代ヒトのPDACの多様なセットから誘導される膵臓のCSCをスクリーニングするために、このアッセイを使用し、これらの細胞は抗糖尿病化合物のメトホルミンによる代謝再プログラミングに対して非常に脆弱であることを示しました。以前は、メトホルミンがAMP活性化プロテインキナーゼ(AMPK)シグナリングおよび還元タンパク質合成および細胞増殖の27が得られたmTOR 26のその後の阻害の間接的な活性化による癌細胞の増殖を阻害することが実証されました。バルク腫瘍集団に対するこれらの効果に加えて、その他はメトホルミンを標的とし、実際、乳癌、食道癌、膠芽細胞腫及び膵臓癌28-31 <として固形腫瘍の数のCSCの亜集団を排除することができることを発見しました/ SUP>。このように、メトホルミンは、現在満たされていない医療ニーズを持ついくつかの癌のための有望な、安全な新しい治療戦略を表しています。また、CSCを濃縮するために方法として、球体の形成を使用して、我々は、膵臓のCSCのメトホルミンの主な効果はAMPK活性化とは無関係に、ほとんど明らかにサブセットに対して致死であった、(複合体Iの阻害を介して)、そのささやかなミトコンドリア毒性に依存していたことを示しましたのCSCだけ。後者のために、我々は、細胞レベルでの薬物の毒性の指標としてそれらの細胞の酸素消費量とミトコンドリアROS産生を評価することができました。続いて、これらのインビトロのデータは、前臨床マウスモデルにおいて検証し、実際に大幅に生存期間の延長31をもたらした可能性があります。本明細書に提示する方法は、CSC代謝に及ぼす影響についての研究を含めたCSCのための薬剤感受性プロファイルの迅速な生成を可能にします。現在、利用コムについて拡張実験の詳細を提供しますin vitroおよびin vivoの手順で plementary。
プロトコル
ヒトPDAC腫瘍は書面によるインフォームドコンセント(コムニダードマドリード、スペイン(CP CNIO-CTC-11で得られた - 。CI 103分の11-E)免疫不全マウスへのヒト膵臓腫瘍の移植は、施設内倫理委員会の承認を必要とするだけでなく、制度動物実験委員会(IACUC)異種移植膵腫瘍マウスモデルの手順は、制度や国の規制(インスティテュート·デ·サルド山カルロス3世のここに倫理委員会、マドリード、スペイン、プロトコルPA 34_2012)に従って実施されなければなりません。
1.文化メディア
- 完全培地を準備します。
- 10%FBS、100単位/ mlのペニシリン/ストレプトマイシンを含むRPMI培地を補充します。 RPMI 500mlのための熱不活性化FBSおよびペニシリン/ストレプトマイシンの6ミリリットル(10,000 U / mlで、100X)の55ミリリットルを追加します。
- 4℃での完全培地を格納します。
- CSCはミディアムを準備します。
- 無血清DMEM / F12のmediuを補います100単位/ mlのペニシリン/ストレプトマイシンおよび2mMのグルタミンとM。
- 4℃でCSC媒体に保管してください。 B27(1:50)および20 ng / mlのbFGFを新たに各実験の前に培地に添加されます。
注:B27の添加は、腫瘍球形成を増加させ、球培養物32のいくつかの通路を維持することが示されています。培地組成は重要なステップであり、培養物中の各細胞型について試験されなければなりません。我々は、球体の自己再生および分化能力をテストし、フローサイトメトリー( すなわち、CD133 +及びCD44 +)でCSCマーカーの発現を分析するお勧めします。
- 細胞外フラックスアッセイ培地を準備します。
- この特定の培地は、ビタミン、アミノ酸および他のサプリメントを含むが、グルタミン、グルコース、ピルビン酸および重炭酸塩を欠く基礎DMEM 5030です。
- 現在のアッセイのために、完全なミトコンドリアの代謝活性に2 mMグルタミン、8 mMグルコースおよび2mMピルビン酸ナトリウムを含む培地を補います。
注:重炭酸ナトリウムの不在は重炭酸塩を含む定期的な培地は、アッセイ中のpHの変動を緩衝するので、正確に、培養物中で増殖する細胞の細胞外酸性化を測定するために不可欠です。さらに、基礎培地の使用は、異なるアッセイ条件および/またはアプリケーションに必要なグルコースまたはピルビン酸ナトリウム(Lアラニル - グルタミンのような)、L-グルタミンの濃度の厳密な制御を可能にします。
2.球をアッセイおよび分析を形成します
注:すべての組織培養プロトコルおよび操作は、クリーン、界面活性剤を含まない、無菌のガラス器具を使用して、大きな注意を払って、滅菌技術を使用して実行する必要があります。 37℃のウォーターバスで使用する前に、事前に暖かいすべての培地および溶液(代替として、あなたはメディアやソリューション室温で予め温めを使用することができます)。以前に21を詳述したようにヒトPDAC腫瘍を入手します。
- ヒトPDACからのCSCの単離( 図1)
- 無菌のバイオセーフティキャビネット内で無菌1Xリン酸緩衝生理食塩水(PBS)1 mlを含む60×15ミリメートル培養皿にヒトのPDAC組織を移します。滅菌メスとピンセットを用いて - (5ミリ1)小片に腫瘍をみじん切り。
- 培養皿に滅菌1X PBSを1mlを追加し、組織が完全に解離されるまで、摩砕工程を繰り返し、定期的にこれは3-4ラウンドを必要とします。滅菌チューブに(上1×PBSで5 mlの最終容量まで)組織懸濁液を移し、機械的にgentleMACSとして解離とそれを均質化します。
- 37℃で60分間、コラゲナーゼでホモジナイズした組織を(1×PBS中のコラゲナーゼの2.5 mg / mlのを使用)インキュベートした後、900 X gで5分間遠心します。上清を除去し、完全培地10mlに細胞ペレットを再懸濁します。 900×gで5分間、40ミクロンストレーナと遠心を介して細胞懸濁液をフィルタリングします。
- 上清を除去し、再懸濁赤血球溶解緩衝液(塩化アンモニウム - カリウム、ACK)5mlでペレット化し、インキュベート
- ゼラチンコートディッシュ上のCSC培地、プレート内のペレットを再懸濁し、37℃で1時間インキュベートします。このステップは、すぐにプレートに付着線維芽細胞の大部分を除去します。
- インキュベーターからプレートを取り外し、慎重に細胞懸濁液を回収し、血球計数器を用いて(トリパンブルー陰性)生存細胞の数を定量化します。この目的のために、静かにエッペンドルフチューブにサスペンションのサスペンションやピペット20μLを混合します。マイクロ遠心チューブ中の細胞にトリパンブルーの:(1比1)とよく混ぜ20μlのを追加します。ピペット血球計数器への混合物の約10μlの。
- 生菌数のための計数室の四隅の象限内のすべての明確な細胞を数えます。注:細胞の生存率および収率は腫瘍標本の間で大幅に変化してもよいです。 PDACのための試料の生存率は、定期的にbetweの範囲45から70まで%エン、および3の直径を有する巨視的な腫瘍試料からの組織片- 5ミリ、約5×10 6生細胞に生じるはずです。
- 球形成アッセイおよびメトホルミン治療
- 細胞の必要な数を取り、2,000細胞/ mlの細胞濃度を調製するためのCSC媒体の適切な量を加えます。もう1時間以上氷上で細胞懸濁液を保持せず、めっき前に十分に混合しないでください。
- 培地の蒸発を最小限にするために加湿用の24ウェルプレートの最初と最後の行に1×PBSを500μlを追加します。腫瘍球培地1ml(2,000細胞/ ml)中でウェルあたり2,000細胞の密度で超低付着細胞プレートに細胞をシード。
注:腫瘍球形成アッセイのために使用される細胞の数は、腫瘍タイプの間で変化してもよいです。 - 車両(陰性対照)とそれぞれに割り当てられた処理を施した4ウェル、メトホルミンの例えば 、3 mMの、少なくとも4つのウェルを処理します。 PL37℃に設定したインキュベーター中で細胞をエースと一週間、5%CO 2で細胞を供給する。
注:培地は、腫瘍球の乱されない形成を可能にするために変更されるべきではないが、それらは培養培地中で安定でないように日常的に増殖因子を補充することができます。 - 一日おきに、 例えば 、処理を追加します。、メトホルミンまたは車両の3 mMのを各ウェルに。より大きな構造( 図2)の計数を可能にする自動細胞カウンターを使用して5および/ または7日後に形成された腫瘍球の数を評価します。
注:少なくとも40ミクロンを有する唯一の腫瘍球が考慮されるべきであり、小型のように分類することができ、それぞれ、 - - (120ミクロン80)(40〜80ミクロン)または大。結果は、播種した細胞の最初の数( 例えば、2,000細胞)で割った腫瘍球の割合として示すことができます。
- 第一世代の腫瘍球の連続継代
- インキュベーションの7日後に40μmのセルストレーナーを用いて腫瘍球を採取し、室温で900×gで5分間、それらを遠心します。
- トリプシンを用いて、単一の細胞に腫瘍球のペレットを分離し、その後上記のように、他の7日(2.2参照)のために再度得られた単一細胞の細胞懸濁液を展開します。
3.代謝分析(ROS生産と酸素消費量)
- ROS生産
- このプロトコルでは、我々はそれがROSを検出するための、手頃な価格、迅速かつ広範に使用されるプローブであるため、ROS産生を測定するための一例として、カルボキシDCFDAを使用しています。しかし、このアッセイのために使用することができるいくつかの他のプローブおよび方法があります。
- 時間の割当量を2.2に記載されているようにメトホルミンと腫瘍球を扱います。処置の終わりに、40μmの細胞ストレーナーを用いて収穫腫瘍球を、5分間、900×gで細胞を遠心分離し、tryps 1ml中にペレットを再懸濁しますである。37℃で20分間インキュベートします。
- 細胞が単数化されると、900×gで遠心分離し、2.5μMカルボキシDCFDAを含むHBSSで細胞を再懸濁します。暗所で37℃で20分間細胞をインキュベートします。
- カルボキシDCFDAは、光酸化偽陽性の結果を与えることができるようにフローサイトメトリー分析の前に、光から染色された細胞を保護します。分析まで氷上にチューブを置きます。
注:カルボキシDCFDAは、FL1(。。例:488nmの、EM 520nmの)で検出される活性酸素と窒素種の様々な、と反応させた後の蛍光です。
- 酸素消費量測定
- このプロトコルのために、我々は、一例として、タツノオトシゴBiosciences社から細胞外フラックスアナライザーシステムを使用します。コートRTで20分間、細胞および組織接着剤の22.4 / mlの溶液と所望の細胞培養プレート。細胞を播種する前に3回 - 水で2井戸を洗浄します。
- 処置の終了時に、収穫腫瘍球は4を使用して0ミクロンセルストレーナー、遠心分離機5分間900×gで細胞およびトリプシン1mlのペレットを再懸濁します。 37℃で20分間インキュベートします。
- (:150μlの最終体積)プレート/ウェルを96ウェルプレートに30,000細胞の密度で細胞培養プレート中で細胞を単数化。 8 mMグルコースおよび2mMのピルビン酸ナトリウムを含有する酸素消費アッセイ培地で細胞を再懸濁します。
- 100 XGに達するまで井戸のスピン遠心分離によりウェルの底に細胞を遠心分離した後、ブレーキをオフにして遠心分離を停止させて。プレートの向きを逆にして、プロセスを繰り返します。 30分間CO 2を添加せずに37℃のインキュベーターにプレートを転送します。
- 一方で、分析用のカートリッジを準備します。各ウェルをロードする4つの異なるインジェクタ(25μL/ポート)があります。
- ポートA:メトホルミン。ウェルに3 mMの最終濃度を得、最終容積として8X溶液(24ミリモル)を調製するには、175になりますμlのポートAの注射後
- ポートB:メトホルミン。 3 mMのを追加し、ウェル中の6mmの最終濃度を得るためには、ポートBの注射後に200μlになる最終体積として9xの溶液(27 mm)を用意
- ポートC:メトホルミン。 3 mMのを追加し、よくさ9mmの最終濃度を得るためには、ポートCの注射後225μLになり、最終体積として10倍の溶液(30 mm)を用意
- ポートD:ロテノン11μM、ウェル(11X)に最終濃度として1μMを得ました。注:ロテノンは完全に任意の残留ミトコンドリア活性を阻害します。
- カートリッジをキャリブレーションし、細胞培養プレートをロードします。混合および測定の標準プロトコルでアッセイを行います。
- (100%に設定)ロテノンで得られた阻害のパーセンテージとしてメトホルミンによって達成総ミトコンドリア呼吸の阻害の割合を計算します。
4。免疫不全マウスにおけるヒト膵臓癌のための異種移植モデル
注:オーダーの実験33のためのそのようなNOD-SCID、SCIDベージュ、またはNSGなどの雌の無胸腺ヌードマウスまたは他の、より多くの免疫不全マウスモデルの十分な数。実験前に、すべての手術器具をオートクレーブし、それらを使用する前に室温まで冷却します。皮下腫瘍のために我々は8腫瘍の合計脇腹あたり1腫瘍で条件当たり4匹のマウスの最小値を使用していました。
- 異種移植移植
- ヒト膵臓癌組織標本からの腫瘍片を準備します。ペトリ皿に腫瘍を移し、組織を保持するためにメスや鉗子を使用して小片(直径2mm、〜8ミリメートル3)に組織を解剖。氷上に保持しゲル状のタンパク質混合物の溶液中に得られたピースを浸し。
- 3%のイソフルランまたは他の吸入または注射麻酔薬 - 1を使用して、マウスを麻酔。
注:任意の外科PROCを開始する前にedureは、マウスが完全にトゲの鉗子で腹部の皮膚やトウを刺激することによって、意識を失っていることを確認してください。乾燥を防ぐために、眼軟膏を適用します。 - 麻酔が反映された後、消毒エタノール含有の皮膚を用いたマウスの背中を拭いてください。術後鎮痛を確保するために手術前にブプレノルフィン(0.05ミリグラム/ kg体重)を管理します。
- 0.7にし、鉗子で背部皮膚を持ち上げる-無菌マイクロハサミで1.0センチの切開をした後、露骨患者由来の膵臓癌組織片が挿入されている小さな皮下ポケット、(〜8ミリメートル3)を作製。
- 2スキンステープル - 1を使用して傷を閉じます。 7日後にそれらを削除します。ケージにマウスを返し、彼らは再び完全にアクティブになるまで加熱パッド上又は加熱ランプの下でそれらを保ちます。
- 腫瘍移植後、少なくとも週二回、腫瘍の成長や、フリル毛皮、huncheとして生じる病的状態の一般的な兆候がマウスを監視D姿勢、および不動。
- 腫瘍が200mm 3の平均サイズに達したら、マウスを、それぞれの治療に無作為化されます。腹腔内注射(150 / kg体重)を介して、または同等の治療効果の飲料水(150ミリグラム/ kg体重)を介して、毎日車またはメトホルミンを投与します。
- キャリパーを用いて腫瘍負荷を監視し、腫瘍体積を計算週に一度(腫瘍体積の測定幅×ブレス×= 1/2の長さ)。
- 腫瘍が直径1cmに達しているか、上記で指定されたマウスは、激しい痛みや病気の兆候を示し始めるとマウスを生け贄に捧げます。
結果
メトホルミンは、選択的に膵臓のCSCを対象
我々は最初のCSC の in vitroでの自己再生能力にメトホルミン治療の機能的効果を調べました。この目的のために、我々は、手術中に切除PDAC組織から単離された初代ヒト膵臓癌細胞を使用して球体形成アッセイを行いました。我々は、メトホルミンが強く形成された球体( 図1A)の大きさを減少させたことを観察しました。これは、彼らだけのCSCのために濃縮されているように、まだ球で見つかった細胞の大部分を表すCSCの子孫の拡大を阻害することにより、最も可能性が高いとしました。実際、長い球になりますより分化子孫のより広範な展開を継代することなく培養されます。したがって、我々は、Cの自己再生能力の強力な阻害を示唆して用量依存的に発生する、かなり実際にそれらのサイズにかかわらず、形成された球の数を減少させるメトホルミンを発見しましたのSC(データは示さず)。私たちは3 mmにメトホルミンを大幅に( 図1B)が形成された球体の数を減少させたことがわかりました。より厳しくのCSCの自己再生能力にメトホルミンの長期的影響を研究するために、我々は、その後、第二級および第三級球状に形成された一次球を継代しました。唯一の主要な球体がメトホルミンで処理したが、第二および第三の通路内の球の形成を大幅にますますメトホルミン治療が実際に不可逆的のCSC( 図1C)の大部分を除去した関与、減少しました。したがって、我々のデータは、一次膵臓のCSCの自己再生能力にメトホルミンのための有意な治療効果を示し、したがって、さらに機械的なだけでなく、in vivoでの研究を行うために私たちを奨励しました。
メトホルミンは、ミトコンドリア酸素消費量を抑制し、ROSの産生を誘導します
metformiので、nは、部分的に複合体Iの活性を阻害することによってミトコンドリア毒として作用することが示された、我々は次の球由来細胞における細胞の酸素消費に対するメトホルミンの急性の効果を調べました。この目的のために、我々は2つの代表的な一次PDAC腫瘍に由来する細胞を選択し、3 mMのメトホルミン(3回の注射)及び1μMのロテノン(一回の注射)の連続注入後の時間の経過とともに酸素消費量を測定しました。 図2Aに示すように、メトホルミンの注入は、異なる腫瘍の間でかなり変化し、酸素消費量の迅速かつ用量依存的な減少を誘発しました。我々は完全にミトコンドリアの酸素消費量を抑制することが可能であるロテノン、私は強力な阻害剤複合体を、注入することによって、メトホルミン治療の際に残存ミトコンドリア活性を算出しました。 POPUの平均値のずれとして定義ROSの産生を誘導する能力と相関して、ミトコンドリア酸素消費の観点からメトホルミンに対する感受性簡単に( 図2B、右パネル)を定量することができるメトホルミン治療( 図2B、左パネル)、後レーション。予想されるように、酸素消費の阻害に最も感受性であった初代細胞はまた、メトホルミン治療時ROS産生の最も強力な増加を示しました。したがって、これらの代謝のin vitro実験は、その後のミトコンドリアROS産生の増加およびアポトーシスの誘導、最終的にその結果、ミトコンドリア機能への依存を阻害することにより、そのメトホルミンターゲットのCSCを示しています。
インビボでのメトホルミン屋台PDACの進行
我々は最終的にPDACと異なる患者由来の組織の異種移植片を用いてインビボでのメトホルミンの効果を検討しました。我々は、対照群と比較して、メトホルミン処置マウスについての腫瘍進行の有意な減少が観察されたが、腫瘍は決して完全にDISAppeared( 図3)。続いて、長期的なフォローアップ時にすべての腫瘍は、最終的には、治療の初期段階を生存細胞のメトホルミン性を示唆して再発しました。それにもかかわらず、メトホルミン治療は、単剤として適用した場合であっても、大幅にすべてのマウスの生存を延長しました。
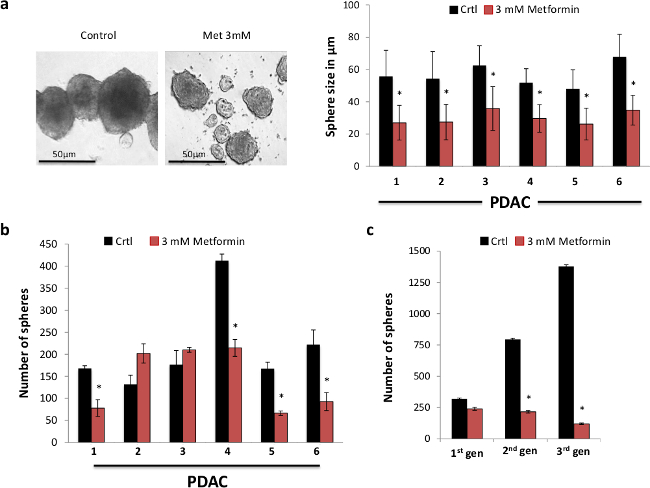
図1.メトホルミンを選択のCSCをターゲットとします。(A)メトホルミンは、球の大きさを減少させました。球体の代表的な画像は、7日(右パネル)のためのメトホルミンの示された用量での治療後に得られました。球の大きさの定量化(n≥6)(左パネル)は、横軸で表示された数字は、個々の腫瘍を表します。 (B)7日(n≥6)のためのメトホルミンの存在下または非存在下で球形成能力、横軸で表示された数字軸は、個々の腫瘍を表します。 (C)一次膵臓癌細胞の第二級および第三級球におけるCSCの自己再生能力の代表的なグラフ。球はわずか7日間の合計のための第一世代の球形成の間に処理した(n = 6)である。 この図の拡大版を表示するには、こちらをクリックしてください。
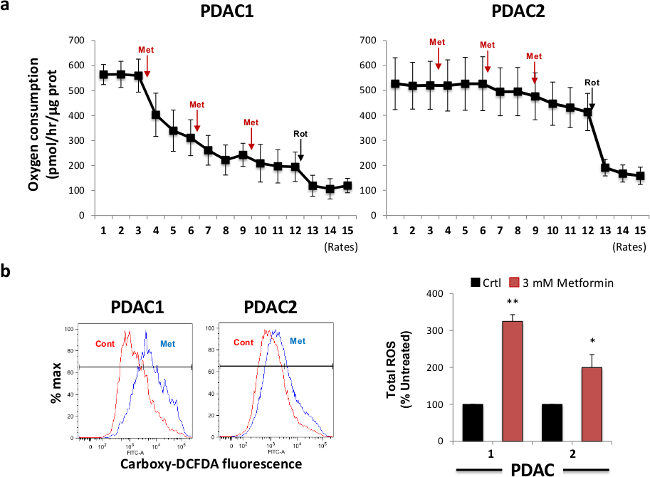
図2.メトホルミン治療阻害の酸素消費量と誘導するROS生産。(A)メトホルミンの添加は、球由来細胞の酸素消費量(OCR)を阻害します。二つの異なるPDAC二球はメトホルミンで処理し、OCRの変化は、細胞外フラックス分析により測定しました。ロテノン注射は総ミトコンドリアOCRの消費のための対照として使用しました。X軸は、各ウェル中のタンパク質含有量によって正規化された酸素/ hrのピコモルでの酸素消費速度を表します。 Aに用いられる(B)PDAC球はメトホルミンで8時間処理し、ROSの産生がカルボキシDCFDAを用いたフローサイトメトリーによって評価しました。左、プロット代表的なフローサイトメトリー。右、3つの独立した実験からのデータの要約。 この図の拡大版を表示するには、こちらをクリックしてください。
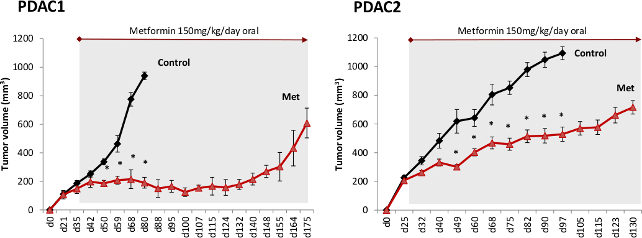
図3. インビボでのメトホルミン屋台PDAC進行が。二つの異なるPDAC異種移植組織を免疫不全マウスに移植した、初期の腫瘍テイクを確認した後に処理を割り当てられました。マウスは、メトホルミン(メット)で処理した飲料水に添加した(150mgの/ kg体重ウェイGHT;一日あたりの水消費量の5ミリリットルに基づく)。 この図の拡大版を表示するには、こちらをクリックしてください。
ディスカッション
多くの腫瘍のためのCSCの概念の出現とその後の検証では、薬剤開発の分野では、より効率的ながん治療法を開発し、その後、疾患の再発のリスクを低減するための可能性を有する、新たな勢いを得ています。しかし、CSCのフィールドは、CSCの起源と伝播し、腫瘍構造を形成および転移を促進する上で自分の役割を理解するという点で達成されるべき初期の状態、よりニーズにとどまっています。
この文脈において、再現性と意味のあるCSCアッセイの使用だけでなく、得られたデータの情報に基づいた解釈は、CSC生物学の我々の理解を進めるための重要なコンポーネントを表します。多くの生物学的観点から、球の形成は非常に貴重なアッセイとして浮上しています。それにもかかわらず、ユーザーが適切に実験結果を解釈するためにその限界を認識する必要があります。でも球フォーマの評価の前に考慮すべき重要な側面るデータは、新鮮な患者由来の試料から得られた結果は、確立された癌細胞株から得られたものとは大きく異なる可能性があるので、調査サンプルの起源です。
古典的な球体形成アッセイは、21超低付着プレートにクローン密度で細胞を播種し、上皮成長因子(EGF)および/ または塩基性線維芽細胞増殖因子(b-FGF)の存在下で、球体形成を評価する富むが、無血清培地含みます34。培地組成物は、考慮すべき重要な課題です。我々の経験では、血清の非存在下でB27、bFGFおよびグルタミンを補充したDMEM / F12は、未分化状態でCSCを、成長拡大し、維持するために最適な媒体であることがわかりました。私たちは、CK(この培養条件(培地、懸濁液)で細胞が(CD133 +、CD44 +およびCD24 +を含む)がん幹細胞マーカーを大量に発現し、分化関連タンパク質を発現しないことがわかりました-20及びCK-19)。
これらのアッセイのための基本的な前提条件の一つは、各球がクローンであることである、 すなわち、1つの球は、単一の幹細胞の増殖に起因します。しかし、球は本質的に低くても播種密度35で融合する傾向があるダイナミックな構造です。細胞をプレーティングすることは、プロトコルにおける重要なステップであり、1つの細胞/ウェルの密度は確かに集約問題を回避することができます。しかし、たとえ前向きソート前駆細胞のために、これは定期的に低い固有の球形成活性に非常に低い球の形成をもたらし、またによる希釈効果に限定されるもので自己分泌刺激に起因します。我々の経験では、播種した細胞の30%のみが球体を形成することができることを観察しました。我々は一貫して再現性のある結果を得るために/よく、少なくとも100個の細胞を使用することをお勧めします。
成長CSCに対する他の培養方法は、Mに基づいて、固体または半固体の3D培養( 例えば、に基づいていますatrigel、コラーゲンまたはメチルセルロース)。これらの方法は、細胞の移動およびその後の細胞の集合36を制限するために使用されてきました。しかし、これらの行列の各々は、独自の制限を有します。例えば、マトリゲルは、エンゲル·ホルム·スワン(EHS)腫瘍から単離された可溶性基底膜であり、抽出物は、多くの組織に見られる複雑な細胞外腫瘍環境に似ているが、それは多くの場合、機械的なレンダリング複数多かれ少なかれ定義された成長因子を含んでいます非常に困難な特定の調節エレメントのための研究。対価のもう一つのポイントは、球形成能力をし、幹細胞の機能が交換可能な用語34ではないということです。特定の幹細胞および前駆細胞は、in vivoでの幹/前駆機能を除外するものではないin vitroでの球を生成するための球形成能37、故障を示すことが示されているが。例えば、静止状態の幹細胞は、単にによって提供外の合図に応答しないことがあります体外培養条件で選択。したがって、 インビトロおよび精製された細胞集団のインビボでの自己再生能力の長期的には、優先的に連続継代中に、幹細胞の機能を証明または反証するために評価されるべきです。この文脈では、前向きと同時に幹細胞および前駆細胞の多様な集団を増殖させる能力は、球体形成アッセイの重要な側面であり、CSCのフィールドのために非常に価値のあるこのアッセイを描画します。限りその限界が得られたデータの解釈の際に留意されます。
球形成アッセイは広く遡及インビトロで単一細胞レベルでの自己再生および分化の能力に基づいて幹細胞を同定するために使用されています。それらのインビボニッチからの幹細胞およびそれらの子孫の将来の分離を可能にするマーカーの発見は精製集団の機能的特性を定義することができます。 C言語球形成アッセイおよびFACSのombinationは、固形組織から細胞を単離または培養中のPDACの特定の亜集団を豊かにするための成功戦略です。元の腫瘍の不均一性を反映し、自己再生、分化し、腫瘍を開始:例えば、EpCAMを、CD24およびCD44の同時発現は、することができるのCSCの亜集団を定義します。ヘルマンら 。 CD133 +細胞は増強増殖能力を保有し、CSCが15を備えていることを示しました。他のマーカーはまた、CSCをの特徴付けのために使用されている:ALDH- 1(アルデヒドデヒドロゲナーゼ-1)の発現が膵臓癌38において非常に腫瘍形成性細胞と関連しています。 DNA色素ヘキスト33342を排除することができる細胞は、名前のサイドポピュレーション(SP)細胞は、腫瘍39を開始することが証明能力を有します。最近、我々は、細胞内の自家蛍光の区画が異なる腫瘍タイプにわたって排他CSC形質を持つヒト細胞の別個の集団を特徴づけることが示されました40。これらのマーカーのいずれも選択のCSCの純粋な集団を特徴づけるために表示されませんが、マーカーのより多くの複雑な組み合わせは、細胞のより洗練された集団を精製し、FACSに使用する必要があります。
多くの質問はまだ正確な起源のCSCの役割、進行、および腫瘍の薬剤耐性について残ります。例えば、単一のCSCは、腫瘍を開始する場合、どのように定義するためにクローン進化の問題に対処するための一つの方法は、疾患の異なる段階で患者の試料を分析し、具体的には、治療中および治療後のCSCを数に従うことである可能性があります。これらの質問に答えることによって、我々は、固形腫瘍内のCSCの我々の知識の意味のある進展を行い、最終的には腫瘍の進行や再発を防止するための薬物療法を開発することができます。
開示事項
著者らは、開示することは一切競合する興味を持っていません。
謝辞
本研究はでサポートされていたERC高度な研究者グラント(PA-CSC 233460)、グラント契約なし256974(EPC-TM-NET)となし602783(CAM-PACの下に欧州共同体のセブンス枠組み計画(FP7 / 2007から2013) )、Subdirección一般デEvaluaciónY Fomento·デ·ラ·Investigación、フォンド·デ·InvestigaciónSANITARIA(PS09 / 02129&PI12 / 02643)、およびPROGRAMAナシオナルデInternacionalización·デ·ラ·I + D、Subprogramma:FCCI 2009(PLE2009-0105; MINISTERIOデEconomíaY Competitividad、スペイン)。 E. Lonardoはロシュフェローシップによってサポートされていました。 M. Cioffiは、ラ·カイシャ博士号を取得する前のフェローシップ·プログラムによってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Counting Chamber/Hemocytometer | Hausser Scientific Co | 3200 | |
| CASY Cell Counter and Analyzer for proliferation and viability measurement | Roche Innovatis | AG CASY Model TTC 45,60,150 μm | |
| GentleMACS Dissociator | Miltenyi Co | 130-093-235 | |
| GentleMACS C Tubes | Miltenyi Co | 130-093-237 | |
| 24-well Ultra-low Attachment Plates | Corning | 3474 | |
| 100-mm tissue culture dishes | BD Falcon | 353803 | |
| Cell strainer | BD Falcon | 352350 | |
| 15-ml polypropylene conical tube | BD Falcon | 352097 | |
| 50-ml polypropylene conical tube | BD Falcon | 352070 | |
| 1.5 ml sterile tubes | Eppendorf | 0030 120.086 | |
| 50 ml centrifuge tubes | Corning | 430828 | |
| Sterile petri dishes, 10 cm dishes | Corning | 353003 | |
| 26 G needles | BD Falcon | 300600 | |
| 100 ul Hamilton Syringe | Hamilton Syringe Co | 81075 | |
| Collagenase type IV | Stem Cell Technologies | 7909 | |
| RPMI Medium 1640 | Life technologies | 11875-085 | |
| Penicillin/Streptomycin solution, 100X | Life technologies | SV30010 | |
| Metformin | Sigma | D150959-5G | |
| L-glutamine, 200 mM, 100X | Life technologies | 25030-081 | |
| D-Glucose | Sigma | G8270 | |
| 100mM Sodium Pyruvate solution | Life technologies | 11360-070 | |
| Seahorse Assay medium | Seahorse Bioscience | 100965-000 | |
| BD Cell-TAK Cell and Tissue adhesive | BD Biosciences | 354240 | |
| Trypsin solution, 0.05% | Life technologies | 25300054 | |
| B27 Supplement 50x | Life technologies | 17504-044 | |
| Basic Fibroblast Growth Factor | Sigma | F0291 | |
| Bovine Serum Albumin | Sigma | A9576 | |
| Dulbecco’s Modified Eagle Medium/F12 | Sigma | D8437 | |
| Sterile 1x Dulbecco’s Phosphate Buffered Saline | Sigma | D8537 | |
| Trypan Blue | Life technologies | 15250-061 | |
| Carboxy-DCFDA(5-(and-6)-Carboxy-2',7'-DichlorofluoresceinDiacetate) | Life technologies | C-369 | |
| Rotenone | Sigma | R8875 | |
| Ethanol 70% (vol/vol) | Sigma | 459844 | |
| Isofluorane | IsoVet, Braun | 571105.8 | |
| Matrigel | BD Biosciences | 35620 | |
| Sterile Cotton tipped applicator | Puritan medical | ||
| XF96e FluxPak with cell plates, calibrant and cartridges | Seahorse Bioscience | 102416-100 | |
| XF96e Extracellular Flux analyzer | Seahorse Bioscience | ||
| Incubator with CO2 input | |||
| Micro scissors | |||
| Curved forceps | |||
| Splinter forceps | |||
| Caliper |
参考文献
- Whipple, C. A., Young, A. L., Korc, M. A KrasG12D-driven genetic mouse model of pancreatic cancer requires glypican-1 for efficient proliferation and angiogenesis. Oncogene. 31 (20), 2535-2544 (2012).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4 (11), 1649-1652 (2009).
- Rahib, L., et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res. 74 (11), 2913-2921 (2014).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics. CA Cancer J Clin. 62 (1), 10-29 (2012).
- Burris, H. A., et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 15 (6), 2403-2413 (1997).
- Moore, M. J., et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol. 25 (15), 1960-1966 (2007).
- Cunningham, D., et al. Phase III randomized comparison of gemcitabine versus gemcitabine plus capecitabine in patients with advanced pancreatic cancer. J Clin Oncol. 27 (33), 5513-5518 (2009).
- Von Hoff, D. D., et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 369 (18), 1691-1703 (2013).
- Conroy, T., et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 364 (19), 1817-1825 (2011).
- Gourgou-Bourgade, S., et al. Impact of FOLFIRINOX compared with gemcitabine on quality of life in patients with metastatic pancreatic cancer: results from the PRODIGE 4/ACCORD 11 randomized trial. J Clin Oncol. 31 (1), 23-29 (2013).
- Yachida, S., et al. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature. 467 (7319), 1114-1117 (2010).
- Garcia-Silva, S., Frias-Aldeguer, J., Heeschen, C. Stem cells & pancreatic cancer. Pancreatology. 13 (2), 110-113 (2013).
- Hermann, P. C., Mueller, M. T., Heeschen, C. Pancreatic cancer stem cells--insights and perspectives. Expert Opin Biol Ther. 9 (10), 1271-1278 (2009).
- Hermann, P. C., Huber, S. L., Heeschen, C. Metastatic cancer stem cells: a new target for anti-cancer therapy. Cell Cycle. 7 (2), 188-193 (2008).
- Hermann, P. C., et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 1 (3), 313-323 (2007).
- Li, C., et al. Identification of pancreatic cancer stem cells. Cancer Res. 67 (3), 1030-1037 (2007).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell Stem Cell. 14 (3), 275-291 (2014).
- Gallmeier, E., et al. Inhibition of ataxia telangiectasia- and Rad3-related function abrogates the in vitro and in vivo tumorigenicity of human colon cancer cells through depletion of the CD133(+) tumor-initiating cell fraction. Stem Cells. 29 (3), 418-429 (2011).
- Hermann, P. C., Bhaskar, S., Cioffi, M., Heeschen, C. Cancer stem cells in solid tumors. Semin Cancer Biol. 20 (2), 77-84 (2010).
- Mueller, M. T., et al. Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer. Gastroenterology. 137 (3), 1102-1113 (2009).
- Lonardo, E., et al. Nodal/Activin signaling drives self-renewal and tumorigenicity of pancreatic cancer stem cells and provides a target for combined drug therapy. Cell Stem Cell. 9 (5), 433-446 (2011).
- Li, C., et al. c-Met is a marker of pancreatic cancer stem cells and therapeutic target. Gastroenterology. 141 (6), 2218-2227 (2011).
- Chen, J., et al. A restricted cell population propagates glioblastoma growth after chemotherapy. Nature. 488 (7412), 522-526 (2012).
- Schepers, A. G., et al. Lineage tracing reveals Lgr5+ stem cell activity in mouse intestinal adenomas. Science. 337 (6095), 730-735 (2012).
- Driessens, G., Beck, B., Caauwe, A., Simons, B. D., Blanpain, C. Defining the mode of tumour growth by clonal analysis. Nature. 488 (7412), 527-530 (2012).
- Shaw, R. J., et al. The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin. Science. 310 (5754), 1642-1646 (2005).
- Martin-Castillo, B., Vazquez-Martin, A., Oliveras-Ferraros, C., Menendez, J. A. Metformin and cancer: doses, mechanisms and the dandelion and hormetic phenomena. Cell Cycle. 9 (6), 1057-1064 (2010).
- Honjo, S., et al. Metformin sensitizes chemotherapy by targeting cancer stem cells and the mTOR pathway in esophageal cancer. Int J Oncol. 45 (2), 567-574 (2014).
- Wurth, R., et al. Metformin selectively affects human glioblastoma tumor-initiating cell viability: A role for metformin-induced inhibition of Akt. Cell Cycle. 12 (1), 145-156 (2013).
- Cufi, S., et al. Metformin-induced preferential killing of breast cancer initiating CD44+CD24-/low cells is sufficient to overcome primary resistance to trastuzumab in HER2+ human breast cancer xenografts. Oncotarget. 3 (4), 395-398 (2012).
- Lonardo, E., et al. Metformin targets the metabolic achilles heel of human pancreatic cancer stem cells. PLoS One. 8 (10), e76518 (2013).
- Gu, Y., et al. The effect of B27 supplement on promoting in vitro propagation of Her2/neu-transformed mammary tumorspheres. J Biotech Res. 3, 7-11 (2011).
- Ishizawa, K., et al. Tumor-initiating cells are rare in many human tumors. Cell Stem Cell. 7 (3), 279-282 (2010).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat Methods. 3 (10), 801-806 (2006).
- Lawson, D. A., Xin, L., Lukacs, R. U., Cheng, D., Witte, O. N. Isolation and functional characterization of murine prostate stem cells. Proc Natl Acad Sci U S A. 104 (1), 181-186 (2007).
- Seaberg, R. M., van der Kooy, D. Adult rodent neurogenic regions: the ventricular subependyma contains neural stem cells, but the dentate gyrus contains restricted progenitors. J Neurosci. 22 (5), 1784-1793 (2002).
- Jimeno, A., et al. A direct pancreatic cancer xenograft model as a platform for cancer stem cell therapeutic development. Mol Cancer Ther. 8 (2), 310-314 (2009).
- Hirschmann-Jax, C., et al. A distinct 'side population' of cells with high drug efflux capacity in human tumor cells. Proc Natl Acad Sci U S A. 101 (39), 14228-14233 (2004).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nat Methods. 11 (11), 1161-1169 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved