Method Article
研究胰腺癌干细胞特性开发新的治疗策略
摘要
Pancreatic cancer stem cells (CSCs) can be expanded in vitro using the anchorage-independent sphere culture technique, which represents a powerful tool to study CSC biology and can serve as the first step to develop novel CSC-targeting therapies. Here the methodology for expanding, analyzing and targeting of pancreatic CSCs is provided.
摘要
胰腺导管腺癌(PDAC)包含专致瘤性癌干细胞(CSCs的),它已显示出以驱动肿瘤发生,转移,抗放射和化疗的一个子集。在这里,我们描述了在锚地独立条件下培养初级人类胰腺肿瘤干细胞作为肿瘤领域的具体方法。细胞生长在无血清,非粘附条件,以富集肿瘤干细胞,而他们的更加分化的子代不能存活,并在下面的单个细胞接种初始阶段增殖。该测定可用于估计存在于肿瘤细胞群的CSCs的百分比。两者大小的形成肿瘤球(其范围可以从35至250微米)和数字代表窝藏在任一散装培养癌细胞的细胞群体或新鲜收获的和消化的肿瘤1,2- CSC活性。使用这种方法,我们最近发现,二甲双胍选择性烧蚀pancreatIC CSCs的;这一发现随后进一步通过展示的多能性相关基因/表面标记物的减少的表达的证实,并减少在二甲双胍处理的细胞的体内致肿瘤性。至于临床前开发的最后一步,我们处理的小鼠轴承已建立的肿瘤与二甲双胍和发现显著延长生存期。临床研究与PDAC测试使用二甲双胍的患者目前正在( 例如,NCT01210911,NCT01167738和NCT01488552)。机理上,我们发现,二甲双胍通过提高活性氧(ROS)生产和减少线粒体跨膜电位诱导的CSCs一个致命的能源危机。与此相反,非肿瘤干细胞不是由二甲双胍治疗消除,而是经历可逆的细胞周期停滞。因此,我们的研究作为一个成功的例子体外球形成作为筛选工具的潜力,以确定潜在目标CSC化合物S,但这种技术将进一步需要在体外和体内验证,以消除错误的发现。
引言
胰腺导管腺癌(PDAC)是最积极的实体瘤中的一个。这是目前第 4最常见的癌症相关死亡在西方社会,并预计将上升到第二最常见的原因在未来十年内(每〜世界范围内达到40人死亡)3 .AT时间的诊断90%的患者存在晚期疾病,其中有一个5年生存率小于5%。该存活率仍然令人失望,在过去的50年不变,尽管越来越多地密集调研活动4。的谁具有潜在的"可固化的"疾病通过手术切除的患者的剩余的10%的,80%将死于复发5年内。多年照顾为晚期疾病的标准已经吉西他滨单一治疗,但是这仅赋予边际生存优势5。在短期存活小改进已通过加入取得6厄洛替尼或卡培他滨7,然而生存的好处是在周中位总生存期仍〜6个月的订单。近日,更令人鼓舞的成果已经出现吉西他滨/ NAB -紫杉醇8和FOLFIRINOX组合政权9,10。这些疗法改善位生存微升2 4个月分别,但具有很强的毒性和长期存活者仍然是一个罕见的例外。虽然治疗提供了潜在的改善,这些都是有毒的政权,许多患者不响应或者只显示总生存期逐步改善。因此,目前迫切需要补充当前疗法和开发新的,最有可能的多峰的治疗方法。
肿瘤的异质
现在越来越明显的是,癌症的异质性不仅限于不同的进化亚克隆within分别肿瘤11,而且每个亚克隆12内驱动表型和功能的异质性和可塑性。所谓癌症干细胞(CSCs的)或肿瘤促进细胞负责intraclonal异质13-16。具体地讲,CSCs的代表癌细胞的一个子集,为此我们和其他人已经提供的确证,下至单个细胞,它们代表疾病的根由每个癌症亚克隆17内引起所有分化后代。更重要的是,这些细胞可用于转移性行为所必需,也表示以下的处理的一个重要来源,疾病复发,即使有能够诱导初始肿瘤消退( 例如,白蛋白 -紫杉醇)15,18-20的相对有效的药物。要注意的是CSCs的并不一定代表真正的干细胞,它们也不从组织干细胞出现在许多情况下,它是重要的,而它们具有ACQuired干细胞的某些特征。大多数的这些功能上的定义,例如肿瘤干细胞都配备有不定的自我更新能力使得它们对常规化疗抗性,并显示增加的侵袭促进转移活性。
功能性肿瘤干细胞表型
的CSCs的功能表型是根据自己的能力自我更新,这可以在体外分别采用串行球形成和集落形成测定法进行测试。甚至更重要的是,它可以通过有限稀释体内测定作为最终官能读出,优选在指示排他性长期致瘤性连续移植待测体内致瘤能够自我更新熊的CSCs。此外,有上述CSC隔室中的异质性,具有的CSCs轴承引起转移专属能力的一个独特的亚群,是不是只是一个直接后果是他们的专属体内的致瘤性。事实上,metastastitic肿瘤干细胞采集逃避原发肿瘤,生存失巢凋亡并最终转运和种子二级站点的能力。这些高级功能的能力可以在体外使用利用转移测定法改性入侵检测和体内进行测试。
针对癌症干细胞
我们和其他人已经提供了令人信服的证据表明治疗注重分化PDAC细胞的大块肿瘤,甚至在与基质靶向试剂组合,没有对肿瘤进展和随后的结果产生重大的影响,除非结合CSC定位策略21, 22。因此,基于在疾病进展和抗治疗的CSCs的关键功能,这些细胞应当表示为任何新的治疗方法18,20的必要成分,但是将需要一个更全面的理解ø˚F社区体育的监管机制。虽然肿瘤干细胞和它们的更加分化后代承担相同的遗传基态相对于遗传改变,肿瘤干细胞表现出截然不同的,因此表观遗传学确定基因的表达谱的份额模块的多能干细胞。大多数参与生成诱导的多能干细胞(Nanog的,的Oct3 / 4,Klf4的,Sox2的)的基因不仅与癌症有关,但它们的表达主要限于所述的CSCs隔室。此外,CSCs的由丧失功能的使用遗传工具用于靶向CSCs的实验的功能关联性现已确立上述CSC概念几个癌症类型23-25。虽然大多数的这些方法都是基于小鼠模型,因此不容易转移进入临床,但它们提供证明的概念用于靶向CSCs的结合大块肿瘤细胞的潜在的临床意义。
研究癌症干细胞六卓以确定他们的阿喀琉斯之踵
为了确定新的和临床上适用的方式用于靶向CSCs的,其特征被定期研究在体外和球形成被广泛使用于该上下文。原本为研究正常干细胞生物学,包括自我更新和分化的能力的发展,该测定后来被改编以研究在体外的CSCs和已被用于研究的CSCs从PDAC 20隔离。我们发现,从初级人类PDAC细胞形成肿瘤球的CSC承担所有的鲜明特色,因此表明它们含有善意胰腺肿瘤干细胞21。因此,肿瘤球测定表示一个强大的工具来筛选更有效的治疗在体外 ,但结果需要进一步评估在更严格的体内测定。事实上,用这种体外试验产生的数据要十分小心为TH对待Ë分析会受到显著的错误。高度标准化的协议,包括形成球体自动计数,应建立确保重现和预测数据。
在这方面,我们最近使用此测定法来筛选来自原代人PDAC的的一组不同来源的胰CSCs的,并表明这些细胞是由抗糖尿病化合物二甲双胍极易受到代谢重新编程。先前,二甲双胍已被证明抑制癌细胞膨胀通过AMP活化蛋白激酶(AMPK)信号和随后的抑制mTOR的26,从而降低蛋白质合成和细胞增殖27间接活化。除了 在大块肿瘤人口这些效果,我们和其他人已发现,二甲双胍是能够靶向和实际上消除的CSCs亚群在许多实体瘤,如乳腺癌,食管癌,成胶质细胞瘤和胰腺癌28-31 <的/ SUP>。因此,二甲双胍是一个有希望和安全的新的治疗策略,一些癌症与目前未满足的医疗需求。此外,使用球形成的一种方式,以丰富的肿瘤干细胞,我们发现,二甲双胍对胰腺肿瘤干细胞的主要作用是独立的AMPK激活,大部分(通过抑制复合物I),这显然是致命的子集,依靠微薄的线粒体毒性的CSCs只。对于后者,我们能够评估其细胞耗氧量和线粒体活性氧的产生为在细胞水平的指标药物的毒性。随后,这些体外数据可在临床前小鼠模型中进行验证,实际上导致了显著延长生存31。本文介绍的方法允许快速生成的肿瘤干细胞药物的敏感性配置文件,包括其对CSC代谢的影响研究。我们现在提供了扩展有关使用COM实验细节互补在体外和体内过程。
研究方案
人类PDAC肿瘤书面知情同意书(马德里自治区,西班牙(CP CNIO-CTC-11获得 - CI一百零三分之一十一-E)的人类胰腺肿瘤免疫缺陷小鼠植入要求机构审查委员会的批准,以及机构。动物护理和使用委员会(IACUC)的异种移植胰腺肿瘤小鼠模型的程序必须按照制度和国家规定进行(;西班牙马德里;在德研究所Salud的卡洛斯三世在这里伦理委员会的协议PA 34_2012)。
1.文化传媒
- 准备完整的媒介。
- 补充RPMI培养基含10%FBS,100单位/ ml青霉素/链霉素。对于500毫升的RPMI添加55青霉素/链霉素(10,000单位/毫升,100X)的ml热灭活的FBS和6ml。
- 存放在4℃的完全培养基。
- 准备中的CSCs。
- 补充的无血清DMEM / F12 mediu米,100单位/ ml青霉素/链霉素和2mM谷氨酰胺。
- 存放在4℃的CSC培养基。 B27(1:50)和20毫微克/ ml的bFGF被新添加到每次实验前的介质。
注:除B27已被证明能增加肿瘤球形成和维持球体培养物32的几段。培养基的组成是一个关键步骤,并具有用于在培养的细胞类型进行测试。我们推荐测试的自我更新和球体的分化能力和分析的CSC标记物通过流式细胞术表达( 即,CD133 +和CD44 +)。
- 准备外通量测定介质。
- 这个特定介质是含有维生素,氨基酸和其它补充剂,但缺乏谷氨酰胺,葡萄糖,丙酮酸和碳酸氢基底的DMEM 5030。
- 对于目前的试验中,补充了2mM谷氨酰胺,8毫米的葡萄糖和2mM丙酮酸钠为完整线粒体代谢活性的介质。
注意:没有碳酸氢钠是为了准确地测量细胞培养物中生长的细胞外酸化必不可少的,因为经常含有介质碳酸氢钠将测定期间缓冲pH值的变化。此外,使用一个基础培养基允许L-谷氨酰胺(如L-丙氨酰谷氨酰胺)葡萄糖,或必要的不同的测定条件和/或应用程序丙酮酸钠的浓度的严格控制。
2.球形成实验及分析
注:所有组织培养协议和操作必须使用无菌技术,非常注重用干净,洗涤剂,无菌玻璃器皿进行。使用前,前期预热所有中型和解决方案在37℃水浴(作为替代,您可以使用媒体和解决方案预先加热到RT)。获得人PDAC肿瘤如前面详述21。
- 从人类PDAC肿瘤干细胞的分离( 图1)
- 在无菌生物安全柜人类PDAC组织转移到含1ml无菌1X磷酸盐缓冲盐水(PBS)中的60×15毫米培养皿中。剁碎肿瘤小块 - 用无菌解剖刀和镊子(1 5毫米)。
- 加入1毫升无菌1X PBS中的培养皿,并重复研磨步骤,直至组织被完全解离,经常这需要3-4轮。转移的组织悬浮液(顶部最多5毫升用1X PBS中的最终体积)到无菌管中,并机械地与离解之均匀,如gentleMACS。
- 孵育胶原酶的组织匀浆(用2.5毫克/毫升胶原酶在1X PBS)中60分钟,在37℃,然后离心5分钟,在900×g下。滗析出上清液和重悬细胞沉淀在10ml完全培养基。过滤通过40微米的过滤器和离心机的细胞悬浮液5分钟,在900×g下。
- 滗析出上清液和重悬沉淀用5ml的红细胞裂解缓冲液(铵氯化物 - 钾,ACK),并孵育
- 悬浮在明胶包被的培养皿中的CSCs介质,板片状,并在37℃下进行1小时。此步骤将除去大部分的成纤维细胞,迅速附着到板的。
- 从培养箱中取出盘子并小心地回收细胞悬浮液和量化可行(台盼蓝阴性)使用血球细胞的数量。为了这个目的,轻轻混合悬浮液和吸取20微升悬浮液到Eppendorf管。加入20微升:台盼蓝(1比1)的细胞在离心管中拌匀。吸管大约10微升到血球混合物。
- 算上计数室的活菌数的四个角象限中的所有单元格清晰。注:细胞活力和产量可显着地改变肿瘤标本之间。对于PDAC样品活力定期范围betwe烯45-70%,和组织碎片从一个直径为3的肉眼可见的肿瘤样品- 5 mm产品应该产生大约5×10 6活细胞。
- 球形成分析和二甲双胍治疗
- 取细胞的所需数量和添加的CSCs介质的适当体积,制备2,000个细胞/ ml的细胞浓度。不要让细胞悬浮液在冰上不超过1小时长,以及混合电镀前。
- 加入500μl1X PBS中至24孔板加湿的第一行和最后一行,以便帮助最小化介质的蒸发。种子细胞进入超低附着细胞板中,每孔2,000个细胞在1ml肿瘤球培养基(2000个细胞/ ml)的密度。
注意:用于肿瘤球形成测定法可以肿瘤类型之间有所不同的细胞数。 - 治疗至少4个孔用载体(阴性对照)和4个孔,每个分配处理,二甲双胍例如 ,3毫米。 PL王牌细胞在培养箱设定为37℃,并供给将细胞与5%CO 2的一个星期。
注:介质不应以允许未受扰动形成肿瘤球被改变,但是可以加满用生长因子,每天,因为它们不是稳定的培养基中。 - 隔日加治疗,二甲双胍或车辆如 ,3mM至每个孔中。通过使用自动细胞计数器,其允许更大的结构( 图2)的数量的评估形成肿瘤球后5和/或7天数。
注意:只有肿瘤球具有至少40微米,应考虑,并且可以被分类为小(40 - 80微米)或大(80 - 120微米),分别。结果可表示为肿瘤球体由细胞接种( 例如,2,000个细胞)的初始数除以百分比。
- 第一代肿瘤球连续传代
- 经过7天的培养收获使用40微米的细胞过滤的肿瘤球,并在900×g离心在RT离心他们5分钟。
- 解离的肿瘤球用胰蛋白酶单个细胞沉淀,然后再展开获得的单细胞的细胞悬浮液另外7天为如上所述(见2.2)。
3.代谢分析(ROS生产和氧耗)
- ROS的产生
- 在这个协议中,我们已经使用羧基DCFDA作为一个例子来测量ROS产生,因为它是一个经济,快速和广泛使用的探针的ROS检测。然而,还有其他几种探针和方法可以用于该测定。
- 在2.2中所述的时间分配量治疗肿瘤领域与二甲双胍。在治疗结束时,使用一个40微米的细胞过滤的收获肿瘤球,离心细胞,在900×g离心5分钟,并且重悬沉淀在1ml tryps的英寸孵育20分钟,在37℃。
- 一旦细胞singularized,离心机在900×g离心,重悬含有2.5μM的羧基DCFDA的细胞,在HBSS中。在黑暗中孵育细胞20分钟,在37℃下。
- 之前流式细胞仪分析保护着色细胞从光作为羧基DCFDA可以是光氧化给出假阳性结果。置于冰上管直至分析。
注:羧基DCFDA是荧光灯FL1中检测到与各种活性氧和氮物种的,反应后(例如488nm的,电磁520nm处。)。
- 耗氧量测定
- 对于这个协议中,我们将使用外磁分析器系统从海马Biosciences公司,作为一个例子。涂层的所需的细胞培养板的细胞和组织粘合剂22.4微克/毫升20分钟在室温的溶液中。冲洗井的水2 - 要在播种前细胞的3倍。
- 在治疗结束时,收获肿瘤球使用40微米的细胞过滤,离心细胞,在900×g离心5分钟,并且重悬沉淀在1ml胰蛋白酶。孵育20分钟,在37℃。
- 板singularized细胞在细胞培养板上以30000个细胞的密度/孔的96孔板(最终体积:150微升)。重悬的细胞在含8mM的葡萄糖和2mM丙酮酸钠耗氧测定培养基。
- 离心细胞的深受井旋转离心底部,直到100 XG已经达到,然后让离心机停止与制动关闭。反向板的取向,并重复该过程。所述板转移到37℃培养箱不加入二氧化碳的30分钟。
- 在此期间,准备盒用于测定。每口井有4个不同的喷油器加载(25微升/端口):
- 端口A:二甲双胍。以得到在井3 1mM的终浓度,制备一个8倍的溶液(24毫摩尔)作为最终的体积为175μL进样口A.后
- 端口B:二甲双胍。添加3mM的,将获得6毫在井中的终浓度,制备9x的溶液(27毫摩尔)作为最终的体积将注射端口B后200微升
- 端口C:二甲双胍。添加3mM的,将获得在井9 1mM的终浓度,制备10倍的溶液(30毫摩尔)作为最终的体积将注射端口C的后225微升
- 端口D:鱼藤酮11微米,以获得1μM作为井(11X)终浓度。注:鱼藤酮完全抑制任何残留的线粒体活性。
- 校准盒和加载的细胞培养板。执行与混合和测量的标准协议的测定。
- 计算抑制由二甲双胍作为抑制鱼藤酮(设定为100%)得到的百分比达到总线粒体呼吸的百分比。
4。异种移植模型的人类胰腺癌的免疫缺陷小鼠
注:订购足够数量的雌性无胸腺裸鼠或其他更免疫功能低下小鼠模型,如NOD-SCID,SCID米色或核供应国集团的实验33。高压釜在实验前所有手术器械,并允许他们使用前冷却至室温。对于皮下肿瘤,我们使用最少4只小鼠每条件的每侧翼一种肿瘤为总共8肿瘤。
- 异种移植
- 肿瘤准备从片的人胰腺癌组织标本。转移肿瘤到培养皿,并用手术刀和镊子保持组织解剖组织切成小块(直径2mm,〜8毫米3)。浸得到的块放入凝胶状蛋白混合物溶液保持在冰上。
- 使用麻醉小鼠1 - 3%异氟烷或其他吸入性或注射麻醉剂。
注:在开始任何手术PROCedure,确保老鼠已经通过刺激腹部皮肤完全失去了知觉,或拖一对分裂镊子。应用眼膏,以防止干燥。 - 一旦麻醉已生效,擦拭小鼠背部用含有乙醇的皮肤消毒剂。辖丁丙诺啡(0.05毫克/公斤体重)在手术前,以确保术后镇痛。
- 抬起背部皮肤与钳,使0.7 - 1.0厘米长的切口,用无菌微剪刀然后直截了当地准备一个小的皮下袋,其中一块患者来源胰腺癌组织的插入(〜8毫米3)。
- 关闭使用1伤口 - 2皮肤主食。 7天后删除它们。回到老鼠它们的笼子,让他们在一个加热垫或加热灯下,直到他们完全活跃起来。
- 继肿瘤植入,监测小鼠至少每周两次肿瘤的生长和发病率上升,如皱皮一般的迹象,huncheð姿势,和不动。
- 一旦肿瘤达到200毫米3的平均尺寸,将小鼠随机分配到相应的治疗方法。每天通过腹腔注射(150毫克/公斤体重)或通过饮水(150毫克/千克体重)相媲美的治疗效果给予车辆或二甲双胍。
- 使用卡尺监测肿瘤负荷,并计算肿瘤体积,每周一次(肿瘤体积的测量= 1/2长×呼吸×宽度)。
- 牺牲小鼠的肿瘤后达到1厘米直径或小鼠开始显示出如上规定的剧烈疼痛或疾病的迹象。
结果
二甲双胍选择性靶向胰腺肿瘤干细胞
我们首先检查上的CSCs的体外的自我更新能力二甲双胍治疗的功能效果。为了这个目的,我们使用原代人胰腺癌细胞从手术中切除的PDAC组织中分离进行球形成测定。我们观察到,二甲双胍强烈降低形成球体( 图1A)的大小。这是最有可能通过抑制CSC的后代,它仍然代表大部分领域中发现的细胞,因为它们不仅丰富了社区体育的发展。事实上,时间越长球不都是传代的更加分化后代更广泛的扩展将是培养。因此,我们发现二甲双胍显著减少它们的尺寸的实际形成,不论球体的数量,以剂量依赖的方式暗示C的自我更新能力的强烈抑制发生雪旺(数据未显示)。我们发现,二甲双胍在3毫显著降低球的形成( 图1B)的数目。为了更严格地研究二甲双胍对肿瘤干细胞的自我更新能力的长期影响,我们随后的传代初级形成到球体二级和三级领域。虽然只有初级球体二甲双胍治疗,在第二和第三通道球体的形成极大地和逐渐减小,暗示二甲双胍治疗确实不可逆地消除了大部分的CSCs( 图1C)。因此,我们的数据表明二甲双胍初级胰腺癌的CSCs的自我更新能力显著治疗效果,因此鼓励我们以执行进一步机械以及体内研究。
二甲双胍抑制线粒体耗氧量和诱导活性氧的产生
由于metformiN为示出由部分地抑制复合物I活性充当线粒体毒物,我们接下来检测二甲双胍对蜂窝耗氧量的球来源的细胞的急性作用。为了这个目的,我们选择从两个有代表性的主PDAC肿瘤衍生的细胞,并测量氧消耗随时间以下顺序注射的3mM的二甲双胍(三次注射)和1μM的鱼藤酮(一次注射)。 如图2A所示 ,二甲双胍注射诱导的耗氧量,其中变化相当大的不同的肿瘤之间的快速和剂量依赖性减少。我们通过注射鱼藤酮,一种有效的配合物I抑制剂,其能够完全抑制线粒体氧消耗计算在二甲双胍治疗的残留线粒体活性。灵敏度二甲双胍线粒体氧消耗其容量相关的术语来诱导定义为珀普的平均值的位移ROS产生后二甲双胍治疗( 图2B,左面板),它可以很容易地定量( 图2B,右图)LATION。正如预期的那样,初级细胞是最敏感的抑制氧消耗也显示在二甲双胍治疗的最强增加ROS的产生。因此,这些代谢的体外实验表明,二甲双胍目标的CSCs通过抑制其对线粒体功能的依赖,从而产生一个随后增加线粒体ROS产生,并最终诱导细胞凋亡。
二甲双胍摊位PDAC进展体内
我们终于研究二甲双胍在体内使用从不同患者PDAC来源的组织异种移植物的影响。我们观察到显著减少肿瘤进展二甲双胍治疗的小鼠相比,对照组,但肿瘤从未完全迪萨ppeared( 图3)。随后,在长期随访所有肿瘤最终复发表明细胞存活治疗的早期阶段的二甲双胍阻力。然而,二甲双胍治疗,即使在单剂应用,显著延长生存期在所有小鼠。
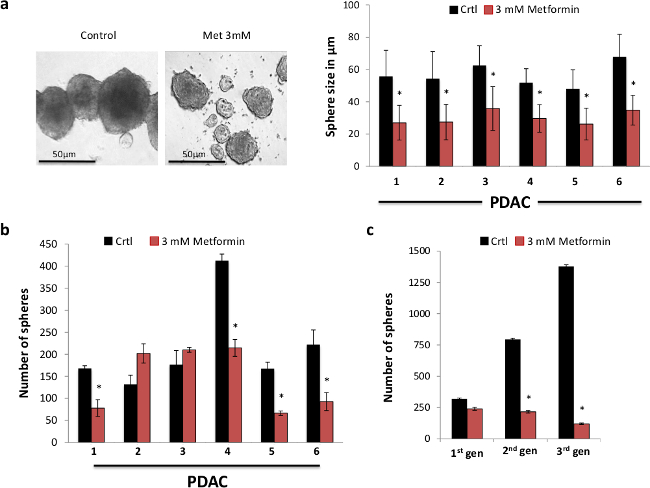
图1.二甲双胍选择性靶向的肿瘤干细胞。(A)二甲双胍降低球的大小。球体的代表图像与指定剂量二甲双胍7天(右图)处理后获得的。球尺寸(n≥6)(左图)的定量,在横坐标轴上表示的数字表示个别肿瘤。 (B)的球体形成的能力在横坐标存在或不存在二甲双胍7天(n≥6),所指示的数字轴表示单个肿瘤。 (C)的CSC的自我更新能力在小学胰腺癌细胞的二级和三级领域代表图。该领域在第一代球形成只处理了共7天(N = 6)。 请点击此处查看该图的放大版本。
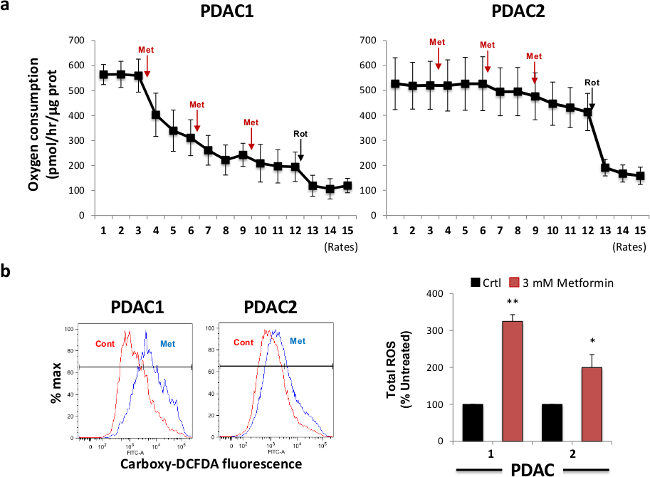
图2.二甲双胍治疗抑制氧消耗和诱导活性氧的产生。(A)除二甲双胍抑制球体源性细胞的耗氧量(OCR)。两种不同的PDAC二次球分别用二甲双胍和OCR变化是由细胞外流量分析测量。鱼藤酮注射被用作总线粒体OCR消耗的控制。X轴表示的氧消耗率的氧/小时通过在每个孔中的蛋白质含量标准化皮摩尔。在一个用(B)PDAC球共治疗8小时与二甲双胍和ROS的产生通过流式细胞仪用羧基DCFDA评估。左,代表流式细胞仪图。右键,从三个独立的实验数据的汇总。 请点击此处查看该图的放大版本。
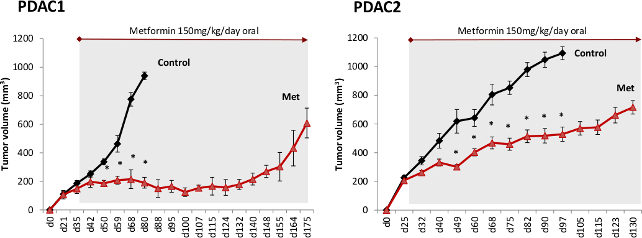
图3.二甲双胍摊档PDAC 进展体内有两种不同的PDAC移植组织植入小鼠免疫功能低下和治疗被分配在初次服用的肿瘤进行了验证。小鼠用二甲双胍(蛋氨酸)处理加入到饮用水(150毫克/公斤体卫GHT;基于5毫升每天用水量)的。 请点击此处查看该图的放大版本。
讨论
随着CSC概念的出现和随后的验证许多肿瘤,药物开发领域已经获得了新的动力,与潜在的开发更有效的癌症治疗,随后降低风险的疾病复发。不过,中信建投领域还处于起步状态,更需要被理解CSC的起源和传播,以及他们在塑造肿瘤结构和促进转移中的作用方面取得。
在这种情况下,使用可重复的和有意义的CSC测定以及获得的数据的知情解释表示用于推进我们CSC生物学的理解的一个关键组成部分。从许多生物的角度,球形成已经成为一个极有价值的分析;但是用户应该知道它的局限性,以便正确地解释他们的实验结果。一个重要的方面,甚至球体形式上的评估之前,需要考虑灰数据是所研究样品的起源,因为从新鲜患者来源的样本中获得的结果可能是显著不同于从既定的癌细胞系获得。
经典球形成测定法涉及在克隆密度在超低附着板接种细胞和评估的表皮生长因子的存在(EGF)和/或富含碱性成纤维细胞生长因子(B-FGF)球形成,但无血清培养基21, 34。培养基组合物也是要考虑的重要问题。根据我们的经验,我们发现,在DMEM / F12在无血清的补充有B27,bFGF和谷氨酰胺是成长,扩展和维护上述CSC在未分化的条件下的最佳介质。我们发现,在这种培养条件(培养基和悬浮液)的细胞表达高量的癌干细胞标记物(包括CD133 +,CD44 +和CD24 +)和不表达分化相关蛋白(CK-20和CK-19)。
一种用于这些测定法的基本假设是,每个球体是克隆, 例如,一球从一个单一的干细胞的膨胀造成的。然而,球在本质上是很容易,即使在低接种密度35融合的动态结构。电镀细胞是在协议的关键步骤和一个小区/密度以及可以规避一定的聚集问题。但是,即使是前瞻性排序祖细胞,这经常导致非常低的球形成,由于低的固有球体形成的活性,也可以归因于有限的自分泌刺激由于稀释效应。根据我们的经验,我们观察到,只有30%的细胞铺板的能够形成的球体。我们建议使用至少100个细胞/孔,以获得一致的和可重复的结果。
其他培养方法生长CSC是基于固体或半固体的3D培养物( 例如,基于米atrigel,胶原或甲基纤维素)。这些方法已被用来限制细胞迁移和随后的细胞聚集36。然而,每一个这些矩阵的承载其自身的局限性。例如,基质胶是一种可溶性基底膜从Engelbreth-Holm的-天鹅(EHS)分离肿瘤和虽然提取类似于在许多组织中发现的复合细胞外肿瘤环境,但它包含多个或多或少定义的生长因子常常呈现机械研究具体的调控元件非常困难。考虑另一点是,球形成能力和干细胞的功能是不可互换的条款34。虽然某些干细胞和祖细胞已经显示出呈现球形形成能力37,不能产生体外球体并不排除体内干细胞/祖功能。例如,静止的干细胞可以简单地不被提供的胞外线索响应在体外培养条件下选择的。因此,长期在体外和纯化的细胞群,优选在连续传代的体内自我更新的能力,应以证明或反驳干细胞功能的评估。在这种情况下,以前瞻性和同时传播干细胞和祖细胞的不同人群的能力是球体形成实验的一个重要方面,并呈现该测定对于上述CSC字段高度有价值;只要它的局限性是牢记对所获得的数据的解释。
球形成测定法已被广泛用于追溯识别根据其能力,自我更新和分化在体外单细胞水平的干细胞。标记,允许干细胞的潜在隔离及其后代从他们体内龛的发现允许定义纯化种群的功能特性。的C球体形成实验ombination和流式细胞仪是一个成功的策略,以隔离固体组织细胞或充实PDAC的特定亚群的文化。例如,EpCAM的,CD24和CD44的同时表达限定的CSCs能的亚群:自我更新,分化和发起一个肿瘤,反映了原发肿瘤的异质性。赫尔曼等人 。表明CD133 +细胞具有增强增殖能力和CSC拥有15。其他标记物也已被用于对肿瘤干细胞的表征:ALDH- 1(醛脱氢酶-1)的表达具有高度致瘤性细胞在胰腺癌38相关联;细胞能够排除DNA染料赫斯特33342,命名为侧群(SP)细胞,具有启动肿瘤39探明能力。最近我们发现,亚细胞自体荧光表征车厢人体细胞具有在不同肿瘤类型独家CSC特质鲜明的群体40。虽然没有这些标记显示以选择性表征的CSCs的纯群体,标志物越来越复杂的组合需要用于FACS纯化的细胞的更精致的人群。
许多问题仍然大约的CSCs在原点,进展和药物的肿瘤抗性的确切作用。例如,一种解决克隆演变的问题来定义是否以及如何将单个CSC发起肿瘤的方式,可以分析患者样品在疾病的不同阶段,并且具体遵循的CSCs的数量时和治疗后。通过回答这些问题,我们可以使我们在实体瘤肿瘤干细胞的知识有意义的进步和开发药物治疗,以最终防止肿瘤恶化和复发。
披露声明
作者有没有竞争的利益披露。
致谢
本研究是由一个ERC高级研究员格兰特(PA-CSC 233460),欧洲共同体的第七框架计划(FP7 / 2007-2013)根据赠款协议没有256974(EPC-TM-NET)和No 602783(CAM-PAC ),该Subdirección一般德EvaluaciónŸFOMENTO德拉Investigación,丰德Investigación疗养(PS09 / 02129和PI12 / 02643),以及Programa国立Internacionalización德拉I + D,Subprogramma:FCCI日(PLE2009-0105;部: EconomíaÿCompetitividad,西班牙)。 E. Lonardo由罗氏奖学金的支持。 M.西菲由巴塞罗那储蓄银行博士前奖学金计划的支持。
材料
| Name | Company | Catalog Number | Comments |
| Counting Chamber/Hemocytometer | Hausser Scientific Co | 3200 | |
| CASY Cell Counter and Analyzer for proliferation and viability measurement | Roche Innovatis | AG CASY Model TTC 45,60,150 μm | |
| GentleMACS Dissociator | Miltenyi Co | 130-093-235 | |
| GentleMACS C Tubes | Miltenyi Co | 130-093-237 | |
| 24-well Ultra-low Attachment Plates | Corning | 3474 | |
| 100-mm tissue culture dishes | BD Falcon | 353803 | |
| Cell strainer | BD Falcon | 352350 | |
| 15-ml polypropylene conical tube | BD Falcon | 352097 | |
| 50-ml polypropylene conical tube | BD Falcon | 352070 | |
| 1.5 ml sterile tubes | Eppendorf | 0030 120.086 | |
| 50 ml centrifuge tubes | Corning | 430828 | |
| Sterile petri dishes, 10 cm dishes | Corning | 353003 | |
| 26 G needles | BD Falcon | 300600 | |
| 100 ul Hamilton Syringe | Hamilton Syringe Co | 81075 | |
| Collagenase type IV | Stem Cell Technologies | 7909 | |
| RPMI Medium 1640 | Life technologies | 11875-085 | |
| Penicillin/Streptomycin solution, 100X | Life technologies | SV30010 | |
| Metformin | Sigma | D150959-5G | |
| L-glutamine, 200 mM, 100X | Life technologies | 25030-081 | |
| D-Glucose | Sigma | G8270 | |
| 100mM Sodium Pyruvate solution | Life technologies | 11360-070 | |
| Seahorse Assay medium | Seahorse Bioscience | 100965-000 | |
| BD Cell-TAK Cell and Tissue adhesive | BD Biosciences | 354240 | |
| Trypsin solution, 0.05% | Life technologies | 25300054 | |
| B27 Supplement 50x | Life technologies | 17504-044 | |
| Basic Fibroblast Growth Factor | Sigma | F0291 | |
| Bovine Serum Albumin | Sigma | A9576 | |
| Dulbecco’s Modified Eagle Medium/F12 | Sigma | D8437 | |
| Sterile 1x Dulbecco’s Phosphate Buffered Saline | Sigma | D8537 | |
| Trypan Blue | Life technologies | 15250-061 | |
| Carboxy-DCFDA(5-(and-6)-Carboxy-2',7'-DichlorofluoresceinDiacetate) | Life technologies | C-369 | |
| Rotenone | Sigma | R8875 | |
| Ethanol 70% (vol/vol) | Sigma | 459844 | |
| Isofluorane | IsoVet, Braun | 571105.8 | |
| Matrigel | BD Biosciences | 35620 | |
| Sterile Cotton tipped applicator | Puritan medical | ||
| XF96e FluxPak with cell plates, calibrant and cartridges | Seahorse Bioscience | 102416-100 | |
| XF96e Extracellular Flux analyzer | Seahorse Bioscience | ||
| Incubator with CO2 input | |||
| Micro scissors | |||
| Curved forceps | |||
| Splinter forceps | |||
| Caliper |
参考文献
- Whipple, C. A., Young, A. L., Korc, M. A KrasG12D-driven genetic mouse model of pancreatic cancer requires glypican-1 for efficient proliferation and angiogenesis. Oncogene. 31 (20), 2535-2544 (2012).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4 (11), 1649-1652 (2009).
- Rahib, L., et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res. 74 (11), 2913-2921 (2014).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics. CA Cancer J Clin. 62 (1), 10-29 (2012).
- Burris, H. A., et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 15 (6), 2403-2413 (1997).
- Moore, M. J., et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol. 25 (15), 1960-1966 (2007).
- Cunningham, D., et al. Phase III randomized comparison of gemcitabine versus gemcitabine plus capecitabine in patients with advanced pancreatic cancer. J Clin Oncol. 27 (33), 5513-5518 (2009).
- Von Hoff, D. D., et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 369 (18), 1691-1703 (2013).
- Conroy, T., et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 364 (19), 1817-1825 (2011).
- Gourgou-Bourgade, S., et al. Impact of FOLFIRINOX compared with gemcitabine on quality of life in patients with metastatic pancreatic cancer: results from the PRODIGE 4/ACCORD 11 randomized trial. J Clin Oncol. 31 (1), 23-29 (2013).
- Yachida, S., et al. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature. 467 (7319), 1114-1117 (2010).
- Garcia-Silva, S., Frias-Aldeguer, J., Heeschen, C. Stem cells & pancreatic cancer. Pancreatology. 13 (2), 110-113 (2013).
- Hermann, P. C., Mueller, M. T., Heeschen, C. Pancreatic cancer stem cells--insights and perspectives. Expert Opin Biol Ther. 9 (10), 1271-1278 (2009).
- Hermann, P. C., Huber, S. L., Heeschen, C. Metastatic cancer stem cells: a new target for anti-cancer therapy. Cell Cycle. 7 (2), 188-193 (2008).
- Hermann, P. C., et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 1 (3), 313-323 (2007).
- Li, C., et al. Identification of pancreatic cancer stem cells. Cancer Res. 67 (3), 1030-1037 (2007).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell Stem Cell. 14 (3), 275-291 (2014).
- Gallmeier, E., et al. Inhibition of ataxia telangiectasia- and Rad3-related function abrogates the in vitro and in vivo tumorigenicity of human colon cancer cells through depletion of the CD133(+) tumor-initiating cell fraction. Stem Cells. 29 (3), 418-429 (2011).
- Hermann, P. C., Bhaskar, S., Cioffi, M., Heeschen, C. Cancer stem cells in solid tumors. Semin Cancer Biol. 20 (2), 77-84 (2010).
- Mueller, M. T., et al. Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer. Gastroenterology. 137 (3), 1102-1113 (2009).
- Lonardo, E., et al. Nodal/Activin signaling drives self-renewal and tumorigenicity of pancreatic cancer stem cells and provides a target for combined drug therapy. Cell Stem Cell. 9 (5), 433-446 (2011).
- Li, C., et al. c-Met is a marker of pancreatic cancer stem cells and therapeutic target. Gastroenterology. 141 (6), 2218-2227 (2011).
- Chen, J., et al. A restricted cell population propagates glioblastoma growth after chemotherapy. Nature. 488 (7412), 522-526 (2012).
- Schepers, A. G., et al. Lineage tracing reveals Lgr5+ stem cell activity in mouse intestinal adenomas. Science. 337 (6095), 730-735 (2012).
- Driessens, G., Beck, B., Caauwe, A., Simons, B. D., Blanpain, C. Defining the mode of tumour growth by clonal analysis. Nature. 488 (7412), 527-530 (2012).
- Shaw, R. J., et al. The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin. Science. 310 (5754), 1642-1646 (2005).
- Martin-Castillo, B., Vazquez-Martin, A., Oliveras-Ferraros, C., Menendez, J. A. Metformin and cancer: doses, mechanisms and the dandelion and hormetic phenomena. Cell Cycle. 9 (6), 1057-1064 (2010).
- Honjo, S., et al. Metformin sensitizes chemotherapy by targeting cancer stem cells and the mTOR pathway in esophageal cancer. Int J Oncol. 45 (2), 567-574 (2014).
- Wurth, R., et al. Metformin selectively affects human glioblastoma tumor-initiating cell viability: A role for metformin-induced inhibition of Akt. Cell Cycle. 12 (1), 145-156 (2013).
- Cufi, S., et al. Metformin-induced preferential killing of breast cancer initiating CD44+CD24-/low cells is sufficient to overcome primary resistance to trastuzumab in HER2+ human breast cancer xenografts. Oncotarget. 3 (4), 395-398 (2012).
- Lonardo, E., et al. Metformin targets the metabolic achilles heel of human pancreatic cancer stem cells. PLoS One. 8 (10), e76518 (2013).
- Gu, Y., et al. The effect of B27 supplement on promoting in vitro propagation of Her2/neu-transformed mammary tumorspheres. J Biotech Res. 3, 7-11 (2011).
- Ishizawa, K., et al. Tumor-initiating cells are rare in many human tumors. Cell Stem Cell. 7 (3), 279-282 (2010).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat Methods. 3 (10), 801-806 (2006).
- Lawson, D. A., Xin, L., Lukacs, R. U., Cheng, D., Witte, O. N. Isolation and functional characterization of murine prostate stem cells. Proc Natl Acad Sci U S A. 104 (1), 181-186 (2007).
- Seaberg, R. M., van der Kooy, D. Adult rodent neurogenic regions: the ventricular subependyma contains neural stem cells, but the dentate gyrus contains restricted progenitors. J Neurosci. 22 (5), 1784-1793 (2002).
- Jimeno, A., et al. A direct pancreatic cancer xenograft model as a platform for cancer stem cell therapeutic development. Mol Cancer Ther. 8 (2), 310-314 (2009).
- Hirschmann-Jax, C., et al. A distinct 'side population' of cells with high drug efflux capacity in human tumor cells. Proc Natl Acad Sci U S A. 101 (39), 14228-14233 (2004).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nat Methods. 11 (11), 1161-1169 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。