Method Article
في المختبر والمجراة نموذج لدراسة التصاق البكتيريا إلى سفينة ستريت تحت ظروف التدفق
In This Article
Summary
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
Abstract
من أجل تسبب التهابات اللف والتهاب الشغاف، تحتاج البكتيريا لتكون قادرة على الانضمام إلى جدار الوعاء الدموي بينما التعرض للإجهاد القص المتدفقة الدم.
تحديد العوامل البكتيرية والمضيفة التي تساهم في التصاق الأوعية الدموية من الكائنات الحية الدقيقة، وهناك حاجة إلى نماذج مناسبة دراسة هذه التفاعلات في ظل ظروف القص الفسيولوجية. هنا، نحن تصف في المختبر تدفق نموذج الغرفة التي تسمح للتحقيق التصاق البكتيريا لمختلف مكونات المصفوفة خارج الخلية أو الخلايا البطانية، ونموذج intravital المجهري التي وضعت لتصور مباشرة التصاق الأولي من البكتيريا إلى الدورة الدموية في الجسم الحي حشوي . ويمكن استخدام هذه الأساليب لتحديد العوامل البكتيرية والمضيفة اللازمة لالتصاق البكتيريا تحت التدفق. نحن لتوضيح أهمية إجهاد القص ودور عامل فون ويلبراند للالتصاق Staphylococcus الذهبية باستخدام كل من في المختبر، ونموذج الجسم الحي.
Introduction
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
Protocol
وتمت الموافقة على التجارب على الحيوانات من قبل اللجنة الأخلاقية لوفين KU.
1. البكتيريا التحضير لفي المختبر Perfusions والتجارب في فيفو
- كنا S. الذهبية سلالة نيومان لجميع التجارب وصفها في هذه المخطوطة. S. تم تخزينها الذهبية نيومان في الدماغ القلب تسريب (BHI) مع 10٪ الجلسرين في -80 ° C.
- استخدام حلقة معقمة لتتخلص من البكتيريا المجمدة وإيقاف تطعيم في 5 مل زيتية الصويا مرق (TSB) O / N عند 37 درجة مئوية (OD 600> 3).
- يغسل البكتيريا عن طريق الطرد المركزي (2600 غرام، RT، 5 دقائق) و resuspend بيليه الجرثومي في 5 مل PBS (الفوسفات مخزنة المالحة).
- يعد حل 1 ملغ / مل من 5 (6) -carboxy-فلوريسئين استر N-hydroxysuccinimidyl (كربوكسي فلوريسئين) في الإيثانول. تمييع 1 ملغ / حل كربوكسي فلوريسئين مل إلى 150 ميكروغرام / مل في الماء مختبر الصف (على سبيل المثال، الماء MilliQ). حماية الأنابيب من الضوءمع رقائق الألومنيوم وتخزينها في -20 ° C.
- أجهزة الطرد المركزي البكتيريا (2600 x ج، RT، 5 دقائق). resuspend الكرية الجرثومي في 800 ميكرولتر PBS وإضافة 200 ميكرولتر (تركيز النهائي من 30 ميكروغرام / مل لإجراء التجارب التروية) أو 400 ميكرولتر (تركيز النهائي 50 ميكروغرام / مل لإجراء التجارب في الجسم الحي) من 150 ميكروغرام / مل من محلول كربوكسي-فلوريسئين. حماية الأنابيب من الضوء بورق الألمنيوم واحتضان لمدة 30 دقيقة في RT على شاكر.
- بعد وضع العلامات، وكتلة مع 6٪ ألبومين المصل البقري (BSA) حل في برنامج تلفزيوني.
- تمييع البكتيريا باستخدام كثافة البصرية (OD)، وهو OD 600 0.65 لإجراء التجارب في المختبر (المقابل لحوالي 3 × 10 8 مستعمرة (كفو) / مل للبكتريا المكورة العنقودية البرتقالية) وOD 600 من 1.8 لفي التجارب المجراة ( المقابل لحوالي 1 × 10 9 CFU / مل للبكتريا المكورة العنقودية البرتقالية) في برنامج تلفزيوني. حماية الأنابيب من الضوء بورق الألومنيوم ويترك على الجليد.
2. تجارب في المختبر الإرواء
- طلاء الزجاج coverslips
- تمييع عامل فون ويلبراند (VWF) (Haemate P، تركيز الأسهم 2400 ميكروغرام / مل) في الماء مختبر الصف (منزوع الأيونات المقطر) إلى تركيز النهائي من 50 ميكروغرام / مل.
- تمييع الكولاجين في محلول متساوي التوتر الجلوكوز (حل SKF، ودرجة الحموضة 2،7-2،9، كما تم توفيره من قبل الشركة المصنعة) إلى التركيز النهائي من 160 ميكروغرام / مل.
- coverslips الزجاج معطف (24 × 50 ملم) مع VWF أو الكولاجين من خلال إسقاط 200 ميكرولتر من الطلاء على parafilm ووضع ساترة على رأس الحبرية. سوف تنتشر الحبرية على طول سطح ساترة.
- احتضان ساترة في وعاء مرطب لمدة 4 ساعة على RT. رفع بعناية لل coverslips من parafilm مع إبرة حادة. جبل ساترة في الجزء السفلي من الغرفة التدفق.
- طلاء من البلاستيك ينزلق مع الخلايا البطانية
- زلات معطف البلاستيك(1 جيدا غرفة زراعة الخلايا PCA، SARSTEDT، ألمانيا) مع 1 مل من محلول الجيلاتين 1٪ في برنامج تلفزيوني واحتضان لمدة 30 دقيقة عند 37 ° C. بذور الخلايا البشرية الوريد السري البطانية (HUVECs) على الجيلاتين المغلفة زلات البلاستيك وتنمو لهم 70-80٪ confluency. جبل زلة البلاستيك في الجزء السفلي من الغرفة التدفق.
- نضح التجربة
ملاحظة: لمحة التخطيطي للفي المختبر نموذج نضح تتمثل في الشكل 1.- أداء في الدراسات المختبرية التصاق البكتيريا في غرفة تدفق لوحة مواز الصغيرة في الضغط الصفحي القص بين 2.5 داين / سم 2 و 20 داين / سم 2 لمحاكاة مختلف ظروف تدفق الفسيولوجية.
- و(تصميم داخلي) غرفة تدفق يتكون من إطار معدني وغرفة نضح مصنوعة من الزجاج (بولي (ميثيل) ميتاكريليت (PMMA)). من خلال توصيله إلى مضخة التسريب عالية الدقة (PHD 2000 التسريب، جهاز هارفارد، الولايات المتحدة الأمريكية)، ونحن يمكن أن تولد را تدفققسم التدريب والامتحانات بين 0.0001 ميكرولتر / دقيقة و220.82 مل / دقيقة.
- توصيل أنابيب إلى الجزء العلوي من غرفة التدفق وضخ المتوسطة في الأنبوب. وضع بلطف الجزء العلوي من غرفة التدفق على الجزء العلوي من الجزء السفلي وغرفة تجميع التدفق. كن حذرا لتجنب فقاعات الهواء. حقن 1 مل من المتوسط من خلال غرفة للتأكد من أن الغرفة وعدم حدوث أي تسرب، وإزالة حل طلاء الزائد. تجنب فقاعات الهواء.
- ضع الماوس على وسادة التدفئة التي تسيطر عليها الحرارية عند 37 درجة مئوية على صينية المجهر. وبما أن هذا هو الإجراء المحطة، ليست هناك حاجة لإجراءات صارمة asceptic. إجراء شق بالقرب من حبل الوريد، وإزالة بلطف الجانب الأيمن من عضلة عنق الرحم وعزل الوريد الوداجي من الأنسجة المحيطة بها.
- إعداد مضخة التسريب ومضان المجهر. تعتمد إعدادات مضخة التسريب على قطر حقنة ومعدل التدفق المطلوب (انظر القسم 2.4). من الآن فصاعدا، والعمل في غرفة مظلمة.
- VWF طلاء:
- حقنة ملء مع البكتيريا fluorescently المسمى وذلك لربط أنبوب مدخل. تجنب فقاعات الهواء. بدء تشغيل مضخة التسريب لمدة 10 دقيقة. الوقت التسريب يعتمد على معدل القص وطلاء، والبكتيريا والوسيلة المستخدمة ويجب أن تمثل حالة مستقرة من الالتصاق.
- بعد 10 دقيقة، يغسل البكتيريا غير منضم من خلال ربط المحاقن مع برنامج تلفزيوني للأنبوب مدخل والبدء في مضخة التسريب.
- يستغرق 15 على الأقل الصور أو الأفلام في مواقع مختلفة بعد عملية الغسيل. بكتيريا صغيرة ويمكن أن تكون صعبة للتركيز عليها. قبل التجربة تدفق في المختبر، وطائرة الوصل المناسبة يمكن استرجاعها عن طريق وضع قطرة من البكتيريا fluorescently المسمى على ساترة، ووضع ساترة في غرفة التدفق. ثم، ابحث عن البؤري المناسبة وحفظ الإعدادات.
ملاحظة: خلال التجربة تدفق في المختبر، واستولت على الصور أثناء الخطوة الغسيل (± 5 دقائق بعد بداية) يضمن فقطيتم التقاط إشارة للبكتيريا ملتصقة.
- الكولاجين طلاء:
- إضافة 60 ميكروغرام / مل VWF للبكتيريا fluorescently المسمى فقط قبل بدء الارواء. حقنة ملء مع البكتيريا fluorescently المسمى أو البكتيريا fluorescently المسمى تستكمل مع 60 ميكروغرام / مل VWF وذلك لربط أنبوب مدخل. تجنب فقاعات الهواء. كرر الخطوات من 2.3.5.2 إلى 2.3.5.3
- الخلايا البطانية:
- تنشيط الخلايا البطانية التي نضح مع حل 0.1 ملم من الكالسيوم 2+ -ionophore A23187 (محلول المخزون 10 ملي الذائبة في سلفوكسيد ثنائي ميثيل (DMSO)) في DMEM في نفس معدل القص كما نضح البكتيري لمدة 10 دقيقة قبل نضح مع 0.1 ملم. كرر الخطوات من 2.3.5.2 إلى 2.3.5.3.
- حساب معدل القص وإجهاد القص على النحو التالي.
معدل القص = 6Q / ملحق 2
حيث: Q: معدل في مل / دقيقة، ث تتدفق: عرض في سم، ح: ارتفاع في سم
إجهاد القص (τ) = الفئران القصاللزوجة EX (μ)
حيث μ: متوسط: 0.01 dynes س ثانية / سم 2، والدم كله: 0.04 dynes س ثانية / سم 2 - تحليل الصور
- الحصول على الصور الحية باستخدام مجهر مضان مقلوب مع كاميرا سوداء وبيضاء وتطوير استخدام برامج التصوير. استخدام وقت التعرض لل 1.5 ثانية. أخذ لقطات متعددة (15 على الأقل) تنتشر بشكل عشوائي على سطح مصقول من غرفة التدفق وحفظها في تنسيق الملف المناسب.
- لتحليل صورة مع يماغيج. طرح الخلفية لإزالة الخلفيات مستمرة على نحو سلس من الصورة (عملية - خلفية Substract) وتحديد عتبة لتعيين قيم العتبة الدنيا والعليا، بتجزئة حجم الصور الرمادي إلى الميزات المثيرة للاهتمام. قياس منطقة تقتصر على العتبة.
- مقارنة التصاق البكتيريا، كما أعرب عن منطقة الفلورسنت، على سبيل المثال، وذلك باستخدام برامج التحليل الإحصائي. مقارنة بين جماعات تستخدم في اتجاه واحد أنوفا أو تيالتعليم الجامعي الذيل اختبار تي الطالب. الإبلاغ عن جميع القيم كما يعني الخطأ ± المعياري للمتوسط (SEM). النظر في قيمة P-من <0.05 كبير (* P <0.05 **؛ P <0.01؛ *** ف <0.001).
3. في فيفو مساريقي الإرواء نموذج
- إعداد / جراحة الماوس
- صيام الماوس في الليلة التي سبقت التجربة من أجل الحد من حركة الأمعاء.
- إعطاء الماوس القديم 6-8 الأسبوع (C57BL / 6) التسكين قبل العملية من قبل الحقن تحت الجلد البوبرينورفين (0.1 ملغم / كغم من وزن الجسم (BW)) 20-30 دقيقة قبل الجراحة.
- تخدير الماوس عن طريق الحقن داخل الصفاق الكيتامين (125 ملغ / كغ BW) وزيلازين (12.5 ملغ / كغ BW). تحقق بواسطة دواسة المنعكس. تطبيق مرهم الطبيب البيطري لمنع جفاف.
- ضع الماوس على وسادة التدفئة التي تسيطر عليها الحرارية عند 37 درجة مئوية على صينية المجهر. وبما أن هذا هو الإجراء المحطة، ليست هناك حاجة لascepti صارمةإجراءات ج. إجراء شق بالقرب من حبل الوريد، وإزالة بلطف الجانب الأيمن من عضلة عنق الرحم وعزل الوريد الوداجي من الأنسجة المحيطة بها.
- إدراج 2 القسطرة الوريدية الفرنسية في الوريد الوداجي الأيمن للتسريب من البكتيريا fluorescently المسمى أو غيرها من الحلول. فتح التجويف البريتوني عن طريق شق البطن خط الوسط واستخدام قطعة قطن لنشر mesenterium وتصور تصلب المساريقي وتداول venular.
- ضع الماوس على الجانب الأيمن على لوحة شفافة وتأمين قنية مع الشريط. استخدام حزمة الساخنة لمنع انخفاض حرارة الجسم. لمنع جفاف الأنسجة، وإسقاط 500 ميكرولتر 0.9٪ كلوريد الصوديوم في الأمعاء.
- مضان المجهر من التصاق البكتيريا إلى الدورة الدموية المساريقي
- العمل في غرفة مظلمة. استخدام مسحات القطن لشل حركة السفن وتصور لهم تحت مجهر مقلوب.
- تطبيق موضعيا 5 ميكرولتر من 10 ملي حل سو كا 2+ -ionophore A23187 الذائبة في DMSO. بعد 10 ثانية، وضخ 100 ميكرولتر المسمى البكتيريا (راجع الخطوة 1) عن طريق القسطرة الوداجي. التقاط صور مرور الزمن. بعد الانتهاء من التجربة، الموت ببطء الماوس وفقا للمبادئ التوجيهية المؤسسية المعتمدة.
- تحليل صورة
- الحصول على الصور الحية باستخدام مجهر مضان مقلوب، استولت باستخدام كاميرا أبيض وأسود وتطويرها باستخدام أي برنامج التصوير. تطبيق الآلي وقت التعرض وعلى النقيض الأمثل محددة إلى المعدات المستخدمة.
- الحصول على الوقت الفاصل بين الصور باستخدام أداة "اكتساب" في شريط الأدوات (الاستحواذ متعددة الأبعاد - الوقت) باستخدام 40 دورات 1000 صور / ثانية. حفظ الصور في شكل ملف الصورة المناسبة.
- صور العملية باستخدام برامج التحليل يماغيج لقياس مجال إشارة الفلورسنت في الصورة. تحديد عتبة لتعيين قيم العتبة الدنيا والعليا، بتجزئة حجم الصور الرمادي إلى وeatures من الفائدة. تحديد المنطقة ذات الاهتمام (الأوعية الدموية) وقياس مساحة محدودة للعتبة والمنطقة من الفائدة. مقارنة التصاق البكتيريا، كما أعرب عن منطقة الفلورسنت استخدام أي من البرامج الإحصائية أو الرسوم البيانية.
النتائج
S. الذهبية الانضمام إلى VWF، مصفوفة تحت البطانة والخلايا البطانية هي ظاهرة تعتمد إجهاد القص
التأكيد على دور إجهاد القص في التفاعل بين S. الذهبية وVWF، أجرينا perfusions على VWF يعطى coverslips المغلفة بأسعار القص المختلفة (لمحة التخطيطي للفي المختبر نموذج نضح في الشكل 1. التصاق S. الذهبية لVWF زيادة مع زيادة معدلات القص من 250 ثانية -1 إلى 2000 ثانية -1 (الشكل 2)، مشيرا إلى أن قوى القص عالية لا تمنع إلا أن يؤكد التصاق البكتيريا إلى VWF.
من أجل تحقيق مساهمة VWF لالتصاق البكتيريا إلى الكولاجين، والمكون الرئيسي للمصفوفة تحت البطانة، ونحن perfused لfluorescently المسمى S. الذهبية على الكولاجين في وجود أو عدم وجود VWF. في غياب VWF، التصاق S. لانخفضت ureus الكولاجين مع زيادة معدلات القص. ومع ذلك، عندما كان VWF الحالي على المدى المتوسط، والتصاق S. زيادة الذهبية مع تزايد معدلات القص (الشكل 3).
في المختبر نموذج تدفق يسمح لنا أيضا لدراسة التصاق البكتيريا إلى الخلايا البطانية تحت التدفق. نحن perfused لHUVECs مع fluorescently المسمى S. الذهبية في معدلات القص من 500 إلى 2000 ثانية -1. حيث أشار، وتنشيط HUVECs مع الكالسيوم 2+ -ionophore، أو التسبب في الإفراج عن VWF. تنشيط الخلايا البطانية وإطلاق سراح VWF لاحق، وزيادة التصاق S. الذهبية (الشكل 4A)، والتي شكلت أنماط نموذجية "مثل سلسلة" المسمى من fluorescently المجموعات البكتيرية الانحياز في اتجاه قوة القص (الشكل 4B)، مما يشير إلى الربط من البكتيريا على طول امتدت خطية VWF الجزيء.
الأولي في الجسم الحيوتتوسط التصاق البكتيريا في الأوردة حشوي التي كتبها VWF
منذ S. العنقودية الذهبية هي قادرة على التمسك VWF، استخدمنا الفئران wildtype (VWF + / +) وVWF التي تعاني من نقص الفئران (VWF - / -) لتحقيق التصاق البكتيريا لجدار الوعاء الدموي تفعيلها في الجسم الحي. في الوقت الحقيقي videomicroscopy الأوردة حشوي يسمح التصور في الجسم الحي تعميم fluorescently المسمى S. الذهبية (نظرة عامة تخطيطي لفي الجسم الحي نموذج نضح تتمثل في الشكل 5).
بعد تفعيل الدوائية من البطانة التي كتبها كا 2+ -ionophore، لاحظنا تراكم المحلي السريع للبكتيريا الفردية ومجاميع من البكتيريا لجدار الوعاء الدموي من WT الفئران (فيديو التكميلي 1 و 2). وقد لوحظ أي ما يقرب من التصاق البكتيريا على جدار الوعاء الدموي تفعيلها من VWF -deficieالإقليم الشمالي الفئران (التكميلي فيديو 3) مقارنة مع التصاق في الفئران WT (الشكل 6). غياب VWF يقلل من قدرة S. الذهبية التمسك جدار الوعاء الدموي تفعيلها.
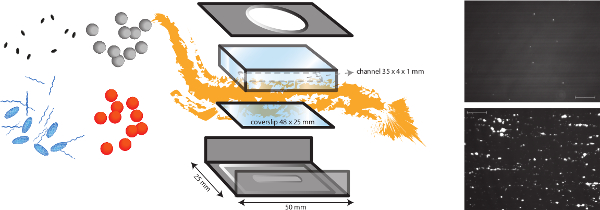
الشكل 1. تمثيل تخطيطي للفي المختبر نموذج التدفق. في المختبر نموذج تدفق هو نموذج متعدد الوظائف، والذي يسمح بدراسة مختلف الآليات التي تعتمد القص مثل التصاق البكتيريا إلى مصفوفة تحت البطانة ولكن أيضا الجلطة التشكيل. يتم وضع غرفة تدفق مواز الصغيرة على ساترة (البلاستيك أو الزجاج) مع طبقات مختلفة من البروتينات والخلايا البطانية. التصاق البكتيريا المختلفة (البرتقال والنقاط الرمادية) يمكن تحليلها، وتأثير وجود بروتينات البلازما، الصفائح الدموية والدم كله يمكن تقييمها. علامات الفلورسنت لالصفائح الدموية (بيضاوية اللون الأزرق) أو fibrinogEN (سلاسل الزرقاء) يمكن أن تستخدم في تركيبة مع مثبطات مختلفة (البيضاوية السوداء) للتمييز العوامل البكتيرية والمضيفة. صور تمثيلية من التصاق البكتيريا من S. وتظهر الذهبية لطلاء الكولاجين في وجود (القاع) أو غياب (أعلى) من VWF (شريط المقياس هو 100 ميكرون). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
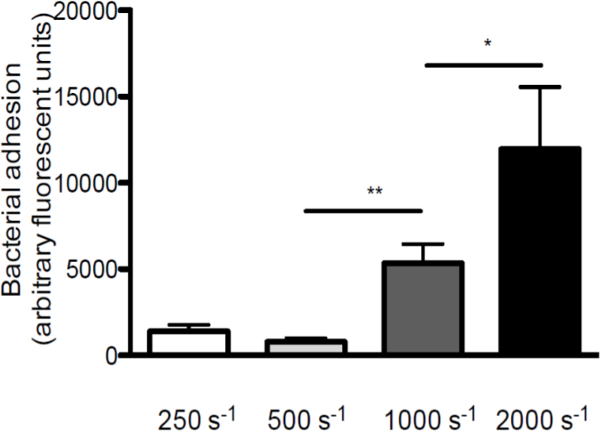
الشكل 2. التصاق S. الذهبية للزيادات VWF مع زيادة معدلات القص. مايكرو مواز نضح غرفة تدفق أكثر المغلفة VWF (50 ميكروغرام / مل) مع fluorescently المسمى S. الذهبية نيومان في معدلات القص من 250 إلى 2000 ثانية -1 (ثانية -1) في المتوسط (ن> 5). يتم التعبير عن جميع النتائج كما يعني ± SEM. * P <0.05، ** p <0.01.
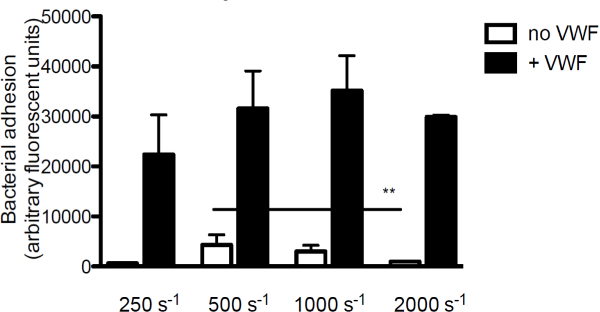
الشكل 3. التصاق S. الذهبية لتحت البطانة غير القص وVWF يتوقف. مايكرو مواز نضح غرفة تدفق أكثر من الكولاجين المغلفة (160 ميكروغرام / مل) مع fluorescently المسمى S. الذهبية نيومان في معدلات القص من 250 إلى 2000 ثانية -1 في المتوسط (ن> 5). كان VWF (60 ميكروغرام / مل) الحالي على المدى المتوسط حيث المشار إليها. يتم التعبير عن جميع النتائج كما يعني ± SEM. ** p <0.01.
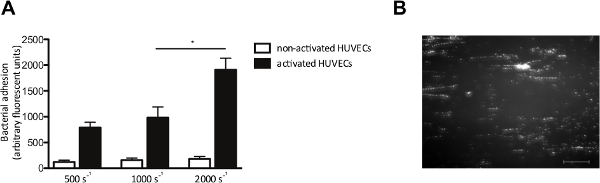
الرقم 4. التصاق S. الذهبية لتنشيط الخلايا البطانية هو القص تعتمد. غرفة تدفق نضح مايكرو مواز على الخلايا البطانية. تم تفعيلها (A) الخلايا البطانية الوريد السري الإنسان مع الكالسيوم 2+ -ionophore A23187 (0.1 ملم) يليه نضح 10 دقيقة وصفت من fluorescently S. الذهبية نيومان في معدلات القص من 500 إلى 2000 ثانية -1 في المتوسط (ن> 5). يتم التعبير عن جميع النتائج كما يعني ± SEM. * P <0.05. (B) صورة الصغرى مواز غرفة تدفق نضح على HUVECs تفعيلها مع S. الذهبية بمعدل القص من 1000 ثانية -2. S. الذهبية تشكل سلاسل ± 200 ميكرون طول، مما يشير إلى الانضمام إلى multimers VWF (شريط المقياس هو 100 ميكرون). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

يتم إدخال الرقم 5. لمحة التخطيطي للفي الجسم الحي نموذج التروية المساريقي. حق الوريد الوداجي القسطرة (الخط الأصفر) لإدارة فلورالبكتيريا المسماة escently (نقطة البرتقالي)، ومواد التخدير إضافية أو المكونات الأخرى مثل مثبطات الدوائية والأجسام المضادة. فتح التجويف البريتوني وينتشر mesenterium لتصور الأوعية الدموية (الأوردة والشرايين) تحت المجهر مضان. بعد تفعيل الدوائية من البطانة من قبل -ionophore الكالسيوم 2+، الذي يدفع الافراج عن VWF، يمكن حقن البكتيريا عن طريق الوريد الوداجي القسطرة. الفيديو في الوقت الحقيقي داخل الأوعية المجهر يسمح التصور في الجسم الحي تعميم البكتيريا fluorescently المسمى ونتج ذلك عن تكوين البكتيريا الصفائح الدموية الجلطة الدموية. الرجاء النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
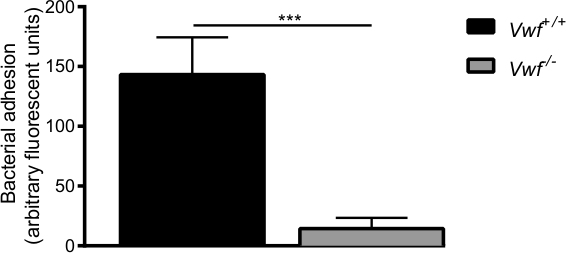
الرقم 6. التصاق الأولي من S. الذهبية ليتم بوساطة البطانة تفعيلها في الحي بواسطة VWF في الجسم الحي وريدي المساريقي نموذج نضح مع C57BL / 6- VWF + / + وC57BL / 6- VWF - / - الفئران. التصاق المسمى من fluorescently S. الذهبية لجدار الوعاء الدموي تفعيلها محليا هو أقل من ذلك بكثير في VWF - / - الفئران. يتم التعبير عن جميع النتائج كما يعني ± SEM. *** P <0.001، ن> 7.
الفيديو 1: في الوقت الحقيقي التصاق S. الذهبية لتنشيط جدار الوعاء الدموي في VWF + / + الفئران. الرجاء انقر هنا لمشاهدة هذا الفيديو.
FO: المحافظة على together.within صفحة = "دائما"> 
فيديو 2: في الوقت الحقيقي تشكيل الكلي والانصمام من S. الذهبية في VWF + / + الفئران. الرجاء انقر هنا لمشاهدة هذا الفيديو.

الفيديو 3: في الوقت الحقيقي التصاق S. الذهبية لتنشيط جدار الوعاء الدموي في VWF - / - الفئران في الجسم الحي المساريقي نموذج نضح مع VWF + / + وVWF - / - الفئران. وكان خمسة ميكرولتر من الكالسيوم 2+ -ionophore (10 ملم) APPLIإد إلى المنطقة من السرير الوعائي تصور. A تعليق المسمى كربوكسي فلوريسئين-S. تم حقن الذهبية عن طريق القسطرة الوداجي. وتصور تداول المساريقي تحت مجهر مقلوب. الرجاء انقر هنا لمشاهدة هذا الفيديو.
Discussion
إجهاد القص هو عامل حاسم لالتصاق البكتيريا في وقت مبكر لجدار الوعاء الدموي وللجيل اللاحق من اللف أو تنبتات شغافية والتهابات النقيلي 4،5. وصفنا التكميلية في التجارب المختبرية والنماذج الحية لدراسة التسبب في العدوى داخل الأوعية الدموية تحت إجهاد القص الفسيولوجية. وقد سمحت هذه النماذج لنا التعرف فون ويلبراند ملزم عامل البروتين (vWbp) مثل S. الرئيسي البروتين الذهبية للتفاعل في إطار تدفق مع جدار الأوعية الدموية المصاب تعريض VWF 4.
التهابات داخل الأوعية الدموية، والتهاب الشغاف على وجه الخصوص، مصدرا للقلق ليس فقط بسبب فشل الجهاز الناجم عن الإنتان والموت، ولكن أيضا بسبب ('المتنقل') مضاعفات المحلية والبعيدة. أن تسبب التهاب الشغاف والتهابات المتنقل، والبكتيريا يجب أن تلتزم جدار الوعاء الدموي، وبالتالي مقاومة إجهاد القص المتدفقة الدم. معظمدراسات على البكتيريا الفوعة أجريت العوامل في ظروف ثابتة. ومع ذلك، قد أنشأت هذه التفاعلات لا تصمد أمام قوى القص والدراسات في ظل ظروف تدفق يمكن أن تكشف عن عوامل جديدة، غير المعترف بها سابقا في تفاعل البكتيريا المضيف.
باستخدام غرفة تدفق الصغرى بالتوازي مع ذلك، نحن وغيرنا قد أظهرت أهمية VWF للالتصاق الأوعية الدموية. تحت إجهاد القص، VWF تدريجيا يتفتح من هيكلها كروي يستريح، ويعرض المجال A1 التي تتفاعل مع الصفائح الدموية عن طريق مستقبلات GPIB 6 منه. تم غرف تدفق تستخدم على نطاق واسع لدراسة وظيفة الصفائح الدموية 7.
ومن اللافت للنظر أيضا S. الذهبية التصاق تحت تدفق يتطلب VWF، وعلى وجه الخصوص في المجال A1 التي يتعرض لها على القص. حددنا vWbp للتوسط VWF ملزمة. vWbp هو المخثرة التي تساهم في S. الذهبية الفيزيولوجيا المرضية من خلال تفعيل البروثرومبين المضيف. Staphylothrombin، والدقةulting المجمع من المخثرة البكتيرية والبروثرومبين، يحول الفيبرينوجين إلى الليفين غير قابلة للذوبان 8،9. وقد أظهرت دراساتنا أن vWbp لا يتم تنشيط البروثرومبين فحسب، بل يؤدي تشكيل المجاميع البكتيريا الليفين، الصفائح الدموية، التي تعزز التصاق الأوعية الدموية تحت تدفق 4،10،11.
في المختبر تدفق نموذج غرفة يسمح لدراسة مختلف اللاعبين في التصاق البكتيريا إلى المكونات الخلوية أو المصفوفة. عوامل الفوعة البكتيرية يمكن دراستها باستخدام المسوخ أو البكتيريا غير ضارة معربا عن البروتينات السطحية النوعية. بدلا من ذلك، مثبطات دوائية أو الأجسام المضادة حجب يمكن أن تضاف إلى المتوسطة في غرفة التدفق. دور العوامل المضيفة مثل مختلف مكونات المصفوفة خارج الخلية يمكن دراستها باستخدام coverslips مع الطلاء المختلفة. كما يمكن تغطيتها لل coverslips مع الخلايا البطانية، والتي من حالة التنشيط يمكن عن طريق التضمين مضيفا التحفيز والتشجيع محددة. APAغ من جدار الأوعية الدموية، ومساهمة من خلايا الدم المضيفة وبروتينات البلازما يمكن دراستها عن طريق إضافة هذه العوامل إلى المتوسطة المتدفقة. وبالتالي، يمكن دراسة ظروف مختلفة من التعقيد المتزايد في ظل ظروف موحدة للتدفق الصفحي لكشف التفاعلات التي تسمح للبكتيريا على الانضمام إلى جدار الوعاء الدموي في الجسم الحي.
يتم دراسة التفاعلات التي تم تحديدها في نموذج في المختبر في وقت لاحق في نموذج حيواني لاختبار أهميتها في كائن معقد. البعض في النماذج الحية لدراسة التفاعلات الحيوية في ظل تدفق تم وصفها، مثل الهامستر ظهري طبقات الجلد الغرفة 12 ونموذج المشمرة 13. وبالمقارنة، فإن النموذج التروية المساريقي الموصوفة هنا يوفر العديد من المزايا بسبب سهولة استخدامه وإمكانية تختلف استضافة الخلفية الوراثية للفئران وتقييم التدخلات الدوائية.
في الختام، ونماذج وصفهاتوفر إمكانية لدراسة البروتينات السطحية ليس فقط من S. الذهبية، ولكن العديد من الكائنات الحية الدقيقة الأخرى في الخلفيات المضيف مختلفة، من أجل فهم أفضل التسبب في التهابات الأوعية الدموية.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وأيد هذا العمل من قبل فون للحصول على Wetenschappelijk Onderzoek (FWO) VLAANDEREN G0466.10، 11I0113N. "إدي ميركس منحة بحثية" و "Sporta البحوث غرانت" لأمراض القلب للأطفال، UZ لوفين، بلجيكا (JC)؛ ويدعم مركز الجزيئية والأوعية الدموية الأحياء التي Programmafinanciering KU لوفين (PF / 10/014)، من قبل "Geconcentreerde Onderzoeksacties" (غوا 2009/13) من جامعة لوفين و منحة بحثية من بورنغير إنغلهايم،.
Materials
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
References
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved