Method Article
In vitro et in vivo modèle pour étudier l'adhésion bactérienne au navire muraux dans des conditions de débit
Dans cet article
Résumé
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
Résumé
Afin de provoquer des infections endovasculaires et l'endocardite infectieuse, les bactéries ont besoin pour être en mesure d'adhérer à la paroi du vaisseau tout en étant exposés à la contrainte de cisaillement du sang qui coule.
Pour identifier les facteurs hôtes bactériennes et qui contribuent à l'adhérence de micro-organismes vasculaire, des modèles appropriés qui étudient ces interactions dans des conditions de cisaillement physiologiques sont nécessaires. Ici, nous décrivons un modèle in vitro de la chambre d'écoulement en ce que permet d'étudier l'adhérence bactérienne aux différents composants de la matrice extracellulaire ou aux cellules endothéliales, et un modèle de microscopie intravitale qui a été développé pour visualiser directement l'adhérence initiale des bactéries à la circulation splanchnique in vivo . Ces méthodes peuvent être utilisées pour identifier les facteurs hôtes bactériennes et nécessaires pour l'adhésion des bactéries sous flux. Nous illustrons la pertinence de la contrainte de cisaillement et le rôle du facteur de von Willebrand pour l'adhésion de Staphylococcus aureus utilisant à la fois in vitro et in vivo dans le modèle.
Introduction
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
Protocole
Les expérimentations animales ont été approuvés par le comité d'éthique de la KU Leuven.
1. Préparation des bactéries in vitro perfusions et expériences in vivo
- Nous avons utilisé S. aureus souche Newman pour toutes les expériences décrites dans ce manuscrit. S. aureus Newman a été stocké dans Brain Heart Infusion (BHI) avec 10% de glycérol à -80 ° C.
- Utilisez une boucle stérile pour gratter les bactéries congelées off et l'inoculer dans 5 ml bouillon de soja tryptique (TSB) O / N à 37 ° C (600 OD> 3).
- Laver les bactéries par centrifugation (2600 g, RT, 5 min) et remettre en suspension le culot bactérien dans 5 ml de PBS (tampon phosphate salin).
- Préparer une solution à 1 mg / ml de 5 (6) ester de N-hydroxysuccinimidyle carboxy-fluorescéine (carboxy-fluorescéine) dans de l'éthanol. Diluer le / solution à 1 mg ml carboxy-fluorescéine à 150 pg / ml dans de l'eau de qualité laboratoire (par exemple, l'eau MilliQ). Protéger les tubes de lumièreavec une feuille d'aluminium et conserver à -20 ° C.
- Centrifuger les bactéries (2600 xg, RT, 5 min). Remettre en suspension le culot bactérien dans 800 ul de PBS et ajouter 200 ul (concentration finale de 30 ug / ml pour les expériences de perfusion) ou 400 pl (concentration finale 50 pg / ml pour les expériences in vivo) de la / ml solution de carboxy-fluorescéine 150 ug. Protéger les tubes de la lumière avec du papier aluminium et laisser incuber pendant 30 min à température ambiante sur un agitateur.
- Après marquage, bloc avec bovin solution à 6% de sérum albumine (BSA) dans du PBS.
- Diluer à l'aide de bactéries densitométrie optique (DO), une DO600 de 0,65 pour les expériences in vitro (correspondant à environ 3 x 10 8 unités formant des colonies (UFC) / ml pour S. aureus) et une DO 600 de 1,8 pour les expériences in vivo ( correspondant à environ 1 x 10 9 CFU / ml pour S. aureus) dans du PBS. Protéger les tubes de la lumière avec une feuille d'aluminium et laisser sur la glace.
2. Des expériences in vitro perfusion
- Revêtement de verre Lamelles
- Diluer le facteur de von Willebrand (VWF) (Haemate P, concentration stock de 2400 pg / ml) dans de l'eau de qualité laboratoire (déminéralisée distillée) à une concentration finale de 50 pg / ml.
- Diluer le collagène dans une solution isotonique de glucose (solution SKF, pH 2.7 à 2.9, tel que fourni par le fabricant) à une concentration finale de 160 ug / ml.
- des lamelles de verre de manteau (24 × 50 mm) avec VWF ou du collagène par 200 ul de déposer le revêtement sur du parafilm et placer la lamelle couvre-objet au-dessus de la gouttelette. La goutte se propage le long de la surface de la lamelle.
- Incuber la lamelle couvre-objet dans un conteneur humidifié pendant 4 heures à température ambiante. Soulevez délicatement les lamelles du parafilm avec une aiguille émoussée. Montez la lamelle dans la partie inférieure de la chambre d'écoulement.
- Revêtement de plastique Slips avec les cellules endothéliales
- Bordereaux Manteau en plastique(1 puits chambre de culture de cellules APC, Sarstedt, Allemagne) avec 1 ml d'une solution de gélatine à 1% dans du PBS et incuber pendant 30 min à 37 ° C. des cellules de semence humaine endotheliales de veine ombilicale (HUVEC) sur les fiches de gélatine revêtues de plastique et les cultiver à 70-80% de confluence. Montez le glissement plastique dans la partie inférieure de la chambre d'écoulement.
- Perfusion Experiment
REMARQUE: une vue d'ensemble schématique du modèle in vitro de perfusion est représenté sur la figure 1.- Effectuer des études in vitro l'adhérence de bactéries dans une chambre d'écoulement de la plaque de micro-parallèle à une contrainte de cisaillement laminaire entre 2,5 dyne / cm 2 et 20 dyne / cm 2 pour simuler des conditions d'écoulement physiologiques.
- Le (conception interne) chambre d'écoulement est constituée d'une structure métallique et une chambre de perfusion faite de plexiglas (poly (méthyl) méthacrylate de méthyle (PMMA)). En le connectant à une pompe à perfusion de haute précision (PHD 2000 Infusion, Harvard Apparatus, USA), nous pouvons générer des flux de rates entre 0,0001 ul / min et 220,82 ml / min.
- Connecter le tube à la partie supérieure de la chambre d'écoulement et d'injecter dans le tube support. Placez délicatement la partie supérieure de la chambre d'écoulement sur le dessus de la partie inférieure et assembler la chambre d'écoulement. Soyez prudent pour éviter les bulles d'air. Injecter 1 ml de milieu à travers la chambre pour vous assurer que la chambre ne fuit pas et pour éliminer la solution de revêtement en excès. Éviter les bulles d'air.
- Placez la souris sur un coussin chauffant thermo-régulée à 37 ° C sur un plateau de microscope. Etant donné que cette procédure est un terminal, il n'y a pas besoin de procédures aseptiques strictes. Faire une incision près de la veine jugulaire, retirez délicatement le côté droit du muscle col de l'utérus et d'isoler la veine jugulaire du tissu environnant.
- Mettre en place la pompe de perfusion et microscope à fluorescence. réglages de la pompe à perfusion dépendent du diamètre de la seringue et le débit souhaité (voir section 2.4). A partir de maintenant, travailler dans une pièce sombre.
- Revêtement VWF:
- Remplir une seringue avec des bactéries marquées par fluorescence et de le connecter au tube d'entrée. Éviter les bulles d'air. Démarrer la pompe de perfusion pendant 10 minutes. Le temps de perfusion dépend du taux de cisaillement et le revêtement, les bactéries et moyen utilisés et devrait représenter l'état d'équilibre de l'adhérence.
- Après 10 min, lavé de bactéries non liées par la connexion d'une seringue avec du PBS pour le tube d'entrée et de démarrage de la pompe de perfusion.
- Prenez au moins 15 images ou de vidéos en différents endroits après le processus de lavage. Les bactéries sont de petite taille et potentiellement difficile de se concentrer sur. Avant l'expérience de flux in vitro, le plan focal approprié peut être obtenu en plaçant une goutte de bactéries marquées par fluorescence sur une lamelle couvre-objet et en plaçant la lamelle couvre-objet dans la chambre d'écoulement. Ensuite, recherchez le plan focal approprié et enregistrer les paramètres.
Remarque: Au cours de l'expérience de flux in vitro, la capture des images au cours de l'étape de lavage (± 5 min après le début) fait en sorte que seule lasignal pour les bactéries adhérentes est capturé.
- Collagène Revêtement:
- Ajouter 60 pg / ml VWF aux bactéries marquées par fluorescence juste avant de commencer la perfusion. Remplir une seringue avec des bactéries marquées par fluorescence ou des bactéries marquées par fluorescence complété avec 60 ug / ml VWF et de le connecter au tube d'entrée. Éviter les bulles d'air. Répétez les étapes 2.3.5.2 à 2.3.5.3
- Cellules endothéliales:
- Activer les cellules endotheliales par perfusion avec une solution à 0,1 mM de Ca 2+ -ionophore A23187 (solution mère 10 mM dissous dans du diméthylsulfoxyde (DMSO)) dans du DMEM à la même vitesse de cisaillement que la perfusion bactérienne pendant 10 minutes par perfusion avec un 0,1 mm. Répétez les étapes 2.3.5.2 à 2.3.5.3.
- Calculer le taux de cisaillement et de cisaillement comme suit.
taux de cisaillement = 6Q / wh 2
Où: Q: débit en ml / min, w flux: largeur en cm, h: hauteur en cm
Contrainte de cisaillement (de τ) = cisaillement ratex viscosité (μ)
Où μ: moyenne: 0.01 x sec dynes / cm 2, le sang total: 0,04 x sec dynes / cm 2 - L'analyse d'image
- Obtenir des images en direct en utilisant un microscope inversé à fluorescence avec une caméra noir et blanc et de développer l'utilisation de logiciels d'imagerie. Utilisez le temps d'exposition de 1,5 sec. Prenez plusieurs instantanés (au moins 15) réparties de manière aléatoire sur la surface revêtue de la chambre de flux et de les enregistrer dans le format de fichier approprié.
- Effectuer l'analyse d'image avec ImageJ. Soustraire le fond pour enlever milieux lisses continues de l'image (Process - Contexte Soustraire) et définir le seuil à fixer des valeurs limites inférieure et supérieure, la segmentation des images d'échelle de gris en caractéristiques d'intérêt. Mesurer la zone limitée au seuil.
- Comparer adhésion bactérienne, exprimée en partie fluorescente, par exemple, en utilisant un logiciel d'analyse statistique. Comparer les groupes utilisant ANOVA unidirectionnelle ou two-tailed test t de Student. Signaler toutes les valeurs que moyenne ± erreur standard de la moyenne (SEM). Envisager une valeur p <0,05 significative (* p <0,05; ** p <0,01; *** p <0,001).
3. mésentérique perfusion in vivo Modèle
- Préparation / chirurgie de la souris
- Jeûner la souris la nuit avant l'expérience, afin de limiter le mouvement de l'intestin.
- Donner une vieille souris 6-8 de la semaine (C57BL / 6) l'analgésie pré-opératoire par une injection sous-cutanée de la buprénorphine (0,1 mg / kg de poids corporel (BW)) 20-30 min avant la chirurgie.
- Anesthésier la souris par injection intra-péritonéale de kétamine (125 mg / kg de poids corporel) et de xylazine (12,5 mg / kg de poids corporel). Vérifiez par la pédale réflexe. Appliquer une pommade vétérinaire pour prévenir la sécheresse.
- Placez la souris sur un coussin chauffant thermo-régulée à 37 ° C sur un plateau de microscope. Etant donné que cette procédure est un terminal, il n'y a pas besoin de ascepti strictprocédures c. Faire une incision près de la veine jugulaire, retirez délicatement le côté droit du muscle col de l'utérus et d'isoler la veine jugulaire du tissu environnant.
- Insérez un cathéter intraveineux 2 français dans la veine jugulaire droite pour perfusion de bactéries marquées par fluorescence ou d'autres solutions. Ouvrez la cavité péritonéale par une incision abdominale médiane et utiliser des cotons-tiges pour répandre le mésentère et de visualiser le artérioles mésentériques et la circulation des veinules.
- Placez la souris sur le côté droit sur une plaque transparente et fixer la canule avec du ruban adhésif. Utilisez une compresse chaude pour éviter l'hypothermie. Pour prévenir la déshydratation du tissu, déposer 500 pi NaCl à 0,9% sur les intestins.
- La microscopie à fluorescence de l'adhérence bactérienne à la circulation mésentérique
- Travailler dans une pièce sombre. Utilisez des cotons-tiges pour immobiliser les navires et de les visualiser sous un microscope inversé.
- Appliquer localement 5 pi d'une solution à 10 mM of le Ca 2+ A23187 -ionophore dissous dans du DMSO. Après 10 secondes, injecter 100 pi bactéries marquées (voir l'étape 1) à travers le cathéter jugulaire. Prenez des photos de time-lapse. Après l'expérience est terminée, euthanasier la souris selon les directives institutionnels approuvés.
- Analyse d'image
- Obtenir des images en direct en utilisant un microscope inversé à fluorescence, capturé à l'aide d'une caméra noir et blanc et développée en utilisant un logiciel d'imagerie. Appliquer le temps d'exposition automatique et l'optimisation de contraste spécifique à l'équipement utilisé.
- Acquérir les images de time-lapse en utilisant l'outil "acquisition" dans la barre d'outils (des acquisitions multidimensionnels - Time) en utilisant 40 cycles de 1 000 images / sec. Enregistrez les images dans un format de fichier image approprié.
- Traiter les images à l'aide de logiciels d'analyse ImageJ pour mesurer la surface de signal fluorescent par image. Définir le seuil à fixer des valeurs limites inférieure et supérieure, la segmentation des images d'échelle de gris dans fonctions d'intérêt. Identifier la région d'intérêt (vaisseau sanguin) et mesurer la zone limitée au seuil et la région d'intérêt. Comparer adhésion bactérienne, exprimée en zone fluorescente utilisant un logiciel statistique ou graphique.
Résultats
S. aureus adhésion à VWF, matrice sous-endothéliale et les cellules endothéliales est un phénomène dépendant de la contrainte de cisaillement
Pour souligner le rôle de la contrainte de cisaillement dans l'interaction entre S. aureus et VWF, nous avons réalisé des perfusions plus de VWF lamelles recouvertes de différents taux de cisaillement (un aperçu schématique du modèle in vitro de perfusion est donné dans la figure 1. L'adhérence de S. aureus VWF a augmenté avec l'augmentation des taux de cisaillement de 250 sec -1 à 2000 s-1 (Figure 2), ce qui indique que les forces de cisaillement élevées mais ne inhibent renforcent l'adhérence de bactéries à VWF.
Afin d'étudier la contribution du VWF à l'adhérence bactérienne au collagène, la principale composante de la matrice sous-endothéliale, nous perfusé marqué par fluorescence S. aureus sur le collagène en présence ou en l'absence de VWF. En l'absence de VWF, l'adhérence de S. uneuréus au collagène diminue avec l'augmentation des taux de cisaillement. Toutefois, lorsque le VWF est présent dans le milieu, l'adhérence de S. aureus a augmenté avec l'augmentation des taux de cisaillement (Figure 3).
Le modèle in vitro d'écoulement en nous permet également d'examiner l'adhésion des bactéries aux cellules endothéliales sous flux. Nous perfusé avec HUVEC marqué par fluorescence S. aureus à un taux de cisaillement de 500 à 2000 s -1. Le cas échéant, HUVECs ont été activés avec un Ca 2+ -ionophore, à provoquer la libération du VWF. Activation des cellules endothéliales et la libération subséquente VWF, une adhérence accrue de S. aureus (figure 4A), qui a formé des motifs de chaîne "analogue" typiques de grappes de bactéries marquées par fluorescence alignées dans la direction de la force de cisaillement (figure 4B), ce qui suggère la liaison de bactéries le long d'une molécule linéaire VWF-étiré.
Initial in vivoadhésion bactérienne dans les veines splanchniques est médiée par VWF
Depuis S. aureus est en mesure d'adhérer à VWF, nous avons utilisé des souris de type sauvage (vWF + / +) et VWF souris déficientes (vWF - / -) pour étudier l'adhésion bactérienne sur la paroi du vaisseau activé in vivo. Vidéomicroscopie en temps réel des veines splanchniques permis la visualisation in vivo de circuler marqué par fluorescence S. aureus (Vue d'ensemble schématique du modèle in vivo de perfusion est représenté sur la figure 5).
Après l'activation pharmacologique de l'endothélium par le Ca2 + -ionophore, nous avons observé une accumulation locale rapide des bactéries et des agrégats de bactéries individuelles à la paroi de la cuve de souris WT (Vidéos supplémentaire de 1 et 2). Presque aucune adhésion des bactéries n'a été observée sur la paroi de la cuve du vWF activé -deficiesouris nt (vidéo supplémentaire 3) par rapport à l'adhérence chez les souris WT (Figure 6). L'absence de VWF diminue la capacité de S. aureus à adhérer à la paroi du vaisseau activé.
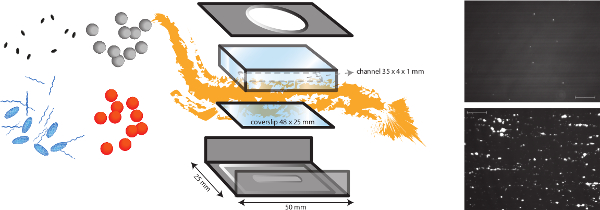
Figure 1. Représentation schématique du modèle de flux in vitro. Le modèle d'écoulement vitro dans un modèle multifonctionnel, ce qui permet l'étude des différents mécanismes qui dépendent de cisaillement telle que l'adhérence bactérienne à la matrice sous-endothéliale, mais aussi la formation thrombus. La chambre d'écoulement micro-parallèle est placée sur une lamelle couvre-objet (plastique ou verre) avec différents revêtements de protéines et de cellules endotheliales. L'adhérence des bactéries différentes (orange et points gris) peut être analysé, et l'impact de la présence de protéines de plasma, les plaquettes et le sang total peut être évalué. Des marqueurs fluorescents pour les plaquettes (bleu) ou ovales fibrinogfr (strings bleu) peut être utilisé en combinaison avec différents inhibiteurs (ovales noires) de distinguer les facteurs bactériens et d'accueil. Des images représentatives de l'adhésion bactérienne de S. aureus au collagène revêtement en présence (en bas) ou l'absence (en haut) du VWF sont présentées (barre d'échelle est de 100 um). S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
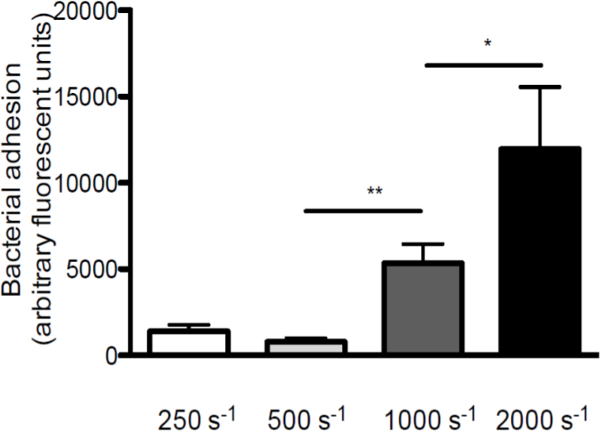
Figure 2. L'adhérence de S. aureus à VWF augmente avec l'augmentation des taux de cisaillement. Micro-parallèle perfusion de la chambre d'écoulement au-dessus de VWF enrobé (50 pg / ml) marqué par fluorescence avec S. aureus Newman au taux de cisaillement de 250 à 2.000 sec -1 (sec -1) dans le milieu (n> 5). Tous les résultats sont exprimés en moyenne ± SEM. * P <0,05, ** p <0,01.
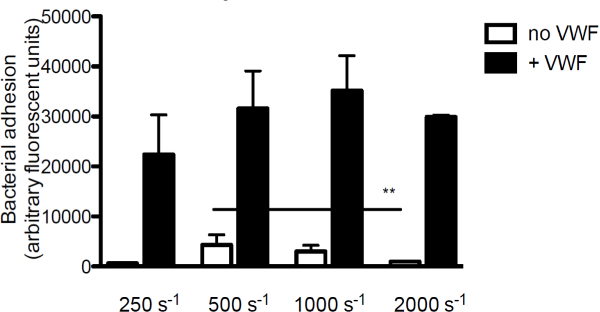
Figure 3. L'adhérence de S. aureus à sous-endothélium est dépendante de cisaillement et VWF. Micro-parallèle perfusion de la chambre d'écoulement au-dessus de collagène revêtu (160 ug / ml) marqué par fluorescence avec S. aureus Newman au taux de cisaillement de 250 à 2.000 sec -1 en moyenne (n> 5). VWF (60 ug / ml) était présent dans le milieu spécification. Tous les résultats sont exprimés en moyenne ± SEM. ** P <0,01.
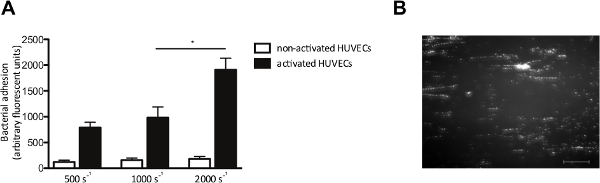
Figure 4. L'adhérence de S. aureus aux cellules endothéliales activées est dépendante cisaillement. chambre d'écoulement perfusion de Micro-parallèle sur les cellules endothéliales. (A) les cellules endothéliales de veine ombilicale humaine ont été activés avec le Ca2 + A -ionophore23 187 (0,1 mM) suivie d'une perfusion de 10 min marqué par fluorescence S. aureus Newman au taux de cisaillement de 500 à 2.000 sec -1 en moyenne (n> 5). Tous les résultats sont exprimés en moyenne ± SEM. * P <0,05. (B) Image de la micro-parallèle chambre d'écoulement perfusion sur HUVEC activées avec S. aureus à un taux de cisaillement de 1000 sec -2. S. aureus forme des chaînes de ± 200 microns de longueur, ce qui suggère l'adhésion à multimères VWF (barre d'échelle est de 100 um). S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.

Figure 5. Un aperçu schématique du modèle de perfusion mésentérique in vivo. Un droit de cathéter de la veine jugulaire (ligne jaune) est inséré pour l'administration de fluorbactéries escently marqués (points orange), des anesthésiques supplémentaires ou d'autres composants tels que les inhibiteurs pharmaceutiques et des anticorps. La cavité peritoneale est ouverte et le mésentère, réparties de visualiser les vaisseaux sanguins (artériels et veineux) sous un microscope à fluorescence. Après l'activation pharmacologique de l'endothélium par un -ionophore Ca2 +, ce qui induit la libération de VWF, les bactéries peuvent être injectés à travers le cathéter de la veine jugulaire. Vidéo en temps réel intravasculaire microscopie permet la visualisation in vivo de circulation bactéries marquées par fluorescence et de la formation résultant de bactéries-plaquettaires thrombus. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
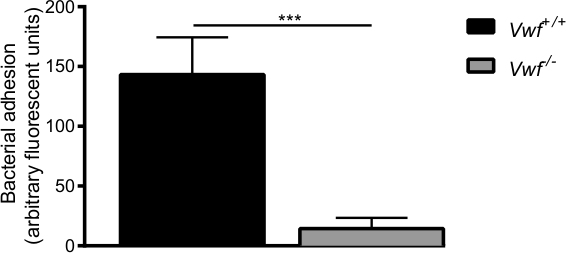
Figure 6. L'adhérence initiale de S. aureusà l'endothélium activé in vivo est médiée par VWF In vivo veineuse modèle de perfusion mésentérique avec C57BL / 6- VWF + / + et C57BL / 6- VWF -. / - souris. L'adhérence de S. marqué par fluorescence aureus à la paroi du vaisseau actif localement est significativement plus faible dans Vwf - / - souris. Tous les résultats sont exprimés en moyenne ± SEM. *** P <0,001, n> 7.
Vidéo 1: adhérence en temps réel de S. aureus à la paroi du vaisseau activé dans + / + souris VWF. S'il vous plaît cliquer ici pour voir cette vidéo.

Vidéo 2: la formation d'agrégats en temps réel et l'embolisation de S. aureus dans Vwf des souris + / +. S'il vous plaît cliquer ici pour voir cette vidéo.

Vidéo 3: adhérence en temps réel de S. aureus à la paroi du vaisseau activé dans Vwf - / -. In vivo souris modèle de perfusion mésentérique avec Vwf + / + et Vwf souris - / -. Cinq ul d'une -ionophore Ca2 + (10 mM) a été applied dans la région du lit vasculaire visualisée. Une suspension de carboxy-fluorescéine S. aureus a été injecté à travers le cathéter jugulaire. La circulation mésentérique a été visualisée sous un microscope inversé. S'il vous plaît cliquer ici pour voir cette vidéo.
Discussion
Contrainte de cisaillement est un facteur crucial pour l'adhésion bactérienne précoce de la paroi du vaisseau et de la génération suivante de endovasculaire ou végétations endocardiaques et les infections métastatiques 4,5. Nous avons décrit complémentaire in vitro et dans des modèles in vivo pour étudier la pathogenèse des infections endovasculaires moins de contrainte de cisaillement physiologique. Ces modèles ont permis d'identifier le facteur von Willebrand-binding protein (vWbp) comme le principal S. aureus protéines d'interagir sous flux avec une paroi vasculaire lésée exposer VWF 4.
Infections endovasculaires, et l'endocardite infectieuse, en particulier, sont une préoccupation non seulement en raison de l'échec et de la mort organe induite par le sepsis, mais aussi à cause de ('') métastatiques complications locales et distantes. Pour provoquer l'endocardite infectieuse et les infections métastatiques, les bactéries ont à adhérer à la paroi de la cuve et donc résister à la contrainte de cisaillement de sang qui coule. Plusétudes sur les facteurs de virulence des bactéries ont été réalisées dans des conditions statiques. Cependant, ces interactions établies pourraient ne pas résister à des forces de cisaillement et des études dans des conditions d'écoulement peut révéler de nouveaux facteurs, non comptabilisés précédemment dans interaction bactérie-hôte.
Utilisation de la chambre d'écoulement micro-parallèle, nous et d'autres avons montré l'importance de VWF pour l'adhésion vasculaire. Sous la contrainte de cisaillement, VWF progressivement se déploie à partir de sa structure globulaire repos, et expose le domaine A1 qui interagit avec les plaquettes via son récepteur GPIb 6. chambres d'écoulement ont été largement utilisés pour étudier la fonction des plaquettes 7.
De manière remarquable, également S. aureus adhérence sous flux nécessite VWF, et en particulier le domaine A1 qui est exposée à un cisaillement. Nous avons identifié vWbp de médiation contraignant VWF. vWbp est une coagulase qui contribue à S. aureus physiopathologie en activant la prothrombine de l'hôte. Staphylothrombine, les resUlting complexe d'une coagulase bactérienne et la prothrombine, convertit le fibrinogène en fibrine insoluble 8,9. Nos études ont montré que seulement vWbp ne pas activer la prothrombine, mais déclenche la formation d'agrégats de bactéries fibrine-plaquettes, qui améliorent l'adhérence aux vaisseaux sanguins sous flux 4,10,11.
Le modèle in vitro de la chambre de flux permet d'étudier les différents acteurs de l'adhérence bactérienne aux composants cellulaires ou matrice. Facteurs de virulence bactériennes peuvent être étudiés en utilisant des mutants ou des bactéries exprimant des protéines inoffensives de surface spécifiques. En variante, les inhibiteurs pharmacologiques ou des anticorps bloquants peuvent être ajoutés au milieu dans la chambre d'écoulement. Le rôle des facteurs de l'hôte tels que les différents constituants de la matrice extracellulaire peut être étudiée en utilisant des lamelles avec différents revêtements. Les lamelles peuvent également être recouverts avec des cellules endotheliales, dont l'état d'activation peut être modulée par adjonction de stimulateurs spécifiques. Apart de la paroi vasculaire, la contribution des cellules du sang de l'hôte et des protéines plasmatiques peut être étudiée en ajoutant ces facteurs dans le milieu en écoulement. Par conséquent, différentes conditions de plus en plus complexes peuvent être étudiés dans des conditions normalisées de flux laminaire pour démêler les interactions qui permettent aux bactéries d'adhérer à la paroi du vaisseau in vivo.
Interactions identifiés dans le modèle in vitro sont ensuite étudiés dans un modèle animal pour tester leur pertinence dans un organisme complexe. Autres modèles in vivo pour étudier les interactions dynamiques sous écoulement ont été décrits, comme la chambre de hamster pli cutané dorsal 12 et le modèle de cremaster 13. En comparaison, le modèle de perfusion mésentérique décrit ici offre plusieurs avantages en raison de sa facilité d'utilisation, la possibilité de faire varier accueillir fond génétique des souris et d'évaluer les interventions pharmacologiques.
En conclusion, les modèles décritsoffrir la possibilité d'étudier des protéines non seulement de S. de surface aureus, mais de nombreux autres micro-organismes dans différents milieux d'accueil, afin de mieux comprendre la pathogenèse des infections vasculaires.
Déclarations de divulgation
Les auteurs ont rien à révéler.
Remerciements
Ce travail a été soutenu par le Fonds voor Wetenschappelijk Onderzoek (FWO) Vlaanderen G0466.10, 11I0113N; "Eddy Merckx subvention de recherche» et le «Sporta recherche Grant" pour cardiologie pédiatrique, UZ Leuven, Belgique (JC); le Center for Molecular and Vascular Biology est soutenu par le Programmafinanciering KU Leuven (PF / 10/014), par le "Geconcentreerde Onderzoeksacties" (GOA 2009/13) de l'Université de Louvain et une subvention de Boehringer-Ingelheim recherche.
matériels
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
Références
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon