Method Article
在体外和体内模型来研究细菌粘附于血管壁下流动条件
摘要
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
摘要
为了使血管内感染和感染性心内膜炎,细菌必须能够粘附于血管壁,同时被暴露于流动的血液的剪切应力。
要识别有助于微生物血管粘附的细菌和宿主因素,需要的研究生理剪切条件下,这些相互作用合适的模型。在这里,我们描述了一种在体外流动室模型,允许调查细菌粘附到细胞外基质的不同成分或与内皮细胞,并开发了一个活体显微镜模型直接可视化的细菌的初始粘合力,以在体内内脏循环。这些方法可用于鉴定所需细菌下流动的粘附的细菌和宿主因素。我们示出了剪切应力的相关性和血管性血友病因子为Staphy的粘合作用黄色葡萄球菌同时使用体外和体内模型。
引言
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
研究方案
动物实验批准了鲁汶的伦理委员会。
体外灌注和体内实验1.准备细菌
- 我们使用S.金黄色葡萄球菌菌株Newman在这个手稿中描述的所有实验。S.金黄色葡萄球菌Newman贮存在脑心浸液(BHI),用10%甘油在-80℃。
- 使用无菌环刮冷冻细菌关闭并接种在5毫升的胰蛋白酶大豆肉汤(TSB)中O / N在37℃(OD 600> 3)。
- 通过离心(2600克,室温,5分钟)洗涤细菌和悬浮细菌沉淀在5ml PBS(磷酸盐缓冲盐水)。
- 准备一个1mg / ml的溶液的5(6) - 羧基荧光素的N-羟基琥珀酰亚胺基酯(羧基荧光素)的乙醇。稀释的1mg / ml的羧基荧光素的溶液,以150微克/毫升在实验室级水( 例如,的MilliQ水)。避光管用铝箔和储存在-20℃。
- 离心细菌(2600×g离心,室温,5分钟)。重悬细菌沉淀在800微升PBS中,并加入200微升或150微克/毫升羧基荧光素溶液的400微升(终浓度50μg/ ml的为进行体内实验)(30微克/毫升为灌注实验的最终浓度)。保护管从光用铝箔和孵育在室温30分钟在振荡器上。
- 标记后,用在PBS中的6%的牛血清白蛋白(BSA)溶液块。
- 稀释使用光学密度菌(OD)的OD用于体外实验600 0.65(相当于约3×10 8菌落形成单位(CFU)/ ml的金黄色葡萄球菌 )和一个外径为进行体内实验600 1.8(对应于在PBS中约1×10 9 CFU / ml的金黄色葡萄球菌 )。从光用铝箔保护管,置于冰上。
2. 体外灌流实验
- 盖玻片涂层
- 在实验室级水稀von Willebrand因子(vWF)(Haemate磷,库存浓度2400微克/毫升)(用去离子),以50微克/毫升的最终浓度。
- 在等渗葡萄糖溶液(SKF溶液,pH值2.7-2.9,由制造商提供)至160微克/ ml的终浓度稀释胶原。
- 涂层的玻璃盖玻片(24×50毫米)的VWF或胶原滴加200μl的上封口膜涂层并放置盖玻片上的液滴的顶部。液滴将沿盖玻片的表面上扩散。
- 孵育在加湿容器盖玻片为4小时,在室温。小心地提起从封口膜盖玻片用钝针头。安装盖玻片在流动室的底部部分。
- 塑料涂布泥釉与内皮细胞
- 外套塑料单(1阱的PCA细胞培养室,Sarstedt的,德国)用1ml在PBS中的1%明胶溶液并孵育30分钟,在37℃。在明胶包被的塑料单种子的人脐静脉内皮细胞(HUVECs)和成长他们70-80%汇合。装入塑料滑移在流动室的底部部分。
- 灌注试验
注: 在体外灌注模型的示意图表示在图1。- 执行体外细菌粘附研究中微平行板流动室在层流剪切应力2.5达因/厘米2和20达因/厘米2之间,以模拟不同的生理流动条件。
- 流室(室内设计)由金属框架,并提出了有机玻璃的灌注腔(聚(甲基)丙烯酸甲酯(PMMA))的。通过将其连接到一个高精度输注泵(PHD 2000输液,哈佛仪器,USA)中,我们可以生成流岭0.0001微升/分钟和220.82毫升/分钟之间TES。
- 的管路连接到流动室的上部,并在管道注入介质。轻轻放置在底部部件的顶流室的上部和组装流室。要小心,以避免产生气泡。注射1毫升培养基通过腔室以确保该室是不渗漏,并除去多余的涂覆溶液。避免气泡。
- 鼠标放置在一个热控制的加热垫在37℃下在显微镜托盘。由于这是一个终端的程序,也没有必要为严格asceptic程序。使靠近颈静脉切开,轻轻取出右侧颈肌和从周围组织分离出颈静脉。
- 设置输液泵和荧光显微镜。输液泵设置取决于注射器直径和所需的流量(参见2.4节)。从现在起,工作在一个黑暗的房间。
- VWF涂层:
- 填的注射器用荧光标记的细菌,并将其连接到入口管。避免气泡。启动输液泵10分钟。输注时间取决于所用的剪切速率和涂层,细菌和介质,并应代表粘连的稳定状态。
- 10分钟后,洗去未结合的细菌用PBS注射器连接到入口管和启动输液泵。
- 至少要花15幅图像或电影在洗涤过程后不同的位置。细菌是小的和潜在的难以集中。在此之前的体外流动的实验中,合适的焦平面可以将一滴荧光标记的细菌对盖玻片和放置盖玻片在流室进行检索。然后,搜索相应的焦平面并保存设置。
注:在体外流动实验,在清洗步骤期间捕获的图像(开始后±5分钟)确保只信号附着的细菌被捕获。
- 胶原蛋白涂层:
- 添加60微克/毫升VWF的荧光标记的细菌刚开始灌注前。填的注射器用补充有60微克/毫升的VWF荧光标记的细菌或荧光标记的细菌,并将其连接到入口管。避免气泡。重复步骤2.3.5.2 2.3.5.3至
- 内皮细胞:
- 激活的内皮细胞通过灌注用的Ca 2+ -ionophore A23187的0.1毫溶液(原液的10mM溶解在二甲基亚砜(DMSO))的DMEM以相同的剪切速率为细菌灌注10分钟通过灌注用0.1毫米。重复步骤2.3.5.2 2.3.5.3来。
- 计算剪切速率和剪切应力如下。
剪切速率= 6Q / WH 2
其中:Q:流速在毫升/分钟,瓦特:在厘米宽度中,h:高度厘米
剪切应力(τ)=剪鼠前粘度(μ)
其中μ:媒体:0.01达因x秒/厘米2,全血:0.04达因x秒/厘米2 - 图像分析
- 使用带有黑白摄像机倒置荧光显微镜获取实时图像,并使用图像处理软件开发。用1.5秒的曝光时间。采取多个快照(至少15)随机分布在流室的涂层表面,并将其保存在相应的文件格式。
- 与ImageJ的图像进行分析。减去背景来从图像中删除(处理过程 - Substract背景)平滑连续的背景和定义的阈值来设置下限和上限阈值,分割灰度图像转换成所关注的特征。测量限于阈的区域。
- 比较细菌粘附,表示为荧光区域, 例如,使用统计分析软件。比较使用单向ANOVA或叔基团WO尾学生的t检验。报告所有值平均值±标准平均(SEM)的错误。考虑<0.05显著一个P值(* P <0.05; ** P <0.01; *** P <0.001)。
3. 体内肠系膜灌注模型
- 鼠标的制备/手术
- 实验前禁食的小鼠的夜晚,以限制排便。
- 通过皮下注射丁丙诺啡(0.1毫克/公斤体重(BW))20-30之前的手术分钟得到6-8周龄小鼠(C57BL / 6)的手术前镇痛。
- 通过腹膜内注射氯胺酮(125毫克/千克体重)和甲苯噻嗪(12.5毫克/千克体重),麻醉鼠标。通过检查反射踏板。适用兽医药膏,以防止干燥。
- 鼠标放置在一个热控制的加热垫在37℃下在显微镜托盘。由于这是一个终端的程序,也没有必要为严格asceptic程序。使靠近颈静脉切开,轻轻取出右侧颈肌和从周围组织分离出颈静脉。
- 插入一个2法国静脉导管插入右颈静脉输液荧光标记的细菌或其它解决方案。通过中线腹部切口打开腹腔,并用棉签传播系膜并以可视化的肠系膜动脉和小静脉循环。
- 将鼠标在右侧上的透明板和固定套管用胶带。使用热敷,以防止体温过低。为了防止组织脱水,降500微升0.9%氯化钠的肠子。
- 细菌粘附的荧光显微镜肠系膜循环
- 在黑暗的房间工作。用棉签来固定船只和可视化他们倒置显微镜下。
- 局部应用5微升10毫米的解决方案邻f显示的Ca 2+ -ionophore A23187溶解在DMSO中。 10秒后,注入100微升标记的细菌(参见步骤1)通过颈静脉导管。花时间推移图像。后的实验结束后,根据机构批准的指南安乐死的小鼠。
- 图像分析
- 获得使用倒置荧光显微镜,采用了黑白摄像机和使用任何图像软件开发捕获的实时图像。应用自动曝光时间和特定于所使用的设备的对比度优化。
- 获得使用工具栏中的"收购"工具(多维收购 - 时间)时间推移图像使用1000张/秒的40个循环。将图像保存在一个合适的图像文件格式。
- 使用ImageJ分析软件来测量每幅图像的荧光信号的区域处理的图像。定义阈值来设置下限和上限阈值,分割灰度图像到f中感兴趣的功能设定。标识感兴趣(血管)的区域,并测量限于阈值和感兴趣的区域的面积。比较细菌粘附,使用任何统计或制图软件表示为荧光区域。
结果
金黄色葡萄球菌的粘合性的VWF,内皮下基质和内皮细胞是一种剪切应力依赖性现象
要强调在间S的相互作用的剪切应力的作用金黄色葡萄球菌和VWF,我们进行灌注过的VWF在不同剪切速率涂覆的盖玻片( 在体外灌注模型的示意图在图中给出的金黄色葡萄球菌 1。粘附到VWF从250秒的增加而增加的剪切速率-1〜2,000秒-1( 图2),这表明高的剪切力不抑制,但加强细菌附着到VWF。
为了研究的VWF的细菌粘附于胶原的贡献,内皮下基质的主要成分,我们灌注荧光标记S.金黄色葡萄球菌在胶原中VWF的存在或不存在。在不存在的VWF,S的密合性一个ureus胶原随着剪切速率降低。然而,当VWF是存在于培养基中,S的粘着黄色葡萄球菌的增加而增加的剪切速率( 图3)。
体外流模型还允许我们检查细菌的粘附下流动于内皮细胞。我们内皮细胞灌注与荧光标记的S.金黄色葡萄球菌在剪切速率为500〜2000秒-1。凡表示,内皮细胞被激活了的Ca 2+ -ionophore,造成VWF释放。内皮细胞的活化和随后的VWF释放,S的增加粘附金黄色葡萄球菌 ( 图4A),从而形成典型的"带状"图案的荧光标记在剪切力( 图4B)的方向上排列的细菌集群,这表明沿着线性拉伸的VWF分子的细菌的结合。
最初在体内细菌附着在内脏静脉被VWF介
由于S.金黄色葡萄球菌是能够坚持的VWF,我们用野生型小鼠(VWF + / +)和VWF缺陷型小鼠(VWF - / - ),调查细菌粘附到活化血管壁体内 。内脏静脉实时电视显微镜允许体内可视化的循环荧光标记S.黄色葡萄球菌 ( 在体内灌注模型的示意图概述示于图5)。
内皮由钙 -ionophore药理活化后,我们观察到个体的细菌和细菌的聚集体的快速局部堆积到WT小鼠的血管壁(补充视频1和2)。细菌几乎没有发生粘着上观察到VWF -deficie的活化的血管壁nt的小鼠(补充视频3)与WT小鼠的附着力相比( 图6)。不存在的VWF降低S的能力金黄色葡萄球菌坚持以激活血管壁。
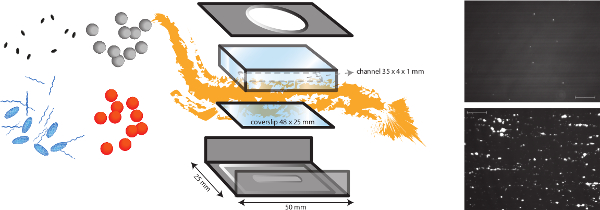
图1. 在体外流动模型的示意图。 在体外流动模型是一种多功能模型,它允许不同的剪切依赖性机制的研究,如细 菌粘附于内皮下基质也是血栓形成。微平行流动室被放置在盖玻片(塑料或玻璃)与蛋白质和血管内皮细胞的不同的涂层。不同的细菌(橙色和灰色点)的密合性,可以分析和血浆蛋白,血小板和全血的存在的影响进行评估。荧光标记的血小板(蓝色椭圆形)或fibrinog烯(蓝色串)可以用在具有不同的抑制剂(黑色椭圆)组合来区分细菌和宿主因素。 S的 细菌粘附的代表图像黄色葡萄球菌对VWF胶原涂层的存在(底部)或无(顶部)显示(比例尺为100微米)。 请点击此处查看该图的放大版本。
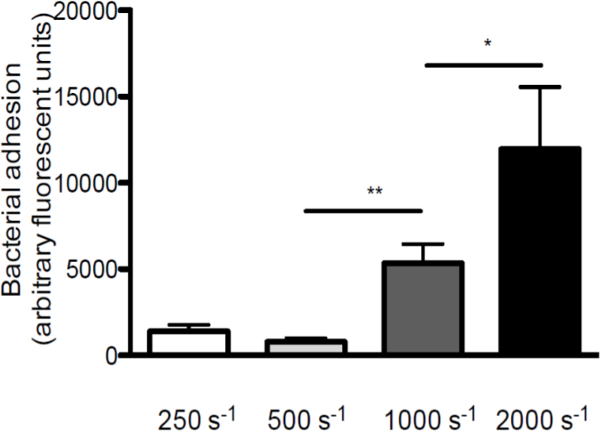
图2.粘附S.黄色葡萄球菌对VWF增加而增加的剪切速率。微平行流动室灌注过涂覆的VWF(50微克/毫升)与荧光标记S.金黄色葡萄球菌Newman在250至2000秒-1(秒-1)在中等剪切速率(正> 5)。所有结果表示为平均值±SEM表示。 * P <0.05,** P <0.01。
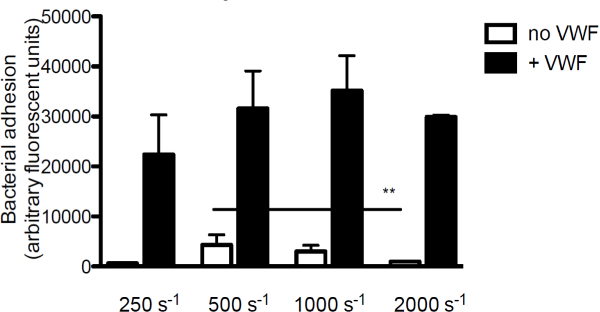
图3.粘附S.黄色葡萄球菌对内皮下膜是剪切和VWF依赖性。微平行流动室灌注过涂覆胶原(160微克/毫升)与荧光标记S.金黄色葡萄球菌Newman在250至2000秒-1在中等剪切速率(正> 5)。 VWF(60微克/毫升)存在于培养基中,其中表示。所有结果表示为平均值±SEM表示。 ** P <0.01。
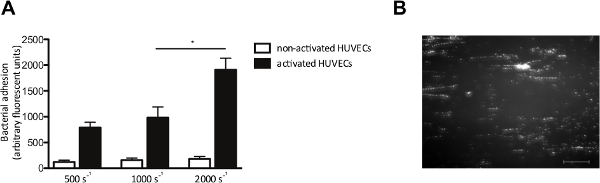
图4.粘附S.黄色葡萄球菌对活化的内皮细胞是剪切依赖性的。微平行流动室灌注过的内皮细胞。 ( 一 )人脐静脉内皮细胞的钙离子-ionophore一个激活23187(0.1毫摩尔),接着通过一个10分钟的灌注荧光标记S.金黄色葡萄球菌Newman在500至2000秒-1在中等剪切速率(正> 5)。所有结果表示为平均值±SEM表示。 * P <0.05。微平行流室灌注(B)在图像内皮细胞活化与S.金黄色葡萄球菌在1000秒的剪切速率-2 S。金黄色葡萄球菌形成了±200微米长字符串,暗示附着力VWF多(比例尺为100微米)。 请点击此处查看该图的放大版本。

图5. 体内肠系膜灌注模型的示意图,一个右颈内静脉置管(黄线)插入氟的管理escently标记的细菌(橙色点),附加的麻醉剂或其它成分,如药物抑制剂和抗体。腹膜腔被打开,肠系膜铺展以可视化的血管(静脉和动脉)在荧光显微镜下。内皮由钙 -ionophore,其诱导的VWF的释放药理活化后,细菌可以通过颈静脉导管注射。实时视频血管显微允许循环荧光标记的细菌在体内的可视化和由此产生的细菌血小板血栓形成。 请点击此处查看该图的放大版本。
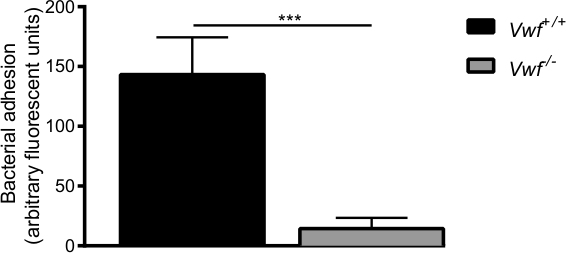
图6的S的初始粘合金黄色葡萄球菌。 - / -小鼠对激活的内皮是在体内通过的VWF 的体内静脉肠系膜灌注之C57B1 / 6- VWF + / +和C57BL / 6- VWF模型介导的 。粘连的荧光标记S.金黄色葡萄球菌的局部活化血管壁是显著低于VWF - / -小鼠。所有结果表示为平均值±SEM表示。 *** P <0.001,N> 7。
视频1:S的实时粘连金黄色葡萄球菌活化血管壁VWF + / +小鼠。 请点击此处观看该视频。

视频2:实时聚集形成和栓塞S.金黄色葡萄球菌在VWF + / +小鼠。 请点击此处观看该视频。

视频3:S的实时粘连黄色葡萄球菌对活化血管壁中VWF - - / -小鼠/ -与VWF + / +和VWF 小鼠 体内肠系膜灌注模型。五微升钙 -ionophore(10毫米)的是APPLI编到的可视化血管床的区域。羧基荧光素标记S的悬挂金黄色葡萄球菌是通过颈静脉导管注入。肠系膜循环被倒置显微镜下观察。 请点击此处观看该视频。
讨论
剪应力是为早期细菌粘附于血管壁和用于随后产生的血管内或心内膜赘生物和转移性感染4,5的一个关键因素。我们的体外和体内模型中所述互补研究生理剪切应力下的血管内感染的发病机制。这些模型使我们能够确定血管性血友病因子结合蛋白(vWbp)作为主要的S.金黄色葡萄球菌蛋白流下互动与一个受伤的血管壁露出VWF 4。
血管内感染,尤其是感染性心内膜炎,值得关注,不仅是因为败血症所致的器官衰竭而死亡,但由于也本地和遥远('转移')的并发症。引起感染性心内膜炎和转移性感染,细菌有附着到容器壁上,从而抗蚀剂流动的血液的剪切应力。最对细菌的研究毒力因子已经在静态条件下被执行。然而,这些相互作用建立可能无法承受剪切力,并研究流量条件下,可以揭示新的,以前没有认识到的因素在细菌宿主相互作用。
使用微平行流动室,我们和其他人已经表明的VWF对血管粘附的重要性。在剪切应力,VWF逐步展现出来的,从它的休息球状结构,并公开通过其受体GPIb的血小板6交互的A1域。流动腔室已被广泛用来研究血小板功能7。
值得注意的是,还S.下流动葡萄球菌粘附需要的VWF,以及尤其是在剪切露出的A1结构域。我们确定vWbp调解VWF结合。 vWbp是凝固酶,有助于S.金黄色葡萄球菌病理生理通过激活宿主的凝血酶原。 Staphylothrombin,水库ulting细菌凝固酶和凝血酶原复合物,纤维蛋白原转变成不溶性纤维蛋白8,9。我们的研究表明,vWbp不仅激活凝血酶原,但触发细菌血纤维蛋白-血小板聚集,这提高下流动4,10,11的粘附到血管的形成。
体外流室模型允许不同的球员 在细菌粘附研究细胞或基质成分。细菌毒力因子可以通过使用突变体或无害的细菌表达特定表面蛋白进行研究。可替代地,药理抑制剂或阻断抗体可以被添加到在流动室中的介质。的宿主因素如细胞外基质的不同成分的作用可以通过使用盖玻片与不同涂层进行研究。盖玻片也可覆盖有内皮细胞,其中的活化状态可以通过添加特异性刺激进行调制。阿帕室温从血管壁,宿主血细胞和血浆蛋白质的贡献可以通过加入这些因素,流动介质进行研究。因此,增加了复杂性不同的条件可以在层流的标准条件进行研究,以解开,允许细菌附着于血管壁体内的相互作用。
在体外模型中鉴定相互作用随后研究的动物模型,以测试其相关性在一个复杂的有机体。其它体内模型来研究下流动的动态相互作用已被描述,如仓鼠背皮褶腔12和提睾模型13。相比较而言,这里所描述的肠系膜灌注模型提供,因为它易于使用的几个优点,有可能以改变承载小鼠的遗传背景,并评价药物干预。
总之,所描述的模型提供研究表面蛋白不仅S的可能性金黄色葡萄球菌 ,但在不同的主机背景许多其它微生物,以更好地理解血管感染的发病机制。
披露声明
作者什么都没有透露。
致谢
这项工作是由该基金VOOR Wetenschappelijk Onderzoek(FWO)VLAANDEREN G0466.10,11I0113N支持; "埃迪墨克斯研究基金"和"Sporta研究经费"为小儿心脏病,UZ比利时鲁汶(JC);该中心分子和血管生物学由Programmafinanciering鲁汶(PF / 10/014)的支持下,由鲁汶大学的"Geconcentreerde Onderzoeksacties"(GOA一十三分之二千零九)和勃林格殷格翰研究经费。
材料
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
参考文献
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。