Method Article
במבחנת in vivo המודל ללמוד הידבקות חיידקים לכלי השיט וול תנאי זרימה תחת
In This Article
Summary
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
Abstract
על מנת לגרום לזיהומי endovascular ואנדוקרדיטיס זיהומית, חיידקים צריכים להיות מסוגל לדבוק בקיר הכלי בעוד שנחשף ללחץ הגזירה של זורם דם.
כדי לזהות את גורמי חיידקים ומארח שתורמים להידבקות של כלי דם של מיקרואורגניזמים, מודלים מתאימים שללמוד אינטראקציות אלה בתנאים פיסיולוגיים גזירה יש צורך. כאן, אנו מתארים במבחנה מודל תא זרימה המאפשר לחקור הידבקות חיידקים לרכיבים שונים של מטריקס או לתאי אנדותל, ומודל מיקרוסקופיה intravital שפותח כדי לחזות ישירות ההידבקות הראשונית של חיידקים למחזור splanchnic in vivo . שיטות אלה יכולים לשמש כדי לזהות את גורמי חיידקים ומארח נדרשים להידבקות של חיידקים תחת זרימה. אנו ממחישים את הרלוונטיות של מאמץ גזירה ואת התפקיד של גורם פון Willebrand להידבקות של Staphylococcus aureus באמצעות שתי במבחנה ובמודל vivo.
Introduction
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
Protocol
ניסויים בבעלי חיים אושרו על ידי ועדת האתיקה של לובן KU.
1. חיידקים הכנה לזילופי מבחנה ובניסויים בVivo
- השתמשנו ס aureus מתח ניומן לכל הניסויים שתוארו בכתב היד הזה. ס aureus ניומן היה מאוחסן במוח לב עירוי (BHI) עם גליצרול 10% ב -80 ° C.
- השתמש לולאת סטרילי כדי לגרד את החיידקים קפואים ומלחסן בO 5 מיליליטר tryptic סויה מרק (TSB) / N ב 37 ° C (OD 600> 3).
- לשטוף את החיידקים על ידי צנטריפוגה (2,600 גרם, RT, 5 דקות) וresuspend גלולה חיידקים ב5 מיליליטר PBS (פוספט שנאגרו מלוח).
- הכן פתרון 1 מ"ג / מיליליטר 5 (6) אסתר -carboxy-והעמסת N-hydroxysuccinimidyl (carboxy-והעמסת) באתנול. לדלל את 1 מ"ג הפתרון / מיליליטר carboxy-והעמסת 150 מיקרוגרם / מיליליטר במי כיתה מעבדה (למשל, המים MilliQ). להגן על הצינורות מן האורבנייר האלומיניום ולאחסן ב -20 ° C.
- צנטריפוגה החיידקים (2600 XG, RT, 5 דקות). Resuspend גלולה חיידקים ב800 μl PBS ולהוסיף 200 μl (ריכוז סופי של 30 מיקרוגרם / מיליליטר לניסויי זלוף) או 400 μl (ריכוז סופי 50 מיקרוגרם / מיליליטר לניסויי in vivo) של / מיליליטר פתרון carboxy-והעמסת 150 מיקרוגרם. להגן על הצינורות מן האור עם רדיד אלומיניום דגירה במשך 30 דקות ב RT על שייקר.
- לאחר תיוג, בלוק עם 6% פתרון שור אלבומין בסרום (BSA) ב- PBS.
- לדלל חיידקים באמצעות צפיפות אופטית (OD), OD 600 של 0.65 לניסויים במבחנה (המקביל ל 3 x 10 8 יחידות כ מושבה להרכיב (CFU) / מיליליטר לS. aureus) וOD 600 של 1.8 לin vivo ניסויים ( מתאים לכ 1 x 10 9 CFU / ml עבור ס aureus) ב- PBS. להגן על הצינורות מן האור עם רדיד אלומיניום ולהשאיר על קרח.
2. ניסויים במבחנה זלוף
- ציפוי של Coverslips הזכוכית
- לדלל גורם פון Willebrand (VWF) (Haemate P, 2,400 מיקרוגרם / מיליליטר ריכוז המלאי) במי כיתה מעבדה (Deionized מזוקק) לריכוז סופי של 50 מיקרוגרם / מיליליטר.
- לדלל קולגן בתמיסה איזוטונית גלוקוז (פתרון SKF, pH 2.7-2.9, כפי שסופקו על ידי היצרן) לריכוז סופי של 160 מיקרוגרם / מיליליטר.
- coverslips זכוכית מעיל (24 × 50 מ"מ) עם VWF או קולגן על ידי הטלת 200 μl של הציפוי על parafilm ולמקם את coverslip על גבי אגל. אגל יתפשט על פני השטח של coverslip.
- דגירה coverslip במכל humidified במשך 4 שעות ב RT. רם בזהירות את coverslips מparafilm עם מחט קהה. הר coverslip בחלק התחתון של תא הזרימה.
- ציפוי של פלסטיק מחליקה עם תאי האנדותל
- תלושי פלסטיק מעיל(1-גם תא תרבית תאי PCA, Sarstedt, גרמניה) עם 1 מיליליטר של פתרון ג'לטין 1% ב- PBS והדגירה של 30 דקות ב 37 מעלות צלזיוס. תאי זרע אנושיים וריד טבור אנדותל (HUVECs) בתלושי הפלסטיק מצופה ג'לטין ולגדל אותם לconfluency 70-80%. הר להחליק הפלסטיק בחלק התחתון של תא הזרימה.
- ניסוי זלוף
הערה: סקירה סכמטי של במבחנה המודל זלוף מיוצגת באיור 1.- לבצע במבחנה הידבקות חיידקים בזרם צלחת תא מיקרו מקביל במאמץ גזירת מינרית בין 2.5 דיין / 2 סנטימטר ו -20 דיין / 2 סנטימטר כדי לדמות תנאי זרימה פיסיולוגיים שונים.
- (העיצוב בבית) תא זרימה מורכב מסגרת מתכת וחדר זלוף עשוי מפרספקס (פולי (מתיל) methacrylate (PMMA)). על ידי חיבורו למשאבת דיוק גבוה עירוי (PHD 2000 עירוי, הרווארד Apparatus, ארה"ב), אנחנו יכולים ליצור תזרים raTES בין 0.0001 μl / דקה ו220.82 מיליליטר / דקה.
- חבר את הצינור לחלקו העליון של תא הזרימה ולהזריק בינוני בצינור. מניח בעדינות את החלק העליון של תא הזרימה על גבי החלק התחתון ולהרכיב את תא הזרימה. להיות זהיר, כדי למנוע בועות אוויר. הזרק 1 מיליליטר של מדיום דרך החדר כדי לוודא שהתא לא דולף ולהסיר פתרון ציפוי עודף. למנוע בועות אוויר.
- מניחים את העכבר על כרית חימום מבוקר תרמו על 37 מעלות צלזיוס במגש מיקרוסקופ. מכיוון שמדובר בהליך מסוף, אין צורך בהליכי asceptic קפדן. עושה חתך ליד וריד הצוואר, להסיר בעדינות בצד ימין של שריר צוואר הרחם ולבודד את וריד הצוואר מהרקמה הסובבת.
- הגדר את משאבת העירוי ומיקרוסקופ פלואורסצנטי. הגדרות משאבת עירוי תלויות בקוטר המזרק ואת קצב הזרימה הרצוי (ראה סעיף 2.4). מעתה והלאה, לעבוד בחדר חשוך.
- VWF ציפוי:
- ממלאי מזרק עם חיידקים שכותרתו fluorescently ולחבר אותו לצינור הכניסה. למנוע בועות אוויר. התחל משאבת העירוי למשך 10 דקות. זמן העירוי תלוי בשיעור הגזירה וציפוי, חיידקים ובינוניים המשמש וצריך לייצג את המצב היציב של הידבקות.
- לאחר 10 דקות, לשטוף את החיידקים מאוגד על ידי חיבור מזרק עם PBS לצינור הכניסה ומתחיל את משאבת העירוי.
- קח לפחות 15 תמונות או סרטים במקומות שונים לאחר תהליך השטיפה. חיידקים הם קטנים וקשים שעלולים להתמקד ב. לפני במבחנה ניסוי הזרימה, מישור המוקד המתאים יכול להאסף על ידי הצבת ירידה של חיידקים שכותרתו fluorescently על coverslip והצבת coverslip בתא הזרימה. לאחר מכן, לחפש את מישור המוקד המתאים ולשמור את ההגדרות.
הערה: במהלך הניסוי במבחנה הזרימה, לכידת התמונות במהלך שלב הכביסה (± 5 דקות אחרי ההתחלה) מבטיחה כי רקאות לחיידקים חסיד הוא נתפס.
- קולגן ציפוי:
- להוסיף VWF / מיליליטר 60 מיקרוגרם לחיידקים שכותרתו fluorescently רק לפני שמתחיל זלוף. ממלאי מזרק עם חיידקים שכותרתו fluorescently או חיידקים שכותרתו fluorescently בתוספת 60 מיקרוגרם VWF / מיליליטר ולחבר אותו לצינור הכניסה. למנוע בועות אוויר. חזור על שלבים 2.3.5.2 ל2.3.5.3
- תאי האנדותל:
- הפעל את תאי האנדותל על ידי זלוף עם פתרון 0.1 מ"מ של Ca 2 + -ionophore A23187 (פתרון מניות 10 מ"מ מומס בsulfoxide דימתיל (DMSO)) בDMEM באותו שיעור הגזירה כזלוף החיידקים במשך 10 דקות על ידי זלוף עם 0.1 מ"מ. חזור על שלבים 2.3.5.2 ל2.3.5.3.
- חישוב שיעור גזירה ולחץ גזירה כדלקמן.
שיעור גזירה = 6Q / ש"ש 2
איפה: ש: קצב זרימה במ"ל / דקה, w: רוחב בס"מ, שעות: גובה בס"מ
מאמץ גזירה (τ) = חולדה גזירהצמיגות לשעבר (μ)
איפה μ: בינוני: 0.01 שניות dynes / 2 סנטימטר, כל דם x: 0.04 שניות dynes x / 2 סנטימטר - ניתוח תמונה
- להשיג תמונות חיות באמצעות מיקרוסקופ פלואורסצנטי הפוך עם מצלמה בשחור לבן ולפתח באמצעות תוכנת הדמיה. השתמש בזמן חשיפה של 1.5 שניות. לצלם תמונות מרובות (לפחות 15) להפיץ באופן אקראי על פני המשטח המצופה של תא הזרימה ולשמור אותם בפורמט של הקובץ המתאים.
- לבצע ניתוח תמונה עם ImageJ. הפחת את הרקע כדי להסיר רקע רציף וחלק מהתמונה (תהליך - רקע Substract) ולהגדיר את הסף להגדרת ערכי סף תחתון ועליונים, פילוח תמונות גוניות אפורות לתכונות של עניין. למדוד את השטח מוגבל לסף.
- שקלו את הידבקות חיידקים, מתבטא בשטח ניאון, למשל, באמצעות תוכנת ניתוח סטטיסטית. השווה את הקבוצות באמצעות ANOVA חד-כיווני או לאמבחן T- של הסטודנטים זנב וו. דווח על כל הערכים כשגיאת ± סטנדרטי הממוצעת של הממוצע (SEM). שקול ערך p- של <0.05 משמעותיים (* p <0.05; ** p <0.01; *** p <0.001).
3. בVivo mesenteric זלוף דגם
- הכנה / ניתוח של העכבר
- לצום עכבר הלילה שלפני הניסוי כדי להגביל את תנועת מעיים.
- תן עכבר 6-8 בן שבוע (C57Bl / 6) שיכוך כאבים טרום ניתוחיים על ידי הזרקה תת עורית של עצירות (0.1 מ"ג / קילוגרם משקל גוף (BW)) דקות 20-30 לפני הניתוח.
- להרדים את העכבר על ידי הזרקה תוך הצפק של קטמין (125 מ"ג / קילוגרם BW) וxylazine (12.5 מ"ג / קילוגרם BW). בדוק על ידי רפלקס דוושה. החל משחה וטרינר כדי למנוע יובש.
- מניחים את העכבר על כרית חימום מבוקר תרמו על 37 מעלות צלזיוס במגש מיקרוסקופ. מכיוון שמדובר בהליך מסוף, אין צורך בascepti קפדןנהלי ג. עושה חתך ליד וריד הצוואר, להסיר בעדינות בצד ימין של שריר צוואר הרחם ולבודד את וריד הצוואר מהרקמה הסובבת.
- הכנס קטטר תוך ורידי צרפתי 2 לוריד הצוואר הימני לעירוי של חיידקים שכותרתו fluorescently או פתרונות אחרים. פתח את חלל הצפק דרך חתך בבטן קו האמצע ולהשתמש צמר גפן כדי להפיץ את mesenterium ולדמיין arteriolar mesenteric ומחזור venular.
- מניחים את העכבר בצד ימין על צלחת שקופה ולאבטח את הצינורית עם קלטת. השתמש חבילה חמה כדי למנוע היפותרמיה. כדי למנוע התייבשות של הרקמות, שחרר 500 μl 0.9% NaCl במעיים.
- מיקרוסקופ פלואורסצנטי של הידבקות חיידקים למחזור mesenteric
- לעבוד בחדר חשוך. השתמש צמר גפן כדי לשתק את כלי השיט ולדמיין אותם תחת מיקרוסקופ הפוכה.
- מריחה להחיל 5 μl של o פתרון 10 מ"מו A23187 -ionophore Ca 2 + מומס DMSO. לאחר 10 שניות, להזריק 100 μl כותרת חיידקים (ראה שלב 1) דרך קטטר וריד הצוואר. קח זמן לשגות תמונות. לאחר הניסוי סיים, להרדים את העכבר על פי הנחיות שאושרו מוסדיות.
- ניתוח תמונה
- להשיג תמונות חיות באמצעות מיקרוסקופ פלואורסצנטי הפוך, שנתפס באמצעות מצלמה בשחור לבן ופותח באמצעות כל תוכנת הדמיה. החל זמן חשיפה אוטומטי ואופטימיזציה ניגוד מסוימת לציוד המשמש.
- לרכוש זמן לשגות תמונות באמצעות הכלי 'הרכישה' בסרגל הכלים (רכישות רב ממדי - זמן) באמצעות 40 מחזורים של 1,000 תמונות / sec. שמור את התמונות בפורמט קובץ תמונה מתאים.
- תמונות תהליך באמצעות תוכנת ניתוח ImageJ למדוד את השטח של אות ניאון לכל תמונה. הגדר את הסף להגדרת ערכי סף תחתון ועליונים, פילוח תמונות גוניות אפורות לתוך Features של עניין. זהה את האזור של עניין (כלי דם) ולמדוד את השטח מוגבל לסף והאזור של עניין. שקלו את הידבקות חיידקים, מתבטא בשטח ניאון באמצעות כל תוכנה סטטיסטית או גרפים.
תוצאות
הידבקות aureus S. לVWF, מטריצת subendothelial ותאי האנדותל היא תופעה תלויה מאמץ גזירה
כדי להדגיש את תפקידו של מאמץ גזירה באינטראקציה בין ס aureus וVWF, ביצעו זילופים על VWF coverslips המצופה בשיעורי גזירה שונים (סקירה סכמטי של במבחנה המודל זלוף ניתן באיור 1. הדבקה של S. aureus לVWF גדלה עם הגדלת שיעורי גזירה מ 250 שניות -1 2,000 שניות -1 (איור 2), מצביעים על כך שכוחות גזירה גבוהה לא לעכב אבל לחזק את ההידבקות של חיידקים לVWF.
על מנת לחקור את התרומה של VWF להידבקות חיידקים לקולגן, המרכיב העיקרי של מטריצת subendothelial, אנחנו perfused שכותרתו fluorescently ס aureus על קולגן בנוכחות או עדר של VWF. בהעדר VWF, ההידבקות של סureus לקולגן ירד עם עליית שיעורי גזירה. עם זאת, כאשר VWF היה נוכח במדיום, ההידבקות של ס aureus גדל עם עלייה בשיעורי גזירה (איור 3).
במבחנה זרימת המודל גם מאפשר לנו לבחון את ההידבקות של חיידקים לתאי אנדותל בזרימה. אנו perfused HUVECs עם כותרתו fluorescently ס aureus בשיעורי גזירה מ -500 עד 2,000 שניות -1. בהם מצויינים, HUVECs הופעלו עם Ca 2 + -ionophore, לגרום לשחרורו של VWF. הפעלת האנדותל תא ושחרור VWF לאחר מכן, הידבקות מוגברת של ס aureus (איור 4 א), שנוצר דפוסים "כמו מחרוזת-" טיפוסיים שהכותרת שלו fluorescently אשכולות חיידקים מיושרים בכיוון של כוח הגזירה (איור 4), המצביע על הכריכה של חיידקים לאורך מולקולת VWF-נמתח ליניארי.
ראשוני in vivoהידבקות חיידקים בעורקי splanchnic מתווכת על ידי VWF
מאז ש ' aureus הוא מסוגל לדבוק VWF, השתמשנו עכברי wildtype (Vwf + / +) וVWF לקוי עכברים (Vwf - / -) לחקור הידבקות חיידקים לדופן כלי הדם מופעל in vivo. videomicroscopy של ורידי splanchnic בזמן אמת אפשר להדמיה vivo של מחזורי שכותרתו fluorescently ס aureus (סקירה סכמטי של מודל in vivo זלוף מיוצג באיור 5).
לאחר הפעלה תרופתית של האנדותל על ידי Ca 2 + -ionophore, צפינו הצטברות מקומית מהירה של חיידקים ומצרפים של חיידקים בודדים לקיר הכלי של עכברי WT (וידאו משלימה 1 ו -2). כמעט אין הידבקות של חיידקים נצפתה על קיר הכלי מופעל של -deficie Vwfעכברי NT (משלימה וידאו 3) בהשוואה להידבקות בעכברי WT (איור 6). היעדר VWF מקטין את יכולתו של ס ' aureus לדבוק בקיר הכלי הופעל.
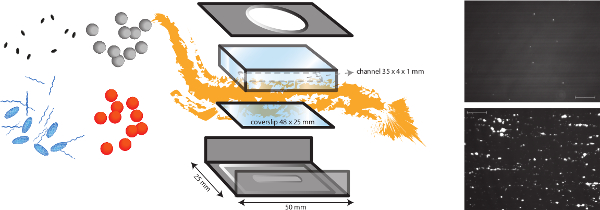
איור 1. ייצוג סכמטי של במבחנה זרימת המודל. במבחנה זרימת המודל הוא מודל רב תכליתי, המאפשר חקר מנגנונים תלויים גזירה שונות כגון הידבקות חיידקים למטריצת subendothelial אלא גם פקיק היווצרות. תא זרימת המייקר מקביל מושם על coverslip (פלסטיק או זכוכית) עם ציפויים שונים של חלבונים ותאי האנדותל. ההידבקות של חיידקים שונים (כתום ונקודות אפורות) ניתן לנתח, ואת ההשפעה של הנוכחות של חלבוני פלזמה, טסיות דם וכל דם ניתן להעריך. סמני ניאון לטסיות דם (אליפסות כחולות) או fibrinogen (מחרוזות כחולות) יכול לשמש בשילוב עם מעכבים שונים (אליפסות שחורות) להבחין גורמי חיידקים ומארח. נציג תמונות של הידבקות חיידקים של ס aureus לציפוי קולגן בנוכחות (התחתונה) או היעדר (למעלה) של VWF מוצג (סרגל קנה מידה הוא 100 מיקרומטר). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
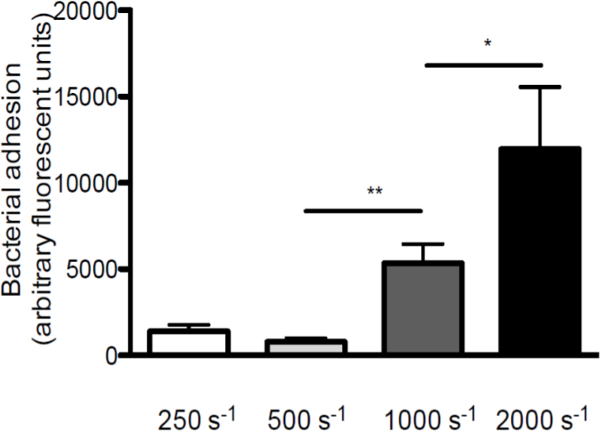
איור 2. הדבקה של ס aureus לעליות VWF עם הגדלת שיעורי גזירה. תא זרימת זלוף מיקרו-במקביל על VWF המצופה (50 מיקרוגרם / מיליליטר) עם כותרתו fluorescently ס aureus ניומן בשיעורי גזירה של 250 עד 2,000 שניות -1 (סעיף -1) במדיום (n> 5). כל התוצאות באות לידי ביטוי כממוצע ± SEM. * P <0.05, ** p <0.01.
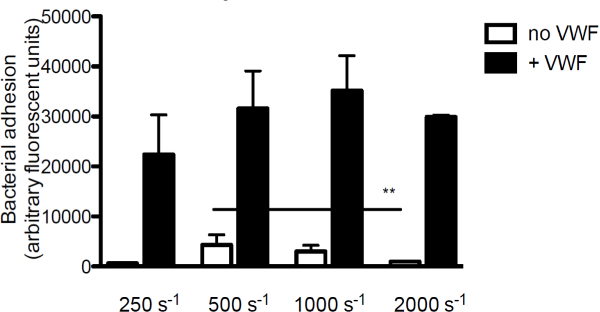
איור 3. הדבקה של ס aureus לsubendothelium הוא גזירה וVWF תלוי. תא זרימת זלוף מיקרו-במקביל על קולגן המצופה (160 מיקרוגרם / מיליליטר) עם כותרתו fluorescently ס aureus ניומן בשיעורי גזירה של 250 עד 2,000 שניות -1 במדיום (n> 5). VWF (60 מיקרוגרם / מיליליטר) היה נוכח במדיום בהם מצויינים. כל התוצאות באות לידי ביטוי כממוצע ± SEM. ** P <0.01.
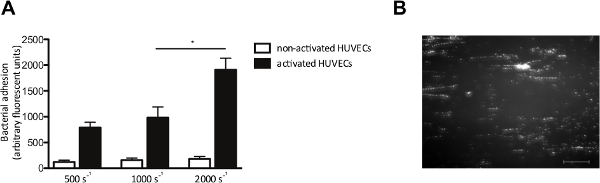
איור 4. הדבקה של ס aureus לתאי האנדותל הוא מופעלים תא זרימת זלוף מיקרו-במקביל גזירה תלויה. על תאי האנדותל. (א) בתאי אנדותל וריד טבור אדם הופעלו עם Ca 2 + -ionophore23,187 (0.1 מ"מ) ואחריו זלוף 10 דקות שכותרת שלו fluorescently ס aureus ניומן בשיעורי גזירה של 500 עד 2,000 שניות -1 במדיום (n> 5). כל התוצאות באות לידי ביטוי כממוצע ± SEM. * P <0.05. תמונה (ב) לזלוף תא זרימת מייקר מקביל על HUVECs מופעל עם ס ' aureus בשיעור גזירה של 1,000 שניות -2. ס aureus יוצר מחרוזות באורך 200 מיקרון ±, המצביע על הידבקות לmultimers VWF (סרגל קנה מידה הוא 100 מיקרומטר). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 5. סקירה סכמטי של מודל זלוף mesenteric in vivo. קטטר וריד הצוואר ימני (קו צהוב) מוכנס לניהול פלואורידחיידקי שכותרת escently (נקודות כתומות), הרדמה נוספת או רכיבים אחרים כגון מעכבים ונוגדני תרופות. חלל הצפק נפתח וmesenterium משתרע לדמיין את כלי דם (ורידים ועורקים) תחת מיקרוסקופ פלואורסצנטי. לאחר הפעלה תרופתית של האנדותל ידי -ionophore Ca 2 +, אשר גורם לשחרור של VWF, ניתן להזריק חיידקים דרך קטטר וריד הצוואר. מיקרוסקופ וידאו תוך-בזמן אמת מאפשר ההדמיה in vivo של מחזורי חיידקים שכותרתו fluorescently והיווצרות חיידקי thrombi-טסיות וכתוצאה מכך. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
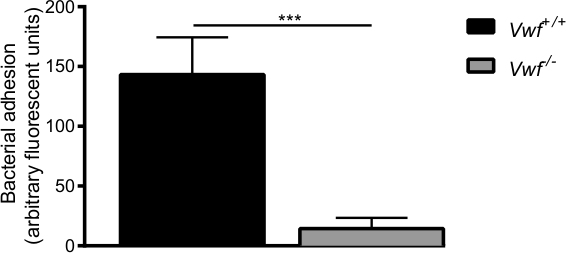
איור 6. ההידבקות הראשונית של ס aureus להאנדותל מופעל in vivo מתווך על ידי VWF בvivo ורידי מודל זלוף mesenteric עם C57Bl / 6 Vwf + / + וC57Bl / 6 Vwf -. / - עכברים. הידבקות כותרת של fluorescently ס aureus לקיר הכלי מופעל באופן מקומי הוא נמוך באופן משמעותי בVwf - / - עכברים. כל התוצאות באות לידי ביטוי כממוצע ± SEM. *** P <0.001, n> 7.
וידאו 1: הידבקותו של ס 'בזמן אמת aureus לקיר כלי מופעל בVwf + / + עכברים. אנא לחץ כאן כדי לצפות בסרטון זה.
FO: לשמור-together.within עמודים = "תמיד"> 
וידאו 2: היווצרות המצרפי בזמן אמת ואמבוליזציה של ס aureus בVwf + / + עכברים. אנא לחץ כאן כדי לצפות בסרטון זה.

וידאו 3: הידבקותו של ס 'בזמן אמת aureus לקיר הופעל כלי בVwf - / -. עכברים בvivo מודל זלוף mesenteric עם Vwf + / + וVwf - / - עכברים. חמש μl של -ionophore Ca 2 + (10 מ"מ) היה appliאד לאזור של מיטת כלי הדם דמיינה. השעיה של ס 'שכותרתו קרבוקסי-והעמסת aureus הוזרק דרך קטטר וריד הצוואר. מחזור mesenteric היה דמיין תחת מיקרוסקופ הפוכה. אנא לחץ כאן כדי לצפות בסרטון זה.
Discussion
מאמץ גזירה הוא גורם מכריע להידבקות חיידקים מוקדם לקיר הכלי ועבור הדור הבא של endovascular או vegetations endocardial וזיהומים גרורתי 4,5. תארנו משלים במבחנה ובמודלי vivo ללמוד את הפתוגנזה של זיהומי endovascular תחת מאמץ גזירה פיסיולוגי. מודלים אלה אפשרו לנו לזהות חלבון פון Willebrand מחייב גורם (vWbp) כס המרכזי חלבון aureus לאינטראקציה תחת זרימה עם קיר כלי דם פגוע חושף VWF 4.
זיהומי Endovascular, ואנדוקרדיטיס זיהומית בפרט, הם דאגה לא רק בגלל כשל איברים מושרה אלח דם ומוות, אלא גם בגלל סיבוכים מקומיים ומרוחקים ("גרורתי"). לגרום לאנדוקרדיטיס זיהומית וזיהומים גרורתי, חיידקים יש לדבוק בקיר הכלי ובכך לעמוד בלחץ הגזירה של זורם דם. רובמחקרים על חיידקי גורמי אלימות בוצעו בתנאים סטטיים. עם זאת, אינטראקציות המבוססות אלה עלולים שלא לעמוד בכוחות ומחקרי גזירה תחת תנאי זרימה יכולה לחשוף גורמים חדשים, בלתי מוכרים בעבר ביחסי גומלין חיידקים-מארח.
שימוש בתא זרימת מיקרו-המקביל, אנחנו ואחרים הראינו את החשיבות של VWF להידבקות של כלי דם. תחת מאמץ גזירה, VWF הדרגה נפרשות מהמבנה הכדורי מנוחתו, וחושף את תחום A1 שאינטראקציה עם טסיות דם באמצעות קולט GPIB 6. תאי זרימה נעשו שימוש נרחב ללמוד לתפקד טסיות דם 7.
למרבה הפלא, גם ס הידבקות aureus תחת זרימה דורשת VWF, ובפרט תחום A1 שנחשף על גזירה. זיהינו vWbp לתווך VWF מחייב. vWbp הוא coagulase שתורם לס aureus הפתופיזיולוגיה ידי הפעלת פרותרומבין של המארח. Staphylothrombin, מילulting המורכב של coagulase ופרותרומבין חיידקים, ממיר את פיברינוגן לפיברין 8,9 מסיס. המחקרים שלנו הראו כי vWbp לא רק להפעיל פרותרומבין, אבל מפעיל את ההיווצרות של אגרגטים חיידקי הפיברין-טסיות, אשר משפרים את ההידבקות לכלי דם תחת זרימת 4,10,11.
במבחנה מודל תא הזרימה מאפשר ללמוד את השחקנים השונים בהידבקות חיידקים למרכיבים תאיים או מטריצה. ניתן ללמוד גורמים ארסי חיידקים באמצעות מוטציות או חיידקים מזיקים לבטא חלבוני משטח ספציפיים. לחלופין, ניתן להוסיף מעכבים תרופתיים או נוגדני חסימה למדיום בתא הזרימה. תפקידם של גורמי מארח כגון מרכיבים שונים של מטריקס ניתן ללמוד באמצעות coverslips עם ציפויים שונים. Coverslips גם יכול להיות מכוסה בתאי האנדותל, שמצב ההפעלה יכול להיות מווסת על ידי הוספה לגירוי ספציפי. APART מקיר כלי הדם, התרומה של תאי דם מארח וחלבוני פלזמה ניתן ללמוד על ידי הוספת הגורמים הללו למדיום זורם. לפיכך, תנאים שונים של מורכבות גוברים ניתן ללמוד בתנאים סטנדרטיים של זרימה למינרית לפענח את האינטראקציות המאפשרות לחיידקים להיצמד לקיר כלי in vivo.
אינטראקציות שזוהו במודל במבחנה הם למדו לאחר מכן במודל חיה כדי לבדוק את הרלוונטיות שלהם באורגניזם מורכב. אחר במודלי vivo ללמוד אינטראקציות דינמיות תחת זרימה תוארו, כגון תא גב אוגר skinfold 12 ומודל Cremaster 13. לשם השוואה, מודל זלוף mesenteric המתואר כאן מציע מספר יתרונות בגלל קלות שימוש, האפשרות ללהשתנות לארח רקע גנטי של העכברים ולהעריך התערבויות תרופתיות.
לסיכום, תאר דגמיםמציע את האפשרות ללמוד חלבונים לא רק של ס משטח aureus, אלא של רבים מיקרואורגניזמים אחרים ברקע מארח שונה, כדי להבין טוב יותר את הפתוגנזה של זיהומי כלי דם.
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי חטיבות voor Wetenschappelijk Onderzoek (כשיש שתיים) Vlaanderen G0466.10, 11I0113N; "אדי מרקס מענק מחקר" ו" ספורטה המחקר גרנט "לקרדיולוגיה ילדים, UZ לובן, בלגיה (JC); המרכז לביולוגיה מולקולרית כלי דם נתמך על ידי Programmafinanciering KU Leuven (PF / 10/014), על ידי "Onderzoeksacties Geconcentreerde" (GOA 2009/13) מאוניברסיטת לובן ומענק מחקר מBoehringer Ingelheim-.
Materials
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
References
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved