Method Article
In vitro e in vivo modelo para estudiar la adhesión bacteriana a la pared del recipiente en condiciones de flujo
En este artículo
Resumen
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
Resumen
Con el fin de causar infecciones endovasculares y endocarditis infecciosa, las bacterias deben ser capaces de adherirse a la pared del vaso mientras se expone a la tensión de cizallamiento de la sangre que fluye.
Para identificar los factores bacterianos y de acogida que contribuyen a la adhesión vascular de los microorganismos, se necesitan modelos apropiados que estudian estas interacciones en condiciones de cizallamiento fisiológicas. Aquí, se describe un modelo in vitro de cámara en flujo que permite investigar la adhesión bacteriana a diferentes componentes de la matriz extracelular o a las células endoteliales, y un modelo de microscopía intravital que fue desarrollado para visualizar directamente la adherencia inicial de las bacterias a la circulación esplácnica in vivo . Estos métodos pueden ser utilizados para identificar los factores bacterianos y del huésped requeridos para la adherencia de las bacterias bajo flujo. Ilustramos la relevancia de la tensión de cizallamiento y el papel del factor von Willebrand para la adhesión de Staphylococcus aureus utilizando tanto el modelo in vitro y in vivo.
Introducción
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
Protocolo
Los experimentos con animales fueron aprobados por el Comité Ético de la Universidad Católica de Lovaina.
1. Las bacterias Preparación para In Vitro perfusiones e in vivo
- Se utilizó S. aureus cepa Newman para todos los experimentos descritos en este manuscrito. S. aureus Newman se almacenó en infusión cerebro corazón (BHI) con 10% de glicerol a -80 ° C.
- Use un asa estéril para raspar las bacterias congeladas fuera e inocular en 5 ml de caldo de soja tríptico (TSB) O / N a 37 ° C (OD 600> 3).
- Lavar las bacterias por centrifugación (2600 g, RT, 5 min) y resuspender el sedimento bacteriano en 5 ml de PBS (tampón fosfato salino).
- Preparar una solución de 1 mg / ml de 5 (6) éster de N-hidroxisuccinimidilo-carboxi fluoresceína (carboxi-fluoresceína) en etanol. Diluir el / solución de 1 mg ml carboxi-fluoresceína a 150 g / ml en agua de calidad de laboratorio (por ejemplo, agua MilliQ). Proteja los tubos de luzcon papel de aluminio y se almacena a -20 ° C.
- Centrifugar las bacterias (2.600 xg, RT, 5 min). Resuspender el sedimento bacteriano en 800 l de PBS y añadir 200 l (concentración final de 30 mg / ml para los experimentos de perfusión) o 400 l (concentración final 50 mg / ml para los experimentos in vivo) de la / ml solución carboxi-fluoresceína 150 g. Proteja los tubos de la luz con papel de aluminio y se incuba durante 30 minutos a temperatura ambiente en un agitador.
- Después del marcaje, bloque con una solución de 6% de albúmina de suero bovino (BSA) en PBS.
- Diluir bacterias usando densitometría óptica (DO), un OD 600 de 0,65 para los experimentos in vitro (correspondiente a aproximadamente 3 x 10 8 unidades formadoras de colonias (UFC) / ml para S. aureus) y un OD 600 de 1,8 para experimentos in vivo ( correspondiente a aproximadamente 1 x 10 9 UFC / ml para S. aureus) en PBS. Proteja los tubos de la luz con papel de aluminio y dejar en hielo.
2. Los experimentos in vitro de perfusión
- Recubrimiento de cubreobjetos de vidrio
- Diluir el factor de von Willebrand (VWF) (Haemate P, concentración de stock 2,400 g / ml) en agua de calidad de laboratorio (destilada desionizada) a una concentración final de 50 mg / ml.
- Diluir colágeno en solución isotónica de glucosa (solución SKF, pH 2.7 a 2.9, tal como se suministra por el fabricante) a una concentración final de 160 mg / ml.
- Escudo cubreobjetos de vidrio (24 × 50 mm) con VWF o colágeno dejando caer 200 l de la capa en Parafilm y colocar el cubreobjetos en la parte superior de la gotita. La gota se extenderá a lo largo de la superficie del cubreobjetos.
- Incubar el cubreobjetos en un recipiente humidificado durante 4 horas a RT. Levante con cuidado el cubreobjetos de la parafina con una aguja roma. Montar el cubreobjetos en la parte inferior de la cámara de flujo.
- El recubrimiento de plástico desliza con células endoteliales
- Resbalones plástico Escudo(1-así cámara de cultivo celular PCA, Sarstedt, Alemania) con 1 ml de una solución de gelatina al 1% en PBS e incubar durante 30 min a 37 ° C. Sembrar las células endoteliales de vena umbilical humanas (HUVEC) en las hojas de plástico recubiertos con gelatina y crecer a 70-80% de confluencia. Montar la hoja de plástico en la parte inferior de la cámara de flujo.
- Experimento de perfusión
NOTA: Una visión esquemática del modelo in vitro de perfusión en está representado en la figura 1.- Realizar estudios in vitro la adhesión bacteriana en una cámara de flujo placa de micro-paralelo a un esfuerzo de cizalla laminar entre 2,5 dinas / cm 2 y 20 dinas / cm 2 para simular diferentes condiciones de flujo fisiológicas.
- El (diseño en-casa) cámara de flujo consiste en una estructura de metal y una cámara de perfusión hecha de plexiglás (poli (metil) metacrilato (PMMA)). Por lo conecta a una bomba de infusión de alta precisión (PHD 2000 Infusión, Harvard Apparatus, EE.UU.), podemos generar ra flujotes entre 0,0001 l / min y 220,82 ml / min.
- Conectar el tubo a la parte superior de la cámara de flujo e inyectar medio en el tubo. Colocar suavemente la parte superior de la cámara de flujo en la parte superior de la parte inferior y montar la cámara de flujo. Tenga cuidado para evitar las burbujas de aire. Inyectar 1 ml de medio a través de la cámara para asegurarse de que la cámara no tenga fugas y para eliminar la solución de revestimiento en exceso. Evite las burbujas de aire.
- Coloque el ratón sobre una almohadilla caliente termo-controlado a 37 ° C en una bandeja microscopio. Dado que este es un procedimiento de terminal, no hay necesidad de procedimientos asépticas estrictas. Hacer una incisión cerca de la vena yugular, eliminar suavemente el lado derecho del músculo cervical y aislar la vena yugular del tejido circundante.
- Configure la bomba de infusión y el microscopio de fluorescencia. Ajustes de la bomba de infusión dependen del diámetro de la jeringa y el caudal deseado (ver sección 2.4). A partir de ahora, trabajar en un cuarto oscuro.
- VWF Recubrimiento:
- Llene una jeringa con bacterias marcadas con fluorescencia y conectarlo al tubo de entrada. Evite las burbujas de aire. Encienda la bomba de infusión durante 10 minutos. El tiempo de infusión depende de la velocidad de cizallamiento y el recubrimiento, las bacterias y medio utilizado y debe representar el estado estacionario de la adhesión.
- Después de 10 min, lavar las bacterias no unidas mediante la conexión de una jeringa con PBS al tubo de entrada y de arrancar la bomba de infusión.
- Tomar por lo menos 15 imágenes o películas en diferentes lugares después del proceso de lavado. Las bacterias son pequeñas y potencialmente difícil de enfocar. Antes del experimento de flujo in vitro, el plano focal apropiada puede ser recuperada mediante la colocación de una gota de bacterias marcadas con fluorescencia en un cubreobjetos y colocar el cubreobjetos en la cámara de flujo. A continuación, busque el plano focal apropiado y guardar la configuración.
NOTA: Durante el experimento de flujo in vitro, la captura de las imágenes durante la etapa de lavado (± 5 min después del inicio) asegura que sólo elseñal para las bacterias adherentes es capturado.
- Colágeno Recubrimiento:
- Añadir 60 g / ml VWF a las bacterias marcadas fluorescentemente justo antes de comenzar la perfusión. Llene una jeringa con bacterias marcadas con fluorescencia o bacterias marcadas fluorescentemente suplementado con 60 g / ml VWF y conectarlo al tubo de entrada. Evite las burbujas de aire. Repita los pasos 2.3.5.2 a 2.3.5.3
- Células Endoteliales:
- Activar las células endoteliales por perfusión con una solución 0,1 mM del Ca 2+ -ionophore A23187 (solución madre 10 mM disueltos en dimetil sulfóxido (DMSO)) en DMEM a la misma velocidad de cizallamiento como la perfusión bacteriana durante 10 min por perfusión con una 0,1 mM. Repita los pasos 2.3.5.2 a 2.3.5.3.
- Calcula la velocidad de cizallamiento y la tensión de cizallamiento de la siguiente manera.
Velocidad de cizallamiento = 6Q / wh 2
Donde: Q: tasa en ml / min, flujo w: Ancho en cm, h: altura en cm
Esfuerzo de corte (τ) = rata cizallaex viscosidad (μ)
Donde μ: media: 0,01 dinas x seg / cm 2, la sangre total: 0,04 x seg dinas / cm 2 - Análisis de imagen
- Obtener imágenes en directo usando un microscopio de fluorescencia invertida con una cámara en blanco y negro y desarrollar el uso de software de imágenes. Utilice el tiempo de exposición de 1,5 seg. Tome varias instantáneas (al menos 15) distribuidas al azar sobre la superficie revestida de la cámara de flujo y guardarlos en el formato de archivo apropiado.
- Realizar análisis de imágenes con ImageJ. Reste el fondo para eliminar fondos continuos suaves de la imagen (Proceso - Antecedentes Resta) y definir el umbral para establecer los valores de umbral inferior y superior, la segmentación de imágenes en escala de grises en las características de interés. Mida la zona limitada al umbral.
- Comparar la adhesión bacteriana, expresado como área fluorescente, por ejemplo, usando software de análisis estadístico. Comparar los grupos usando ANOVA de una vía o two-cola prueba t de Student. Denuncie todos los valores como media ± error estándar de la media (SEM). Considere un valor de p <0,05 significativo (* p <0,05; ** p <0,01; *** p <0,001).
3. En Vivo Modelo de perfusión mesentérica
- Preparación / cirugía del ratón
- Fast el ratón la noche antes del experimento con el fin de limitar el movimiento intestinal.
- Dale un ratón viejo 6-8 semanas (C57BL / 6) analgesia preoperatoria mediante una inyección subcutánea de buprenorfina (0,1 mg / kg de peso corporal (PC)) 20 a 30 minutos antes de la cirugía.
- Anestesiar el ratón por inyección intraperitoneal de ketamina (125 mg / kg de peso corporal) y xilazina (12,5 mg / kg de peso corporal). Compruebe por reflejo pedal. Aplique un ungüento veterinario para evitar la sequedad.
- Coloque el ratón sobre una almohadilla caliente termo-controlado a 37 ° C en una bandeja microscopio. Dado que este es un procedimiento de terminal, no hay necesidad de una estricta asceptiprocedimientos c. Hacer una incisión cerca de la vena yugular, eliminar suavemente el lado derecho del músculo cervical y aislar la vena yugular del tejido circundante.
- Insertar un catéter intravenoso francesa 2 en la vena yugular derecha para la infusión de bacterias marcadas fluorescentemente u otras soluciones. Abra la cavidad peritoneal a través de una incisión abdominal en la línea media y el uso de hisopos de algodón para difundir el mesenterio y para visualizar el arteriolas mesentéricas y circulación venular.
- Coloque el ratón en el lado derecho en una placa transparente y asegurar la cánula con cinta adhesiva. Utilice una compresa caliente para evitar la hipotermia. Para prevenir la deshidratación del tejido, la caída de 500 l 0,9% de NaCl en los intestinos.
- Microscopía de fluorescencia de la adhesión bacteriana a la circulación mesentérica
- Trabajar en un cuarto oscuro. Use hisopos de algodón para inmovilizar los vasos y visualizarlos en un microscopio invertido.
- Por vía tópica aplicar 5 l de una solución 10 mM of Ca 2+ -ionophore A23187 disolvió en DMSO. Después de 10 seg, inyectar 100 l bacterias marcadas (ver paso 1) a través del catéter yugular. Tomar imágenes con lapso de tiempo. Una vez finalizado el experimento, la eutanasia el ratón de acuerdo con las directrices aprobadas institucionales.
- Análisis De Imagen
- Obtener imágenes en directo utilizando un microscopio de fluorescencia invertida, capturaron con una cámara en blanco y negro y desarrollado utilizando cualquier software de imágenes. Aplicar tiempo de exposición automatizada y el contraste optimización específica para el equipo utilizado.
- Adquirir imágenes con lapso de tiempo utilizando la herramienta de 'Adquisición' en la barra de herramientas (Adquisiciones multidimensionales - Tiempo) usando 40 ciclos de 1.000 imágenes / seg. Guarde las imágenes en un formato de archivo de imagen correspondiente.
- Imágenes de proceso utilizando el software de análisis ImageJ para medir el área de la señal fluorescente por imagen. Definir el umbral para establecer los valores de umbral inferior y superior, la segmentación de imágenes en escala de grises en fsticasoperativas de interés. Identificar la región de interés (vaso sanguíneo) y medir el área limitada al umbral y la región de interés. Comparar la adhesión bacteriana, expresado como el área de fluorescencia utilizando cualquier software estadístico o de gráficos.
Resultados
S. aureus adhesión a FVW, la matriz subendotelial y las células endoteliales es un fenómeno dependiente de la tensión de cizallamiento
Para enfatizar el papel del esfuerzo cortante en la interacción entre S. aureus y VWF, que realizaron perfusiones más de FVW cubreobjetos recubiertos a diferentes velocidades de corte (una visión esquemática del modelo in vitro de perfusión en se da en la figura 1. La adhesión de S. aureus a FVW incrementa con velocidades de cizalla crecientes de 250 seg -1 a 2000 sec -1 (Figura 2), lo que indica que las fuerzas de alto cizallamiento no inhiben pero refuerzan la adhesión de las bacterias a VWF.
Con el fin de investigar la contribución de VWF a la adhesión bacteriana a colágeno, el componente principal de la matriz subendotelial, que perfundidos marcado con fluorescencia S. aureus sobre colágeno en presencia o ausencia de VWF. En ausencia de VWF, la adhesión de S. laureus al colágeno disminuye con el aumento de velocidades de cizallamiento. Sin embargo, cuando VWF estaba presente en el medio, la adherencia de S. aureus aumentó con el aumento de las tasas de corte (Figura 3).
El modelo de flujo in vitro también nos permite examinar la adhesión de las bacterias a las células endoteliales bajo flujo. Nos perfundidos HUVECs con fluorescencia etiquetados S. aureus a velocidades de cizallamiento de 500 a 2000 seg -1. Donde se indique, HUVECs se activa con un Ca 2+ -ionophore, para provocar la liberación de FVW. La activación de células endoteliales y la posterior liberación VWF, aumento de la adhesión de S. aureus (Figura 4A), que se formó patrones típicos "-cadena como" de marcado con fluorescencia agrupaciones bacterianas alineados en la dirección de la fuerza de corte (Figura 4B), lo que sugiere la unión de bacterias a lo largo de una molécula lineal VWF-estirado.
Inicial in vivola adhesión bacteriana en las venas esplácnico está mediada por VWF
Desde S. aureus es capaz de adherirse a VWF, hemos utilizado ratones de tipo salvaje (vWF + / +) y VWF-ratones deficientes (vWF - / -) para investigar la adhesión bacteriana a la pared del vaso activado in vivo. Videomicroscopia en tiempo real de las venas esplácnicos permitió la visualización in vivo de la circulación de la etiqueta fluorescente S. aureus (visión general esquemática del modelo de perfusión en vivo se representa en la figura 5).
Después de la activación farmacológica del endotelio por el Ca 2+ -ionophore, se observó una rápida acumulación local de las bacterias y los agregados de bacterias individuales a la pared del vaso de ratones WT (Videos suplementario 1 y 2). Se observó casi ninguna adherencia de bacterias en la pared del vaso activada de vWF -deficieratones nt (suplementario Video 3) en comparación con la adhesión en ratones WT (Figura 6). La ausencia de VWF disminuye la capacidad de S. aureus de adherirse a la pared del vaso activado.
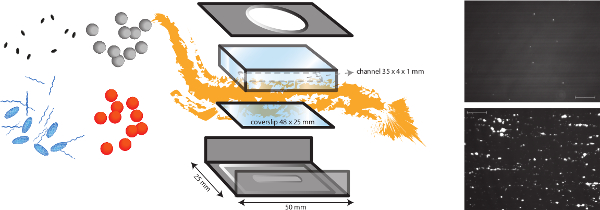
Figura 1. Una representación esquemática del modelo de flujo in vitro. El modelo de flujo in vitro es un modelo multifuncional, que permite el estudio de diferentes mecanismos dependientes de cizallamiento tales como la adhesión bacteriana a la matriz subendotelial, sino también la formación de trombos. La cámara de flujo micro-paralelo se coloca sobre un cubreobjetos (de plástico o vidrio) con diferentes recubrimientos de proteínas y células endoteliales. La adhesión de bacterias diferentes (naranja y puntos grises) puede ser analizada, y el impacto de la presencia de las proteínas del plasma, plaquetas y sangre entera puede ser evaluada. Marcadores fluorescentes para plaquetas (óvalos azules) o fibrinogen cadenas (azul) se puede utilizar en combinación con diferentes inhibidores (óvalos negros) para distinguir factores bacterianos y del huésped. Imágenes representativas de la adhesión bacteriana de S. aureus al recubrimiento de colágeno en presencia (inferior) o ausencia (superior) del FVW se muestra (barra de escala es de 100 micras). Por favor, haga clic aquí para ver una versión más grande de esta figura.
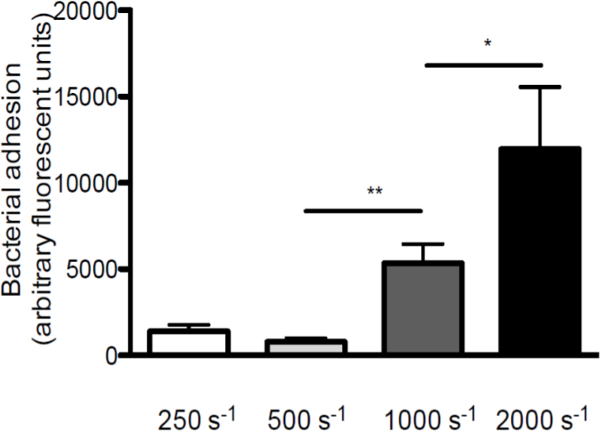
Figura 2. La adhesión de S. aureus a los aumentos de FVW con el aumento de velocidades de cizallamiento. Micro-paralelo perfusión cámara de flujo sobre revestido VWF (50 g / ml) con marcado con fluorescencia S. aureus Newman a velocidades de cizallamiento de 250 a 2000 s-1 (s-1) en el medio (n> 5). Todos los resultados se expresan como media ± SEM. * P <0,05, ** p <0,01.
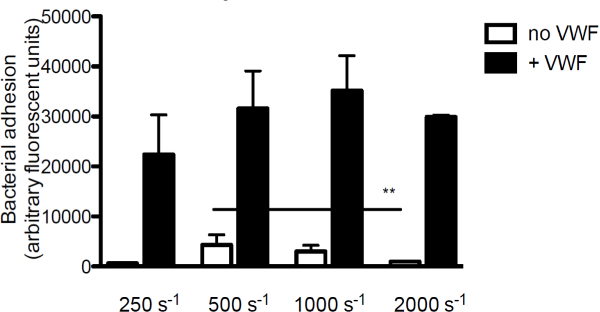
Figura 3. La adhesión de S. aureus a subendotelio es cizallamiento y VWF dependiente. Micro-paralelo perfusión cámara de flujo sobre colágeno recubierto (160 g / ml) con la etiqueta fluorescente S. aureus Newman a velocidades de cizallamiento de 250 a 2000 seg -1 en medio (n> 5). VWF (60 g / ml) estaba presente en el medio donde se indica. Todos los resultados se expresan como media ± SEM. ** P <0,01.
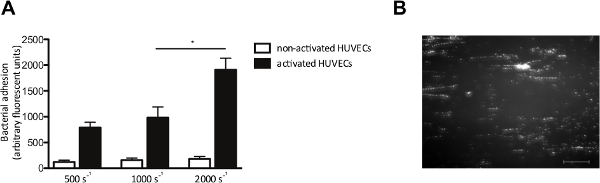
Figura 4. La adhesión de S. aureus a las células endoteliales activadas es cizalla dependiente. perfusión cámara de flujo-Micro paralelo sobre las células endoteliales. (A) las células endoteliales de la vena umbilical humana se activaron con el Ca 2+ -ionophore A23.187 (0,1 mM) seguido de una perfusión de 10 min marcado con fluorescencia S. aureus Newman a velocidades de cizallamiento de 500 a 2000 seg -1 en medio (n> 5). Todos los resultados se expresan como media ± SEM. * P <0,05. (B) Imagen de la micro-cámara de flujo paralelo de perfusión durante HUVECs activadas con S. aureus a una velocidad de cizallamiento de 1000 seg -2. S. aureus forma cadenas de ± 200 micras de longitud, lo que sugiere la adhesión a multímeros de FVW (barra de escala es de 100 micras). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. Una visión esquemática del modelo de perfusión mesentérica in vivo. Un catéter en la vena yugular derecha (línea amarilla) está insertada para la administración de fluorbacterias escently marcados (puntos de color naranja), anestésicos adicionales u otros componentes tales como inhibidores farmacéuticos y anticuerpos. La cavidad peritoneal se abre y el mesenterio se extiende para visualizar los vasos sanguíneos (venosos y arteriales) bajo un microscopio de fluorescencia. Después de la activación farmacológica del endotelio por un -ionophore Ca 2+, que induce la liberación de FVW, las bacterias pueden ser inyectados a través del catéter de la vena yugular. Microscopía de vídeo intravascular en tiempo real permite la visualización en vivo de bacterias circulantes marcados con fluorescencia y la formación resultante de bacterias en plaquetas trombos. Por favor, haga clic aquí para ver una versión más grande de esta figura.
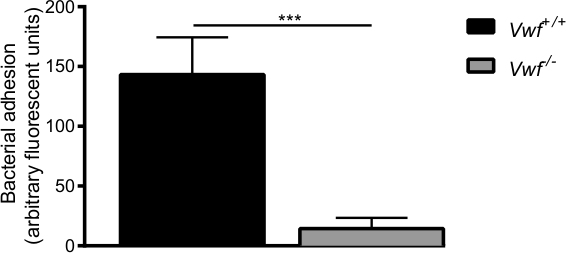
Figura 6. La adhesión inicial de S. aureusal endotelio activado in vivo está mediada por FVW En vivo venosa modelo perfusión mesentérica con C57BL / 6-FVW + / + y C57BL / 6-vWF -. / - ratones. La adhesión de la etiqueta fluorescente S. aureus a la pared del vaso localmente activado es significativamente menor en vWF - / - ratones. Todos los resultados se expresan como media ± SEM. *** P <0.001, n> 7.
Video 1: adherencia en tiempo real de S. aureus a la pared del vaso activado en FVW + / + ratones. Por favor, haga clic aquí para ver el vídeo.

Video 2: formación de agregados en tiempo real y la embolización de S. aureus en FVW ratones + / +. Por favor, haga clic aquí para ver el vídeo.

Video 3: adherencia en tiempo real de S. aureus a la pared del vaso activado en FVW - / -. ratones in vivo modelo de perfusión mesentérica con FVW + / + y vWF - / - ratones. Cinco l de una -ionophore Ca 2+ (10 mM) se aplied a la región de la cama vascular visualizado. Una suspensión de la etiqueta-carboxi-fluoresceína S. aureus se inyectó a través del catéter yugular. La circulación mesentérica se visualizó bajo un microscopio invertido. Por favor, haga clic aquí para ver el vídeo.
Discusión
El esfuerzo cortante es un factor crucial para la pronta adhesión bacteriana a la pared del vaso y para la posterior generación de endovascular o vegetaciones endocárdicas e infecciones metastásicas 4,5. Hemos descrito complementario in vitro y en modelos in vivo para estudiar la patogénesis de las infecciones endovasculares bajo estrés de cizalla fisiológica. Estos modelos han permitido identificar la proteína de unión del factor de von Willebrand (vWbp) como el principal S. proteína aureus para interactuar bajo flujo con una pared vascular lesionada exponer VWF 4.
Infecciones endovasculares y la endocarditis infecciosa, en particular, son motivo de preocupación no sólo por la insuficiencia orgánica inducida por sepsis y muerte, pero también a causa de ('') metastásicos complicaciones locales y distantes. Para provocar endocarditis infecciosa e infecciones metastásicas, las bacterias tienen que adherirse a la pared del vaso y por lo tanto resistir el esfuerzo cortante de la sangre que fluye. Másestudios sobre bacterias factores de virulencia se han realizado en condiciones estáticas. Sin embargo, estas interacciones establecidas no pueden soportar las fuerzas de corte y estudios en condiciones de flujo puede revelar nuevos factores, no reconocidos previamente en la interacción bacteria-huésped.
El uso de la cámara de flujo micro-paralelo, nosotros y otros han demostrado la importancia de FVW de adhesión vascular. Bajo esfuerzo de corte, FVW progresivamente se despliega a partir de su estructura globular de descanso, y expone el dominio A1 que interactúa con las plaquetas a través de su receptor GPIb 6. Cámaras de flujo se han utilizado ampliamente para estudiar la función plaquetaria 7.
Sorprendentemente, también S. aureus adherencia bajo flujo requiere VWF, y en particular el dominio A1 que se expone a cizallamiento. Identificamos vWbp para mediar FVW vinculante. vWbp es un coagulasa que contribuye a S. aureus fisiopatología mediante la activación de la protrombina del anfitrión. Staphylothrombin, la resulting complejo de un coagulasa bacteriana y protrombina, convierte el fibrinógeno en fibrina insoluble 8,9. Nuestros estudios han demostrado que vWbp no sólo activar la protrombina, pero desencadena la formación de agregados de bacterias de fibrina-plaquetas, que mejoran la adherencia a los vasos sanguíneos bajo flujo de 4,10,11.
El modelo de cámara de flujo in vitro permite estudiar los diferentes actores de la adhesión bacteriana a componentes celulares o matriz. Factores de virulencia bacterianos pueden ser estudiados utilizando mutantes o bacterias inocuas que expresan proteínas de superficie específicas. Alternativamente, los inhibidores farmacológicos o anticuerpos bloqueantes pueden añadirse al medio en la cámara de flujo. El papel de los factores del huésped tales como diferentes constituyentes de la matriz extracelular se puede estudiar mediante el uso de cubreobjetos con diferentes recubrimientos. Los cubreobjetos también pueden ser cubiertos con células endoteliales, de los cuales el estado de activación puede modularse mediante la adición de estimuladores específicos. Apart de la pared vascular, la contribución de las células de la sangre de acogida y las proteínas plasmáticas puede ser estudiada mediante la adición de estos factores al medio que fluye. Por lo tanto, diferentes condiciones de creciente complejidad se pueden estudiar en condiciones estandarizadas de flujo laminar para desentrañar las interacciones que permiten que las bacterias se adhieran a la pared del vaso in vivo.
Interacciones identificadas en el modelo in vitro se estudian posteriormente en un modelo animal para probar su relevancia en un organismo complejo. Otros modelos in vivo para estudiar las interacciones dinámicas bajo flujo han sido descritos, tales como la cámara de pliegue cutáneo dorsal de hámster 12 y el modelo 13 cremáster. En comparación, el modelo de perfusión mesentérica descrito aquí ofrece varias ventajas debido a su facilidad de uso, la posibilidad de variar el anfitrión de antecedentes genéticos de los ratones y para evaluar las intervenciones farmacológicas.
En conclusión, los modelos descritosofrecer la posibilidad de estudiar las proteínas de superficie no sólo de S. aureus, sino de muchos otros microorganismos en los diferentes orígenes de acogida, para comprender mejor la patogénesis de las infecciones vasculares.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Fonds voor Wetenschappelijk Onderzoek (FWO) Vlaanderen G0466.10, 11I0113N; "Eddy Merckx Beca de Investigación" y el "Sporta investigación Grant" la cardiología pediátrica, UZ Lovaina, Bélgica (JC); el Centro de Molecular y Biología Vascular es apoyado por el Programmafinanciering KU Leuven (PF / 10/014), por el "Geconcentreerde Onderzoeksacties" (GOA 2009/13) por la Universidad de Lovaina y una beca de investigación de Boehringer Ingelheim.
Materiales
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
Referencias
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados