Method Article
In vitro e in vivo modello per studiare l'adesione batterica alla parete del serbatoio in condizioni di flusso
In questo articolo
Riepilogo
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
Abstract
Per causare infezioni endovascolari, endocardite infettiva, batteri devono essere in grado di aderire alla parete del vaso mentre viene esposta alla sollecitazione di taglio del flusso sanguigno.
Per identificare i fattori batterici e di accoglienza che contribuiscono alla adesione vascolare di microrganismi, sono necessari modelli appropriati che studiano queste interazioni in condizioni fisiologiche di taglio. Qui, descriviamo un modello vitro camera di flusso che permette di indagare adesione batterica alle diverse componenti della matrice extracellulare o alle cellule endoteliali, e un modello di microscopia intravitale che è stato sviluppato di visualizzare direttamente l'adesione iniziale dei batteri alla circolazione splancnica in vivo . Questi metodi possono essere utilizzati per identificare i fattori batterici e host richiesto per l'adesione dei batteri sotto flusso. Illustriamo la rilevanza di sforzo di taglio e il ruolo del fattore di von Willebrand per l'adesione di Staphylococcus aureus utilizzando sia in vitro e in modelli in vivo.
Introduzione
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
Protocollo
Gli esperimenti sugli animali sono stati approvati dal Comitato Etico della KU Leuven.
1. I batteri Preparazione in vitro perfusione e in vivo
- Abbiamo usato S. aureus ceppo Newman per tutti gli esperimenti descritti in questo manoscritto. S. aureus Newman è stato memorizzato in Brain Heart Infusion (BHI) con il 10% di glicerolo a -80 ° C.
- Utilizzare un'ansa sterile per raschiare i batteri congelati off e inoculare in 5 ml Tryptic Soy Broth (TSB) O / N a 37 ° C (OD 600> 3).
- Lavare i batteri mediante centrifugazione (2.600 g, RT, 5 min) e risospendere il pellet batterico in 5 ml di PBS (tampone fosfato salino).
- Preparare una soluzione di 1 mg / ml di 5 (6) estere -carboxy-fluoresceina N-hydroxysuccinimidyl (carbossi-fluoresceina) in etanolo. Diluire il / soluzione 1 mg ml di carbossi-fluoresceina a 150 mg / ml in acqua grado di laboratorio (ad esempio, acqua MilliQ). Proteggere i tubi di lucecon un foglio di alluminio e conservare a -20 ° C.
- Centrifugare i batteri (2.600 xg, RT, 5 min). Risospendere il pellet batterico in 800 l di PBS e aggiungere 200 ml (concentrazione finale di 30 mg / ml per gli esperimenti di perfusione) o 400 ml (concentrazione finale 50 mg / ml per gli esperimenti in vivo) della / ml soluzione carbossi-fluoresceina 150 mcg. Proteggere i tubi dalla luce con un foglio di alluminio e incubare per 30 minuti a RT su un agitatore.
- Dopo etichettatura, blocco con soluzione al 6% albumina di siero bovino (BSA) in PBS.
- Diluire batteri utilizzando densitometria ottica (OD), un OD 600 di 0,65 per esperimenti in vitro (corrispondenti a circa 3 x 10 8 unità formanti colonie (CFU) / ml di S. aureus) e un diametro esterno di 600 1.8 per esperimenti in vivo ( corrispondente a circa 1 x 10 9 CFU / ml per S. aureus) in PBS. Proteggere i tubi dalla luce con un foglio di alluminio e lasciare sul ghiaccio.
2. Gli esperimenti in vitro perfusione
- Rivestimento di vetrini di vetro
- Diluire fattore di von Willebrand (VWF) (Haemate P, concentrazione della 2.400 mg / ml) in acqua grado di laboratorio (deionizzata distillata) ad una concentrazione finale di 50 mg / ml.
- Diluire collagene in soluzione isotonica di glucosio (soluzione SKF, pH 2,7-2,9, come fornito dal produttore) ad una concentrazione finale di 160 mg / ml.
- Coprioggetto di vetro Coat (24 × 50 mm) con VWF o collagene facendo cadere 200 ml di rivestimento sul parafilm e posizionare il vetrino in cima della goccia. La goccia si diffonderà lungo la superficie del vetrino.
- Incubare il vetrino in un contenitore umidificato per 4 ore a temperatura ambiente. Sollevare con cautela i coprioggetti dal parafilm con un ago smussato. Montare il vetrino nella parte inferiore della camera di flusso.
- Rivestimento di plastica scivola con le cellule endoteliali
- Scivola Coat plastica(1-well camera di coltura cellulare PCA, Sarstedt, Germania) con 1 ml di una soluzione di gelatina 1% in PBS e incubare per 30 min a 37 ° C. Cellule umane Seed vena ombelicale endoteliali (HUVEC) sui gelatina rivestito scivola di plastica e di farle crescere al 70-80% di confluenza. Montare lo scorrimento in plastica nella parte inferiore della camera di flusso.
- Perfusion Experiment
NOTA: Una panoramica schematica del modello di perfusione in vitro è rappresentata in figura 1.- Eseguire in vitro studi adesione batterica in una camera di flusso lamiera microforata parallelo ad un carico laminare taglio tra 2,5 dyne / cm 2 e 20 dyne / cm 2 per simulare diverse condizioni di flusso fisiologiche.
- Il (progettazione interno) camera di flusso è costituito da un telaio metallico e una camera di perfusione fatto di plexiglas (poli (metil) metacrilato (PMMA)). Collegando ad una pompa per infusione ad alta precisione (PHD 2000 Infusion, Harvard Apparatus, Stati Uniti d'America), siamo in grado di generare flussi di raTES tra 0,0001 ml / min e 220,82 ml / min.
- Collegare il tubo per la parte superiore della camera di flusso e iniettare fluido nel tubo. Posizionare delicatamente la parte superiore della camera di flusso sopra la parte inferiore e montare la camera di flusso. Fare attenzione a evitare bolle d'aria. Iniettare 1 ml di terreno attraverso la camera per assicurarsi che la camera non perde e per rimuovere la soluzione di rivestimento in eccesso. Evitare bolle d'aria.
- Posizionare il mouse su una piastra elettrica termo-controllata a 37 ° C su un vassoio microscopio. Poiché questo è un procedimento terminale, non vi è alcuna necessità di severe procedure asettiche. Fare un'incisione vicino alla vena giugulare, rimuovere delicatamente il lato destro del muscolo cervicale e isolare la vena giugulare dal tessuto circostante.
- Impostare la pompa di infusione e microscopio a fluorescenza. Impostazioni della pompa di infusione dipendono dal diametro siringa e la portata desiderata (vedere paragrafo 2.4). D'ora in poi, lavorare in una stanza buia.
- VWF Rivestimento:
- Riempire una siringa con batteri fluorescente e collegarlo al tubo di ingresso. Evitare bolle d'aria. Avviare la pompa di infusione per 10 minuti. Il tempo di infusione dipende dalla velocità di deformazione e il rivestimento, batteri e mezzo utilizzato e dovrebbe rappresentare lo stato stazionario di aderenza.
- Dopo 10 min, lavare via i batteri non legato collegando una siringa con PBS al tubo di ingresso e di avviare la pompa per infusione.
- Prendere almeno 15 immagini o filmati in diversi punti dopo il processo di lavaggio. I batteri sono piccoli e potenzialmente difficile mettere a fuoco. Prima dell'esperimento flusso in vitro, il piano focale appropriata può essere recuperato mettendo una goccia di batteri fluorescente su un vetrino e posizionare il vetrino nella camera di flusso. Quindi, cercare il piano focale appropriata e salvare le impostazioni.
NOTA: Durante l'esperimento flusso in vitro, catturando le immagini durante la fase di lavaggio (± 5 min dopo l'avvio) assicura che solo lasegnale per i batteri aderenti viene catturato.
- Collagene Rivestimento:
- Aggiungere 60 mg / ml VWF ai batteri fluorescente appena prima di iniziare la perfusione. Riempire una siringa con batteri fluorescente o batteri fluorescente integrata con 60 mg / ml VWF e collegarlo al tubo di ingresso. Evitare bolle d'aria. Ripetere i passaggi da 2.3.5.2 a 2.3.5.3
- Cellule endoteliali:
- Attivare le cellule endoteliali mediante perfusione con una soluzione 0,1 mM di Ca 2+ -ionophore A23187 (soluzione stock 10 mM disciolto in dimetilsolfossido (DMSO)) in DMEM alla stessa velocità di taglio come la perfusione batterico per 10 min in perfusione con 0,1 mm. Ripetere i passaggi da 2.3.5.2 a 2.3.5.3.
- Calcola gradiente di velocità e sforzo di taglio come segue.
Tasso Shear = 6Q / wh 2
Dove: Q: portata in ml / min, w: larghezza in cm, h: altezza in cm
Lo stress Shear (τ) = taglio rattoex viscosità (μ)
Dove μ: media: 0.01 dynes x sec / cm 2, sangue intero: 0.04 dine x sec / cm 2 - L'analisi delle immagini
- Ottenere le immagini dal vivo utilizzando un microscopio a fluorescenza invertito con una macchina fotografica in bianco e nero e sviluppare mediante software di imaging. Utilizzare il tempo di esposizione di 1,5 sec. Prendere istantanee multiple (almeno 15) distribuite casualmente sulla superficie rivestita della camera di flusso e salvarli nel formato di file appropriato.
- Eseguire l'analisi delle immagini con ImageJ. Sottrarre il fondo per rimuovere continui sfondi lisci dall'immagine (Process - Contesto Sottrarre) e definire la soglia per impostare i valori di soglia inferiore e superiore, segmentando le immagini in scala di grigi in caratteristiche di interesse. Misurare l'area limitata alla soglia.
- Confronta adesione batterica, espresso in zona fluorescenti, ad esempio, utilizzando il software di analisi statistica. Confronta i gruppi utilizzando ANOVA unidirezionale o two-coda t-test di Student. Segnala tutti i valori medi errore ± standard della media (SEM). Si consideri un valore p- <0,05 significative (* p <0,05; ** p <0.01; *** p <0.001).
3. In Vivo mesenterica Perfusion Modello
- Preparazione / chirurgia del mouse
- Digiunare il mouse la notte prima dell'esperimento per limitare il movimento intestinale.
- Dare un 6-8 settimane vecchio mouse (C57Bl / 6) l'analgesia pre-operatoria per una iniezione sottocutanea di buprenorfina (0,1 mg / kg di peso corporeo (BW)) 20-30 minuti prima dell'intervento.
- Anestetizzare il topo mediante iniezione intraperitoneale di ketamina (125 mg / kg di peso corporeo) e xilazina (12,5 mg / kg di peso corporeo). Controllare a pedale reflex. Applicare veterinario pomata per prevenire la secchezza.
- Posizionare il mouse su una piastra elettrica termo-controllata a 37 ° C su un vassoio microscopio. Poiché questo è un procedimento terminale, non vi è alcuna necessità di una rigorosa asceptiProcedure c. Fare un'incisione vicino alla vena giugulare, rimuovere delicatamente il lato destro del muscolo cervicale e isolare la vena giugulare dal tessuto circostante.
- Inserire un catetere endovenoso francese 2 nella vena giugulare destra per l'infusione di batteri fluorescente o altre soluzioni. Aprire la cavità peritoneale attraverso un incisione addominale mediana e utilizzare tamponi di cotone per diffondere il mesentere e di visualizzare il arteriolare mesenterica e la circolazione venulare.
- Posizionare il mouse sul lato destro su una lastra trasparente e fissare la cannula con nastro. Utilizzare un impacco caldo per prevenire l'ipotermia. Per evitare la disidratazione del tessuto, goccia 500 ml 0,9% NaCl l'intestino.
- Microscopia a fluorescenza di adesione batterica alla circolazione mesenterica
- Lavorare in una stanza buia. Usare tamponi di cotone per immobilizzare i vasi e li visualizza sotto un microscopio invertito.
- Topicamente applicare 5 ml di una soluzione 10 mM of Ca 2+ -ionophore A23187 disciolto in DMSO. Dopo 10 secondi, iniettare 100 pl batteri etichettati (vedi punto 1) attraverso il catetere giugulare. Prendere immagini time-lapse. Dopo l'esperimento è finito, eutanasia il mouse secondo le linee guida istituzionali approvate.
- Image Analysis
- Ottenere le immagini dal vivo usando un microscopio a fluorescenza invertito, catturata con una macchina fotografica in bianco e nero e sviluppato utilizzando qualsiasi software di imaging. Applicare tempo di esposizione automatizzato e ottimizzazione contrasto specifici per l'apparecchiatura utilizzata.
- Acquisire time-lapse immagini utilizzando lo strumento 'acquisizione' nella barra degli strumenti (Acquisizioni multidimensionale - Time) con 40 cicli di 1.000 immagini / sec. Salvare le immagini in un formato di file immagine appropriato.
- Le immagini del processo utilizzando il software di analisi ImageJ per misurare l'area del segnale fluorescente per immagine. Definire la soglia per impostare i valori di soglia inferiore e superiore, segmentando le immagini in scala di grigi in features di interesse. Identificare la regione di interesse (vaso sanguigno) e misurare l'area limitata alla soglia e la regione di interesse. Confronta adesione batterica, espresso in zona fluorescenti utilizzando qualsiasi software statistico o grafica.
Risultati
S. aureus adesione alla VWF, matrice subendoteliale e cellule endoteliali è un fenomeno dipendente sforzo di taglio
Per sottolineare il ruolo dello stress di taglio nell'interazione tra S. aureus e VWF, abbiamo eseguito perfusioni oltre VWF vetrini rivestiti a differenti velocità di taglio (una visione schematica del modello di perfusione in vitro è dato in Figura 1. Adesione di S. aureus per VWF aumentato con l'aumento dei tassi di taglio da 250 sec -1 a 2.000 sec -1 (Figura 2), indicando che elevate forze di taglio non inibiscono ma rinforzano l'adesione dei batteri alle VWF.
Per investigare il contributo di VWF per adesione batterica al collagene, il componente principale della matrice subendoteliale, abbiamo perfuso fluorescente S. aureus sopra collagene in presenza o assenza di VWF. In assenza di VWF, adesione di S. unureo al collagene è diminuita con l'aumentare i tassi di taglio. Tuttavia, quando VWF era presente nel mezzo, l'adesione di S. aureus aumentava con l'aumentare shear rate (Figura 3).
Il modello di flusso in vitro ci permette anche di valutare l'adesione dei batteri alle cellule endoteliali sotto flusso. Abbiamo perfuso HUVECs con fluorescente S. aureus a velocità di taglio da 500 a 2.000 sec -1. Dove indicato, HUVECs sono stati attivati con un Ca 2+ -ionophore, a causare il rilascio di VWF. Attivazione delle cellule endoteliali e del successivo rilascio VWF, maggiore adesione di S. aureus (Figura 4A), che costituiva schemi tipici "stringa-like" di fluorescente cluster batteriche allineati nella direzione della forza di taglio (Figura 4B), suggerendo il legame di batteri lungo una VWF molecola lineare allungata.
Iniziale in vivoadesione batterica nelle vene splancnico è mediato da VWF
Da S. aureus è in grado di aderire a VWF, abbiamo utilizzato topi di tipo selvatico (VWF + / +) e VWF topi con deficit (VWF - / -) per indagare adesione batterica alla parete del vaso attivata in vivo. In tempo reale videomicroscopia delle vene splancnici permesso la visualizzazione in vivo di far circolare fluorescente S. aureus (Schema del modello in vivo perfusione è rappresentato in figura 5).
Dopo l'attivazione farmacologica dell'endotelio dal Ca 2+ -ionophore, abbiamo osservato rapido accumulo locale dei singoli batteri e aggregati di batteri alla parete del vaso di topi WT (supplementare Video 1 e 2). Quasi nessuna adesione dei batteri è stato osservato sulla parete del vaso attivato di vWF -deficient topi (supplementare Video 3) rispetto ad adesione in topi WT (Figura 6). L'assenza di VWF diminuisce la capacità di S. aureus di aderire alla parete del vaso attivato.
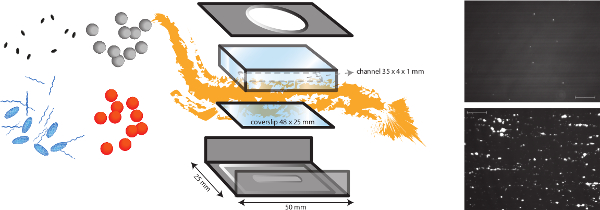
Figura 1. Una rappresentazione schematica del modello di flusso in vitro. Il modello di flusso in vitro è un modello multifunzionale, che consente lo studio di diversi meccanismi dipendenti taglio come adesione batterica alla matrice sottoendoteliale ma anche la formazione di trombi. La camera di flusso micro-parallelo è posto su un vetrino (plastica o vetro) con differenti rivestimenti di proteine e cellule endoteliali. L'adesione dei batteri diversi (arancione e punti grigi) possono essere analizzati, e l'impatto della presenza di proteine plasmatiche, piastrine e sangue intero può essere valutato. Marcatori fluorescenti per piastrine (ovali blu) o fibrinogit (stringhe blu) può essere utilizzato in combinazione con diversi inibitori (ovali neri) di distinguere fattori batterici e di accoglienza. Immagini rappresentative della adesione batterica di S. aureus a rivestimento di collagene in presenza (in basso) o assenza (superiore) del VWF sono mostrati (barra della scala è di 100 micron). Clicca qui per vedere una versione più grande di questa figura.
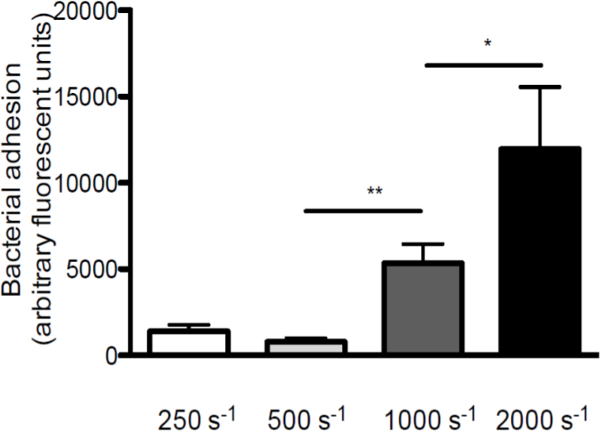
Figura 2. Adesione di S. aureus di VWF aumenta con l'aumentare i tassi di taglio. Micro-parallelo perfusione camera di flusso su patinata VWF (50 mg / ml) con fluorescente S. aureus Newman a velocità di taglio di 250 a 2000 sec -1 (sec -1) a medio (n> 5). Tutti i risultati sono espressi come media ± SEM. * P <0.05, ** p <0,01.
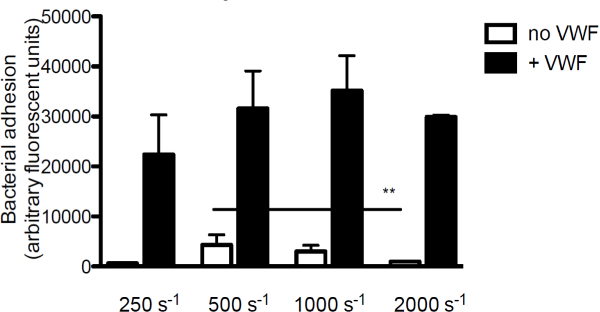
Figura 3. Adesione di S. aureus a subendothelium è taglio e VWF dipendente. Micro-parallelo perfusione camera di flusso su collagene rivestito (160 mg / ml) con fluorescente S. aureus Newman a velocità di taglio di 250 a 2000 sec -1 in media (n> 5). VWF (60 ug / ml) era presente nel mezzo di dove indicato. Tutti i risultati sono espressi come media ± SEM. ** P <0.01.
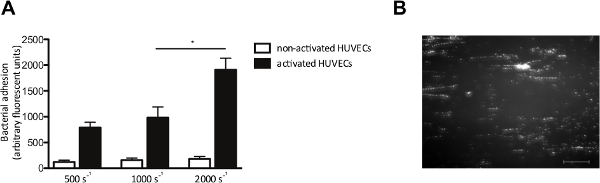
Figura 4. Adesione di S. aureus alle cellule endoteliali attivate è taglio dipendente. Micro-parallelo perfusione camera di flusso su cellule endoteliali. (A) cellule endoteliali umane della vena ombelicale sono state attivate con l'Università Ca 2+ -ionophore A23187 (0.1 mM) seguito da 10 minuti di perfusione fluorescente S. aureus Newman a velocità di taglio di 500 a 2000 sec -1 in media (n> 5). Tutti i risultati sono espressi come media ± SEM. * P <0,05. (B) L'immagine di micro-parallelo perfusione camera di flusso su HUVECs attivati con S. aureus ad una velocità di taglio di 1.000 sec -2. S. aureus forma stringhe di ± 200 micron di lunghezza, il che suggerisce l'adesione di multimeri VWF (barra della scala è di 100 micron). Cliccate qui per vedere una versione più grande di questa figura.

Figura 5. Una panoramica schematica del modello di perfusione mesenterica in vivo. Un catetere giugulare destra (linea gialla) è inserito per la somministrazione di fluorobatteri escently etichettati (punti arancione), anestetici aggiuntivi o di altri componenti come gli inibitori farmaceutiche e gli anticorpi. La cavità peritoneale è aperta e il mesentere si sviluppa per visualizzare i vasi sanguigni (arteriosi e venosi) sotto un microscopio a fluorescenza. Dopo l'attivazione farmacologica dell'endotelio da Ca 2+ -ionophore, che induce il rilascio di VWF, batteri possono essere iniettati attraverso il catetere vena giugulare. In tempo reale video microscopia intravascolare permette di visualizzare in vivo di circolante batteri fluorescente e la conseguente formazione di batteri-piastrinici trombi. Cliccate qui per vedere una versione più grande di questa figura.
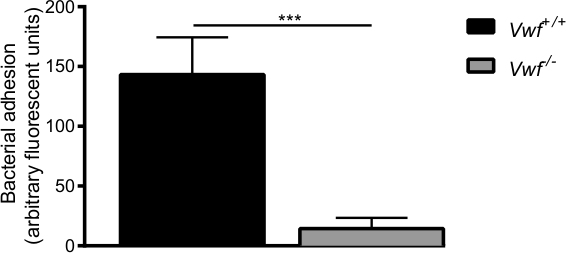
Figura 6. L'adesione iniziale di S. aureusdi endotelio attivato in vivo è mediata da VWF In vivo venosa mesenterica modello perfusione con C57BL / 6- VWF + / + e C57BL / 6- FvW -. / - mice. Adesione di fluorescente S. aureus alla parete del vaso localmente attivato è significativamente più bassa in VWF - / - mice. Tutti i risultati sono espressi come media ± SEM. *** P <0,001, n> 7.
Video 1: in tempo reale adesione di S. aureus a parete dei vasi attivato al VWF + / + topo. Cliccate qui per vedere il video.

Video 2: la formazione di aggregati in tempo reale e embolizzazione di S. aureus in VWF + / + topo. Clicca qui per vedere il video.

Video 3: tempo reale adesione di S. aureus a parete dei vasi attivato al VWF - / -. topi in vivo modello perfusione mesenterica con VWF + / + e VWF - / - mice. Cinque microlitri di Ca 2+ -ionophore (10 mM) è stato applied alla regione del letto vascolare visualizzato. Una sospensione di carbossi-fluoresceina S. aureus è stato iniettato attraverso il catetere giugulare. La circolazione mesenterica è stato visualizzato sotto un microscopio invertito. Clicca qui per vedere il video.
Discussione
Lo stress Shear è un fattore cruciale per l'adesione batterica presto alla parete del vaso e per la successiva generazione di endovascolare o vegetazioni endocardial e infezioni metastatiche 4,5. Abbiamo descritto complementari in vitro e in vivo per studiare la patogenesi delle infezioni endovascolari sotto sforzo di taglio fisiologico. Questi modelli hanno permesso di individuare von Willebrand factor-binding protein (vWbp) come la principale S. proteine aureus di interagire in corrente con una parete vascolare lesa esporre VWF 4.
Infezioni endovascolari e endocardite infettiva in particolare, sono fonte di preoccupazione non solo per insufficienza d'organo indotta dalla sepsi e la morte, ma anche a causa della ("metastatico") complicanze locali e distanti. Per causare endocardite infettiva e infezioni metastatiche, i batteri devono aderire alla parete del vaso e resistere alla sollecitazione di taglio del sangue che scorre così. Piùstudi sui batteri fattori di virulenza sono stati eseguiti in condizioni statiche. Tuttavia, queste interazioni stabiliti non potrebbero sopportare le forze di taglio e gli studi in condizioni di flusso può rivelare nuovi fattori precedentemente non riconosciute in gioco batteri-ospite.
Utilizzando la camera di flusso micro-parallelo, noi e altri hanno mostrato l'importanza di VWF per l'adesione vascolare. Sotto sforzo di taglio, VWF progressivamente dispiega dalla sua struttura globulare di riposo, ed espone il dominio A1 che interagisce con le piastrine attraverso il suo recettore GPIb 6. Camere di flusso sono stati ampiamente utilizzati per studiare la funzione piastrinica 7.
Sorprendentemente, anche S. aureus adesione sotto flusso richiede VWF, in particolare dominio A1 che è esposto sul taglio. Abbiamo identificato vWbp per mediare VWF vincolante. vWbp è un coagulasi che contribuisce ad S. aureus fisiopatologia attivando protrombina del padrone di casa. Staphylothrombin, la resulting complesso di un coagulasi batterica e protrombina, converte il fibrinogeno in fibrina insolubile 8,9. I nostri studi hanno dimostrato che vWbp non solo attiva protrombina, ma innesca la formazione di aggregati batteri fibrina-piastrine, che esaltano l'adesione di vasi sanguigni sotto flusso 4,10,11.
Il flusso modello di camera in vitro permette di studiare i diversi attori in adesione batterica di componenti cellulari e della matrice. Fattori di virulenza batterici possono essere studiati utilizzando mutanti o batteri innocui che esprimono proteine di superficie specifici. In alternativa, inibitori farmacologici o anticorpi bloccanti possono essere aggiunti al mezzo nella camera di flusso. Il ruolo dei fattori dell'ospite, come diversi elementi costitutivi del matrice extracellulare può essere studiato utilizzando coprioggetto con diversi rivestimenti. I vetrini possono essere coperti con le cellule endoteliali, di cui lo stato di attivazione può essere modulata con l'aggiunta di stimolatori specifici. Apart dalla parete vascolare, il contributo delle cellule del sangue dell'ospite e proteine del plasma può essere studiata aggiungendo questi fattori per mezzo fluente. Così, differenti condizioni di crescente complessità possono essere studiati in condizioni standardizzate di flusso laminare per svelare le interazioni che permettono ai batteri di aderire alla parete del vaso in vivo.
Interazioni individuate nel modello in vitro sono poi studiati in un modello animale per testare la loro rilevanza in un organismo complesso. Altri modelli in vivo per studiare interazioni dinamiche sotto flusso sono stati descritti, ad esempio la camera di criceto dorsale plica 12 e il modello cremastere 13. In confronto, il modello perfusione mesenterica qui descritto presenta diversi vantaggi per la sua facilità di utilizzo, la possibilità di variare ospitare background genetico dei topi e per valutare interventi farmacologici.
In conclusione, i modelli descrittioffrire la possibilità di studiare proteine di superficie, non solo di S. aureus, ma di molti altri microrganismi in diversi ambiti di accoglienza, per comprendere meglio la patogenesi delle infezioni vascolari.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal Fonds voor Wetenschappelijk Onderzoek (FWO) Vlaanderen G0466.10, 11I0113N; "Eddy Merckx Research Grant" e la "Sporta Research Grant" per Cardiologia Pediatrica, UZ Leuven, Belgio (JC); il Centro per Molecolare e Biologia Vascolare è supportato dal Programmafinanciering KU Leuven (PF / 10/014), dal "Geconcentreerde Onderzoeksacties" (GOA 2009/13) presso l'Università di Lovanio e un assegno di ricerca da Boehringer-Ingelheim.
Materiali
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
Riferimenti
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon