Method Article
فرز خلية العصبية الجذعية وخلايا السلف من الفأر Subventricular المنطقة الكبار وحية على التصوير من حيوية دورة الخلية الخاصة
* These authors contributed equally
In This Article
Summary
We report a Fluorescent Activated Cell Sorting (FACS)-based method to isolate neural stem cells (NSCs) and their progeny from the subventricular zone (SVZ) of the adult mouse brain. Applied to Fluorescence Ubiquitination Cell Cycle Indicator (FUCCI) transgenic mice, it allows the study of cell cycle progression by live imaging.
Abstract
الخلايا الجذعية العصبية (NSCs) في منطقة subventricular من البطينات الجانبية (SVZ) الحفاظ تكوين الخلايا العصبية الشمية في جميع مراحل الحياة في أدمغة الثدييات. هم على التوالي توليد خلايا العبور تضخيم (جان التقييم التقني) وneuroblasts أن تفرق في الخلايا العصبية بمجرد دمج بصيلات الشم. الناشئة فلوري خلية تنشيط الفرز سمحت (FACS) تقنيات عزل NSCs وكذلك ذريتها وبدأت لتسليط الضوء على شبكات تنظيم الجينات في محاريب العصبية الكبار. نفيدكم هنا تقنية خلية الفرز التي تسمح للمتابعة والتمييز بين ديناميات دورة الخلية من سكان الخلية المشار إليه أعلاه من SVZ الكبار مع ليكس / EGFR / CD24 تلطيخ الثلاثي. ومطلي ثم الخلايا المعزولة كما الخلايا الملتصقة لاستكشاف في تفاصيل تقدم دورة الخلية من خلال الوقت الفاصل بين الفيديو المجهري. تحقيقا لهذه الغاية، ونحن نستخدم المعدلة وراثيا الإسفار Ubiquitination المؤشر دورة الخلية (FUCCI) الفئران التي الخلايا الحمراء الفلورسنت الزيتوز G 1 المرحلة بسبب G 1 محدد مراسل الحمراء Cdt1. هذه الطريقة قد كشفت مؤخرا أن NSCs المتكاثرة يطيل تدريجيا من مرحلة G 1 أثناء الشيخوخة، مما يؤدي إلى ضعف تكوين الخلايا العصبية. هذا الأسلوب هو القابلة للنقل بسهولة إلى أنظمة أخرى، ويمكن أن تكون ذات فائدة كبيرة لدراسة ديناميات دورة الخلية خلايا الدماغ في سياق أمراض الدماغ.
Introduction
الخلايا الجذعية العصبية هادئة (NSCs) هي مصدر لتكوين الخلايا العصبية الكبار (1) ويمكن تحويلها الى التكاثري على "تنشيط" النموذج معربا عن EGFR (aNSCs) 2. تنشيط مرة واحدة، فإنها تؤدي إلى خلايا العبور تضخيم (جان التقييم التقني) 3 ثم neuroblasts التي تهاجر إلى بصيلات الشم (OB) عن طريق أنبوب من الخلايا النجمية وأخيرا تفرق في الخلايا العصبية 4،5. ويتم تنظيم NSCs وذريتها في "منافذ" المتخصصة أبنية على طول البطينين الوحشي، تورط عدد لا يحصى من العوامل المتحكمة انتشارها 6. عزل وتنقية الخلايا العصبية SVZ ضرورية لإلقاء الضوء على التنظيم الجزيئي المعقد من انتشارها ولكنها ظلت تحديا لفترة طويلة بسبب عدم وجود علامات محددة والتقنيات تكييفها.
مناهج جديدة باستخدام التدفق الخلوي قد جعلت من الممكن عزل NSCs وtheiص ذرية من الكبار SVZ 2،7-11. باستخدام علامة الخلية الجذعية ليكس 12 جنبا إلى جنب مع أرومة عصبية علامة CD24 13 وEGF مضان لتسمية EGFR في الخلايا المتكاثرة 2، وضعنا مؤخرا استراتيجية FACS السماح للتنقية من خمسة من الرئيسي السكان العصبية SVZ: هادئة والمفعلين NSCs، جان التقييم التقني، غير ناضج وكذلك المهاجرة neuroblasts 9. هنا، نحن تصف في تفاصيل هذه الخلية الفرز التقنية وكيف يمكن ليكس / EGFR / CD24 تلطيخ الثلاثي سمح لأول مرة عزل كل من NSCs هادئة وتفعيلها.
على الرغم من استمرار الخلايا العصبية خلال مرحلة البلوغ، وانخفض إنتاج خلايا عصبية جديدة بشكل جذري في المخ من الشيخوخة 14. معظم الدراسات تتفق على تخفيض تدريجي في عدد الخلايا المتكاثرة السلف في SGZ وSVZ 15-20. العواقب ليست بسيطة مثل انخفاض المرتبطة بالعمر في تكوين الخلايا العصبية في SVZ يثير تضاؤل نالخلايا العصبية ewborn في بصيلات الشم في الدماغ العمر، مما يؤدي في النهاية إلى ضعف في التمييز الشمي في الفئران الذين تتراوح أعمارهم بين 18. توضيح حركية دورة الخلية من الأسلاف العصبية هو خطوة أساسية لفهم الآليات الكامنة وراء تطور الخلايا العصبية الكبار أثناء الشيخوخة. وقد حقق الدراسات التي أجريت مؤخرا دورة الخلية ونسب تطور الخلايا الجذعية العصبية الكبار في المختبر 21 و في الجسم الحي 22 ولكن أيا منها استغل تقنيات الخلية الفرز والمشفرة وراثيا الفلورسنت تحقيقات الخلية دورة لتصور مراحل دورة الخلية من الخلايا المعزولة على مستوى خلية واحدة.
نحن هنا وصف البروتوكول الذي يستفيد من الفئران المعدلة وراثيا في FUCCI التي فلوري الخلايا خلال دورة الخلية، مما يتيح التمييز بين G 1 و 2 SG / M مراحل 23. ويظهر هذا البروتوكول العزلة كيف المحتملين من NSCs وذريتها من الكبار FUCCI ميلم جنبا إلى جنب مع المجهري الوقت الفاصل بين الفيديو يسمح دراسة ديناميات دورة الخلية على مستوى خلية واحدة.
Protocol
وقد تم تصميم هذا البروتوكول وفقا للمجتمعات الأوروبية توجيه المجلس 24 نوفمبر، تمت الموافقة على 1986 (86/609 / EEC) والتي لدينا لجنة المؤسسية الرفق بالحيوان (CETEA-CEA DSV جيش الدفاع الإسرائيلي).
1. الإعداد الأساسي قبل الثقافة وVideomicroscopy
- استخدام الزجاج لوحات ثقافة القاع أو ميكرون لوحات للمتحد البؤر المجهري الفيديو. 1 - 5 × 10 3 خلايا / جيد، واستخدام لوحات 96-جيدا و24 لوحات جيدة لأكثر من 5 × 10 3 خلايا / جيد.
- يوم واحد على الأقل قبل بدء التجربة، وإعداد العقيمة بولي-D-ليسين (PDL) لوحات المغلفة للثقافات أحادي الطبقة ملتصقة. إضافة ما يكفي PDL (10 ميكروغرام / مل في dH2O ما) إلى معطف أسفل كل بئر واحتضان O / N عند 37 درجة مئوية. إزالة حل PDL وشطف ثلاث مرات مع DH 2 O قبل السماح لوحة لتجف في غطاء محرك السيارة أثناء لا يقل عن 2 ساعة تحت تدفق الصفحي. إذا لم يتم استخدامها فورا، وتخزينها لوحة المغلفة في-20 ° C.
- إعداد مستنبت عن طريق خلط NSC بصل متوسطة والملحق NSC انتشار في 9: 1 نسبة (انظر الجدول المواد) جنبا إلى جنب مع 2 ميكروغرام / الهيبارين مل، 20 نانوغرام / مل النقى عامل نمو البشرة المؤتلف الإنسان (EGF)، و 10 نانوغرام / مل العامل البشري نمو الخلايا الليفية المؤتلف 2 (FGF-2). الاحماء مستنبت إلى 37 درجة مئوية في حمام الماء قبل الاستخدام.
- لتفارق SVZ، وإعداد الحل غراء: 1 ملغ / مل غراء (15 UI / مل) في ميزان محلول الملح ايرل (EBSS) تحتوي على 0.2 ملغ / مل L-السيستين، 0.2 ملغ / مل EDTA، و 0.01 ملغ / مل الدناز I في برنامج تلفزيوني. تعقيم الحل عن طريق تمرير من خلال 0.2 ميكرون التصفية. تتوازن الحل عند 37 درجة مئوية قبل الاستخدام.
- لوقف التفاعل الأنزيمي، يعد حل مثبط البروتياز (مخاطاني البيض): DMEM: F12 المتوسط تحتوي على 0.7 ملغ / مل التربسين نوع المانع II. تصفية الحل باستخدام فلتر 0.2 ميكرون.
- إعداد برنامج تلفزيوني 0.6٪ محلول الجلوكوز لجمع العقول وPBS 0.15٪ BSA الصورةolution لغسل الخطوات وللتلوين الأجسام المضادة.
- إعداد أدوات تشريح: مقص، ملقط تشريح وربط، مشرط. نقع عليها في 70٪ من الإيثانول.
2. حصاد الكبار ماوس العقول وSVZ Microdissections
- التضحية الكبار FUCCI الفئران 23 (القديم-3-شهر 2 و / أو عمره 12 شهرا لدراسات الشيخوخة) إجراء خلع عنق الرحم وفقا للمبادئ التوجيهية المؤسسية المناسبة.
- رش الماوس باستخدام الايثانول 70٪ وقطع رأسه قبالة باستخدام مقص حاد.
- إجراء شق على طول فروة الرأس للكشف عن الجمجمة.
- إجراء قطع خط الوسط الطولي بدءا من قاعدة الجمجمة نحو بصيلات الشم باستخدام زوج من مقص صغير. تأكد لتجنب إتلاف الدماغ الكامنة مع شفرات مقص. إزالة الجزء العلوي مفتوح من الجمجمة مع ملقط المنحنية لفضح الدماغ.
- جمع الدماغ في طبق بتري 15 ملم تحتوي على 0.6٪ الجلوكوز في برنامج تلفزيوني.
- دissect بعيدا بصيلات الشم. وضع الدماغ على السطح الظهري، وجعل قسم الاكليلية من خلال chiasm البصرية باستخدام مشرط.
- تحت المجهر تشريح، ضع الجزء المنقاري لقسم المخ مع السطح الإكليلي قص تواجه صعودا نحو المجرب.
- لتشريح SVZ، وإزالة الحاجز مع ملقط المنحنية الجميلة ثم إدراج طرف واحد من ملقط غرامة في المخطط المجاور على الفور إلى البطين وفصل SVZ من الأنسجة المحيطة بها. للحصول على تفاصيل إضافية، راجع اظهري وآخرون. 24. وضع SVZ تشريح في طبق بتري تحتوي على 1 مل من PBS 0.6٪ الجلوكوز.
3. SVZ الأنسجة التفكك
- فرم SVZ تشريح في طبق بتري حتى لا تظل القطع الكبيرة.
- نقل الأنسجة المفروم مع٪ الجلوكوز PBS 0.6 لأنبوب 15 مل وأجهزة الطرد المركزي في 200 x ج لمدة 5 دقائق.
- تجاهل طاف وإضافة 1 مل من قبل تحسنت غراء (1ملغ / مل، أعدت في الخطوة 1.4) تستكمل مع 0.01 ملغ / مل الدناز أولا احتضان لمدة 10 دقيقة في حمام مائي عند 37 ° C. استخدام 1 مل من غراء في الماوس.
- أجهزة الطرد المركزي في 200 x ج لمدة 5 دقائق وتجاهل طاف.
- إضافة 1 مل من قبل تحسنت مخاطاني البيض (0.7 ملغ / مل، أعدت في الخطوة 1.5) لوقف النشاط غراء. ميكانيكيا فصل الأنسجة المفروم إلى مزيد من تعليق خلية واحدة بواسطة pipetting بلطف صعودا وهبوطا من 20 مرات خلال قمة P1000 micropipette. تجنب فقاعات الهواء.
- تمرير تعليق الخلية من خلال معقم مرشح 20 ميكرون في أنبوب جديد 15 مل. تأكد لغسل تصفية خلية مع PBS 0.15٪ BSA لتجنب فقدان الخلايا.
- أجهزة الطرد المركزي في 200 x ج لمدة 10 دقيقة، وتجاهل طاف. إعادة تعليق الخلايا في 100 ميكرولتر من برنامج تلفزيوني يحتوي على 0.15٪ BSA.
4. مناعي تلطيخ الفرز الخلية
لخلية الفرز باستخدام FUCCI-أحمر الفئران (الشكل 2A)، استخدم ما يليالأجسام المضادة: CD24 فيكوإيريترين-cyanine7 المترافقة [PC7]. CD15 / ليكس ثيوسيانات فلوريسئين [FITC] مترافق وAx647 EGF مترافق يجند.
ملاحظة: ليكس + + EGFR الخلايا وEGFR + الخلايا ليست وفيرة في SVZ الكبار: ≈ 600 و 1500 خلية / الماوس على التوالي 9. ونحن نوصي تجميع الخلايا SVZ 2-3 الفئران لديك ما يكفي من المواد. لا تعمل مع أكثر من 12 الفئران في نفس اليوم حتى أن الخلية الفرز مدة لا تتجاوز 3 ساعات. نضع في اعتبارنا أن العمل مع عدد كبير جدا من الفئران في نفس اليوم سيؤدي إلى خلية الفرز زيادة مدة ربما يؤدي إلى زيادة موت الخلايا و / أو تمايز الخلايا.
- أداء تلطيخ FACS في 100 ميكرولتر من برنامج تلفزيوني 0.15٪ BSA في الماوس (أو في 200 ميكرولتر لمجموعة من 2-3 الفئران لتلطيخ الأمثل).
- إعداد أنابيب السيطرة. استخدام الخرز تعويض لإعداد أنابيب تحكم لون واحد وفقا لالصانع9؛ ق البروتوكول. حدد جزء من الخلايا (1/10 الخلايا المستخرجة من الماوس واحدة تكفي) وفصل في 4 أنابيب لإعداد 1 سلبي أنبوب التحكم (خلايا غير مميزة) و 3 مضان ناقص واحد (FMO) أنابيب السيطرة. resuspend الخلايا في 200 ميكرولتر من برنامج تلفزيوني 0.15٪ BSA في أنبوب.
تلميح: من أجل السيطرة ليكس-FITC FMO، تسمية الخلايا مع CD24-PC7 (01:50) وAx647 مترافق EGF يجند (1: 200)؛ للسيطرة على CD24-PC7 FMO، تسمية الخلايا مع CD15 / ليكس-FITC (01:50) وAx647 مترافق EGF يجند (1: 200) وAx647 مترافق تحكم FMO EGF يجند، تسمية الخلايا مع CD15 / LeX- FITC (01:50) وCD24-PC7 (01:50). - لأنابيب تستخدم لفرز الخلايا، استخدام الأجسام المضادة التالية في التخفيف المشار إليه في برنامج تلفزيوني 0.15٪ BSA: CD24-PC7 (01:50)، CD15 / ليكس-FITC (01:50) وAx647 مترافق يجند EGF (1: 200).
- احتضان لمدة 20 دقيقة على 4 درجات مئوية في الظلام. تغسل مع 1 مل PBS 0.15٪ BSA والطرد المركزي في 200 x ج لمدة 10 دقيقة. resuspend الخلايا في 20081؛ ل من برنامج تلفزيوني 0.15٪ BSA في الدماغ. الحفاظ على الخلية أنابيب الفرز على الجليد والشروع فورا في فرز الخلايا.
- في حالة استخدام الفئران FUCCI والخضر، والكسور ليكس الإيجابية والسلبية ليكس-منفصلة باستخدام أعمدة الفصل قبل الخلية الفرز كما أسهم الأجسام المضادة ليكس-FITC نفس الطول الموجي الانبعاثات من مضان FUCCI الخضراء (الشكل 3A، B).
- أولا، تسمية الخلايا مع الماوس مكافحة الإنسان ليكس الأجسام المضادة (01:50) لمدة 15 دقيقة في 4 درجات مئوية في الظلام في 100 ميكرولتر من برنامج تلفزيوني 0.15٪ BSA.
- غسل الخلايا مع 1 مل PBS 0.15٪ BSA والطرد المركزي في 200 x ج لمدة 10 دقيقة، ثم تسمية الخلايا مع بلي الغلوبولين المناعي الفأر المضادة (01:10) لمدة 15 دقيقة في 4 درجات مئوية في الظلام.
- غسل الخلايا مع 1 مل PBS 0.15٪ BSA والطرد المركزي في 200 x ج لمدة 10 دقيقة. resuspend الخلايا في 500 ميكرولتر PBS 0.15٪ BSA وتصب الخلايا من خلال عمود الفصل في المجال المغناطيسي كما schematized في الشكل 3 C. غسل العمود مع 1 مل PBS 0.15٪ BSA للحصول على ليكس جزء سلبي.
- للحصول على جزء ليكس إيجابية، إزالة العمود الانفصال عن المجال المغناطيسي وأزل الخلايا مع 2 مل PBS 0.15٪ BSA.
- انتقل إلى CD24-PC7 وAx647 مترافق EGF يجند تلطيخ كما هو مبين في 4.2.
5. خلية الفرز
تم فرز الخلايا على فارز FACS في 40 بسي مع 86 ميكرون noozle: مذكرة. وقد تم جمع مضان باستخدام مجموعة التصفية التالية: 520 / 35nm (FITC)، 575 / 26nm (PE)، 670 / 20NM (Ax647) و740LP (PC7). التعويض هو ضروري لمنع إشارات إيجابية كاذبة كما تم العثور على التداخل بين أطياف انبعاث مضان FUCCI الحمراء وصبغ PC7.
- مباشرة قبل الخلية الفرز، إضافة صبغة الحيوي للتمييز على الهواء مباشرة من الخلايا الميتة. كنا HO (انظر الجدول المواد) في 2 ميكروغرام / مل تركيز النهائي. تشغيل أنبوب سيطرة سلبية (خلايا تحمل علامات) من خلال فارز FACS وحدد عشرخلايا البريد باستخدام الجانب مبعثر (SSC) ومبعثر إلى الأمام (FSC) معلمات (الشكل 1A).
ملاحظة: تم استبعاد الخلايا الميتة التي كتبها النابضة سوى جزء HO-سلبي (الشكل 1A ') ومن ثم تم استبعاد الحلل عن طريق اختيار نبض عرض جزء سلبي (الشكل 1A' '). - تشغيل الضوابط لون واحد أعدت في الخطوة 4.2 و ضبط أنبوب مضخم (PMT) الفولتية إذا لزم الأمر (أي الخلايا السكان سلبي عالية جدا و / أو إيجابية خارج نطاق). أداء تعويض اللون في إطار التعويض من البرنامج.
- تشغيل FMO يسيطر على استعداد في الخطوة 4.2 (ليكس-FITC تحكم FMO، CD24-PC7 تحكم FMO وAx647 مترافق تحكم FMO EGF يجند) ورسم بوابات الفرز (الشكل 1). نوع الخلايا مباشرة في 100 ميكرولتر من مستنبت في 1.5 مل microtubes.
6. إعداد الخلايا للفحص المجهري
- لوحة الخلية فرز طازجةالصورة في كثافة 1-3 × 10 3 خلية / جيدا على بولي-D-Lysine- المغلفة 96-جيدا μ-اللوحة مع 300 ميكرولتر من مستنبت.
- قبل المجهر الفيديو، واحتضان لوحات الثقافة عند 37 درجة مئوية و 5٪ CO 2 على الأقل لمدة 1 ساعة للسماح للالتصاق الخلية.
7. إعداد مجهر والحصول على صورة
- أداء التصوير الحي باستخدام الهدف خطة آبو VC 20x وDIC (NA: 0.75) على نظام مجهر المسح بالليزر متحد البؤر تعلق على غرفة thermostated مقلوب عند 37 درجة مئوية تحت 5٪ من CO 2 الغلاف الجوي.
- وضع 96-جيدا μ-لوحة داخل غرفة ما قبل تحسنت ومعايرتها thermostated واستبدال الغطاء بغطاء thermostated.
- فتح البرنامج شيكل، عناصر وانقر في شريط القوائم في "اكتساب / شراء تسيطر / شراء ND" لتحديد خيارات للالفاصل الزمني (طول والمواقف المرحلة، مبائر ض أقسام، ...)، "اكتساب التحكم / شراء / الوسادة تي221؛ لتحديد الأهداف و"اكتساب / ضوابط اقتناء / A1plus الإعدادات" لتحديد مستوى PMT لكل مضان في شريط القوائم اختر مجلد لحفظ ملفات البيانات.
- باستخدام نافذة اكتساب ND، تعيين وسط كل جانب وضع المسرح وحدد الخيار صورة كبيرة ل7 × 7 ملم مربع. وهذا خلق صورة الفسيفساء حول مركز كل بئر. تعيين تداخل للصورة فسيفسائية كبيرة إلى 5٪. التقاط صور كل 20 دقيقة لمدة 24 ساعة. حدد هدف خطة آبو VC 20x وDIC (NA: 0.75) في إطار تي الوسادة.
- في إطار A1plus إعدادات، والحصول على الصور باستخدام الماسح الضوئي بسرعة عالية مدوية في شكل 512 X 512 بكسل مع قرار من 1.26 ميكرون / بكسل. استخدام brightfield لتصور الأشكال الخلية. في حالة الفئران FUCCI الأحمر، تثير مضان أحمر في 561 نانومتر، وجمع باستخدام 595/50 نانومتر التصفية. في حالة الفئران FUCCI والخضر، تثير مضان أخضر في 488 نانومتر، وجمع باستخدام 530/40 نانومتر التصفية. تحديد PM الأمثلمستوى T، ويقابل وقوة الليزر لكل طول موجي.
ملاحظة: نوصي باستخدام وظيفة ضبط تلقائي للصورة للقناة brightfield للسماح للبرامج لضبط تلقائي للصورة في كل موقف المرحلة قبل كل اكتساب. وقد استخدم لقرار الممتاز دون الحاجة للنفط تلميح: ثمة هدف خطة آبو VC 20x وDIC (0.75 NA). ويمكن استخدام الأهداف الأخرى تبعا لقرار الضوئية المرجوة. - حدد زر "تشغيل الآن" على نافذة اكتساب ND أن تبدأ الاستحواذ.
تلميح: متابعة أعمال الكمبيوتر ل1 حلقة للتأكد من أن كل شيء في العمل بشكل صحيح.
8. معالجة الصور وتحليل
- تحليل البيانات مباشرة على البرنامج شيكل، عناصر من خلال تتبع الخلايا بشكل فردي. تلميح: لكسب الوقت، وتوفير كل موقف في شكل افي باستخدام برنامج شيكل، عناصر وتحليل الأفلام مع يماغيج.
- في برنامج يماغيج، تتبع الخلايا الفردية تمر على الأقل 2 الانقسامات (أي خلية واحدة لمستعمرة أربعة الخلية). اقتصاص منطقة صغيرة حول الخلية واختر "صورة / مكرر.
- اختر "صورة / الأكوام / جعل المونتاج" في شريط القائمة لإجراء المونتاج. تحديد الأطر التي ينبغي إدراجها، وحجم الصور وحفظ المونتاج كملف. TIF للقرار الأمثل.
- لحساب SG الأولى 2 / M المرحلة طول (الشكل 2C، D)، حدد خلية الحمراء الفلورسنت واحدة (في G 1) ثم مجموعة تي = 0 (المرحلة S ستبدأ بمجرد أن مضان أحمر ينطفىء). حساب عدد من الإطارات حتى تقسم الخلية إلى تقدير طول SG 2 / M.
ملاحظة: الوقت المحتسب يعتمد على الفاصل الزمني بين كل إطار. - لحساب المرحلة G1 التالية (الشكل 2C، D)، مواصلة تتبع الخلية التي قسمت فقط. إذا تدخل الخلية تنقسم المرحلة G1، سيكون هناك تراكم cdt1 بروتين أحمر فلوري. حساب عدد الإطارات حتى مفاتيح الحمراء مضان قبالة الآغافي كل خلية.
تلميح: في بداية G 1 مضان أحمر قد تكون ضعيفة حتى تختار بداية مرحلة G 1 على الإطار حيث تنقسم الخلية لتجنب تقريبية.
النتائج
القدرة على التمييز بشكل موثوق بين السكان خلية مختلفة من الفأرة الكبار الخلايا الجذعية SVZ النسب هي البدائية للتحقيق في الخصائص الوظيفية. لهذا الغرض، وقد وضعنا / EGFR / CD24 استراتيجية ثلاثية وضع العلامات ليكس السماح للتنقية من فئات معينة من السكان خلية من SVZ الكبار: NSCs هادئة (ليكس مشرق)، NSCs المنشط (ليكس + EGFR +)، جان التقييم التقني (EGFR +) ، neuroblasts غير ناضجة والهجرة (CD24 + EGFR + CD24 + و، على التوالي) 9 (الشكل 1). تطبق على FUCCI الفئران المعدلة وراثيا، الخلية الفرز تقنية تسمح للتصوير حي من مراحل دورة الخلية من السكان العصبية المختلفة على مستوى وحيدة الخلية 25. استخدمت الفئران FUCCI الأحمر لمتابعة المرحلة G 1 مع مضان أحمر باستخدام الوقت الفاصل بين الفيديو المجهري (الشكل 2A). خلايا NEG FUCCI الأحمر تمثل الخلايا في S-G 2 / M مراحل دورة الخلية، وخلايا نقاط البيع FUCCI الحمراء هي G 1 الخلايا والخلايا مشرق FUCCI الحمراء وخلايا الخروج أو الخروج من دورة الخلية (الشكل 2B) 23،26. كانت مطلية يكس + EGFR + وEGFR + الخلايا من الشباب البالغين (الشكل 2C) والفئران في منتصف العمر (الشكل 2D) كما الخلايا الملتصقة على لوحات ثقافة المغلفة بولي-D-يسين. تم التعرف على المرحلة الأولى SG 2 / M على الخلايا واحد مرة واحدة في مضان أحمر ينطفىء حتى تنقسم فيها الخلية. كما لوحظ سابقا SG أظهر 2 / M طول المرحلة لا فرق بين ليكس + EGFR + وEGFR + الخلايا، سواء في الفئران الشباب أو في منتصف العمر. ثم حسبنا المقبل طول المرحلة G 1 من دوري الدرجة الاولى حتى تبديل مضان الأحمر قبالة. ومن المثير للاهتمام، تم العثور على مرحلة إطالة G 1 خلال الشيخوخة في ليكس + EGFR + خلايا ولكن ليسفي EGFR + خلايا 25 (الشكل 2C، D). ونتيجة لذلك، حصل neurospheres 5 أيام بعد الطلاء هي أصغر في خلايا ليكس + EGFR + تم الحصول عليها من الفئران الذين تتراوح أعمارهم بين كما هو مبين في الشكل 2E.
ويمكن أيضا FUCCI والخضر الفئران أن تستخدم لتصور SG 2 / M المرحلة مع مخضر (الشكل 3A، B) ولكن الخلايا يجب أن يكون قبل فرز باستخدام أعمدة الفصل كما يكس-FITC الضد المشتركة نفس الطول الموجي الانبعاثات من FUCCI- مخضر (الشكل 3C). يظهر مثال مضان FUCCI الخضراء لSG الأولى 2 / M مرحلة الشباب البالغين ليكس + EGFR + والخلايا EGFR + في الشكل 3D.
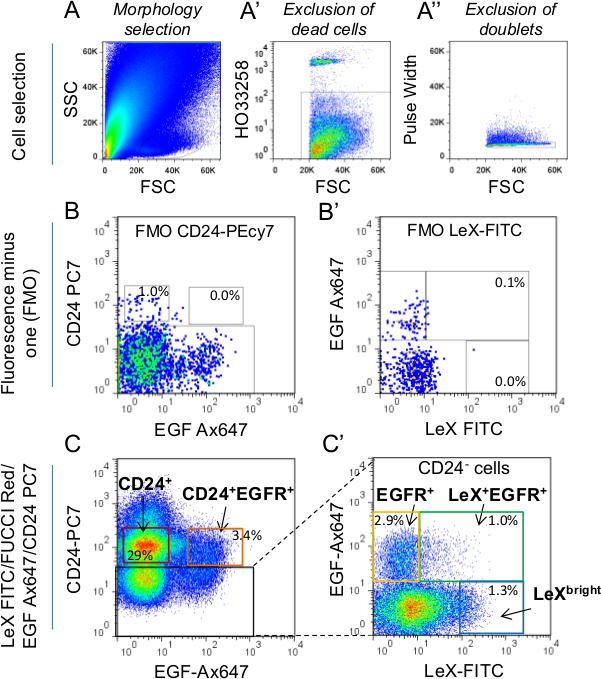
الشكل 1: استراتيجية اختيار الخلية FACS تم اختيار (A) خلايا لأول مرة وفقا لرمورفولوجيا وريث باستخدام مبعثر الجانبية (SSC) مقابل مبعثر إلى الأمام (FSC) معلمات. لمزيد من التفاصيل على التشكل اختيار البوابة، تشير إلى Daynac وآخرون. "وصفت الخلايا الميتة باستخدام HO علامة ويستثنى من التحديد. (A 9 (A) '') تم استبعاد الحلل باستخدام المعلمة عرض النبض. من أجل إعداد الفرز البوابات، الإسفار ناقص واحد (FMO) تسيطر على CD24-PC7 (ليكس-FITC / FUCCI الأحمر / EGF-Ax647 وضع العلامات؛ B) ويكس-FITC (FUCCI الأحمر / EGF-Ax647 / CD24 "كانت تستخدم) (C، C". B) بعد ذلك، تم تحديد بوابات الفرز في يكس-FITC / FUCCI الأحمر / EGF-Ax647 / CD24-PC7 أنابيب وصفت جنبا إلى جنب مع وجود ضوابط FMO، وضع العلامات -PC7. وتمثل النسب المئوية يعني من مجموع الخلايا داخل البوابات. إذا اختيار CD24 + الخلايا (neuroblasts)، وتوخي الحذر لاستبعاد CD24 الخلايا معربا عن مشرقة من البوابة. في الواقع، CD24 تتوافق مشرق لم بطانية عصبيةLLS 2،9. C 'يمثل CD24 الخلايا السلبية (مربع أسود في C). فقط ليكس + EGFR + وEGFR + (C ') استخدمت بوابات الفرز لهذه الدراسة.
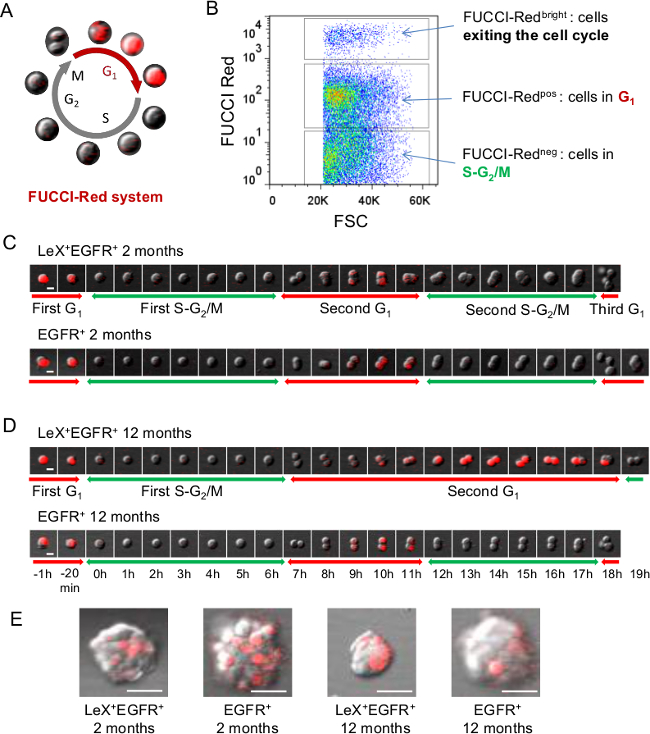
الشكل 2: التحليلات حية من دورة الخلية باستخدام الفئران FUCCI الحمراء (A) تمثيل تخطيطي للدورة الخلية FUCCI الحمراء حيث الخلايا الحمراء الفلورسنت خلال المرحلة G1 وعديم اللون خلال SG 2 / M مراحل 23 تمثيل (B) FACS من. مضان FUCCI-الأحمر على الخلايا SVZ. (C، D) المجهر الفيديو مع ليكس + EGFR + وEGFR + الخلايا مرتبة من الشباب (C) ومتوسطي العمر (D) الفئران FUCCI-أحمر يسمح تتبع للمرحلة G 1 مع مضان أحمر في حين أن SG يمكن استخلاصه 2 / M مراحل عرجن مضان أحمر ينطفىء. وتظهر الصور المتعاقبة مع مقياس الوقت المعروضة في D. (E) صور الممثل المستعمرات (neurospheres) التي تم الحصول عليها 5 أيام بعد الطلاء. شريط النطاق: 10 ميكرون (C، D)، 30μm (E) الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
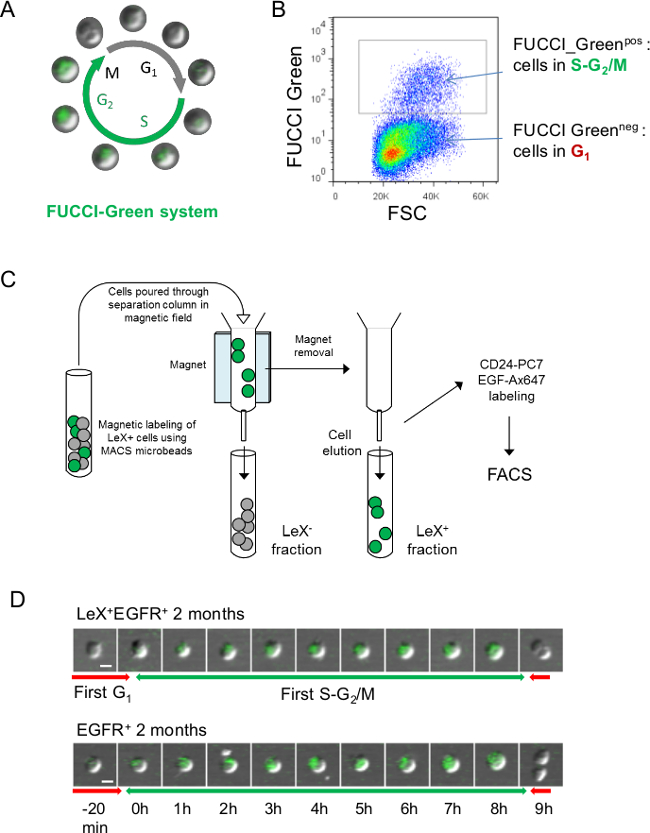
الرقم 3:. استراتيجية التحليلات الحية من دورة الخلية باستخدام الفئران FUCCI والخضر (A) تمثيل تخطيطي للدورة الخلية FUCCI والخضر حيث الخلايا الخضراء خلال SG 2 / M المرحلة وعديم اللون خلال G 1 المرحلة 23 (B) تمثيل FACS مضان FUCCI-الأخضر: خلايا NEG FUCCI والخضر تمثل الخلايا في G 1 مرحلة من مراحل دورة الخلية في حين FUCCI-GREEن خلايا نقاط البيع هي خلايا في SG 2 / M 23. (C) من أجل متابعة SG الخضراء الفلورسنت 2 / M مراحل ليكس + EGFR + والخلايا EGFR +، لديها خلايا SVZ أن يكون قبل فرزها مع الأعمدة الانفصال. وصفت الخلايا مع وأبقي لمكافحة فأر ليكس الأجسام المضادة ويكس + جزء على العمود باستخدام بلي مكافحة فأر (انظر بروتوكول 4.). ثم، ليكس + ويكس - ومزال كسور وصفت مع EGF-Ax647 والأجسام المضادة CD24-PC7 لFACS الفرز (D) المجهر فيديو ليكس + EGFR + وEGFR + الخلايا مرتبة من الشباب الفئران FUCCI والخضر يسمح للتتبع. وSG 2 / M مراحل مع مخضر. وتظهر الصور المتعاقبة مع مقياس الوقت المعروضة في D. شريط النطاق: 10 ميكرومتر (D).
Discussion
تقنية الفرز الخلية المذكورة هنا تسمح التمييز موثوقة بين NSCs هادئة، NSCs تنشيط والدراسات ذرية تمكن من ممتلكاتهم وديناميكية في الدماغ البالغ 9. إلى جانب التكنولوجيا FUCCI الذي يسمح التصور من تقدم دورة الخلية في الخلايا الحية 23، قمنا بتطوير تقنية سريعة وفعالة لمتابعة مراحل G 1 و 2 SG / M من دورة الخلية من الشباب البالغين وخلايا مخ الفأر المسنين.
كانت تقنية خلية الفرز المستخدمة في هذا البروتوكول مزيج التحقق من صحتها الأول من علامات السماح للتنقية من السكان العصبية الرئيسي خمسة من SVZ 9. وكانت أيضا تقنية التحقق من صحة الأولى تمكن من تمييز من NSCs هادئة وتفعيلها. ومن الجدير بالذكر أن هذه التقنية لا تتطلب استخدام الفئران المعدلة وراثيا في حد ذاته، وهو أمر ضروري عندما تتكيف مع نماذج الماوس المعدلة وراثيا سوالفصل كما FUCCI. ومنذ ذلك الحين، استخدمت Codega وآخرون. 10 لGFAP-GFP / CD133 / EGFR مزيج العلامات الثلاثي للتمييز NSCs هادئة من نظيرتها تنشيط ولكن لا يمكن أن تتكيف مع التكنولوجيا FUCCI لأنه يتطلب استخدام GFAP-GFP الفئران المعدلة وراثيا. وضعت ولاية ميشيغان وآخرون. 11 ل/ EGFR / CD24 استراتيجية العلامات ثلاثية Glast أن يشارك النتائج المشتركة مع التقنية المستخدمة في هذه الدراسة 9. في الواقع، لوحظ وجود ارتباط وثيق بين ليكس وعلامات Glast NSCs بالفعل في Daynac آخرون دراسة 9. ومع ذلك، ويقترن الأجسام المضادة Glast المستخدمة في تقنية ولاية ميشيغان وآخرون إلى فيكوإيريترين، وبالتالي لا يمكن أن تتكيف مع استخدام الفئران FUCCI الأحمر.
هناك العديد من النقاط الفنية المهمة التي تتطلب اهتماما قبل فرز الخلايا SVZ. أولا، فإن الخطوة التفكك هي مهمة جدا لأنسجة المخ لابد من فصل إلى الخلايا وحيدة مع الحفاظ على الهيكلية فيtegrity من البروتينات المستخدمة في استراتيجية وضع العلامات الأجسام المضادة. وقد تبين 0.05٪ التربسين-EDTA أن تكون فعالة جدا في النأي SVZ الأنسجة 27 ولكن تم العثور على مستضد ليكس أن تكون حساسة للغاية وتقريبا كل ليكس-FITC المناعي الضائع (لا تظهر البيانات). وهكذا، تم استخدام غراء كما كان أكثر كفاءة وأقل تدميرا من البروتياز الأخرى على أنسجة المخ. وعلاوة على ذلك، تأثرت لا يكس ولا EGFR ولا CD24 عن طريق العلاج غراء. وتجدر الإشارة إلى أن وضع العلامات الضد تم تغيير إذا تجاوزت علاج غراء 15 دقيقة. حصلنا على أفضل النتائج مع العلاج غراء 10 دقيقة المرتبطة تفارق الميكانيكية (ماصة صعودا وهبوطا 20 مرات).
طلاء بولي-D-ليسين يسمح ثقافة الخلايا الملتصقة وتشكيل المستعمرات بعد عدة أيام في الثقافة. ومن المسلم به الآن على نطاق واسع أنه في فحوصات المختبر يأتي مع محدوديتها 28،29. ونحن نوصي تحديد فقط دورة الخلية الأولى لوالخلايا التي تمر تقسيم لاحقة واحدة على الأقل للبقاء في أقرب وقت ممكن لفي الجسم الحي خلية النمط الظاهري.
ومن الجدير بالذكر الإشارة إلى أن Geminin (مخضر) وCdt1 (مضان أحمر) البروتينات المستخدمة لتصميم نظام FUCCI 23 عرضت في وقت سابق أن أعرب بوفرة من قبل الأسلاف العصبية خلال الخلايا العصبية في وقت مبكر من الفئران 30 و في الدماغ الكبار الأنسجة 9،25 . على الرغم من أن mKO2-hCdt1 (30/120) بناء وتستخدم أساسا في هذه الدراسة لمتابعة المرحلة G1 مع مضان أحمر، واستخدام كل من يبني [mKO2-hCdt1 (30/120) وMAG-hGem (1/110) ] يمكن تصوره للسماح التصور للمراحل رئيسية من دورة الخلية (G 1 و 2 SG / M) وكذلك G 1 / S انتقال 23. العيب الرئيسي للتصوير ثنائي اللون هو مجموعات متوافقة محدودة من مضان التي ما زالت قائمة يمكن استخدامها لوضع العلامات الخلية. حل واحد هو استخدام separatiعلى أعمدة. على سبيل المثال، قمنا المنضب بنجاح الكسر-CD24 إيجابي من الخلايا باستخدام أعمدة الفصل قبل الخلية الفرز والعيش التصوير كما كنا الأجسام المضادة CD24-PE التي تتقاسم نفس الطول الموجي الانبعاثات من مضان FUCCI-أحمر 25.
وقد حقق عدد قليل من الدراسات طول دورة الخلية من سكان الماوس SVZ الكبار. إجمالي طول دورة الخلية التي تم الحصول عليها مع أسلوبنا على مقربة من أحد يقدر في المختبر عن طريق كوستا وآخرون 21، ولكن تمكنا للمرة الأولى على التمييز بين مختلف مراحل دورة الخلية. في الدراسة المجراة، بونتي وآخرون. 22 استخدام إدماج النظير ثيميدين لتحديد ديناميكية انتشار مختلف السكان الخلية SVZ. ومع ذلك، فإنها يمكن أن لا إجراء المراقبة المستمرة للدورة الخلية ولا تتبع الخلايا على مستوى خلية واحدة. وهذا يمكن أن يكون مشكلة كما تبين أن عدم التجانس قوي موجود الطرافةهين السكان الخلية SVZ نظرا 22،25. وصفنا هنا بديل في تقنية المختبر، من السهل اقامة، التي تسمح للتصوير حي من مراحل دورة الخلية من البالغين مختلف السكان العصبية على مستوى خلية واحدة.
فهم تنظيم دورة الخلية من الخلايا الجذعية العصبية والأسلاف لا يزال يشكل تحديا لتطوير أساليب علاجية جديدة في سياق شيخوخة الدماغ أو أمراض. وبالتالي يمكن أن بروتوكول لدينا مجموعة واسعة من التطبيقات. في سياق الشيخوخة، ويمكن لهذه التقنية أيضا أن تكون مفيدة لفهم آثار الشيخوخة على NSCs التمايز. في الواقع، فمن الممكن لتحديد الخلايا الجذعية / السلف العصبية دخول المفاضلة كما كثافة الفلورسنت الحمراء لديهم أعلى متميز 26. وأخيرا، فإنه يمكن أيضا أن تكون ذات فائدة لاستغلال التصوير الحي المستمر على مستوى خلية واحدة لدراسة الخلية العمليات الجوهرية وخارجي المسؤولة عن المؤيد النسبزيحان خلفي من NSCs الكبار.
Disclosures
The authors declare that they have no conflict of interest.
Acknowledgements
ونحن مدينون لC جوبير، V نوفيل، V Barroca، J Tilliet وجميع موظفي مرافق الحيوان؛ لJ Baijer وN Dechamps لخلية الفرز. O. اتيان للحصول على المساعدة الفنية، وA. Gouret للحصول على المساعدة الإدارية لها. التدفق الخلوي والفرز خلية نفذت في iRCM التدفق الخلوي الموارد المشتركة، التي أنشئت من المنح المقدمة المعدات من DIM-الجذعية القطب، INSERM، مؤسسة ARC، وCEA. وأيد هذا العمل من المنح المقدمة من كهرباء فرنسا (EDF). MD ديه زمالة من La الدوري الفرنسي مناهضة للسرطان وLM من منطقة إيل-دو-فرانس (DIM Biothérapies). مارك أندريه Mouthon وفرانسوا D. Boussin حصة المشارك كبار التأليف.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well uncoated glass bottom culture plates | MatTek Corp. | P96G-1.5-5-F | |
| µ-Plates 96-well | Ibidi | 89626 | |
| Poly-D-Lysine | Millipore | A003E | |
| NeuroCult NSC Basal Medium | STEMCELL Technologies | 5700 | |
| NeuroCult NSC Proliferation Supplement | STEMCELL Technologies | 5701 | |
| Heparin | STEMCELL Technologies | 7980 | |
| EGF | Millipore | GF144 | |
| FGF-2 | Millipore | GF003 | |
| Papain | Worthington | LS003119 | |
| EBSS | Invitrogen | 24010-043 | |
| L-cysteine | Sigma | C-7352 | |
| 0.5M EDTA, pH 8.0 | Promega | V4231 | |
| DNase I | Sigma | D5025-15KU | |
| Trypsin inhibitor type II | Sigma | T9128 | Ovomucoid |
| DMEM:F12 medium | Life Technologies | 31330-038 | |
| 20 µm filter | BD Medimachine Filcon | 340622 | |
| Eppendorf microtubes 3810X | Sigma | Z606340-1000EA | |
| BSA | Sigma | A1595 | Bovine serum albumin solution |
| CD24 phycoerythrin-cyanine7 conjugate [PC7] | Life Technologies | A14776 | Mouse IgM; clone MMA. 1:50 |
| CD15/LeX fluorescein isothiocyanate [FITC] - conjugated | BD Biosciences | 332778 | Rat IgG2b; clone M1/69. 1:50 |
| Mouse anti-human LeX antibody | BD Pharmingen | 559045 | Mouse IgM; clone MAM. 1:50 |
| Alexa647 - conjugated EGF ligand | Life Technologies | E35351 | 1:200; Ax647-conjugated EGF ligand in the text |
| CompBeads | BD Biosciences | 644204 | |
| MACS LS separation columns | Miltenyi Biotec | 130-042-401 | separation columns (in the manuscript) |
| Anti-mouse IgM microbeads | Miltenyi Biotec | 130-047-301 | |
| Hoechst 33258 | Sigma | 861405 | HO (in the manuscript) |
| INFLUX cell sorter | BD Biosciences | FACS sorter (in the text) | |
| Nikon A1R confocal laser scanning microscope system attached to an inverted ECLIPSE Ti | Nikon Corp. | confocal laser scanning microscope (in the manuscript) | |
| NIS-Elements AR.4.13.01 64-bit software | Nikon Corp. | NIS-Elements software (in the manuscript) | |
| Plan Apo VC 20x DIC objective (NA: 0.75) | Nikon Corp. | ||
| ECLIPSE Ti thermostated chamber | Nikon Corp. | thermostated chamber (in the manuscript) | |
| ImageJ | RBS | ||
| FlowJo | Tree Star, Ashland, OR | ||
| FUCCI mice | RIKEN BioResource Center, JAPAN | Sakaue-Sawano et al. 2008 |
References
- Morshead, C. M., et al. Neural stem cells in the adult mammalian forebrain a relatively quiescent subpopulation of subependymal cells. Neuron. 13, 1071-1082 (1994).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci USA. 106, 6387-6392 (2009).
- Doetsch, F., Caille, I., Lim, D. A., Garcia Verdugo, J. M., Alvarez Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97, 703-716 (1999).
- Kriegstein, A., Alvarez Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Lois, C., Garcia Verdugo, J. M., Alvarez Buylla, A. Chain migration of neuronal precursors. Science. 271, 978-981 (1996).
- Fuentealba, L. C., Obernier, K., Alvarez Buylla, A. Adult neural stem cells bridge their niche. Cell stem cell. 10, 698-708 (2012).
- Rietze, R. L., et al. Purification of a pluripotent neural stem cell from the adult mouse brain. Nature. 412, 736-739 (2001).
- Fischer, J., et al. Prospective isolation of adult neural stem cells from the mouse subependymal zone. Nat Protoc. 6, 1981-1989 (2011).
- Daynac, M., et al. Quiescent neural stem cells exit dormancy upon alteration of GABAAR signaling following radiation damage. Stem Cell Res. 11, 516-528 (2013).
- Codega, P., et al. Prospective identification and purification of quiescent adult neural stem cells from their in vivo niche. Neuron. 82, 545-559 (2014).
- Mich, J. K., et al. Prospective identification of functionally distinct stem cells and neurosphere-initiating cells in adult mouse forebrain. Elife. 3, e02669 (2014).
- Capela, A., Temple, S. LeX ssea 1 is expressed by adult mouse CNS stem cells identifying them as nonependymal. Neuron. 35, 865-875 (2002).
- Calaora, V., Chazal, G., Nielsen, P. J., Rougon, G., Moreau, H. mCD24 expression in the developing mouse brain and in zones of secondary neurogenesis in the adult. Neuroscience. 73, 581-594 (1996).
- Pineda, J. R., et al. Vascular derived TGF-beta increases in the stem cell niche and perturbs neurogenesis during aging and following irradiation in the adult mouse brain. EMBO Mol Med. 5, 548-562 (2013).
- Lugert, S., et al. Quiescent and active hippocampal neural stem cells with distinct morphologies respond selectively to physiological and pathological stimuli and aging. Cell stem cell. 6, 445-456 (2010).
- Blackmore, D. G., Golmohammadi, M. G., Large, B., Waters, M. J., Rietze, R. L. Exercise increases neural stem cell number in a growth hormone dependent manner augmenting the regenerative response in aged mice. Stem cells. 27, 2044-2052 (2009).
- Bouab, M., Paliouras, G. N., Aumont, A., Forest Berard, K., Fernandes, K. J. Aging of the subventricular zone neural stem cell niche evidence for quiescence associated changes between early and mid adulthood. Neuroscience. 173, 135-149 (2011).
- Enwere, E., et al. Aging results in reduced epidermal growth factor receptor signaling diminished olfactory neurogenesis and deficits in fine olfactory discrimination. The Journal of neuroscience the official journal of the Society for Neuroscience. 24, 8354-8365 (2004).
- Maslov, A. Y., Barone, T. A., Plunkett, R. J., Pruitt, S. C. Neural stem cell detection characterization and age related changes in the subventricular zone of mice. The Journal of neuroscience the official journal of the Society for Neuroscience. 24, 1726-1733 (2004).
- Tropepe, V., Craig, C. G., Morshead, C. M., van der Kooy, D. Transforming growth factor alpha null and senescent mice show decreased neural progenitor cell proliferation in the forebrain subependyma. The Journal of neuroscience the official journal of the Society for Neuroscience. 17, 7850-7859 (1997).
- Costa, M. R., et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138, 1057-1068 (2011).
- Ponti, G., et al. Cell cycle and lineage progression of neural progenitors in the ventricular-subventricular zones of adult mice. Proc Natl Acad Sci U S A. 110, 1045-1054 (2013).
- Sakaue Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell cycle progression. Cell. 132, 487-498 (2008).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of visualized experiments JoVE. , (2010).
- Daynac, M., et al. TGFbeta lengthens the G1 phase of stem cells in aged mouse brain. Stem cells. 32, 3257-3265 (2014).
- Roccio, M., et al. Predicting stem cell fate changes by differential cell cycle progression patterns. Development. 140, 459-470 (2013).
- Walker, T. L., Kempermann, G. One mouse two cultures isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of visualized experiments JoVE. , e51225 (2014).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres re evaluating the relationship. Nat Methods. 2, 333-336 (2005).
- Pastrana, E., Silva Vargas, V., Doetsch, F. Eyes wide open a critical review of sphere formation as an assay for stem cells. Cell stem cell. 8, 486-498 (2011).
- Spella, M., et al. Licensing regulators Geminin and Cdt1 identify progenitor cells of the mouse CNS in a specific phase of the cell cycle. Neuroscience. 147, 373-387 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved