Method Article
셀 성인 마우스 뇌실 영역에서 신경 줄기 및 전구 세포의 정렬과 세포주기 역학의 라이브 이미징
* 이 저자들은 동등하게 기여했습니다
요약
We report a Fluorescent Activated Cell Sorting (FACS)-based method to isolate neural stem cells (NSCs) and their progeny from the subventricular zone (SVZ) of the adult mouse brain. Applied to Fluorescence Ubiquitination Cell Cycle Indicator (FUCCI) transgenic mice, it allows the study of cell cycle progression by live imaging.
초록
측면 심실의 뇌실 영역에서 신경 줄기 세포 (NSCs을)은 (SVZ)는 포유류의 뇌에서의 생활을 통해 후각 신경을 유지. 그들은 연속적으로 그들이 후각 전구를 통합하면 신경 세포로 분화 교통 증폭 세포 (TACS)와 neuroblasts를 생성합니다. 신흥 형광 활성 셀 (FACS) 기술은 NSCs을의 분리뿐만 아니라 자손을 허용 한 정렬 및 성인 신경 인성 틈새 시장에서의 유전자 조절 네트워크에 광명을 비춰하기 시작했다. 우리는 여기에 따르고 렉스 / EGFR / CD24 트리플 염색 성인 SVZ에서 상술 한 세포 집단의 세포주기 역학을 구별 할 수 있도록 세포 분류 기술을보고한다. 분리 된 세포는 시간 경과 비디오 현미경으로 자신의 세포주기 진행의 자세한 사항에서 탐구 부착 세포로 도금되어있다. 이를 위해, 우리는 세포가 두린 빨간색 형광되는 형질 전환 형광 유비퀴틴 세포주기 표시기 (FUCCI) 마우스를 사용G G G (1) 특정 붉은 Cdt1 기자에 의한 1 단계. 이 방법은 최근 확산 NSCs을 점진적으로 신경의 손상으로 이어지는, 노화 동안 자신의 G (1) 단계를 길게 것을 밝혔다. 이 방법은 다른 시스템에 쉽게 transposable이고 뇌 병변의 맥락에서 뇌 세포의 세포주기의 역학 연구에 큰 관심이 될 수있다.
서문
대기 신경 줄기 세포 (NSCs을)이 성인 신경 1의 원천과 증식로 변환 할 수 있습니다 EGFR (aNSCs)를 표현 양식을 2 "활성화". 활성화되면, 그들은 성상 세포의 튜브를 통해 후각 전구 (OB)로 마이그레이션 마지막으로 신경 세포 4,5로 분화 후 교통 증폭 세포 (TACS) 3 neuroblasts을 일으키다. NSCs을 그들의 자손들은 확산 (6)을 제어하는 요인의 수많은 연루, 측면 심실 따라 전문 "틈새"아키텍처로 구성됩니다. SVZ 신경성 세포의 분리 및 정제는 증식 조절의 분자 착체를 조명 할 필요가 있지만 인해 특정 마커 및 적응 기술의 부족으로 인해 오랫동안 도전으로 남아있다.
흐름을 사용하여 새로운 접근 방법은 세포 계측법 NSCs을하고 파묻혀의 분리를 가능 렌더링 한성인 SVZ 2,7-11에서 R 자손. 무부하 활성화 NSCs의, TACS : 셀 2 증식에 EGFR에 라벨 neuroblast 마커 CD24 (13) 및 형광 EGF와 함께 줄기 세포 마커 렉스 (12)를 사용하여, 우리는 최근 주요 SVZ 신경성 인구 다섯 정화를 허용 FACS 전략을 개발 미성숙뿐만 아니라 마이그레이션 neuroblasts 9. 여기, 우리는 세부 사항이 기술을 정렬 세포와 방법을 설명 처음으로 허용 렉스 / EGFR / CD24 트리플 염색 대기 및 활성화 NSCs을 모두 분리.
신경 성인기 동안 지속되지만, 새로운 뉴런의 생성이 크게 뇌 노화 (14)에서 감소된다. 대부분의 연구는 SVZ SGZ 및 15-20에서 전구 세포 증식의 수가 프로그레시브 환원에 동의한다. SVZ에서 신경의 연령과 관련된 하락 N의 감소를 유발로 결과는 무해한 없습니다세 뇌의 후각 전구에 ewborn 뉴런은 궁극적으로 세 쥐 18 후각 차별에 손상을 선도. 신경 전구 세포의 세포주기를 밝히는데 동력학은 노화시 성인의 신경 발달을 기본 메커니즘을 이해하는 중요한 단계이다. 최근 연구 시험 관내 21 및 생체 22 성인 신경 줄기 세포의 세포주기 및 계통 진행을 조사했지만 이들 중 어느 것도 분리 된 세포의 세포주기 단계를 시각화하는 세포 분류 기법과 유 전적으로 인코딩 된 형광 세포주기의 프로브를 이용했다하지 단일 세포 수준에서.
여기서 우리는 G 1 및 SG 2 / M (23) 상 사이의 구별을 가능 세포가 세포주기 동안 형광등되는 FUCCI 트랜스 제닉 마우스를 활용하는 프로토콜을 기술한다. 이 프로토콜은 성인 FUCCI 마일에서 NSCs을 그들의 자손의 방법 미래의 절연을 보여줍니다시간 경과 비디오 현미경과 결합 CE는 단일 세포 수준에서 세포주기의 역학 연구를 허용한다.
프로토콜
이 프로토콜은 11 월 24 일의 유럽 공동체위원회 지침을 준수하여 설계되어, 1986 년 (6백9분의 86 / EEC) 및 우리의 동물 복지 제도위원회 (CETEA-CEA DSV IDF)에 의해 승인되었습니다.
문화 Videomicroscopy 1. 기본 설정 이전
- 공 초점 영상 현미경 유리 바닥 배양 플레이트 또는 μ-플레이트를 사용합니다. 1 - / 웰 5 × 103 세포 / 웰 이상 5 × 10 3 세포를 96 웰 플레이트 24 웰 플레이트를 사용합니다.
- 적어도 일일 전에 실험을 시작으로, 부착 단층 문화에 대한 멸균 폴리 -D- 라이신 (PDL) 코팅 된 플레이트를 준비합니다. 각 웰 코트의 바닥에 충분히 PDL (dH2O 중에서 10 ㎍ / ml)에 첨가하고 37 ℃에서 O / N을 부화. PDL 용액을 제거하고 플레이트 층류 아래에 적어도 2 시간 동안 건조 후드 허용하기 전에 DH 2 O로 3 회 헹군다. 즉시 사용하지 않는 경우에 코팅 된 플레이트를 저장할-20 ° C.
- 9에서 NSC 기초 배지 및 NSC 확산 보충을 혼합하여 배지를 준비 : 1의 비율로 2 μg의 / ㎖ 헤파린, 20 NG / ㎖의 정제 된 인간의 재조합 표피 성장 인자 (EGF), 10 NG / ㎖와 함께 (재료 표 참조) 재조합 인간 섬유 모세포 성장 인자 2 (FGF-2). 사용 전에 수조에서 37 ℃로 배양 배지를 워밍업.
- SVZ 해리를 들어, 파파인 용액을 제조 하였다 : 1 ㎎ / ㎖ 파파인 0.2 ㎎ / ㎖의 L 시스테인, 0.2 ㎎ / ㎖ EDTA, 및 0.01 ㎎ / ㎖의 DNase I을 함유하는 얼 밸런스 염 용액 (EBSS)에서 (15 UI / mL) 중 PBS에서. 0.2 ㎛의 필터를 통과하여 용액을 소독. 사용 전에 37 ℃에서 용액을 평형화.
- DMEM : F12 배지 0.7 ㎎ / ㎖의 트립신 억제제를 함유하는 II 형 효소 반응을 중지하기 위해, 프로테아제 저해제 용액 (Ovomucoid)을 준비한다. 0.2 μm의 필터를 사용하여 용액을 필터.
- 뇌와 PBS 0.15 % BSA의를 수집하기 위해 포도당 솔루션 PBS 0.6 % 준비세척 단계에 대한 항체 염색법에 대한 olution.
- 해부하고, 메스를 집게를 묶는, 가위 : 해부 도구를 준비합니다. 70 % 에탄올에서 그들을 적시.
2. 수확 성인 마우스의 뇌와 SVZ Microdissections
- 해당 기관의 지침에 따라 자궁 경부 전위를 수행 희생 성인 FUCCI 마우스 (23) (2 ~ 3 개월 및 / 또는 연구를 노화에 대한 12 개월).
- 70 % 에탄올을 사용하여 마우스 스프레이 날카로운 가위를 사용하여 머리를 잘라.
- 두개골을 나타 내기 위해 두피를 따라 절개를합니다.
- 위의 작은 쌍을 사용 후각 전구 향해 두개골의베이스에서 시작 세로 중심선 절단을 수행한다. 가위 블레이드 기본 뇌 손상을 방지해야합니다. 뇌를 노출 곡선 집게와 두개골의 상단 개방 부분을 제거합니다.
- PBS에 0.6 %의 포도당을 포함하는 15mm 페트리 접시에 뇌를 수집합니다.
- 디후각 전구를 멀리 issect. 는 등의 표면에 뇌를 놓고 메스를 사용하여 광학 chiasm 통해 코로나 섹션을 확인합니다.
- 해부 현미경, 실험자 향해 위쪽으로 향하도록 관상 잘라 뇌 표면 부의 일부를 배치 입쪽.
- , SVZ을 해부 벌금 곡선 집게로 격막을 제거하려면 다음 뇌실 바로 옆에 줄무늬로 미세 집게 중 하나 팁을 삽입하고 주변 조직에서 SVZ를 분리합니다. 자세한 내용은 Azari 등. (24)을 참조하십시오. PBS-0.6 % 포도당 1 ㎖를 포함하는 배양 접시에 해부 SVZ를 놓습니다.
3. SVZ 조직 해리
- 더 큰 조각이 남아 있지 않을 때까지 배양 접시에 해부 SVZ를 말하다.
- 5 분 동안 200 XG에 15 ML 튜브와 원심 분리기에 PBS-0.6 %의 포도당과 함께 다진 조직을 전송합니다.
- (1 뜨는을 취소하고 미리 예열 파파인 1 ㎖를 추가㎎ / ㎖, 37 ℃ 수조에서 10 분 동안 0.01 ㎎ / ㎖ DNase를 I. 인큐베이션 보충) 단계에서 제조 된 1.4. 마우스 당 파파인 1 ㎖를 사용합니다.
- 5 분 200 XG에 원심 분리기 및 상층 액을 버린다.
- 1 ML을 추가 ovomucoid 미리 예열 (0.7 ㎎ / ㎖, 단계 1.5에서 준비) 파파인 활동을 중지 할 수 있습니다. 기계적으로 부드럽게 P1000의 마이크로 피펫 팁을 통해 아래로 20 회를 피펫 팅에 의해 단일 세포 현탁액에 추가 다진 조직을 떼어 놓다. 공기 방울을 피하십시오.
- 15 mL의 새 튜브에 20 ㎛의 멸균 필터를 통해 세포 현탁액을 통과한다. 세포 손실을 방지하기 위해 PBS 0.15 %의 BSA와 세포 필터를 세척해야합니다.
- 10 분 동안 200 XG에서 원심 분리기와 상층 액을 버린다. 0.15 %의 BSA를 함유하는 PBS 100 ㎕에 세포를 다시하는 것은 일시 중지.
셀 정렬 4. 면역 형광 염색법
셀 FUCCI - 레드 마우스 (그림 2A)는, 다음을 사용하여 정렬항체 : CD24 피코 에리 트린 - cyanine7 접합체 [PC7] CD15 / 렉스 형광 염료 [FITC] 결합 및 Ax647 복합 EGF 리간드.
참고 : 렉스 + EGFR + 세포와 EGFR + 세포는 성인 SVZ 풍부하지 않은 : ≈ 600 1500 세포 / 마우스 각각 9. 우리는 충분한 자료를 가지고 2 ~ 3 마우스에서 SVZ 세포를 풀링하는 것이 좋습니다. 셀 정렬 지속 기간을 3 시간을 초과하지 않도록 동일한 날에 12 개 이상의 마우스 작동하지 않는다. 같은 날에 너무 많은 마우스로 작업하는 증가 된 세포 정렬 지속 가능성이 증가 세포 사멸 및 / 또는 세포 분화의 결과로 이어질 것이라는 점을 명심하십시오.
- 마우스 (혹은 최적의 염색에 대한 2 마우스 3의 그룹에 대한 200 μL)에 PBS 0.15 %의 BSA 100 ㎕의 FACS 염색을 수행합니다.
- 제어 튜브를 준비합니다. 제조 업체에 따라 단일 색상 제어 튜브를 준비하는 보상 구슬을 사용하여9;의 프로토콜입니다. 세포의 일부 (한 마우스 충분하다로부터 추출 된 세포의 1/10)을 선택하고 1 음성 대조군 튜브 (표시되지 않은 세포)와 3 형광을 뺀 (FMO) 제어 튜브를 준비하는 4 튜브를 분리합니다. 튜브 당 PBS, 0.15 %의 BSA 200 μL에 세포를 재현 탁.
힌트 : LEX-FITC FMO 제어를 위해, CD24-PC7 (1:50)과 Ax647 - 복합 EGF 리간드로 세포 (1 : 200) 레이블; 및 Ax647 - 복합 EGF 리간드 FMO 제어를위한 CD15 / LeX-와 세포를 라벨 : CD24-PC7 FMO 제어, CD15 / LEX-FITC (1시 50분) 및 Ax647 - 복합 EGF 리간드 (200 1)와 셀 라벨 FITC (1시 50분) 및 CD24-PC7 (1시 50분). - 셀 정렬을 위해 사용되는 튜브를 들어, PBS에 표시된 희석에서 0.15 %의 BSA를 다음과 같은 항체를 사용 CD24-PC7 (1시 50분), CD15 / LEX-FITC (1시 50분) 및 Ax647 - 복합 EGF 리간드 (1 : 200).
- 어둠 속에서 4 ° C에서 20 분 동안 품어. 10 분 동안 200 XG에 1 ml의 PBS 0.15 %의 BSA와 원심 분리기로 세척. (200)에서 세포를 재현 탁81; 뇌 당 PBS 0.15 %의 BSA의 L. 얼음에 셀 정렬 튜브를 유지하고 세포 정렬을 바로 진행합니다.
- FUCCI - 녹색 마우스를 사용하는 경우, 셀이 LEX-FITC 항체 공유로 FUCCI 녹색 형광보다 같은 발광 파장 정렬하기 전에 분리 컬럼을 사용하여 별도의 렉스 양성과 렉스 음성 분수 (그림 3A를, B).
- 먼저, PBS, 0.15 %의 BSA 100 ㎕에서 어두운 4 ° C에서 15 분간 마우스 항 - 인간 항체 렉스 (1시 50분)와 셀 라벨.
- 다음 어둠 속에서 4 ° C에서 15 분 동안 항 - 마우스 IgM의 마이크로 비드 (1시 10분)와 셀 라벨, 10 분 동안 200 XG에 1 ml의 PBS 0.15 %의 BSA와 원심 분리기로 세포를 씻으십시오.
- 10 분 동안 200 XG에 1 ml의 PBS 0.15 %의 BSA와 원심 분리기로 세포를 씻으십시오. 500 μL PBS 0.15 %의 BSA의 세포를 재현 탁하고 그림 3 (C)에 도식화로 자기장 분리 컬럼을 통해 세포를 붓는다. 1 ml의 PBS 0.15 % B를 사용하여 열을 씻으십시오SA 렉스 부정적인 부분을 얻었다.
- 렉스 양성 분획을 얻기 위해, 자기장으로부터 분리 컬럼을 제거하고 PBS 2 ml의 0.15 %의 BSA와 함께 세포를 용출.
- 4.2에 표시된대로 CD24-PC7 및 Ax647 - 복합 EGF 리간드 염색을 진행합니다.
5. 셀 정렬
참고 : 세포는 86 μm의 noozle 40 psi에서 FACS 분류기에 분류되었다. 520 / 35nm를 (FITC), 575 / 26nm (PE), 670 / 20 나노 (Ax647) 및 740LP (PC7) : 형광 다음과 같은 필터 세트를 사용하여 수집 하였다. 오버랩 FUCCI 적색 형광의 발광 스펙트럼과 PC7 염료 사이에서 발견 될 때 보상은 위양성 신호를 방지 할 필요가있다.
- 정렬 세포 직전에, 죽은 세포에서 라이브를 구별 할 수있는 중요한 염료를 추가 할 수 있습니다. 우리는 2 μg의 / ml의 최종 농도 호를 (재료의 표 참조)를 사용. FACS 분류기를 선택 번째를 통해 음성 대조군 튜브 (표시되지 않은 세포)를 실행측면 산란 (SSC) 앞으로 분산 형 (FSC) 매개 변수 (그림 1A)를 사용하여 전자 세포.
주 : 사균은 (도 1a ') 만 HO 음성 분획을 게이팅하고 이중선이 네거티브 펄스 폭 분획 (도 1a를 선택에서 제외 된' ')에서 제외 하였다. - 4.2 단계에서 제조 된 단일 색상 컨트롤을 실행하고 광전자 증 배관을 조정 (PMT)는 필요한 경우 (즉, 음의 인구가 너무 높은 및 / 또는 양성 세포 오프 규모) 전압. 소프트웨어 보상 창에 색 보정을 수행한다.
- 실행 FMO 단계 4.2 (LEX-FITC FMO 제어, CD24-PC7 FMO 제어 및 Ax647 - 복합 EGF 리간드 FMO 제어)에서 준비를 제어하고 정렬 게이트 (그림 1)을 그립니다. 직접 1.5 ML의 마이크로 튜브에서 배양 배지 100 ㎕로 정렬 세포.
현미경에 대한 세포의 6. 준비
- 갓 분류 셀 플레이트1의 농도에서 S - 3 × 103 세포 / 웰의 폴리 옥시 -D- 라이신은 배양 배지 300 μl를 96 웰 플레이트 μ 코팅.
- 비디오 현미경에 앞서, 세포 부착을 허용하도록 적어도 1 시간 동안 CO 2, 37 ℃에서 배양 플레이트를 배양하고 5 %.
7. 현미경 설정 및 이미지 수집
- CO 2 5 %의 분위기하에 37 ℃에서 반전 된 온도 조절 챔버에 부착 된 공 초점 레이저 주사 현미경 시스템에서 : 플랜 아포 VC 20 배의 대물 DIC (0.75 NA)를 사용하여 라이브 영상을 수행한다.
- 예열 및 평형 온도 조절 챔버 내부 96 - 웰 μ-플레이트를 놓고 항온 커버로 뚜껑을 교체합니다.
- NIS 요소 소프트웨어를 열고에 메뉴 표시 줄을 클릭 시간 경과의 옵션 (길이, 무대 위치, 공 초점 Z 섹션, ...), "취득 / 취득 컨트롤을 선택"취득 / 취득 / ND 획득을 제어 " / 티 패드(221); 목표를 선택하고 "취득 / 취득 컨트롤 / A1plus 설정"메뉴 바의 각 형광의 PMT 레벨을 선택합니다. 데이터 파일을 저장할 폴더를 선택합니다.
- ND 획득 창을 사용하여, 각각의 중심뿐만 아니라 스테이지 위치를 설정하고 7 × 7 mm² 인에 큰 이미지 옵션을 선택한다. 이 각 웰의 중심을 모자이크 이미지를 만듭니다. 5 %로 큰 모자이크 이미지의 중첩을 설정합니다. 24 시간 동안 매 20 분 사진을 촬영합니다. 티 패드 창에서 : 계획 아포 VC 20 배 DIC 목표 (0.75 NA)를 선택합니다.
- A1plus 설정 창에서, 1.26 μm의 / 픽셀의 해상도 512 X 512 픽셀 형식에서 고속 공진 스캐너를 사용하여 이미지를 획득. 세포 모양을 시각화하는 시야를 사용합니다. FUCCI - 레드 마우스의 경우, 561 nm의 적색 형광을 여기하고 50분의 595 nm 인 필터를 이용하여 수집한다. FUCCI 그린 쥐의 경우에, 488 nm에서 녹색 형광을 여기하고 40분의 530 nm 인 필터를 이용하여 수집한다. 최적의 오후를 결정각 파장에 대한 T 수준, 오프셋 및 레이저 파워.
참고 : 우리는 소프트웨어가 각 획득하기 전에 각 단계의 위치에 오토 포커스 기능 할 수 있도록 시야 채널의 오토 포커스 기능을 사용하는 것이 좋습니다. 힌트 : 계획 아포 VC 20 배 DIC 목표 (NA : 0.75)는 기름 없이도 뛰어난 해상도를 사용 하였다. 다른 목적은 목적하는 광학 해상도에 따라 사용될 수있다. - 수집을 시작하기 위해 ND 획득 창에서 '지금 실행'버튼을 선택합니다.
힌트 : 제대로 작동에서 그 모든 것을 확인하기 위해 1 루프 컴퓨터 작업을 수행합니다.
8. 이미지 처리 및 분석
- 개별 세포를 추적함으로써 NIS 요소 소프트웨어에 직접 데이터를 분석한다. 힌트 : 시간을 얻을 NIS 요소 소프트웨어를 사용하여 .AVI 형식으로 각각의 위치를 저장하고 ImageJ에 함께 영화를 분석합니다.
- ImageJ에 소프트웨어에서 적어도 2 부문 (즉, 하나의 셀을 겪고 개별 셀을 추적4 셀 식민지). 셀 주위에 작은 영역을 자르기와 '이미지 / 중복'을 선택합니다.
- 몽타주를 만들기 위해 메뉴 바에서 '이미지 / 스택 / 확인 몽타주'를 선택합니다. , 프레임이 포함되는 이미지의 크기를 지정하고 최적의 해상도 된 .tif 파일로 몽타주를 저장합니다.
- 첫 번째 SG 2 / M 상 길이 (그림 2C, D)를 계산하려면, (G 1) 단일 빨간 형광 셀을 선택한 다음 t는 (붉은 형광이 꺼 일단 시작 S 상) = 0으로 설정합니다. 셀 2 SG / M의 길이를 추정 할 때까지 분할 프레임들의 개수를 카운트.
주 : 계산 된 시간은 각각의 프레임 간의 시간 간격에 따라 달라진다. - 다음 단계 G1 (도 2C, D)를 계산하기 위해, 단지 분할 셀을 추적하는 것을 계속한다. 분할 세포가 G1 단계를 입력하면, cdt1 붉은 형광 단백질의 축적이있을 것이다. 붉은 형광이 AGA를 전환 할 때까지 프레임의 수를 계산각 셀에.
힌트 : G (1)의 시작 부분에서 붉은 형광이 약한 될 수 있도록 셀이 근사치를 방지하기 위해 분할 한 프레임에 G 1 단계의 시작을 선택합니다.
결과
확실하게 성인 마우스 SVZ 줄기 세포 계보의 다른 세포 집단을 구별 할 수있는 능력은 자신의 기능적 특성을 조사하기 위해 원시입니다. 그 목적을 위해, 우리는 성인 SVZ에서 특정 세포 집단의 정화 허용 렉스 / EGFR / CD24 트리플 라벨 전략 개발 : 대기 NSCs을 (LEX 밝은), 활성화 NSCs을 (LEX + EGFR +)를, TACS (EGFR의 +) 미성숙 및 마이그레이션 neuroblasts (CD24 + EGFR + 각각 CD24 +) (9) (그림 1). FUCCI 트랜스 제닉 마우스에 도포 기술 분류 셀은 단일 세포 수준에서의 25 가지 신경성 개체군의 세포주기 단계의 라이브 영상을 허용한다. FUCCI - 레드 마우스는 빨간색 형광 사용 시간 경과 비디오 현미경 (그림 2A)와 G (1) 단계를 수행하는 데 사용되었다. FUCCI - 레드 NEG 세포에서 S- 세포를 나타낸다G 세포주기의 2 / M 단계, FUCCI - 레드 POS 세포는 G 1 세포와 FUCCI - 빨간색 밝은 세포 또는 세포주기 중 (그림 2B) 23,26 종료 세포가되어 있습니다. 렉스 + EGFR + 및 젊은 성인 (그림 2C)와 중년 마우스 (그림 2D)에서 EGFR + 세포는 폴리 - D - 라이신 코팅 된 배양 접시에 부착 된 세포로 도금했다. 빨간색 형광 세포가 분열 할 때까지 꺼 일단 첫 번째 SG 2 / M 단계는 단일 세포에서 확인되었다. 이전에 SG를 관찰 2 / M 상 길이는 어느 젊은이나 중년 생쥐에서 렉스 + EGFR +와 EGFR + 세포 사이에 차이를 보이지 않았다. 붉은 형광이 꺼집니다 때까지 우리는 첫 번째 부문에서 다음 G 1 단계 길이를 계산. 흥미롭게도, G 1 상 길게는 렉스 + EGFR + 세포 수 있지만 노화 중에 발견EGFR + 세포 (25) (그림 2C, D)에서. 결과적으로,이 오일 neurosphere를 도금 후의는도 2e에 도시 된 바와 같이 세 마우스로부터 얻은 EGFR 렉스 + + 세포에서 작다.
FUCCI - 녹색 마우스는 또한 SG에게 녹색 형광 2 / M 단계를 시각화하는 데 사용할 수 있습니다 (그림 3a는, B)하지만 세포가 LEX-FITC 항체로 분리 컬럼을 사용하여 미리 분류 할 필요는 FUCCI-보다 같은 발광 파장을 공유 녹색 형광 (그림 3C). 젊은 성인 렉스 + + EGFR 및 EGFR + 세포의 제 2 SG / M 위상 FUCCI 녹색 형광의 일례가도 3d에 도시된다.
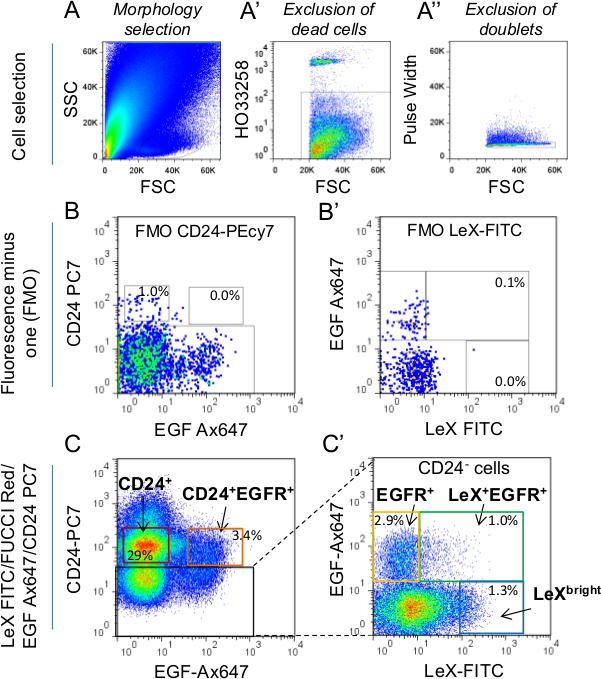
그림 1 :. FACS로 셀 선택의 전략 (A) 세포는 처음 T에 따라 선택했다앞으로 분산 형 (FSC) 매개 변수 대 사이드 분산 형 (SSC)를 사용하여 후계자 형태. 형태 게이트 선택에 대한 자세한 내용은 Daynac 등을 참조하십시오. 9 (A ') 죽은 세포가 HO 마커를 사용하여 표시하고 선택에서 제외 하였다. (' ')는 이중 펄스 폭 매개 변수를 사용하여 제외 하였다. 정렬 게이트, 형광을 뺀 (FMO)를 설정하기 위해 CD24-PC7에 대한 제어 (LEX-FITC가 / FUCCI - 레드 / EGF-Ax647 라벨, B) 및 LEX-FITC (FUCCI - 레드 / EGF-Ax647 / CD24 -PC7 라벨, B ')가 사용되었다 (C, C.'그런 다음 정렬 게이트는 LEX-FITC / FUCCI - 레드 FMO 컨트롤과 함께 / EGF-Ax647 / CD24-PC7 레이블 튜브 측정 하였다). 총 세포의 평균 비율은 게이트 내에서 표시됩니다. CD24 + 세포 (neuroblasts)를 선택하면, 게이트에서 CD24 밝은 발현하는 세포를 제외하려면주의해야합니다. 뇌실막 CE에 실제로, CD24 밝은 대응LLS 2,9. C '는 CD24 음성 세포 (C에서 검은 색 사각형)을 나타낸다. 만 렉스 + EGFR +와 EGFR + (C ') 정렬 게이트는 본 연구에 사용 하였다.
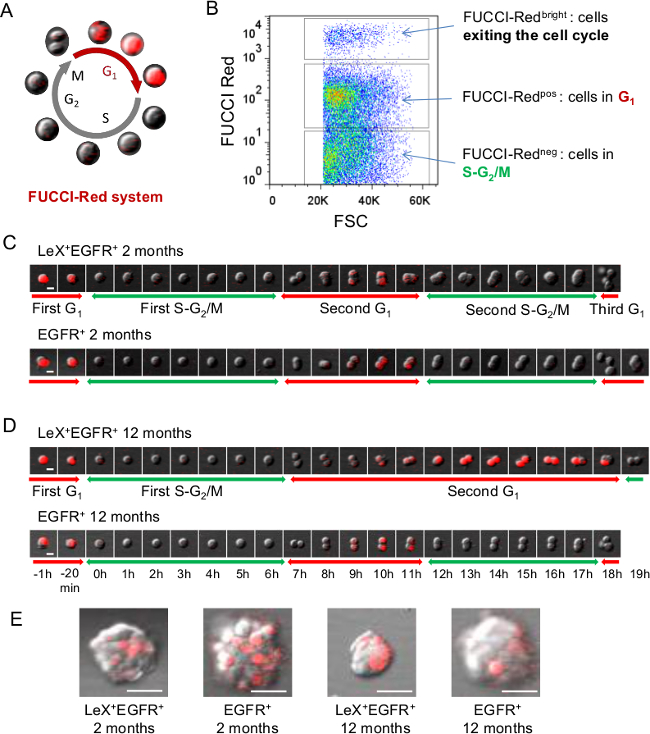
그림 2 : FUCCI - 레드 마우스를 사용하여 세포주기의 실시간 분석 (A) 세포가 SG 2 / M 단계 23 (B) 외과 표현 중 G1 단계에서 붉은 형광과 무색 FUCCI - 레드 세포주기의 도식 표현.. SVZ 세포에 FUCCI - 빨간색 형광. (C, D) LEX + EGFR +와 EGFR + 세포 젊은 (C)에서 정렬 중년 (D)와 비디오 현미경 FUCCI - 레드 마우스는 G 1 단계의 추적과 함께 할 수 있습니다 2 / M 위상이 갔지 추론 할 수있는 SG 반면, 적색 형광n은 적색 형광의 전원이 꺼집니다. 연속적인 이미지가 D에 제시된 시간 단위로 표시됩니다. 식민지의 (E) 대표 이미지 (neurosphere를)은 도금 후 오일을 얻을. 스케일 바 :. 10 μm의 (C, D), 30 ㎛ (E) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
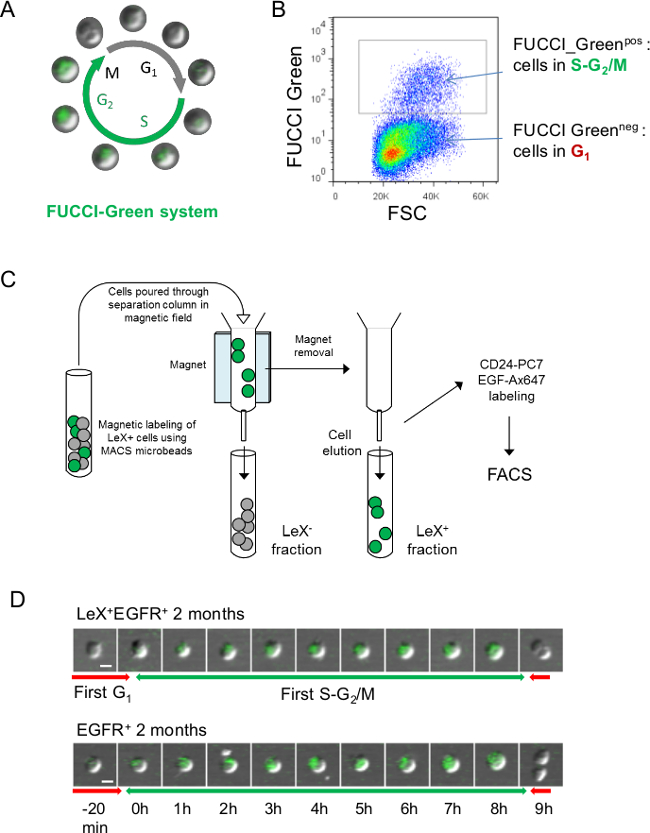
그림 3 :.. FUCCI 그린 마우스를 사용하여 세포주기의 실시간 분석을위한 전략 (A) 세포가 SG 동안 G 1 단계 23시 2 / M 상 무색 녹색 FUCCI 그린 세포주기의 도식 표현 (B) 외과 표현 FUCCI 그린 형광 : FUCCI 그린 NEG 셀 G에서 세포주기의 1 단계를 나타내는 셀 - 초 동안 FUCCIN POS 세포 / M (23) SG 2의 세포이다. (C) 녹색 형광 SG 2 / M 렉스 + EGFR +의 단계와 EGFR + 세포를 수행하기 위해, SVZ 세포를 분리 컬럼으로 사전에 분류되어야했다. 세포를 항 - 마우스 항체 렉스 렉스 + 분획 항 마우스 마이크로 비드를 사용하여 열을 유지한다으로 표지 하였다 (프로토콜 4 참조). 그런 다음, 렉스 +와 렉스 - 분획 용출 및 EGF-Ax647 및 FACS 정렬을위한 CD24-PC7 항체로 표지 된 (D)를 비디오 LEX + EGFR +의 현미경 및 EGFR 젊은 FUCCI 그린 쥐에서 분류 + 세포의 추적을 할 수 있습니다. 녹색 형광와 SG는 2 / M 단계. 연속적인 이미지를 D에 제시 시간 척도로 표시됩니다. 스케일 바 : 10 μm의 (D).
토론
여기에 설명 된 셀 정렬 기술은 성인 뇌 9 대기 NSCs을 활성화 NSCs의 해당 속성의 그들의 자손 수 있도록 연구와 역학 사이에 신뢰할 수있는 차별을 할 수 있습니다. 살아있는 세포를 23 세포주기 진행의 시각화를 허용 FUCCI 기술과 함께, 우리는 젊은 성인 및 노인 마우스 뇌 세포에서 세포주기의 G 1 및 SG 2 / M 단계를 수행하기 위해 신속하고 효율적인 기술을 개발 하였다.
이 프로토콜에서 사용되는 세포 분류 기법 SVZ 9에서 다섯 가지 주요 신경성 개체군의 정화를 허용 마커 제 검증 조합이었다. 또한, 정지 및 작동 NSCs의 구별을 가능하게 제 검증 기술이었다. 또한이 기술은 SU 트랜스 제닉 마우스 모델에 적용 할 때 필요한 트랜스 제닉 마우스 자체의 사용을 요구하지 않는다는 것을 주목해야FUCCI으로 채널. 이후 CODEGA 외. (10)는 활성화 된 상대방으로부터 무부하 NSCs의 구별 GFAP-GFP / CD133 / EGFR 트리플 표지 조합을 사용하고 있지만 GFAP-GFP 형질 전환 마우스의 사용을 필요로는 FUCCI 기술에 적용 할 수 없다. 미시간 외. 11 (9) 본 연구에서 사용 된 기술에 공통 결과를 주 GLAST / EGFR / CD24 트리플 표지 전략을 개발했다. 사실, 렉스와 GLAST NSCs의 마커 사이의 높은 상관 관계는 이미 Daynac 등의 알에서 관찰되었다. (9)을 연구한다. 그러나 MICH에 외. 기법에서 사용 GLAST 항체 피코 에리 트린에 연결되고 따라서 FUCCI 빨강 마우스를 이용하여 구성 될 수 없다.
SVZ 세포를 분류하기 전에주의를 요하는 몇 가지 중요한 기술적 인 사항이 있습니다. 먼저 해리 단계는 뇌 조직의 구조를 유지하면서 하나의 세포로 해리하는 바와 같이 매우 중요항체 표지 전략에 사용되는 단백질의 tegrity. 0.05 % 트립신 EDTA는 SVZ 조직 27하지만 렉스 항원은 거의 모든 렉스-FITC의 면역은 (데이터는 미도시) 잃은 민감한 것으로 밝혀졌다 해리에 매우 효과적인 것으로 밝혀졌다. 더 효율적이고 뇌 조직에 다른 프로테아제 미만 파괴적이었던 것에 따라서, 파파인 사용 하였다. 또한, 렉스도 EGFR도 CD24도는 파파인 처리에 의해 영향을 받았다. 그것은 파파인 처리가 15 분을 초과하는 경우, 항체가 표지 변경되었음을 주목해야한다. 우리는 기계 해리 (피펫 위아래로 20 회)과 관련된 10 분 파파인 처리로 최적의 결과를 얻었다.
폴리 - D - 라이신 코팅 부착 세포의 문화와 문화에 몇 일 후 식민지의 형성을 할 수 있습니다. 그것은 널리 체외 분석에서 자신의 한계 (28, 29)와 함께 제공하는 것이 허용됩니다. 우리 만 제 세포주기를 결정하는 것을 권장적어도 하나의 후속 분열을 겪고있는 세포가 생체 내 세포 표현형에 최대한 가깝게 유지한다.
그것은 Geminin (녹색 형광) 및 Cdt1 (적색 형광) 단백질 이전 마우스 (30)에 성인 뇌 9,25를 조직에서 초기 신경 중에 다량의 신경 전구 세포에서 발현되는 것으로 나타났다 (23) FUCCI 시스템을 설계하는 데 사용되는 것으로 언급 주목할 . mKO2-hCdt1 (1백20분의 30) 구조는 주로 빨간색 형광으로 G1 단계를 따라 본 연구에 사용되었지만, 두 구조의 사용 [mKO2-hCdt1 (1백20분의 30)와 MAG-hGem (110분의 1) 상기 세포주기의 주요 단계의 시각화 (G 1 및 SG 2 / M)뿐만 아니라, 1 G / S 전이 (23)를 허용하도록 구상 될 수있다. 이중 칼라 영상의 주요 단점은 여전히 셀 라벨에 사용할 수있는 형광 호환 제한된 세트이다. 한 가지 해결책은 separati을 사용하는 것입니다열에. 예를 들어, 우리는 성공적으로 정렬 셀 전에 분리 컬럼을 사용하여 세포에서 CD24 양성 분획을 고갈 및 라이브 이미지를 우리가 FUCCI - 적색 형광 (25)보다 동일한 발광 파장을 공유 CD24-PE 항체에 사용되는 바와 같이.
몇몇 연구는 성인 마우스 SVZ 집단의 세포주기의 길이를 조사했다. 우리의 기술로 얻어진 총 세포주기 길이 코스타 외. (21)에 의해 시험 관내에서 추정 한 가깝지만 우리는 상이한 세포주기 단계를 구분하기 위해 처음으로 할 수 있었다. 생체 내 연구에서, 폰티 외. 22 SVZ 다른 세포 집단의 증식 역학을 결정 티미 딘 유사체의 결합을 사용 하였다. 그러나, 이들은 세포주기의 연속적인 모니터링을 수행하지 않고, 단일 세포 수준에서 세포를 추적 할 수있는 둘. 이것은 강한 이질성이 재치있는 것으로 나타났다으로 문제가 될 수주어진 SVZ 세포 인구 22, 25을 힌. 우리는 여기서 단일 세포 수준에서 다른 성인 인구의 신경성 세포주기 단계의 라이브 영상을 허용 쉽게 설정할 관내 기법에 대한 대안을, 설명한다.
신경 줄기 세포 및 전구 세포의 세포주기의 조절을 이해하는 것은 노화 또는 뇌 병변의 컨텍스트에서 새로운 치료 방법의 개발이 과제로 남아. 우리의 프로토콜에 따라서 다양한 애플리케이션을 가질 수있다. 노화의 맥락에서, 본 기술은 또한 NSCs의 분화에 노화의 효과를 이해하는 것이 유용 할 수있다. 실제로, 이들 적색의 형광 강도가 26 명쾌 높을수록 입력 분화 신경 줄기 / 선조 세포를 식별 할 수있다. 마지막으로, 또한 리니지 프로 담당 세포 극한과 외인성 공정을 연구하는 하나의 셀 레벨에서 연속 라이브 영상을 악용 관심이 될 수있는성인 NSCs을의 gression.
공개
The authors declare that they have no conflict of interest.
감사의 말
우리는 C 버트, V 노이 빌레, V Barroca, J Tilliet 동물 시설의 모든 직원에게 빚된다 정렬 셀 J Baijer 및 N Dechamps에; 그녀의 관리 지원을위한 기술 지원 O. 에티엔 느, 그리고 A. Gouret. 유동 세포 계측법 셀 정렬은 DIM-줄기 극, INSERM, Fondation ARC 및 CEA에서 장비 보조금에 의해 설립, IRCM 유동 세포 계측법 공유 리소스에서 수행되었다. 이 작품은 프랑스 전력 (EDF)의 보조금에 의해 지원되었다. 메릴랜드 지역 일 드 프랑스 (DIM Biothérapies)에서 라 리그 Contre 르 암과 LM에서 교제가 있습니다. 마크 - 앙드레 Mouthon 공유 공동 수석 저자 프랑수아 디 Boussin.
자료
| Name | Company | Catalog Number | Comments |
| 96-well uncoated glass bottom culture plates | MatTek Corp. | P96G-1.5-5-F | |
| µ-Plates 96-well | Ibidi | 89626 | |
| Poly-D-Lysine | Millipore | A003E | |
| NeuroCult NSC Basal Medium | STEMCELL Technologies | 5700 | |
| NeuroCult NSC Proliferation Supplement | STEMCELL Technologies | 5701 | |
| Heparin | STEMCELL Technologies | 7980 | |
| EGF | Millipore | GF144 | |
| FGF-2 | Millipore | GF003 | |
| Papain | Worthington | LS003119 | |
| EBSS | Invitrogen | 24010-043 | |
| L-cysteine | Sigma | C-7352 | |
| 0.5M EDTA, pH 8.0 | Promega | V4231 | |
| DNase I | Sigma | D5025-15KU | |
| Trypsin inhibitor type II | Sigma | T9128 | Ovomucoid |
| DMEM:F12 medium | Life Technologies | 31330-038 | |
| 20 µm filter | BD Medimachine Filcon | 340622 | |
| Eppendorf microtubes 3810X | Sigma | Z606340-1000EA | |
| BSA | Sigma | A1595 | Bovine serum albumin solution |
| CD24 phycoerythrin-cyanine7 conjugate [PC7] | Life Technologies | A14776 | Mouse IgM; clone MMA. 1:50 |
| CD15/LeX fluorescein isothiocyanate [FITC] - conjugated | BD Biosciences | 332778 | Rat IgG2b; clone M1/69. 1:50 |
| Mouse anti-human LeX antibody | BD Pharmingen | 559045 | Mouse IgM; clone MAM. 1:50 |
| Alexa647 - conjugated EGF ligand | Life Technologies | E35351 | 1:200; Ax647-conjugated EGF ligand in the text |
| CompBeads | BD Biosciences | 644204 | |
| MACS LS separation columns | Miltenyi Biotec | 130-042-401 | separation columns (in the manuscript) |
| Anti-mouse IgM microbeads | Miltenyi Biotec | 130-047-301 | |
| Hoechst 33258 | Sigma | 861405 | HO (in the manuscript) |
| INFLUX cell sorter | BD Biosciences | FACS sorter (in the text) | |
| Nikon A1R confocal laser scanning microscope system attached to an inverted ECLIPSE Ti | Nikon Corp. | confocal laser scanning microscope (in the manuscript) | |
| NIS-Elements AR.4.13.01 64-bit software | Nikon Corp. | NIS-Elements software (in the manuscript) | |
| Plan Apo VC 20x DIC objective (NA: 0.75) | Nikon Corp. | ||
| ECLIPSE Ti thermostated chamber | Nikon Corp. | thermostated chamber (in the manuscript) | |
| ImageJ | RBS | ||
| FlowJo | Tree Star, Ashland, OR | ||
| FUCCI mice | RIKEN BioResource Center, JAPAN | Sakaue-Sawano et al. 2008 |
참고문헌
- Morshead, C. M., et al. Neural stem cells in the adult mammalian forebrain a relatively quiescent subpopulation of subependymal cells. Neuron. 13, 1071-1082 (1994).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci USA. 106, 6387-6392 (2009).
- Doetsch, F., Caille, I., Lim, D. A., Garcia Verdugo, J. M., Alvarez Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97, 703-716 (1999).
- Kriegstein, A., Alvarez Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Lois, C., Garcia Verdugo, J. M., Alvarez Buylla, A. Chain migration of neuronal precursors. Science. 271, 978-981 (1996).
- Fuentealba, L. C., Obernier, K., Alvarez Buylla, A. Adult neural stem cells bridge their niche. Cell stem cell. 10, 698-708 (2012).
- Rietze, R. L., et al. Purification of a pluripotent neural stem cell from the adult mouse brain. Nature. 412, 736-739 (2001).
- Fischer, J., et al. Prospective isolation of adult neural stem cells from the mouse subependymal zone. Nat Protoc. 6, 1981-1989 (2011).
- Daynac, M., et al. Quiescent neural stem cells exit dormancy upon alteration of GABAAR signaling following radiation damage. Stem Cell Res. 11, 516-528 (2013).
- Codega, P., et al. Prospective identification and purification of quiescent adult neural stem cells from their in vivo niche. Neuron. 82, 545-559 (2014).
- Mich, J. K., et al. Prospective identification of functionally distinct stem cells and neurosphere-initiating cells in adult mouse forebrain. Elife. 3, e02669 (2014).
- Capela, A., Temple, S. LeX ssea 1 is expressed by adult mouse CNS stem cells identifying them as nonependymal. Neuron. 35, 865-875 (2002).
- Calaora, V., Chazal, G., Nielsen, P. J., Rougon, G., Moreau, H. mCD24 expression in the developing mouse brain and in zones of secondary neurogenesis in the adult. Neuroscience. 73, 581-594 (1996).
- Pineda, J. R., et al. Vascular derived TGF-beta increases in the stem cell niche and perturbs neurogenesis during aging and following irradiation in the adult mouse brain. EMBO Mol Med. 5, 548-562 (2013).
- Lugert, S., et al. Quiescent and active hippocampal neural stem cells with distinct morphologies respond selectively to physiological and pathological stimuli and aging. Cell stem cell. 6, 445-456 (2010).
- Blackmore, D. G., Golmohammadi, M. G., Large, B., Waters, M. J., Rietze, R. L. Exercise increases neural stem cell number in a growth hormone dependent manner augmenting the regenerative response in aged mice. Stem cells. 27, 2044-2052 (2009).
- Bouab, M., Paliouras, G. N., Aumont, A., Forest Berard, K., Fernandes, K. J. Aging of the subventricular zone neural stem cell niche evidence for quiescence associated changes between early and mid adulthood. Neuroscience. 173, 135-149 (2011).
- Enwere, E., et al. Aging results in reduced epidermal growth factor receptor signaling diminished olfactory neurogenesis and deficits in fine olfactory discrimination. The Journal of neuroscience the official journal of the Society for Neuroscience. 24, 8354-8365 (2004).
- Maslov, A. Y., Barone, T. A., Plunkett, R. J., Pruitt, S. C. Neural stem cell detection characterization and age related changes in the subventricular zone of mice. The Journal of neuroscience the official journal of the Society for Neuroscience. 24, 1726-1733 (2004).
- Tropepe, V., Craig, C. G., Morshead, C. M., van der Kooy, D. Transforming growth factor alpha null and senescent mice show decreased neural progenitor cell proliferation in the forebrain subependyma. The Journal of neuroscience the official journal of the Society for Neuroscience. 17, 7850-7859 (1997).
- Costa, M. R., et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138, 1057-1068 (2011).
- Ponti, G., et al. Cell cycle and lineage progression of neural progenitors in the ventricular-subventricular zones of adult mice. Proc Natl Acad Sci U S A. 110, 1045-1054 (2013).
- Sakaue Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell cycle progression. Cell. 132, 487-498 (2008).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of visualized experiments JoVE. , (2010).
- Daynac, M., et al. TGFbeta lengthens the G1 phase of stem cells in aged mouse brain. Stem cells. 32, 3257-3265 (2014).
- Roccio, M., et al. Predicting stem cell fate changes by differential cell cycle progression patterns. Development. 140, 459-470 (2013).
- Walker, T. L., Kempermann, G. One mouse two cultures isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of visualized experiments JoVE. , e51225 (2014).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres re evaluating the relationship. Nat Methods. 2, 333-336 (2005).
- Pastrana, E., Silva Vargas, V., Doetsch, F. Eyes wide open a critical review of sphere formation as an assay for stem cells. Cell stem cell. 8, 486-498 (2011).
- Spella, M., et al. Licensing regulators Geminin and Cdt1 identify progenitor cells of the mouse CNS in a specific phase of the cell cycle. Neuroscience. 147, 373-387 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유