Method Article
Zellsortierung von Neural Stamm- und Vorläuferzellen aus dem erwachsenen Maus Subventrikularzone und Live-Bildgebung ihrer Zellzyklus Dynamics
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
We report a Fluorescent Activated Cell Sorting (FACS)-based method to isolate neural stem cells (NSCs) and their progeny from the subventricular zone (SVZ) of the adult mouse brain. Applied to Fluorescence Ubiquitination Cell Cycle Indicator (FUCCI) transgenic mice, it allows the study of cell cycle progression by live imaging.
Zusammenfassung
Neuronale Stammzellen (NSC) in der Subventrikularzone der lateralen Ventrikel (SVZ) aufrechtzuerhalten olfaktorischen Neurogenese während des gesamten Lebens im Säugerhirn. Sie erzeugen nacheinander Transit Verstärken Zellen (TAC) und Neuroblasten, die in Neuronen zu differenzieren, sobald sie die Riechkolben zu integrieren. Schwellenfluoreszenzaktivierte Zellsortierung (FACS) Techniken die Isolierung von NSCs und deren Nachkommen dürfen und haben begonnen, um Licht auf Genregulationsnetzwerken in Erwachsenen neurogenen Nischen zu vergießen. Wir berichten hier über eine Zellsortiertechnik, die zu verfolgen und zu unterscheiden, die den Zellzyklus Dynamik der oben erwähnten Zellpopulationen aus adulten SVZ mit LeX / EGFR / CD24 Dreifachfärbung ermöglicht. Isolierten Zellen werden dann als anhaftenden Zellen plattiert, um zu erkunden in Details ihrer Zellzyklusprogression durch Zeitraffervideomikroskopie. Hierzu verwenden wir transgene Fluorescence Ubiquitinierung Cell Cycle Indicator (Fucci) Mäusen, in denen Zellen sind rot fluoreszierend during G 1-Phase aufgrund eines G 1 spezifischen roten Cdt1 Reporter. Diese Methode wurde vor kurzem gezeigt, dass proliferierende NSCs ihren G1-Phase während der Alterung allmählich zu verlängern, was zu einer Beeinträchtigung der Neurogenese. Dieses Verfahren ist leicht umstellbar zu anderen Systemen und von großem Interesse für die Untersuchung der Zellzyklus-Dynamik von Hirnzellen im Rahmen der Hirnerkrankungen sein.
Einleitung
Ruhe neurale Stammzellen (NSCs) sind die Quelle für adulte Neurogenese 1 und kann in ihre proliferative konvertieren "aktiviert" Form Ausdruck der EGFR (aNSCs) 2. Einmal aktiviert, führen sie zu Transit Verstärken Zellen (TAC) 3 und Neuroblasten, die zu den Riechkolben (OB) wandern durch ein Rohr von Astrozyten und schließlich zu differenzieren zu Neuronen 4,5. NSCs und deren Nachkommen werden in spezialisierten "Nischen" Architekturen entlang der Seitenventrikel organisiert, impliziert eine Vielzahl von Faktoren, die ihre Proliferation 6. Die Isolierung und Reinigung des SVZ neurogener Zellen notwendig ist, die komplexen molekularen Regulierung ihrer Vermehrung zu beleuchten, aber eine Herausforderung für eine lange Zeit aufgrund des Fehlens von spezifischen Markern und von angepassten Techniken blieben.
Neue Ansätze mittels Durchflusszytometrie wurden die Isolierung von NSCs und thei möglich gemachtr Nachkommenschaft aus adulten SVZ 2,7-11. Unter Verwendung der Stammzellmarker LeX 12 zusammen mit Neuroblast Marker CD24 13 und einem Fluoreszenz-EGF an EGFR auf proliferierende Zellen 2 zu kennzeichnen, die wir vor kurzem eine FACS-Strategie ermöglicht die Reinigung von fünf der wichtigsten SVZ neurogene Bevölkerung: ruhenden und aktivierten NSCs, TAC, unreifen als auch die Migration Neuroblasten 9. Hier beschreiben wir in Details dieses Zellsortiertechnik und wie lex / EGFR / CD24 Dreifachfärbung zum ersten Mal erlaubt die Isolierung von sowohl ruhenden und aktivierten NSCs.
Obwohl die Neurogenese im Erwachsenenalter bestehen bleibt, ist die Produktion von neuen Neuronen drastisch im alternden Gehirn 14 verringert. Die meisten Studien sich auf eine fortschreitende Verminderung der Anzahl proliferierender Vorläuferzellen in der SGZ und SVZ 15-20. Die Folgen sind nicht harmlos wie die altersbedingten Rückgang der Neurogenese im SVZ provoziert eine Verminderung der newborn Neuronen im Riechkolben des gealterten Gehirn, letztlich zu einer Beeinträchtigung in olfaktorischen Diskriminierung führt in alten Mäusen 18. Aufklärung Zellzykluskinetik von neuralen Vorläuferzellen ist ein wichtiger Schritt, um die Mechanismen der Entwicklung der adulten Neurogenese während der Alterung zugrunde zu verstehen. Jüngste Studien haben in den Zellzyklus und Abstammung Progression von adulten neuralen Stammzellen in vitro 21 und in vivo 22 untersucht, aber keine von ihnen nutzten Zellsortiertechniken und genetisch kodierte Fluoreszenzzellzyklus-Sonden, die Zellzyklusphasen von isolierten Zellen sichtbar bei einer Einzelzellebene.
Hier beschreiben wir ein Protokoll, das die Vorteile der transgenen Fucci Mäusen, bei denen Zellen während ihres Zellzyklus fluoreszierend, so dass der Unterschied zwischen G 1 und SG 2 / M-Phasen 23. Dieses Protokoll zeigt, wie potenzielle Isolierung von NSCs und deren Nachkommen aus adulten Fucci mice kombiniert mit Zeitraffer-Video-Mikroskopie ermöglicht die Untersuchung der Zellzyklusdynamik bei einer Einzelzellebene.
Protokoll
Dieses Protokoll wurde in Übereinstimmung mit der EG-Richtlinie vom 24. November Rat konzipiert, hat 1986 (86/609 / EWG) und von unseren Tierschutz institutionellen Ausschusses (Cetea-CEA DSV IdF) genehmigt worden.
1. Grundeinstellung Vor der Kultur und Videomikroskopie
- Verwenden Sie Glasboden Kulturplatten oder μ-Platten für die konfokale Videomikroskopie. Für 1-5 x 10 3 Zellen / Vertiefung, verwenden Sie 96-Well-Platten und 24-Well-Platten für mehr als 5 × 10 3 Zellen / Vertiefung.
- Mindestens einen Tag vor Beginn des Experiments, bereiten sterile Poly-D-Lysin (PDL) beschichteten Platten für adhärente Monolayer-Kulturen. Fügen Sie genug PDL (10 ug / ml in dH 2 O) zur Beschichtung der Boden jeder Vertiefung und inkubieren Sie O / N bei 37 ° C. Entfernen der PDL-Lösung und dreimal mit dH 2 O spülen bevor die Platte in der Haube während mindestens 2 Stunden lang unter einer laminaren Strömung zu trocknen. Wenn es nicht sofort verwendet wird, speichern die beschichtete Platte bei-20 ° C.
- Vorbereitung Kulturmedium durch Mischen NSC Basalmedium und NSC Proliferation Supplement in einem Verhältnis 9: 1 (siehe Material Tabelle) zusammen mit 2 & mgr; g / ml Heparin, 20 ng / ml gereinigte menschliche rekombinante epidermale Wachstumsfaktor (EGF) und 10 ng / ml menschlicher rekombinanter Fibroblasten-Wachstumsfaktor 2 (FGF-2). Aufwärmen des Kulturmediums auf 37 ° C in einem Wasserbad vor dem Gebrauch.
- Für die SVZ Dissoziation, bereiten Papainlösung: 1 mg / ml Papain (15 UI / ml) in Earls Gleichgewicht Salzlösung (EBSS), die 0,2 mg / ml L-Cystein, 0,2 mg / ml EDTA und 0,01 mg / ml DNase I in PBS. Sterilisieren der Lösung, indem sie durch einen 0,2 um Filter. Äquilibrieren die Lösung bei 37 ° C vor dem Gebrauch.
- Um die enzymatische Reaktion zu stoppen, bereiten ein Protease-Inhibitor-Lösung (Ovomucoid): DMEM: F12-Medium mit 0,7 mg / ml Trypsin-Inhibitor Typ II. Filtern der Lösung unter Verwendung eines 0,2 um-Filter.
- Bereiten PBS 0,6% Glucose-Lösung, um die Gehirne und PBS 0,15% BSA s sammelnÖSUNG für Waschschritte und für die Antikörperfärbung.
- Bereiten Dissektion Werkzeuge: Schere, seziert und das Binden einer Pinzette, Skalpell. Genießen sie in 70% Ethanol.
2. Die Ernte der erwachsenen Maus-Gehirne und SVZ Mikrodissektionen
- Sacrifice Erwachsenen Fucci Mäusen 23 (2 bis 3 Monate alte und / oder 12 Monate alte für Alterungsuntersuchungen) Durchführen eines Genickbruch in Übereinstimmung mit den entsprechenden Richtlinien des Instituts.
- Sprühen Sie die Maus mit 70% Ethanol und schneiden Sie den Kopf ab mit einer scharfen Schere.
- Einen Einschnitt entlang der Kopfhaut, um den Schädel zu offenbaren.
- Führen Sie eine Längsmittellinie geschnitten beginnend an der Basis des Schädels zu den Riechkolben mit einem kleinen Schere. Stellen Sie sicher, um eine Beschädigung der darunterliegenden Gehirn mit der Scherenblätter. Entfernen Sie die oberen offenen Teil des Schädels mit einer gebogenen Pinzette, um das Gehirn aus.
- Sammeln das Gehirn in einer 15 mm Petrischale, enthaltend 0,6% Glucose in PBS.
- Dissect weg die Riechkolben. Legen Sie das Gehirn auf seiner Rückenfläche und machen einen Frontalschnitt durch das Chiasma mit einem Skalpell.
- Unter einem Binokular, positionieren Sie den rostralen Teil des Gehirns Abschnitt mit der Schnittfläche nach oben koronalen Richtung der Experimentator.
- Um die SVZ sezieren, entfernen Sie das Septum mit einer feinen gebogenen Pinzette und legen Sie einen Tipp von einer feinen Pinzette in das Striatum unmittelbar angrenzend an die Herzkammer und nehmen Sie den SVZ von dem umgebenden Gewebe. Weitere Einzelheiten finden Sie unter Azari et al. 24. Legen Sie die seziert SVZ in eine Petrischale mit 1 ml PBS-0,6% Glucose.
3. SVZ Gewebedissoziation
- Hackfleisch sezierten SVZ in der Petrischale, bis keine große Stücke bleiben.
- Übertragen des zerkleinerten Gewebes zusammen mit der PBS-0,6% Glucose in einem 15 ml-Röhrchen und zentrifugiert bei 200 g für 5 min.
- Überstand verwerfen und 1 ml vorgewärmten Papain (1mg / ml, wird in Schritt 1.4 hergestellten) mit 0,01 mg / ml DNase I. Bei 37 ° C ergänzt für 10 min in einem Wasserbad. Verwenden Sie 1 ml Papain pro Maus.
- Zentrifuge bei 200 xg für 5 min und den Überstand verwerfen.
- 1 ml der vorgewärmten Ovomucoid (0,7 mg / ml, in Schritt 1.5, hergestellt), um Papain-Aktivität zu stoppen. Mechanisch weiter distanzieren das zerkleinerte Gewebe in eine Einzelzellsuspension durch vorsichtiges Auf- und Abpipettieren 20-mal durch eine p1000 Mikropipettenspitze. Vermeiden Sie Luftblasen.
- Übergeben Sie die Zellsuspension durch ein steriles 20-um-Filter in einem neuen 15-ml-Tube. Achten Sie auf die Zellenfilter mit PBS 0,15% BSA zu waschen, um nicht zu verlieren Zellen.
- Zentrifuge bei 200 × g für 10 min und den Überstand verwerfen. Wieder die Zellen in 100 ul PBS, enthaltend 0,15% BSA.
4. Immunfluoreszenzfärbung für Zellsortierung
Für Zellsortierung unter Verwendung Fucci-Red-Mäuse (2A), verwenden Sie die folgendeAntikörper: CD24 Phycoerythrin-Konjugat cyanine7 [PC7]; CD15 / LeX Fluoresceinisothiocyanat [FITC] konjugiert und Ax647 konjugierten EGF-Liganden.
Hinweis: LeX + EGFR + Zellen und EGFR + Zellen sind nicht reichlich in der Erwachsenen SVZ: ≈ 600 und 1500 Zellen / Maus bzw. 9. Wir empfehlen, die Bündelung SVZ Zellen 2-3 Mäusen, um genügend Material haben. Nicht mehr als 12 Mäusen am Tag arbeiten, so dass die Zellsortierung Dauer nicht mehr als 3 h nicht überschreiten. Denken Sie daran, dass die Arbeit mit zu vielen Mäusen am selben Tag wird zu einem erhöhten Zellsortierung Dauer möglicherweise zu einer erhöhten Zelltod und / oder Zelldifferenzierung führen.
- Führen die FACS-Färbung in 100 ul PBS 0,15% BSA pro Maus (oder in 200 & mgr; l für eine Gruppe von 2-3 Mäusen für eine optimale Färbung).
- Bereiten Sie die Kontrollröhrchen. Verwenden Entschädigung Perlen einfarbige Kontrollröhrchen nach Herstellerangaben vorbereiten9; s-Protokoll. Wählen Sie einen Teil der Zellen (1/10 der Zellen von einer Maus reicht extrahiert) und trennen Sie es in 4 Röhren 1 negativen Steuerrohr (nicht markierten Zellen) und 3-Fluoreszenz minus eins (FMO) Kontrollröhrchen vorbereitet. Resuspendieren der Zellen in 200 ul PBS 0,15% BSA pro Röhrchen.
Hinweis: Lex-FITC FMO Kontrolle, beschriften Sie die Zellen mit CD24-PC7 (1:50) und Ax647 konjugierten EGF-Liganden (1: 200); für CD24-PC7 FMO Kontrolle, beschriften Sie die Zellen mit CD15 / LeX-FITC (1:50) und Ax647 konjugierten EGF-Liganden (1: 200) und für Ax647 konjugierten EGF Ligand FMO Kontrolle, beschriften Sie die Zellen mit CD15 / Lexmark FITC (1:50) und CD24-PC7 (1:50). - Für die für die Zellsortierung verwendet Rohre, die folgenden Antikörper bei der angegebenen Verdünnung in PBS 0,15% BSA: CD24-PC7 (1:50), CD15 / LeX-FITC (1:50) und Ax647 konjugierten EGF-Liganden (1: 200).
- Inkubation für 20 min bei 4 ° C im Dunkeln. Waschen mit 1 ml PBS 0,15% BSA und zentrifugiert bei 200 g für 10 min. Resuspendieren der Zellen in 20081; l PBS, 0,15% BSA pro Gehirn. Halten Sie die Zellsortierung Röhrchen auf Eis und gehen sofort in den Zellsortierung.
- Bei Verwendung Fucci-Grün-Mäuse, separate LeX-positive und-negative LeX Fraktionen mit Trennsäulen vor der Zellsortierung als der lex-FITC-Antikörper-Aktien die gleiche Emissionswellenlänge als die Fucci-grüne Fluoreszenz (3A, B).
- Zuerst entsprechend der Zellen mit einem Maus-anti-Mensch-LeX-Antikörper (1:50) für 15 Minuten bei 4 ° C im Dunkeln in 100 ul PBS 0,15% BSA.
- Waschen der Zellen mit 1 ml PBS 0,15% BSA und zentrifugiert bei 200 g für 10 min, dann kennzeichnen die Zellen mit anti-Maus-IgM-Microbeads (1:10) für 15 Minuten bei 4 ° C im Dunkeln.
- Waschen der Zellen mit 1 ml PBS 0,15% BSA und zentrifugiert bei 200 g für 10 min. Resuspendieren der Zellen in 500 ul PBS 0,15% BSA und gießt die Zellen durch Trennsäule im Magnetfeld, wie in Abbildung 3 C schematisiert. Mit 1 ml PBS 0,15% B Die SäuleSA Lex negativen Fraktion zu erhalten.
- Lex-positive Fraktion zu erhalten, entfernen Sie die Trennsäule aus dem Magnetfeld und eluieren die Zellen mit 2 ml PBS 0,15% BSA.
- Fahren Sie mit CD24-PC7 und Ax647 konjugierten EGF-Liganden-Färbung wie in 4.2 angegeben.
5. Zellsortierung
Hinweis: Die Zellen wurden auf einem FACS-Sorter bei 40 psi mit einer 86 & mgr; m Düsenn sortiert. 520/35 nm (FITC), 575/26 nm (PE), 670/20 nm (Ax647) und 740LP (PC7): Die Fluoreszenz wurde unter Verwendung der folgenden Filtersatz gesammelt. Kompensation ist notwendig, um falsch-positive Signale zu verhindern, wie eine Überlappung zwischen den Emissionsspektren der Fucci-roten Fluoreszenz und die PC7 Farbstoff gefunden.
- Unmittelbar vor der Zellsortierung, fügen Sie ein Vitalfarbstoff, um live aus toten Zellen zu unterscheiden. Wir verwendeten HO (siehe Materialtabelle) in einer 2 ug / ml Endkonzentration. Führen Sie den negativen Steuerrohr (nicht markierten Zellen) durch die FACS-Sorter und wählen the-Zellen unter Verwendung von Seitenstreuung (SSC) und Vorwärtsstreuung (FSC) Parameter (Abbildung 1A).
HINWEIS: Tote Zellen wurden durch Gating nur die HO-negative Fraktion (1A) und dann wurden Dubletten durch die Auswahl der Pulsweiten negativen Fraktion (1A ausgeschlossen '') ausgeschlossen. - Führen Sie die einzelnen Farbsteuerung in Schritt 4.2 vorbereitet und stellen Sie den Photomultiplier (PMT) Spannungen bei Bedarf (dh negativen Bevölkerung zu hoch und / oder positive Zellen außerhalb der Skala). Führen Sie Farbausgleich im Ausgleichsfenster der Software.
- Run FMO steuert in Schritt 4.2 (LEX-FITC FMO Kontrolle, CD24-PC7 FMO Steuerung und Ax647 konjugierten EGF Ligand FMO Steuerung) bereit und stellt die Weichen (Abbildung 1). Sortiert die Zellen direkt in 100 ul Kulturmedium in 1,5 ml Mikroröhrchen.
6. Vorbereitung der Zellen für die Mikroskopie
- Platte des frisch sortiert Zells bei einer Dichte von 1-3 x 10 3 Zellen / Well auf Poly-D-Lysin-beschichtete 96-Well-μ-Platte mit 300 & mgr; l Kulturmedium.
- Vor der Videomikroskopie, Inkubation der Kulturplatten bei 37 ° C und 5% CO 2 mindestens 1 Stunde die Zelladhäsion zu ermöglichen.
7. Mikroskop-Setup und Image Acquisition
- Führen die Bildgebung unter Verwendung eines Plan Apo VC 20x DIC Objektiv (NA: 0,75) auf einem konfokalen Laserscanmikroskop mit einem invertierten thermostatisierten Kammer befestigt, auf 37 ° C unter 5% CO 2 Atmosphäre.
- Positionieren Sie den 96-Loch-μ-Platte innerhalb des vorgewärmten und ins Gleichgewicht gebracht thermostatisiert Kammer und ersetzen Sie den Deckel durch ein thermostatisiertes Abdeckung.
- Öffnen Sie die NIS-Elements-Software und klicken Sie in der Menüleiste auf "Acquire / Firmenübernahme steuert / ND Nahme", um die Optionen des Zeitraffer (Länge, Tischpositionen, konfokalen z-Sektionen, ...), "Acquire / Firmenübernahme steuert wählen / Ti-Pad221; um die Ziele auswählen und "Acquire / Firmenübernahme steuert / a1plus Settings" die PMT-Ebene für jede Fluoreszenz in der Menüleiste zu wählen. Wählen Sie einen Ordner, um die Dateien zu speichern.
- Unter Verwendung des Erfassungsfensters ND, setzen Sie die Mitte eines jeden sowie eine Tischposition und wählen Sie das große Bild Option, 7 x 7 mm². Dies wird ein Mosaik-Bild um den Mittelpunkt jeder Vertiefung zu schaffen. Stellen Sie die Überdeckung für die große Mosaikbild zu 5%. Nehmen Sie Bilder alle 20 min für 24 Stunden. Wählen Sie den Plan Apo VC 20x DIC Objektiv (NA: 0,75) in der Ti Pad Fenster.
- Im Fenster a1plus Einstellungen, von Bildern mit hoher Geschwindigkeit Resonanzscanner zu erwerben zu einem 512 x 512 Pixel Format mit einer Auflösung von 1,26 & mgr; m / Pixel. Verwenden Hellfeld, um Zellformen zu visualisieren. Im Falle Fucci-Red Mäusen erregt rote Fluoreszenz bei 561 nm und sammeln unter Verwendung eines 595/50 nm-Filter. Im Falle Fucci-Grün-Mäusen, zu erregen grüne Fluoreszenz bei 488 nm und sammeln unter Verwendung eines 530/40 nm-Filter. Bestimmen Sie die optimale PMT-Ebene, Offset und Laserleistung für jede Wellenlänge.
HINWEIS: Wir empfehlen die Verwendung des Autofokus-Funktion für die Hellfeldkanal, damit die Software in jeder Phase Position vor jedem Erwerb Autofokus. Hinweis: Ein Plan Apo VC 20x DIC Objektiv (NA: 0,75) wurde für seine hervorragende Auflösung, ohne die Notwendigkeit für Öl verwendet. Andere Ziele können je nach der gewünschten optischen Auflösung verwendet werden. - Wählen Sie die "Jetzt ausführen" Taste auf dem Aufnahmefenster ND Akquisition beginnen.
Hinweis: Folgen Sie der Computerarbeit für 1 Schleife, um, dass alles in einwandfrei sicher zu sein.
8. Bildverarbeitung und -analyse
- Analysieren Sie die Daten direkt auf dem NIS-Elements Software individuell die Verfolgung der Zellen. Hinweis: Um Zeit zu gewinnen, speichern Sie jede Position im .avi-Format mit NIS-Elements-Software und analysieren Sie die Filme mit ImageJ.
- In ImageJ-Software, verfolgen einzelne Zellen, die eine mindestens 2 Teilungen (dh einer Zelle zurein Vier-Zellkolonie). Crop einen kleinen Bereich um die Zelle und wählen Sie "Bild / Duplizieren".
- Wählen Sie "Bild / Stacks / Stellen Montage" in der Menüleiste, um eine Montage zu machen. Geben Sie die Rahmen mit einbezogen werden, die Größe der Bilder und speichern Sie die Montage als TIF-Datei für eine optimale Auflösung.
- Zur Berechnung der ersten SG 2 / M-Phase Länge (2C, D), wählen Sie eine einzelne rote Leuchtstoffzelle (in G 1) und stellen Sie dann t = 0 (S-Phase beginnt, sobald der roten Fluoreszenz erlischt). Zählen Sie die Anzahl der Frames, bis die Zelle, um die SG 2 / M Länge schätzen teilt.
HINWEIS: Die berechnete Zeit ist abhängig von dem Zeitintervall zwischen den einzelnen Bildern. - Um die folgende G1-Phase (Abbildung 2C, D) zu berechnen, fortzusetzen, um die Zelle, die gerade unterteilt verfolgen. Wenn der geteilten Zelle G1-Phase eintritt, wird es eine Ansammlung von CDT1 roten fluoreszierenden Protein sein. Berechnen der Anzahl von Rahmen bis roten Fluoreszenz abschaltet again jeder Zelle.
Hinweis: Zu Beginn der G 1 die rote Fluoreszenz möglicherweise zu schwach, so wählen, das Einsetzen der G1-Phase auf dem Rahmen, wo die Zelle geteilt wird, um Näherungen zu vermeiden.
Ergebnisse
Die Fähigkeit, zuverlässig zwischen den verschiedenen Zellpopulationen von der erwachsenen Maus SVZ Stammzellenlinie diskriminationsfähiger primordialen ihre funktionellen Eigenschaften zu untersuchen. Zu diesem Zweck haben wir lex / EGFR / CD24 Triple-Markierungsstrategie ermöglicht die Aufreinigung von spezifischen Zellpopulationen aus der Erwachsenen SVZ entwickelt: Ruhe NSCs (lex hell), aktiviert NSCs (LEX + EGFR +), TAC (EGFR +) unreife und Migration von Neuroblasten (CD24 + CD24 + und EGFR + bezeichnet) 9 (Abbildung 1). Um Fucci transgenen Mäusen angewandt, die Zellsortierung Technik ermöglicht die Echtzeit-Bildgebung der Zellzyklusphasen der verschiedenen neurogenen Populationen auf Einzelzellebene 25. Fucci-Red-Mäuse wurden verwendet, um die G 1 -Phase mit roter Fluoreszenz mit Zeitraffer-Video-Mikroskopie (Abbildung 2A) zu folgen. Fucci-Red neg Zellen der Zellen in S- vertretenG 2 / M-Phasen des Zellzyklus sind Fucci-Red pos Zellen G 1 Zellen und Fucci-Red hellen Zellen Zellen austretende oder aus dem Zellzyklus (2B) 23,26. LeX + EGFR und EGFR + + Zellen aus jungen Erwachsenen (2C) und Mäusen mittleren Alters (2D) wurden als adhärente Zellen auf Poly-D-Lysin beschichteten Kulturplatten. Die erste SG 2 / M Phase wurde an einzelnen Zellen identifiziert, sobald die rote Fluoreszenz schaltet, bis die Zelle teilt. Wie zuvor beobachtet die SG 2 / M-Phase Länge zeigte keinen Unterschied zwischen LeX + + EGFR und EGFR + -Zellen, entweder jung oder mittleren Alters Mäusen. Dann berechneten wir die nächste G1-Phase Länge von der ersten Liga, bis die rote Fluoreszenz erlischt. Interessanterweise wurde ein G 1 -Phase Verlängerung während der Alterung in LeX + EGFR + Zellen, aber nicht gefundenin EGFR + -Zellen 25 (2C, D). Folglich erhalten Neurospheres 5 Tage nach Plattieren sind kleiner in LeX + EGFR + -Zellen aus alten Mäusen erhalten werden, wie in 2E gezeigt ist.
Fucci-Grün-Mäuse können auch verwendet werden, um die SG 2 / M Phase mit grüne Fluoreszenz sichtbar zu machen (3A, B), aber Zellen, die vorsortiert mit Trennsäulen als lex-FITC-Antikörper werden müssen teilten die gleiche Emissionswellenlänge als die FUCCI- grüne Fluoreszenz (3C). Ein Beispiel Fucci grüne Fluoreszenz zum ersten SG 2 / M-Phase des jungen Erwachsenen LeX + EGFR und EGFR + + Zellen ist in 3D gezeigt.
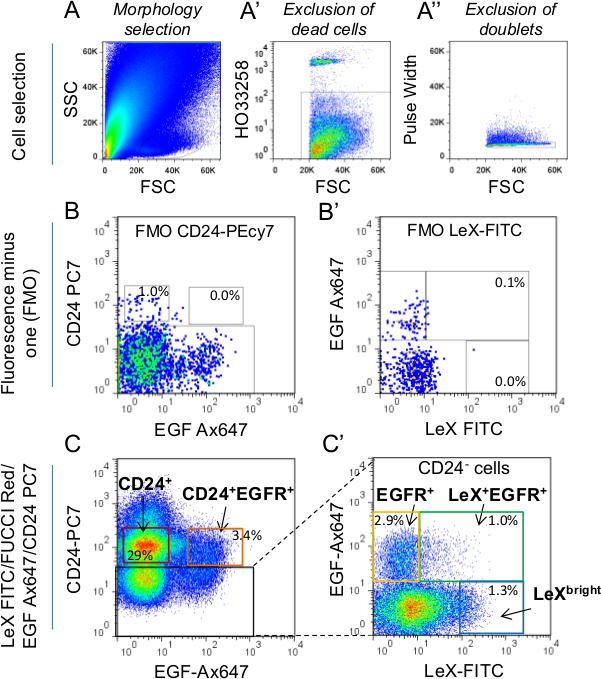
Abb. 1: Strategie der Zellenauswahl durch FACS (A) Die Zellen wurden zunächst nach t gewähltErben Morphologie mit Seitenstreuung (SSC) vs Vorwärtsstreuung (FSC) Parameter. Für weitere Details über die Morphologie Gate-Auswahl, um Daynac et al verwiesen. 9 (A ') Tote Zellen wurden unter Verwendung von HO Marker markiert und von der Auswahl ausgeschlossen. (A' ') Dubletten wurden unter Verwendung von Pulsbreitenparameter ausgeschlossen. Um die Einrichtung der Sortierweichen, Fluoreszenz minus eins (FMO) steuert für CD24-PC7 (LEX-FITC / Fucci-Rot / EGF-Ax647 Kennzeichnung; B) und LeX-FITC (Fucci-Rot / EGF-Ax647 / CD24 -PC7 Kennzeichnung; B ') wurden verwendet, (C, C ".) Dann wurden die Weichen in LeX-FITC / Fucci-Rot / EGF-Ax647 / CD24-PC7 markierten Röhrchen zusammen mit FMO Kontrollen bestimmt. Die mittleren Prozentsätze der Gesamtzellen in den Gattern dargestellt. Bei der Auswahl von CD24 + Zellen (Neuroblasten), seien Sie vorsichtig, um CD24 hell exprimierenden Zellen aus dem Tor auszuschließen. Tatsächlich CD24 hell entsprechen ependymaler cells 2,9. C 'steht für die CD24-negativen Zellen (schwarzes Quadrat in C). Nur LeX + + EGFR und EGFR + (C ') Weichen wurden für diese Studie verwendet.
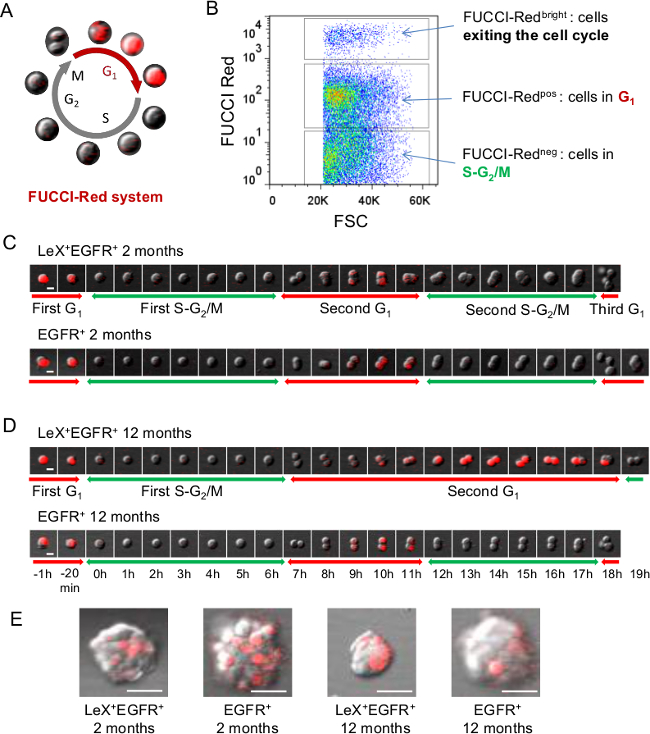
Abbildung 2: Live-Analyse von Zellzyklus mit Fucci-Red-Mäusen (A) Schematische Darstellung der Fucci-Red Zellzyklus, wo Zellen sind rot fluoreszierenden während der G1-Phase und farblos während SG 2 / M-Phasen 23 (B) FACS-Darstellung.. Fucci-rote Fluoreszenz auf SVZ-Zellen. (C, D) Video-Mikroskopie mit Lex + EGFR + und EGFR + Zellen von jungen (C) sortiert und im mittleren Alter (D) Fucci-Red-Mäuse ermöglicht die Verfolgung der G1-Phase mit rote Fluoreszenz, während die SG 2 / M-Phasen kann abgeleitet werden, when die rote Fluoreszenz erlischt. Aufeinanderfolgende Bilder mit einer im D vorgestellt Zeitskala dargestellt. (E) Repräsentative Bilder der Kolonien (Neurosphären) erhaltenen 5 Tage nach dem Ausplattieren. Maßstab:. 10 & mgr; m (C, D), 30 um (E) Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
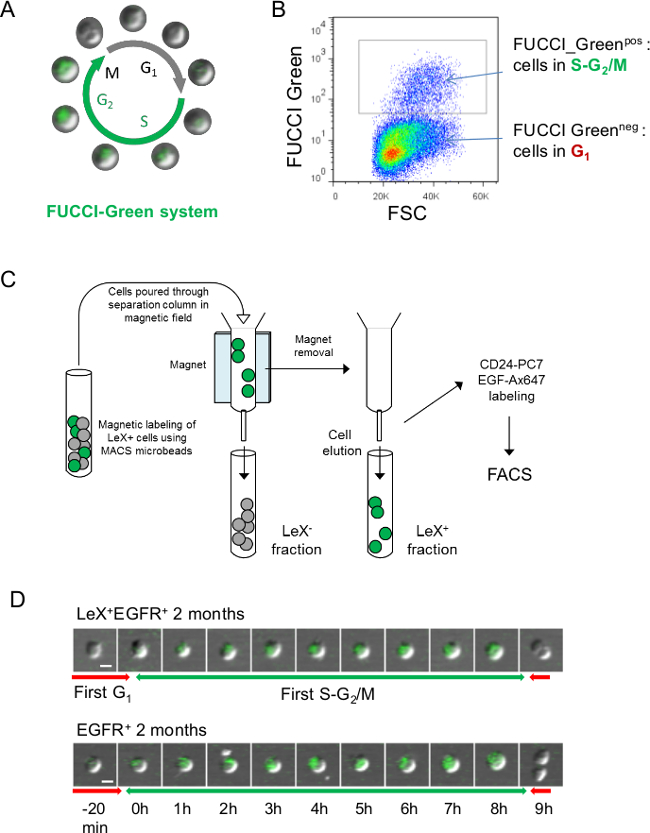
Abbildung 3:.. Strategie für die Live-Analyse von Zellzyklus mit Fucci-Grün-Mäusen (A) Schematische Darstellung der Fucci-Grün Zellzyklus, wo Zellen sind während SG grüne 2 / M-Phase und farblos während G 1-Phase 23 (B) FACS-Darstellung von Fucci-Grün-Fluoreszenz: Fucci-Grün neg Zellen stellen die Zellen in G1-Phase des Zellzyklus während Fucci-Green pos Zellen sind Zellen in SG 2 / M 23. (C) Um dem grün fluoreszierenden SG folgen 2 / M Phasen LeX + EGFR + und EGFR + Zellen, hatte SVZ Zellen vorsortiert werden mit Trennsäulen. Zellen wurden mit Anti-Maus-Antikörper und LeX LeX + Fraktion wurde auf der Säule unter Verwendung von Anti-Maus-Mikrokügelchen erhalten markiert (siehe Protokoll 4.). Dann LeX + Lex - Fraktionen wurden eluiert und mit EGF-Ax647 und CD24-PC7 Antikörper für FACS-Sortierung (d) gekennzeichneten Videomikroskopie des LeX + EGFR + und EGFR + -Zellen aus jungen Fucci-Grün Mäusen sortiert ermöglicht die Nachführung. die SG 2 / M-Phasen mit grünen Fluoreszenz. Aufeinanderfolgende Bilder werden mit einem in D präsentiert Zeitskala dargestellt. Maßstab: 10 & mgr; m (D).
Diskussion
Die hierin beschriebenen Zellsortiertechnik erlaubt eine sichere Unterscheidung zwischen Ruhe NSC, Aktiv NSC und deren Nachkommen ermöglicht Untersuchungen ihrer Eigenschaften und Dynamik im erwachsenen Gehirn 9. Mit der Fucci Technologie, die die Visualisierung der Zellzyklus-Progression in lebenden Zellen 23 erlaubt gekoppelt entwickelten wir eine schnelle und effiziente Technik, um die G 1 und SG 2 / M-Phasen des Zellzyklus von der jungen erwachsenen und alten Mausgehirnzellen folgen.
Die Zellsortiertechnik in diesem Protokoll verwendet das erste validiert Kombination von Markern ermöglicht die Reinigung der fünf Haupt neurogener Populationen vom SVZ 9. Es war auch das erste validierte Methode ermöglicht die Unterscheidung von ruhenden und aktivierten NSCs. Es ist bemerkenswert, dass diese Technik nicht die Verwendung von transgenen Mäusen, per se, die, wenn transgene Mausmodelle so angepasst ist notwendig erfordernch als Fucci. Seitdem Codega et al. 10 eine GFAP-GFP / CD133 / EGFR triple Kennzeichnung Kombination zur Ruhe NSC aus ihrer aktivierten Gegenstück zu unterscheiden, aber es kann nicht auf Fucci Technik angepasst werden, da es die Verwendung von GFAP-GFP-transgenen Mäusen benötigt. Mich et al. 11 haben eine Glast / EGFR / CD24 Dreifachmarkierungsstrategie, die gemeinsamen Ergebnisse mit der Technik, die in dieser Studie verwendet 9 teilt entwickelt. In der Tat wurde eine hohe Korrelation zwischen LeX und Glast NSCs Marker bereits Daynac et al. Untersuchen 9. Jedoch wird die in der Mich et al. Verwendeten Technik Glast Antikörper gekoppelt Phycoerythrin und kann daher nicht mit dem Einsatz von Fucci-Red Mäuse angepasst werden.
Es gibt mehrere wichtige technische Punkte, die Aufmerksamkeit erfordern vor dem Sortieren SVZ Zellen. Erstens ist der Dissoziationsschritt sehr wichtig, da das Hirngewebe hat, in einzelne Zellen dissoziiert werden und gleichzeitig die strukturelle inIntegrität der für die Antikörpermarkierung Strategie verwendeten Proteine. 0,05% Trypsin-EDTA hat sich gezeigt, als sehr wirksam bei distanziert SVZ Gewebe 27, aber der Lex-Antigen wurde festgestellt, hochempfindliche, wie fast alle LeX-FITC Immunfluoreszenz war verloren (Daten nicht gezeigt) sein. Somit wurde Papain verwendet, da es effizienter war und weniger destruktiv als andere Proteasen auf Hirngewebe. Darüber hinaus wurden weder LeX noch EGFR noch CD24 durch Papain-Behandlung nicht beeinflusst. Es sei darauf hingewiesen, dass die Antikörpermarkierung wurde verändert, wenn die Papain-Behandlung mehr als 15 min betragen. Wir erhalten ein optimales Ergebnis mit einem 10 min Papain-Behandlung mit einem mechanischen Dissoziation (Pipette nach oben und unten 20-mal) zugeordnet ist.
Die Poly-D-Lysin-Beschichtung ermöglicht adhärente Zellen und die Bildung von Kolonien nach mehreren Tagen in Kultur. Es ist jetzt allgemein akzeptiert, dass in vitro-Tests wird mit ihren Begrenzungen 28,29. Wir empfehlen die Bestimmung nur den ersten Zellzyklus fürdie Zellen, die zumindest eine nachfolgende Teilung so nahe wie möglich an der in vivo Zell-Phänotyp zu bleiben.
Es ist bemerkenswert zu erwähnen, dass die Geminin (grüne Fluoreszenz) und Cdt1 (rote Fluoreszenz) Proteine verwendet, um die Fucci System 23 wurden zuvor gezeigt reichlich von neuralen Vorläuferzellen exprimiert werden während der frühen Neurogenese bei Mäusen 30 und in der Erwachsenenhirngewebe 9,25 entwerfen . Obwohl die mKO2-hCdt1 (30/120) Konstrukt wurde hauptsächlich in der vorliegenden Studie verwendet, die G1 Phase mit roter Fluoreszenz zu folgen, die Verwendung beider Konstrukte [mKO2-hCdt1 (30/120) und MAG-hGem (1/110) ] könnte in Betracht gezogen werden, um die Visualisierung der Hauptphasen des Zellzyklus (G 1 und SG 2 / M) sowie der G 1 / S-Übergang 23 zu ermöglichen. Der Hauptnachteil des Zweifarbenbilder ist die begrenzte kompatible Sätze von Fluoreszenz, die noch für die Markierung von Zellen verwendet werden kann. Eine Lösung ist die Verwendung separatiauf Säulen. ZB haben wir erfolgreich die CD24-positive Fraktion von Zellen unter Verwendung von Trennsäulen vor abgereicherte Zellsortierung und Live-Bildgebung verwendeten wir eine CD24-PE-Antikörper, die die gleiche Emissionswellenlänge als der Fucci-rote Fluoreszenz 25 geteilt.
Nur wenige Studien haben den Zellzyklus Länge der erwachsenen Maus SVZ Populationen untersucht. Die mit unseren Technik erhaltenen Gesamtzellzykluslänge in der Nähe des einen in vitro durch Costa et al. 21 geschätzt, aber wir waren zum ersten Mal, um die verschiedenen Zellzyklusphasen zu unterscheiden in der Lage. In einem in vivo-Untersuchung, Ponti et al. 22 verwendet den Einbau von Thymidin-Analoga, die Proliferation Dynamik der verschiedenen SVZ Zellpopulationen zu bestimmen. Allerdings konnte sie weder führen eine kontinuierliche Überwachung des Zellzyklus, noch verfolgen die Zellen an der Einzelzellebene. Dies könnte ein Problem sein, da es sich gezeigt, dass eine starke Heterogenität existiert witHin eine gegebene SVZ Zellpopulation 22,25. Wir beschreiben hier eine Alternative in vitro-Technik, einfach zu installieren, die die Live-Bildgebung der Zellzyklusphasen von verschiedenen Erwachsenen neurogene Bevölkerung bei einer Einzelzellebene ermöglicht.
Das Verständnis der Regulation des Zellzyklus der neuralen Stammzellen und Progenitoren vor eine Herausforderung für die Entwicklung neuer therapeutischer Ansätze im Zusammenhang mit der Alterung oder Hirnerkrankungen. Unser Protokoll kann somit über eine breite Palette von Anwendungen. Im Zusammenhang mit der Alterung, könnte diese Technik auch als nützlich erweisen, um die Auswirkungen des Alterns auf NSC Differenzierung zu verstehen. Tatsächlich ist es möglich, neurale Stammzellen / Vorläuferzellen Eingabe Differenzierung zu identifizieren, wie die roten Fluoreszenzintensität ist deutlich höher 26. Schließlich könnte es auch von Interesse sein, die kontinuierliche Echtzeit-Bildgebung bei einer Einzelzellebene zu nutzen, um die Zelle intrinsische und extrinsische Prozesse für die Linie pro verantwortlich studierenSchreiten der Erwachsenen NSCs.
Offenlegungen
The authors declare that they have no conflict of interest.
Danksagungen
Wir sind auf C Joubert, V Neuville, V Barroca, J Tilliet und alle Mitarbeiter von Tiereinrichtungen verschuldet; J Baijer und N Dechamps für Zellsortierung; O. Etienne für die technische Unterstützung, und A. Gouret für ihre administrative Unterstützung. Durchflusszytometrie und Zellsortierung wurden am IRCM Durchflusszytometrie Shared Resource durchgeführt, die von Geräten Zuschüsse von DIM-Stem-polig, INSERM, Fondation ARC und CEA etabliert. Diese Arbeit wurde durch Zuschüsse der Electricité de France (EDF) unterstützt. MD hat eine Gemeinschaft von La Ligue Contre le Cancer und LM von Region Ile-de-France (DIM Biotherapeutika). Marc-André Mouthon und François D. Boussin Anteil Co-Senior-Autorschaft.
Materialien
| Name | Company | Catalog Number | Comments |
| 96-well uncoated glass bottom culture plates | MatTek Corp. | P96G-1.5-5-F | |
| µ-Plates 96-well | Ibidi | 89626 | |
| Poly-D-Lysine | Millipore | A003E | |
| NeuroCult NSC Basal Medium | STEMCELL Technologies | 5700 | |
| NeuroCult NSC Proliferation Supplement | STEMCELL Technologies | 5701 | |
| Heparin | STEMCELL Technologies | 7980 | |
| EGF | Millipore | GF144 | |
| FGF-2 | Millipore | GF003 | |
| Papain | Worthington | LS003119 | |
| EBSS | Invitrogen | 24010-043 | |
| L-cysteine | Sigma | C-7352 | |
| 0.5M EDTA, pH 8.0 | Promega | V4231 | |
| DNase I | Sigma | D5025-15KU | |
| Trypsin inhibitor type II | Sigma | T9128 | Ovomucoid |
| DMEM:F12 medium | Life Technologies | 31330-038 | |
| 20 µm filter | BD Medimachine Filcon | 340622 | |
| Eppendorf microtubes 3810X | Sigma | Z606340-1000EA | |
| BSA | Sigma | A1595 | Bovine serum albumin solution |
| CD24 phycoerythrin-cyanine7 conjugate [PC7] | Life Technologies | A14776 | Mouse IgM; clone MMA. 1:50 |
| CD15/LeX fluorescein isothiocyanate [FITC] - conjugated | BD Biosciences | 332778 | Rat IgG2b; clone M1/69. 1:50 |
| Mouse anti-human LeX antibody | BD Pharmingen | 559045 | Mouse IgM; clone MAM. 1:50 |
| Alexa647 - conjugated EGF ligand | Life Technologies | E35351 | 1:200; Ax647-conjugated EGF ligand in the text |
| CompBeads | BD Biosciences | 644204 | |
| MACS LS separation columns | Miltenyi Biotec | 130-042-401 | separation columns (in the manuscript) |
| Anti-mouse IgM microbeads | Miltenyi Biotec | 130-047-301 | |
| Hoechst 33258 | Sigma | 861405 | HO (in the manuscript) |
| INFLUX cell sorter | BD Biosciences | FACS sorter (in the text) | |
| Nikon A1R confocal laser scanning microscope system attached to an inverted ECLIPSE Ti | Nikon Corp. | confocal laser scanning microscope (in the manuscript) | |
| NIS-Elements AR.4.13.01 64-bit software | Nikon Corp. | NIS-Elements software (in the manuscript) | |
| Plan Apo VC 20x DIC objective (NA: 0.75) | Nikon Corp. | ||
| ECLIPSE Ti thermostated chamber | Nikon Corp. | thermostated chamber (in the manuscript) | |
| ImageJ | RBS | ||
| FlowJo | Tree Star, Ashland, OR | ||
| FUCCI mice | RIKEN BioResource Center, JAPAN | Sakaue-Sawano et al. 2008 |
Referenzen
- Morshead, C. M., et al. Neural stem cells in the adult mammalian forebrain a relatively quiescent subpopulation of subependymal cells. Neuron. 13, 1071-1082 (1994).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci USA. 106, 6387-6392 (2009).
- Doetsch, F., Caille, I., Lim, D. A., Garcia Verdugo, J. M., Alvarez Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97, 703-716 (1999).
- Kriegstein, A., Alvarez Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Lois, C., Garcia Verdugo, J. M., Alvarez Buylla, A. Chain migration of neuronal precursors. Science. 271, 978-981 (1996).
- Fuentealba, L. C., Obernier, K., Alvarez Buylla, A. Adult neural stem cells bridge their niche. Cell stem cell. 10, 698-708 (2012).
- Rietze, R. L., et al. Purification of a pluripotent neural stem cell from the adult mouse brain. Nature. 412, 736-739 (2001).
- Fischer, J., et al. Prospective isolation of adult neural stem cells from the mouse subependymal zone. Nat Protoc. 6, 1981-1989 (2011).
- Daynac, M., et al. Quiescent neural stem cells exit dormancy upon alteration of GABAAR signaling following radiation damage. Stem Cell Res. 11, 516-528 (2013).
- Codega, P., et al. Prospective identification and purification of quiescent adult neural stem cells from their in vivo niche. Neuron. 82, 545-559 (2014).
- Mich, J. K., et al. Prospective identification of functionally distinct stem cells and neurosphere-initiating cells in adult mouse forebrain. Elife. 3, e02669 (2014).
- Capela, A., Temple, S. LeX ssea 1 is expressed by adult mouse CNS stem cells identifying them as nonependymal. Neuron. 35, 865-875 (2002).
- Calaora, V., Chazal, G., Nielsen, P. J., Rougon, G., Moreau, H. mCD24 expression in the developing mouse brain and in zones of secondary neurogenesis in the adult. Neuroscience. 73, 581-594 (1996).
- Pineda, J. R., et al. Vascular derived TGF-beta increases in the stem cell niche and perturbs neurogenesis during aging and following irradiation in the adult mouse brain. EMBO Mol Med. 5, 548-562 (2013).
- Lugert, S., et al. Quiescent and active hippocampal neural stem cells with distinct morphologies respond selectively to physiological and pathological stimuli and aging. Cell stem cell. 6, 445-456 (2010).
- Blackmore, D. G., Golmohammadi, M. G., Large, B., Waters, M. J., Rietze, R. L. Exercise increases neural stem cell number in a growth hormone dependent manner augmenting the regenerative response in aged mice. Stem cells. 27, 2044-2052 (2009).
- Bouab, M., Paliouras, G. N., Aumont, A., Forest Berard, K., Fernandes, K. J. Aging of the subventricular zone neural stem cell niche evidence for quiescence associated changes between early and mid adulthood. Neuroscience. 173, 135-149 (2011).
- Enwere, E., et al. Aging results in reduced epidermal growth factor receptor signaling diminished olfactory neurogenesis and deficits in fine olfactory discrimination. The Journal of neuroscience the official journal of the Society for Neuroscience. 24, 8354-8365 (2004).
- Maslov, A. Y., Barone, T. A., Plunkett, R. J., Pruitt, S. C. Neural stem cell detection characterization and age related changes in the subventricular zone of mice. The Journal of neuroscience the official journal of the Society for Neuroscience. 24, 1726-1733 (2004).
- Tropepe, V., Craig, C. G., Morshead, C. M., van der Kooy, D. Transforming growth factor alpha null and senescent mice show decreased neural progenitor cell proliferation in the forebrain subependyma. The Journal of neuroscience the official journal of the Society for Neuroscience. 17, 7850-7859 (1997).
- Costa, M. R., et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138, 1057-1068 (2011).
- Ponti, G., et al. Cell cycle and lineage progression of neural progenitors in the ventricular-subventricular zones of adult mice. Proc Natl Acad Sci U S A. 110, 1045-1054 (2013).
- Sakaue Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell cycle progression. Cell. 132, 487-498 (2008).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of visualized experiments JoVE. , (2010).
- Daynac, M., et al. TGFbeta lengthens the G1 phase of stem cells in aged mouse brain. Stem cells. 32, 3257-3265 (2014).
- Roccio, M., et al. Predicting stem cell fate changes by differential cell cycle progression patterns. Development. 140, 459-470 (2013).
- Walker, T. L., Kempermann, G. One mouse two cultures isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of visualized experiments JoVE. , e51225 (2014).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres re evaluating the relationship. Nat Methods. 2, 333-336 (2005).
- Pastrana, E., Silva Vargas, V., Doetsch, F. Eyes wide open a critical review of sphere formation as an assay for stem cells. Cell stem cell. 8, 486-498 (2011).
- Spella, M., et al. Licensing regulators Geminin and Cdt1 identify progenitor cells of the mouse CNS in a specific phase of the cell cycle. Neuroscience. 147, 373-387 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten