Method Article
Clasificación celular del Neuronales madre y progenitoras Las células del adulto Ratón zona subventricular y Live-imágenes de sus Dinámica del Ciclo Celular
* Estos autores han contribuido por igual
En este artículo
Resumen
We report a Fluorescent Activated Cell Sorting (FACS)-based method to isolate neural stem cells (NSCs) and their progeny from the subventricular zone (SVZ) of the adult mouse brain. Applied to Fluorescence Ubiquitination Cell Cycle Indicator (FUCCI) transgenic mice, it allows the study of cell cycle progression by live imaging.
Resumen
Las células madre neurales (NSC) en la zona subventricular de los ventrículos laterales (SVZ) sostienen neurogénesis olfativa durante toda la vida en el cerebro de los mamíferos. Generan sucesivamente células tránsito amplificar (TAC) y neuroblastos que se diferencian en neuronas, una vez que se integran los bulbos olfatorios. Emergiendo de células activadas por fluorescencia (FACS) técnicas han permitido el aislamiento de NSCs, así como sus descendientes y han comenzado a arrojar luz sobre las redes de regulación de genes en nichos neurogénicos adultos. Presentamos aquí una técnica de clasificación de células que permite seguir y distinguir la dinámica del ciclo celular de las poblaciones de células antes mencionadas de la SVZ adulto con una LeX / EGFR / CD24 de triple tinción. Las células aisladas se sembraron como células adherentes para explorar en detalle la progresión del ciclo celular por el vídeo time-lapse microscopía. Con este fin, utilizamos transgénico fluorescencia Ubiquitination Indicador del ciclo celular (FUCCI) ratones en los que las células son de color rojo fluorescente During G 1 fase debido a un reportero de color rojo-Cdt1 específica G 1. Este método ha revelado recientemente que NSCs proliferan alargan progresivamente su fase G 1 durante el envejecimiento, lo que lleva a un deterioro de la neurogénesis. Este método es fácilmente extrapolable a otros sistemas y podría ser de gran interés para el estudio de la dinámica del ciclo celular de las células cerebrales en el contexto de patologías cerebrales.
Introducción
Las células madre neurales (NSC) de reposo son la fuente de la neurogénesis adulta 1 y se pueden convertir en su proliferativa "activado" forma expresa los EGFR (aNSCs) 2. Una vez activado, que dan lugar a células de tránsito amplificar (TAC) 3 y luego neuroblastos que migran a los bulbos olfatorios (OB) a través de un tubo de astrocitos y, finalmente, se diferencian en neuronas 4,5. NSC y su progenie se organizan en "nichos" especializados arquitecturas lo largo de los ventrículos laterales, lo que implica una gran cantidad de factores que controlan su proliferación 6. El aislamiento y purificación de las células SVZ neurogénicos es necesaria para iluminar la compleja regulación molecular de su proliferación, pero han seguido siendo un reto para un largo tiempo debido a la falta de marcadores específicos y las técnicas adaptadas.
Nuevos enfoques utilizando citometría de flujo han hecho posible el aislamiento de NSC y their progenie del adulto SVZ 2,7-11. Con el marcador de células madre LeX 12 junto con neuroblast marcador CD24 13 y un EGF de fluorescencia para etiquetar EGFR en células proliferantes 2, recientemente hemos desarrollado una estrategia de FACS que permite la purificación de cinco de las principales poblaciones neurogénicos SVZ: quiescente y activado NSCs, TAC, inmaduros, así como la migración de los neuroblastos 9. A continuación, describimos los detalles en esta célula técnica de clasificación y cómo un LeX / EGFR / CD24 de triple tinción permitido por primera vez el aislamiento de ambos NSCs quiescentes y activados.
Aunque la neurogénesis persiste en la edad adulta, la producción de nuevas neuronas disminuye drásticamente en el envejecimiento cerebral 14. La mayoría de los estudios coinciden en una reducción progresiva del número de la proliferación de células progenitoras en la SGZ y SVZ 15-20. Las consecuencias no son inocuos como el declive relacionado con la edad en la neurogénesis en la SVZ provoca una disminución de nneuronas ewborn en los bulbos olfatorios del cerebro envejecido, en última instancia conduce a un deterioro en la discriminación olfativa en ratones de 18 años. Elucidar cinética del ciclo celular de progenitores neurales es un paso clave para entender los mecanismos subyacentes a la evolución de la neurogénesis adulta durante el envejecimiento. Estudios recientes han investigado el ciclo celular y la progresión del linaje de células madre neurales adultas in vitro 21 e in vivo 22, pero ninguno de ellos se aprovecharon de las técnicas de clasificación de células y sondas del ciclo celular fluorescentes codificadas genéticamente para visualizar las fases del ciclo celular de células aisladas a un nivel de una sola célula.
Aquí se describe un protocolo que se aprovecha de los ratones transgénicos en los que Fucci células son fluorescentes durante su ciclo celular, lo que permite la distinción entre G 1 y 2 SG / M fases 23. Este protocolo prospectivo muestra cómo el aislamiento de NSC y su progenie de adultos FUCCI mice combinado con microscopía de vídeo time-lapse permite el estudio de la dinámica del ciclo celular a nivel de una sola célula.
Protocolo
Este protocolo ha sido diseñado de acuerdo con las Comunidades Europeas Directiva del Consejo, de 24 de noviembre de 1986 (86/609 / CEE) y ha sido aprobado por nuestro bienestar animal comité institucional (CETEA-CEA DSV IDF).
1. Configuración básica Antes de la cultura y videomicroscopia
- Utilice vidrio placas de cultivo de fondo o mu-placas para microscopía confocal de vídeo. 1 - 5 x 10 3 células / así, utilizar placas de 96 pocillos y las placas de 24 pocillos durante más de 5 x 10 3 células / pocillo.
- Al menos un día antes de comenzar el experimento, preparar poli-D-lisina (PDL) estéril placas recubiertas para cultivos monocapa adherentes. Agregar suficiente PDL (10 mg / ml en dH2O) para cubrir el fondo de cada pocillo e incubar O / N a 37 ° C. Retire la solución PDL y enjuagar tres veces con dH2O antes de permitir que la placa se seque en la campana durante al menos 2 horas bajo un flujo laminar. Si no se utiliza inmediatamente, almacenar la placa recubierta en-20 ° C.
- Preparar medio de cultivo mediante la mezcla de NSC Basal Medium y NSC proliferación Suplemento en una relación 9: 1 (ver tabla de materiales), junto con 2 mg / ml de heparina, 20 ng / factor humano purificado ml de crecimiento epidérmico recombinante (EGF), y 10 ng / ml factor de crecimiento de fibroblastos humano recombinante 2 (FGF-2). Calentar el medio de cultivo a 37 ° C en un baño de agua antes de su uso.
- Para la disociación SVZ, preparar la solución de papaína: 1 mg / ml de papaína (15 UI / ml) en el equilibrio salino Solución de Earl (EBSS) que contenía 0,2 mg / ml de L-cisteína, 0,2 mg / ml de EDTA, y 0,01 mg / ml de DNasa I en PBS. Esterilizar la solución haciéndola pasar a través de un filtro de 0,2 micras. Equilibrar la solución a 37 ° C antes de su uso.
- Para detener la reacción enzimática, preparar una solución de inhibidor de proteasa (ovomucoide): medio F12 que contiene 0,7 mg / ml de tripsina inhibidor de tipo II: DMEM. Filtrar la solución usando un filtro de 0,2 micras.
- Preparar PBS 0,6% solución de glucosa para recoger los cerebros y PBS 0,15% de BSA sOLUCIÓN para los pasos de lavado y para la tinción de anticuerpos.
- Preparar herramientas de disección: tijeras, disección y atando unas pinzas, bisturí. Remojar en etanol al 70%.
2. La recolección de Adult ratón cerebros y SVZ microdisecciones
- Sacrificio adultos FUCCI ratones 23 (2 a 3 meses de edad y / o de 12 meses de edad, para el envejecimiento de estudios) la realización de una dislocación cervical de conformidad con las directrices institucionales apropiados.
- Rocíe el ratón usando el 70% de etanol y cortar la cabeza con unas tijeras afiladas.
- Hacer una incisión a lo largo del cuero cabelludo para revelar el cráneo.
- Realizar un corte en la línea media longitudinal a partir de la base del cráneo hacia los bulbos olfatorios utilizando un pequeño par de tijeras. Asegúrese de no dañar el cerebro subyacente con las hojas de las tijeras. Retire la parte abierta superior del cráneo con pinzas curvas para exponer el cerebro.
- Recoger el cerebro en una placa de Petri de 15 mm que contiene 0,6% de glucosa en PBS.
- Dissect distancia los bulbos olfatorios. Coloque el cerebro en su superficie dorsal y hacer una sección coronal a través del quiasma óptico utilizando un bisturí.
- Bajo un microscopio de disección, coloque la parte rostral de la sección del cerebro con la superficie coronal corte hacia arriba hacia el experimentador.
- Para diseccionar la SVZ, quitar el tabique con unas pinzas finas curvas a continuación, insertar un consejo de una multa con fórceps en el cuerpo estriado inmediatamente adyacente al ventrículo y separar la SVZ del tejido circundante. Para más detalles, consulte Azari et al. 24. Coloque la SVZ diseccionado en una placa de Petri que contiene 1 ml de PBS-0,6% de glucosa.
3. SVZ Tissue Disociación
- Picar la SVZ diseccionado en la placa de Petri hasta que no haya piezas grandes se mantienen.
- Transferir el tejido picado junto con el% de glucosa PBS-0,6 a un tubo de 15 ml y centrifugar a 200 xg durante 5 min.
- Descartar el sobrenadante y añadir 1 ml de papaína precalentado (1mg / ml, preparado en la etapa 1.4) suplementado con 0,01 mg / ml de DNasa I. Incubar durante 10 min en un baño de agua a 37 ° C. Utilice 1 ml de papaína por ratón.
- Centrifugar a 200 xg durante 5 min y descartar el sobrenadante.
- Añadir 1 ml de pre-calentado ovomucoide (0,7 mg / ml, preparado en el paso 1.5) para detener la actividad de la papaína. Mecánicamente disociar el tejido picado aún más en una suspensión de una sola célula pipeteando suavemente hacia arriba y hacia abajo 20 veces a través de una punta de la micropipeta p1000. Evite las burbujas de aire.
- Pasar la suspensión celular a través de un filtro de 20 micras estéril en un nuevo tubo de 15 ml. Asegúrese de lavar el filtro de células con PBS 0,15% BSA para evitar la pérdida de células.
- Centrifugar a 200 xg durante 10 min y descartar el sobrenadante. Vuelva a suspender las células en 100 l de PBS que contenía 0,15% de BSA.
4. La tinción de inmunofluorescencia para la clasificación de células
Para la clasificación celular usando-FUCCI Red ratones (Figura 2), utilice la siguienteanticuerpos CD24 conjugado con ficoeritrina:-cyanine7 [PC7]; CD15 / LeX isotiocianato de fluoresceína [FITC] conjugados y Ax647 ligando EGF conjugado.
Nota: Las células LeX + EGFR + y células EGFR + no son abundantes en la SVZ adultos: ≈ 600 y 1500 células / ratón, respectivamente 9. Se recomienda poner en común las células SVZ de 2 a 3 ratones para tener suficiente material. No trabaje con más de 12 ratones en el mismo día por lo que la duración de clasificación de células no exceda de 3 horas. Tenga en cuenta que el trabajo con demasiados ratones en el mismo día dará lugar a un aumento de la duración de la clasificación celular, posiblemente, lo que resulta en aumento de la muerte celular y / o diferenciación celular.
- Realice la tinción FACS en 100 l de PBS 0,15% de BSA por ratón (o en 200 l para un grupo de 2 a 3 ratones para la tinción óptima).
- Preparar los tubos de control. Utilice cuentas de compensación para preparar los tubos individuales de control de color de acuerdo con el fabricante9; s protocolo. Seleccionar una fracción de células (1/10 de las células extraídas de un ratón es suficiente) y separarlo en 4 tubos para preparar tubo 1 control negativo (células sin marcar) y 3 fluorescencia menos uno (FMO) tubos de control. Resuspender las células en 200 l de PBS 0,15% de BSA por tubo.
Sugerencia: Para un control LEX-FITC FMO, etiquetar las células con CD24-PC7 (1:50) y el ligando EGF Ax647 conjugado (1: 200); para el control de CD24-PC7 FMO, etiquetar las células con CD15 / LEX-FITC (1:50) y Ax647 conjugado ligando EGF (1: 200) y para conjugado Ax647 control de FMO ligando EGF, etiquetar las células con CD15 / LEX FITC (1:50) y CD24-PC7 (01:50). - Para los tubos utilizados para la clasificación de células, utilice los siguientes anticuerpos a la dilución indicada en PBS 0,15% de BSA: CD24-PC7 (01:50), CD15 / LEX-FITC (1:50) y el ligando EGF Ax647 conjugado (1: 200).
- Incubar durante 20 min a 4 ° C en la oscuridad. Lavar con 1 ml de PBS 0,15% de BSA y centrifugar a 200 xg durante 10 min. Resuspender las células en 20081; l de PBS 0,15% BSA por cerebro. Mantenga los tubos de clasificación de células en hielo y proceder de inmediato a la clasificación de células.
- Si el uso de ratones FUCCI-Verdes, fracciones LEX-positivas y Lex-negativas separadas utilizando columnas de separación antes de clasificación de células como las acciones de anticuerpos LEX-FITC la misma longitud de onda de emisión de la fluorescencia FUCCI-verde (Figura 3A, B).
- En primer lugar, etiquetar las células con un ratón LEX-anticuerpo anti-humano (1:50) durante 15 minutos a 4 ° C en la oscuridad en 100 l de PBS 0,15% de BSA.
- Lavar las células con 1 ml de PBS 0,15% de BSA y centrifugar a 200 xg durante 10 min, a continuación, marcar las células con microperlas de IgM anti-ratón (1:10) durante 15 minutos a 4 ° C en la oscuridad.
- Lavar las células con 1 ml de PBS 0,15% de BSA y centrifugar a 200 xg durante 10 min. Resuspender las células en 500 l de PBS 0,15% de BSA y se vierte a través de las células de la columna de separación en el campo magnético como se esquematiza en la Figura 3 C. Lavar la columna con 1 ml de PBS 0,15% BSA para obtener la fracción negativa LeX.
- Para obtener fracción LEX-positivo, retire la columna de separación del campo magnético y eluir las células con 2 ml de PBS 0,15% de BSA.
- Proceda a las manchas ligando EGF CD24-PC7 y Ax647 conjugado como se indica en 4.2.
5. Cell Sorting
Nota: Las células fueron ordenados en un clasificador FACS a 40 psi con un 86 micras noozle. La fluorescencia se recogió mediante el siguiente conjunto de filtro: 520/35 nm (FITC), 575 / 26nm (PE), 670 / 20nm (Ax647) y 740LP (PC7). La compensación es necesaria para evitar que las señales de falsos positivos como una superposición se encuentra entre los espectros de emisión de la fluorescencia FUCCI rojo y el tinte PC7.
- Inmediatamente antes de la clasificación de células, añadir un colorante vital para discriminar en vivo de las células muertas. Utilizamos HO (ver tabla de materiales) a / ml de concentración final de 2 mg. Ejecute el tubo de control negativo (células no marcadas) a través del clasificador FACS y seleccione ªcélulas correos utilizando dispersión lateral (SSC) y la dispersión frontal (FSC) parámetros (Figura 1A).
NOTA: Las células muertas se excluyeron por gating sólo la fracción HO-negativo (Figura 1A ') y luego dobletes fueron excluidos por la selección de la fracción de ancho de pulso negativo (Figura 1A' '). - Ejecutar los controles individuales de color preparados en la etapa 4.2 y ajustar el tubo fotomultiplicador (PMT) tensiones (es decir, células escala población negativa demasiado alta y / o positivos off) si es necesario. Realizar compensación de color en la ventana de compensación del software.
- Ejecutar FMO controla preparado en el paso 4.2 (control LEX-FITC FMO, CD24-PC7 control de FMO y Ax647 conjugado de control FMO ligando EGF) y dibujar las puertas de clasificación (Figura 1). Ordenar las células directamente en 100 l de medio de cultivo en microtubos de 1,5 ml.
6. Preparación de las células para microscopía
- Placa de la célula recién ordenadoss a una densidad de 1 - 3 x 10 3 células / pocillo en poli-D-Lisina recubiertas de 96 pocillos μ-Plate con 300 l de medio de cultivo.
- Antes de la microscopía de video, se incuban las placas de cultivo a 37 ° C y 5% de CO 2 al menos por 1 hora para permitir la adhesión celular.
Configuración 7. Microscopio y Adquisición de imágenes
- Realizar imágenes en vivo usando un objetivo del Plan Apo VC 20x DIC (NA: 0.75) en un sistema de microscopio de barrido láser confocal conectado a una cámara con termostato invertida a 37 ° C en 5% de CO 2 atmósfera.
- Coloque el 96 pocillos μ-Placa interior de la cámara con termostato precalentado y se equilibró y reemplace la tapa por una cubierta con termostato.
- Abra el software de NIS-Elements y haga clic en la barra de menú en "Adquirir / Adquisición controla / ND adquisición" para seleccionar las opciones del time-lapse (longitud, posiciones de la etapa, z secciones confocal, ...), "Adquirir controles / Adquisición / Ti Pad221; para seleccionar los objetivos y "Adquirir / controles de adquisición / A1plus Configuración" para seleccionar el nivel de PMT para cada fluorescencia en la barra de menú. Seleccione una carpeta para guardar los archivos de datos.
- Uso de la ventana de adquisición ND, establezca el centro de cada uno, así como una posición escenario y seleccione la opción de imagen de gran tamaño de 7 x 7 mm ². Esto creará una imagen de mosaico alrededor del centro de cada pocillo. Ajuste el solapamiento de la gran imagen de mosaico y el 5%. Hacer fotos cada 20 minutos durante 24 horas. Seleccione el objetivo del Plan Apo VC 20x DIC (NA: 0,75) en la ventana de Ti Pad.
- En la ventana A1plus Configuración, adquirir imágenes utilizando el escáner de resonancia de alta velocidad en un formato de 512 x 512 píxeles con una resolución de 1,26 m / pixel. Use campo claro de visualizar formas celulares. En el caso de los ratones FUCCI-Rojas, excitar la fluorescencia roja de 561 nm y recoger usando un 595/50 nm filtro. En el caso de los ratones FUCCI-Green, excitar la fluorescencia verde a 488 nm y recoger usando un 530/40 nm filtro. Determinar la PM óptimaNivel T, offset y la potencia del láser para cada longitud de onda.
NOTA: Recomendamos el uso de la función de enfoque automático para el canal de campo claro para que el software para el enfoque automático en cada posición de la etapa antes de cada adquisición. Sugerencia: Un Plan Apo VC 20x objetivo DIC (NA: 0,75) fue utilizado por su excelente resolución, sin necesidad de aceite. Otros objetivos pueden ser utilizados dependiendo de la resolución óptica deseada. - Seleccione el botón "Ejecutar ahora" en la ventana de adquisición ND para empezar adquisición.
Sugerencia: Siga el equipo de trabajo de 1 lazo para asegurarse de que todo en el trabajo correctamente.
8. Procesamiento y Análisis de Imágenes
- Analizar los datos directamente en el software de NIS-Elements mediante el seguimiento de las células de forma individual. Sugerencia: Para ganar tiempo, ahorrar cada posición en formato .avi utilizando software NIS-Elements y analizar las películas con ImageJ.
- En el software ImageJ, realizar un seguimiento de las células individuales se someten a por lo menos 2 divisiones (es decir, una célula auna colonia de cuatro celdas). Recortar una pequeña área alrededor de la celda y seleccione 'Imagen / Duplicar'.
- Seleccione "Imagen / Pilas / Hacer Montage 'en la barra de menú para hacer un montaje. Especifique los marcos que se incluirán, el tamaño de las imágenes y guardar el montaje como un archivo .tif de resolución óptima.
- Para el cálculo de la primera SG 2 / M fase de longitud (Figura 2 C, D), seleccione una sola célula fluorescente roja (en G 1) y luego ponga t = 0 (fase S se iniciará una vez que la fluorescencia roja se apaga). Contar el número de fotogramas hasta que la célula se divide para estimar la longitud SG 2 / M.
NOTA: El tiempo calculado depende del intervalo de tiempo entre cada fotograma. - Para calcular la siguiente fase G1 (Figura 2C, D), continúe para realizar un seguimiento de la célula que simplemente dividido. Si la célula dividida entra en la fase G1, habrá una acumulación de la proteína fluorescente de color rojo-Cdt1. Calcular el número de fotogramas hasta rojo-fluorescencia se apaga agaen para cada celda.
Sugerencia: Al comienzo de G 1 la fluorescencia roja podría ser débil así que elige el inicio de la fase G 1 en el marco donde la célula se ha dividido para evitar aproximaciones.
Resultados
La capacidad de discriminar de manera fiable entre las diferentes poblaciones celulares del ratón adulto linaje de células madre SVZ es primordial para investigar sus propiedades funcionales. Para tal fin, se ha desarrollado un CD24 estrategia LeX / EGFR / etiquetado triple de lo que permite la purificación de poblaciones específicas de células de la SVZ adultos: NSCs quiescentes (LEX brillantes), NSCs activados (LEX + EGFR +), TAC (EGFR +) , neuroblastos inmaduros y migratorias (CD24 + CD24 + y EGFR +, respectivamente) 9 (Figura 1). Aplicado a ratones transgénicos Fucci, la clasificación de células técnica permite la formación de imágenes en vivo de las fases del ciclo celular de las diferentes poblaciones neurogénicos a nivel de una sola célula 25. Ratones FUCCI-rojas se utilizan para seguir la fase G 1 con fluorescencia roja utilizando time-lapse de video microscopia (Figura 2). Células neg FUCCI-rojas representan las células en SG 2 / M fases del ciclo celular, las células pos FUCCI-rojos son células G 1 y células brillantes FUCCI-rojos son células que salen o fuera del ciclo celular (Figura 2B) 23,26. LeX + EGFR + y EGFR + células de adulto joven (Figura 2C) y los ratones de mediana edad (Figura 2D) se sembraron como células adherentes en placas de cultivo revestidas con poli-D-lisina. La primera fase de SG 2 / M fue identificado en las células individuales una vez que la fluorescencia roja se apaga hasta que la célula se divide. Como ya se observó la SG longitud 2 / M fase no mostró diferencias entre LeX + EGFR + y células EGFR +, ya sea en ratones jóvenes o de mediana edad. Luego se calculó la longitud siguiente fase G 1 de la primera división hasta que la fluorescencia roja se apaga. Curiosamente, una fase de alargamiento G 1 se encontró durante el envejecimiento en células LeX + EGFR + pero noen EGFR + células 25 (Figura 2 C, D). En consecuencia, neuroesferas obtuvieron 5 días después de la siembra son más pequeñas en las células LeX + EGFR + obtenidas de ratones de edad como se muestra en la Figura 2E.
FUCCI-Green ratones también se puede utilizar para visualizar el SG fase 2 / M con fluorescencia verde (Figura 3A, B), pero las células tienen que ser pre-ordenados usando columnas de separación como anticuerpo LEX-FITC comparte la misma longitud de onda de emisión que el FUCCI- fluorescencia verde (Figura 3C). Un ejemplo de la fluorescencia FUCCI-verde para la primera fase de SG 2 / M de adulto joven LeX + EGFR + y células EGFR + se muestra en la figura 3D.
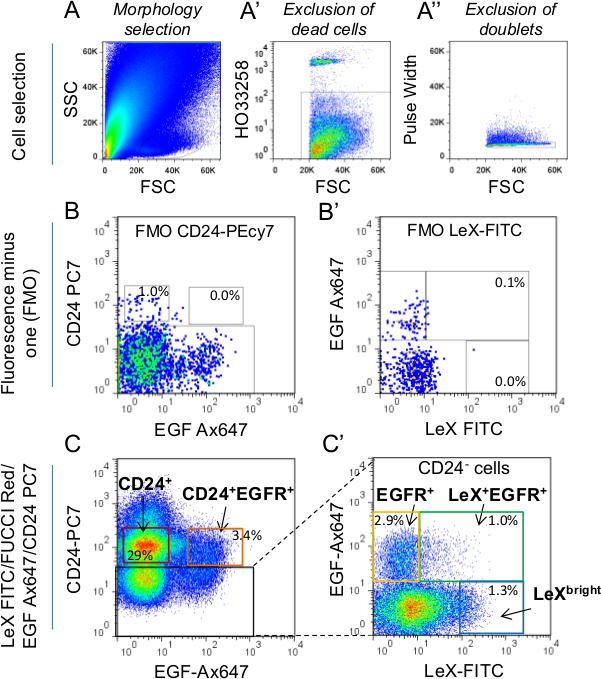
Figura 1:. Estrategia de la selección celular por FACS Las células (A) se seleccionaron primero de acuerdo con tmorfología heredero utilizando dispersión lateral (SSC) vs dispersión frontal parámetros (FSC). Para más detalles sobre la selección puerta morfología, se refieren a Daynac et al. 9 (a ') Las células muertas fueron etiquetados utilizando HO marcador y excluidos de la selección. (A' ') dobletes fueron excluidos con el parámetro de ancho de pulso. (Etiquetado LEX-FITC / FUCCI-Rojo / EGF-Ax647; B) Con el fin de establecer la clasificación de puertas, Fluorescencia menos uno (FMO) controla para CD24-PC7 y Lex-FITC (FUCCI-Rojo / EGF-Ax647 / CD24 'fueron utilizados) (C, C'. B) A continuación, puertas de clasificación se determinaron en LEX-FITC / FUCCI-Rojo / EGF-Ax647 / CD24-PC7 tubos etiquetados, junto con los controles de FMO; etiquetado -PC7. Los porcentajes medios de células totales se representan dentro de las puertas. Si la selección de CD24 + células (neuroblastos), tenga cuidado de excluir a las células que expresan CD24 brillantes de la puerta. De hecho, CD24 corresponden brillante para ce ependimarialls 2,9. C "representa las células CD24 negativas (cuadrados negro en C). Sólo LeX + EGFR + y EGFR + (C ') puertas de clasificación se utilizaron para este estudio.
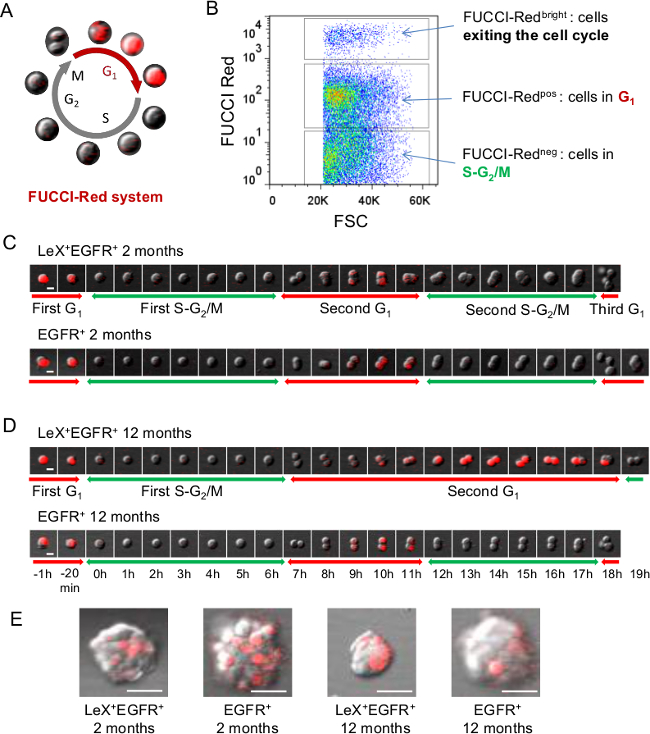
Figura 2: análisis directo del ciclo celular utilizando ratones FUCCI-Rojas (A) Representación esquemática del ciclo celular FUCCI-Rojo, donde las células son de color rojo fluorescente durante la fase G1 y sin color durante SG 2 / M fases 23 representación (B) FACS de.. fluorescencia FUCCI-Rojo en células SVZ. (C, D) microscopía de vídeo con LeX + EGFR + y EGFR + células ordenados desde joven (C) y de mediana edad (D) los ratones FUCCI-Red permite el seguimiento de la fase G 1 con fluorescencia roja mientras que la SG 2 / M fases pueden deducirse cuando planeesn la fluorescencia roja se apaga. Imágenes sucesivas se muestran con una escala de tiempo se presenta en D. (E) Imágenes representativas de colonias (neuroesferas) obtenidas de 5 días después de la siembra. Barra de escala:. 10 micras (C, D), 30μm (E) Haga clic aquí para ver una versión más grande de esta figura.
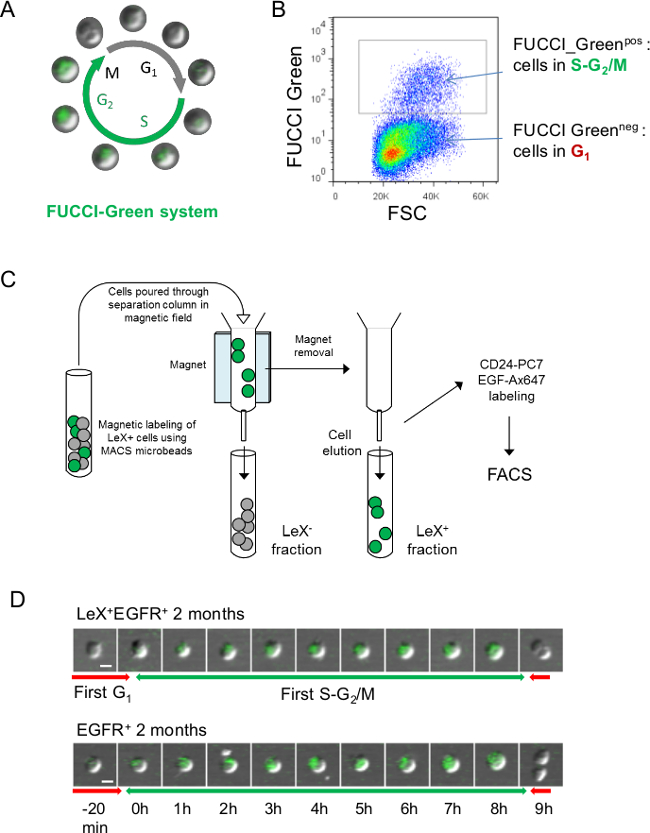
Figura 3:.. Estrategia para el análisis directo de ciclo celular utilizando ratones FUCCI-verde (A) Representación esquemática del ciclo celular FUCCI-Verde donde las células son de color verde durante SG 2 / M fase y sin color durante la fase G 1 23 (B) Representación FACS de la fluorescencia FUCCI-Verde: células neg FUCCI-verdes representan las células en la fase G1 del ciclo celular mientras FUCCI-Green células pos son células en SG 2 / M 23. (C) Con el fin de seguir el SG-verde fluorescente 2 / M fases de LeX + EGFR + y células EGFR +, células SVZ tuvieron que ser pre-ordenado con columnas de separación. Las células se marcaron con anticuerpo anti-ratón de LEX y fracción LeX + se retuvo en la columna usando microperlas anti-ratón (véase el protocolo 4.). Entonces, Lex + y Lex - fracciones se eluyeron y se marcaron con anticuerpos CD24-PC7 para FACS clasificación EGF-Ax647 y (D) la microscopía de vídeo de LeX + EGFR + y EGFR + células ordenados desde jóvenes ratones FUCCI-Green permite el seguimiento de. la SG 2 / M fases con fluorescencia verde. Imágenes sucesivas se muestran con una escala de tiempo se presenta en D. Barra de escala: 10 mm (D).
Discusión
La técnica de clasificación celular descrito en este documento permite la discriminación fiable entre NSCs reposo, NSCs activados y sus estudios progenie permitiendo de sus propiedades y la dinámica en el cerebro adulto 9. Junto con la tecnología FUCCI que permite la visualización de la progresión del ciclo celular en las células vivas 23, hemos desarrollado una técnica rápida y eficiente para seguir las fases G 1 y 2 SG / M del ciclo celular a partir de células de cerebro de ratón adulto joven y de edad.
La técnica de clasificación de células utilizadas en este protocolo fue la primera combinación validado de marcadores que permiten la purificación de los cinco principales poblaciones neurogénica de la SVZ 9. También fue la primera técnica validada que permite la distinción de NSCs en reposo y activadas. Es de destacar que esta técnica no requiere el uso de ratones transgénicos per se, que es necesaria cuando se adapta a modelos de ratones transgénicos such como FUCCI. Desde entonces, Codega et al. 10 han utilizado una combinación triple etiquetado GFAP-GFP / CD133 / EGFR distinguir NSCs reposo de su contraparte activada pero no se puede adaptar a la tecnología FUCCI ya que requiere el uso de ratones transgénicos GFAP-GFP. Mich et al. 11 han desarrollado un / EGFR / CD24 estrategia de etiquetado de triple Glast que comparte resultados comunes con la técnica utilizada en este estudio 9. De hecho, una alta correlación entre LeX y marcadores Glast NSC ya se observó en Daynac et al. Estudio 9. Sin embargo, el anticuerpo Glast utilizado en la técnica Mich et al. Está acoplado a ficoeritrina y por lo tanto no se puede adaptar con el uso de ratones FUCCI-RED.
Hay varios puntos técnicos importantes que requieren atención antes de la clasificación células SVZ. En primer lugar, la etapa de disociación es muy importante como el tejido cerebral tiene que ser disociado en células individuales preservando al mismo tiempo la estructural enintegridad de las proteínas utilizadas para la estrategia de etiquetado de anticuerpos. 0,05% de tripsina-EDTA ha demostrado ser muy eficaz en la SVZ disociar el tejido 27, pero el antígeno LeX se encontró que era altamente sensible como casi todos LEX-FITC inmunofluorescencia fue perdido (datos no mostrados). Por lo tanto, se usó papaína ya que era más eficiente y menos destructivo que otras proteasas en el tejido cerebral. Además, ni LeX ni EGFR ni CD24 se vieron afectados por el tratamiento papaína. Cabe señalar que el etiquetado de anticuerpos fue alterado si el tratamiento papaína superó 15 min. Se obtuvieron resultados óptimos con un tratamiento de la papaína 10 min asociado a una disociación mecánica (pipeta arriba y abajo de 20 veces).
El recubrimiento con poli-D-lisina permite cultivo de células adherentes y la formación de colonias después de varios días en cultivo. Ahora es ampliamente aceptado que en ensayos in vitro viene con sus limitaciones 28,29. Le recomendamos determinar sólo el primer ciclo celular paralas células se someten a por lo menos una división posterior permanecer lo más cerca posible del fenotipo de células en vivo.
Vale la pena mencionar que las proteínas geminin (fluorescencia verde) y Cdt1 (fluorescencia roja) utilizados para diseñar el sistema FUCCI 23 fueron previamente demostrado ser expresado abundantemente por progenitores neurales durante la neurogénesis temprana en ratones 30 y en el cerebro adulto tejidos 9,25 . Aunque el mKO2-hCdt1 (30/120) construcción se utiliza principalmente en el presente estudio para seguir la fase G1 con fluorescencia roja, el uso de ambas construcciones [mKO2-hCdt1 (30/120) y MAG-hGem (1/110) ] podría ser previsto para permitir la visualización de las fases principales del ciclo celular (G 1 y SG 2 / M) así como el G 1 / S transición 23. El principal inconveniente de la proyección de imagen de dos colores es los limitados conjuntos compatibles de fluorescencia que todavía pueden utilizarse para el etiquetado de la célula. Una solución es utilizar separatien columnas. Por ejemplo, hemos agotado con éxito la fracción CD24-positivo de células por medio de columnas de separación antes de la clasificación celular y vivir de imágenes ya que utilizamos un anticuerpo CD24-PE que compartió la misma longitud de onda de emisión de la fluorescencia FUCCI-Red 25.
Pocos estudios han investigado la duración del ciclo celular de las poblaciones SVZ ratón adulto. La duración del ciclo celular total obtenido con nuestra técnica está cerca de la estimada in vitro por Costa et al. 21, pero hemos sido capaces por primera vez de distinguir las diferentes fases del ciclo celular. En un estudio in vivo, Ponti et al. 22 utiliza la incorporación de análogos de timidina para determinar la dinámica de proliferación de las diferentes poblaciones celulares SVZ. Sin embargo, no podían ni realizar una monitorización continua del ciclo celular ni realizar un seguimiento de las células a nivel de una sola célula. Esto podría ser un problema, ya que se demostró que una fuerte heterogeneidad existe ingeniohin una población celular SVZ dada 22,25. Se describe aquí una alternativa en la técnica in vitro, fácil de instalar, que permite la formación de imágenes en directo de las fases del ciclo celular de las poblaciones neurogénicos diferente adultos a nivel de una sola célula.
La comprensión de la regulación del ciclo celular de las células madre neuronales y progenitores sigue siendo un reto para el desarrollo de nuevos enfoques terapéuticos en el contexto del envejecimiento o cerebrales patologías. Nuestro protocolo puede pues tener una amplia gama de aplicaciones. En el contexto del envejecimiento, esta técnica también podría ser útil para comprender los efectos del envejecimiento en NSCs diferenciación. De hecho, es posible identificar las células madre / progenitoras neurales que entran en la diferenciación como su intensidad fluorescente roja es claramente más alto 26. Por último, también podría ser de interés para explotar la formación de imágenes en vivo continua a un nivel de célula única para estudiar la célula procesos intrínsecos y extrínsecos responsables de la pro linajeprogresión de NSCs adultas.
Divulgaciones
The authors declare that they have no conflict of interest.
Agradecimientos
Estamos en deuda con C Joubert, V Neuville, V Barroca, J Tilliet y todo el personal de las instalaciones de los animales; a J Baijer y N Dechamps de clasificación de células; O. Etienne para la asistencia técnica, y A. Gouret por su asistencia administrativa. La citometría de flujo y clasificación de células se llevaron a cabo en la citometría de flujo de recursos compartidos IRCM, establecido por donaciones de equipos de DIM-Stem-Pôle, INSERM, Fundación ARCO, y CEA. Este trabajo fue apoyado por becas de Electricité de France (EDF). MD tiene una beca de La Liga Contra el Cáncer y LM de la región Ile-de-France (DIM bioterapias). Marc-André Mouthon y François D. Boussin autoría cuota de co-mayor.
Materiales
| Name | Company | Catalog Number | Comments |
| 96-well uncoated glass bottom culture plates | MatTek Corp. | P96G-1.5-5-F | |
| µ-Plates 96-well | Ibidi | 89626 | |
| Poly-D-Lysine | Millipore | A003E | |
| NeuroCult NSC Basal Medium | STEMCELL Technologies | 5700 | |
| NeuroCult NSC Proliferation Supplement | STEMCELL Technologies | 5701 | |
| Heparin | STEMCELL Technologies | 7980 | |
| EGF | Millipore | GF144 | |
| FGF-2 | Millipore | GF003 | |
| Papain | Worthington | LS003119 | |
| EBSS | Invitrogen | 24010-043 | |
| L-cysteine | Sigma | C-7352 | |
| 0.5M EDTA, pH 8.0 | Promega | V4231 | |
| DNase I | Sigma | D5025-15KU | |
| Trypsin inhibitor type II | Sigma | T9128 | Ovomucoid |
| DMEM:F12 medium | Life Technologies | 31330-038 | |
| 20 µm filter | BD Medimachine Filcon | 340622 | |
| Eppendorf microtubes 3810X | Sigma | Z606340-1000EA | |
| BSA | Sigma | A1595 | Bovine serum albumin solution |
| CD24 phycoerythrin-cyanine7 conjugate [PC7] | Life Technologies | A14776 | Mouse IgM; clone MMA. 1:50 |
| CD15/LeX fluorescein isothiocyanate [FITC] - conjugated | BD Biosciences | 332778 | Rat IgG2b; clone M1/69. 1:50 |
| Mouse anti-human LeX antibody | BD Pharmingen | 559045 | Mouse IgM; clone MAM. 1:50 |
| Alexa647 - conjugated EGF ligand | Life Technologies | E35351 | 1:200; Ax647-conjugated EGF ligand in the text |
| CompBeads | BD Biosciences | 644204 | |
| MACS LS separation columns | Miltenyi Biotec | 130-042-401 | separation columns (in the manuscript) |
| Anti-mouse IgM microbeads | Miltenyi Biotec | 130-047-301 | |
| Hoechst 33258 | Sigma | 861405 | HO (in the manuscript) |
| INFLUX cell sorter | BD Biosciences | FACS sorter (in the text) | |
| Nikon A1R confocal laser scanning microscope system attached to an inverted ECLIPSE Ti | Nikon Corp. | confocal laser scanning microscope (in the manuscript) | |
| NIS-Elements AR.4.13.01 64-bit software | Nikon Corp. | NIS-Elements software (in the manuscript) | |
| Plan Apo VC 20x DIC objective (NA: 0.75) | Nikon Corp. | ||
| ECLIPSE Ti thermostated chamber | Nikon Corp. | thermostated chamber (in the manuscript) | |
| ImageJ | RBS | ||
| FlowJo | Tree Star, Ashland, OR | ||
| FUCCI mice | RIKEN BioResource Center, JAPAN | Sakaue-Sawano et al. 2008 |
Referencias
- Morshead, C. M., et al. Neural stem cells in the adult mammalian forebrain a relatively quiescent subpopulation of subependymal cells. Neuron. 13, 1071-1082 (1994).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci USA. 106, 6387-6392 (2009).
- Doetsch, F., Caille, I., Lim, D. A., Garcia Verdugo, J. M., Alvarez Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97, 703-716 (1999).
- Kriegstein, A., Alvarez Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Lois, C., Garcia Verdugo, J. M., Alvarez Buylla, A. Chain migration of neuronal precursors. Science. 271, 978-981 (1996).
- Fuentealba, L. C., Obernier, K., Alvarez Buylla, A. Adult neural stem cells bridge their niche. Cell stem cell. 10, 698-708 (2012).
- Rietze, R. L., et al. Purification of a pluripotent neural stem cell from the adult mouse brain. Nature. 412, 736-739 (2001).
- Fischer, J., et al. Prospective isolation of adult neural stem cells from the mouse subependymal zone. Nat Protoc. 6, 1981-1989 (2011).
- Daynac, M., et al. Quiescent neural stem cells exit dormancy upon alteration of GABAAR signaling following radiation damage. Stem Cell Res. 11, 516-528 (2013).
- Codega, P., et al. Prospective identification and purification of quiescent adult neural stem cells from their in vivo niche. Neuron. 82, 545-559 (2014).
- Mich, J. K., et al. Prospective identification of functionally distinct stem cells and neurosphere-initiating cells in adult mouse forebrain. Elife. 3, e02669 (2014).
- Capela, A., Temple, S. LeX ssea 1 is expressed by adult mouse CNS stem cells identifying them as nonependymal. Neuron. 35, 865-875 (2002).
- Calaora, V., Chazal, G., Nielsen, P. J., Rougon, G., Moreau, H. mCD24 expression in the developing mouse brain and in zones of secondary neurogenesis in the adult. Neuroscience. 73, 581-594 (1996).
- Pineda, J. R., et al. Vascular derived TGF-beta increases in the stem cell niche and perturbs neurogenesis during aging and following irradiation in the adult mouse brain. EMBO Mol Med. 5, 548-562 (2013).
- Lugert, S., et al. Quiescent and active hippocampal neural stem cells with distinct morphologies respond selectively to physiological and pathological stimuli and aging. Cell stem cell. 6, 445-456 (2010).
- Blackmore, D. G., Golmohammadi, M. G., Large, B., Waters, M. J., Rietze, R. L. Exercise increases neural stem cell number in a growth hormone dependent manner augmenting the regenerative response in aged mice. Stem cells. 27, 2044-2052 (2009).
- Bouab, M., Paliouras, G. N., Aumont, A., Forest Berard, K., Fernandes, K. J. Aging of the subventricular zone neural stem cell niche evidence for quiescence associated changes between early and mid adulthood. Neuroscience. 173, 135-149 (2011).
- Enwere, E., et al. Aging results in reduced epidermal growth factor receptor signaling diminished olfactory neurogenesis and deficits in fine olfactory discrimination. The Journal of neuroscience the official journal of the Society for Neuroscience. 24, 8354-8365 (2004).
- Maslov, A. Y., Barone, T. A., Plunkett, R. J., Pruitt, S. C. Neural stem cell detection characterization and age related changes in the subventricular zone of mice. The Journal of neuroscience the official journal of the Society for Neuroscience. 24, 1726-1733 (2004).
- Tropepe, V., Craig, C. G., Morshead, C. M., van der Kooy, D. Transforming growth factor alpha null and senescent mice show decreased neural progenitor cell proliferation in the forebrain subependyma. The Journal of neuroscience the official journal of the Society for Neuroscience. 17, 7850-7859 (1997).
- Costa, M. R., et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138, 1057-1068 (2011).
- Ponti, G., et al. Cell cycle and lineage progression of neural progenitors in the ventricular-subventricular zones of adult mice. Proc Natl Acad Sci U S A. 110, 1045-1054 (2013).
- Sakaue Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell cycle progression. Cell. 132, 487-498 (2008).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of visualized experiments JoVE. , (2010).
- Daynac, M., et al. TGFbeta lengthens the G1 phase of stem cells in aged mouse brain. Stem cells. 32, 3257-3265 (2014).
- Roccio, M., et al. Predicting stem cell fate changes by differential cell cycle progression patterns. Development. 140, 459-470 (2013).
- Walker, T. L., Kempermann, G. One mouse two cultures isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of visualized experiments JoVE. , e51225 (2014).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres re evaluating the relationship. Nat Methods. 2, 333-336 (2005).
- Pastrana, E., Silva Vargas, V., Doetsch, F. Eyes wide open a critical review of sphere formation as an assay for stem cells. Cell stem cell. 8, 486-498 (2011).
- Spella, M., et al. Licensing regulators Geminin and Cdt1 identify progenitor cells of the mouse CNS in a specific phase of the cell cycle. Neuroscience. 147, 373-387 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados