Method Article
Tri cellulaire des neurones cellules souches et progénitrices de la souris adulte-ventriculaire Zone et Live-imagerie de la dynamique de leur cycle cellulaire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
We report a Fluorescent Activated Cell Sorting (FACS)-based method to isolate neural stem cells (NSCs) and their progeny from the subventricular zone (SVZ) of the adult mouse brain. Applied to Fluorescence Ubiquitination Cell Cycle Indicator (FUCCI) transgenic mice, it allows the study of cell cycle progression by live imaging.
Résumé
Les cellules souches neurales (NSC) dans la zone sous-ventriculaire des ventricules latéraux (SVZ) soutiennent la neurogenèse olfactive long de la vie dans le cerveau des mammifères. Ils génèrent successivement cellules de transit amplifier (TAC) et les neuroblastes qui se différencient en neurones une fois qu'ils intègrent les bulbes olfactifs. Emerging cellulaire activé par fluorescence (FACS) techniques ont permis l'isolement de NNC ainsi que leur progéniture et ont commencé à faire la lumière sur les réseaux de régulation des gènes dans des niches neurogéniques adultes. Nous rapportons ici une technique de tri cellulaire qui permet de suivre et distinguer la dynamique du cycle cellulaire des populations de cellules mentionnés ci-dessus à partir de la SVZ adulte avec un LeX / EGFR / CD24 triple coloration. Les cellules isolées sont ensuite étalées comme des cellules adhérentes à explorer en détail leur progression du cycle cellulaire par vidéo time-lapse microscopie. À cette fin, nous utilisons transgénique fluorescence Ubiquitination Indicateur du cycle cellulaire (FUCCI) des souris dont les cellules sont de couleur rouge fluorescent During G 1 phase due à un G 1 spécifique journaliste rouge CDT1. Cette méthode a récemment révélé que les CNS prolifération allonger progressivement leur phase G 1 au cours du vieillissement, conduisant à la neurogenèse dépréciation. Cette méthode est aisément transposable à d'autres systèmes et pourrait être d'un grand intérêt pour l'étude de la dynamique du cycle cellulaire des cellules du cerveau dans le cadre de pathologies cérébrales.
Introduction
Cellules souches neurales (NSC) de repos sont la source de la neurogenèse adulte 1 et peuvent se transformer en leur prolifération "activé" forme exprimant les récepteurs EGFR (aNSCs) 2. Une fois activé, ils donnent naissance à des cellules de transit amplifier (TAC) 3, puis neuroblastes qui migrent vers les bulbes olfactifs (OB) à travers un tube d'astrocytes et enfin différencier en neurones 4,5. NNC et leur progéniture sont organisées dans des «niches» spécialisées architectures long des ventricules latéraux, impliquant une myriade de facteurs contrôlant leur prolifération 6. L'isolement et la purification des cellules neurogéniques SVZ est nécessaire pour éclairer la régulation moléculaire complexe de leur prolifération, mais sont restés un défi pour une longue période en raison de l'absence de marqueurs spécifiques et techniques adaptées.
Nouvelles approches en utilisant la cytométrie de flux ont rendu possible l'isolement de NNC et their la descendance de l'adulte SVZ 2,7-11. Utilisation du marqueur de cellules souches LeX 12 avec neuroblaste marqueur CD24 13 et une EGF de fluorescence pour étiqueter EGFR sur la prolifération des cellules 2, nous avons récemment développé une stratégie FACS permettant la purification de cinq des principales populations neurogéniques SVZ: repos et activé CNS, TAC, immatures ainsi que la migration des neuroblastes 9. Ici, nous décrivons en détail cette technique de tri cellulaire et comment un LeX / EGFR / CD24 triple coloration permis pour la première fois l'isolement des deux NSCs repos et activés.
Bien que la neurogenèse persiste à l'âge adulte, la production de nouveaux neurones est considérablement diminué dans le vieillissement du cerveau 14. La plupart des études d'accord sur une réduction progressive du nombre de prolifération des cellules progénitrices dans le SGZ et SVZ 15-20. Les conséquences ne sont pas anodin que la baisse liée à l'âge dans la neurogenèse dans le SVZ provoque une diminution de newborn neurones dans les bulbes olfactifs du cerveau âgé, conduisant finalement à la dépréciation de la discrimination olfactive chez la souris âgée de 18 ans. L'élucidation de la cinétique du cycle cellulaire de progéniteurs neuronaux est une étape clé pour comprendre les mécanismes qui sous-tendent l'évolution de la neurogenèse adulte au cours du vieillissement. Des études récentes ont étudié le cycle cellulaire et la progression de la lignée de cellules souches neurales adultes in vitro 21 et in vivo 22 mais aucun d'entre eux ont profité de techniques de tri de cellules et des sondes de cellules de cycle fluorescents génétiquement codés de visualiser les phases du cycle cellulaire des cellules isolées au niveau d'une seule cellule.
Nous décrivons ici un protocole qui tire parti des souris transgéniques FUCCI dans lequel les cellules sont fluorescentes lors de leur cycle cellulaire, ce qui permet la distinction entre G 1 et 2 SG / M 23 phases. Ce protocole montre comment l'isolement prospective de NNC et de leur progéniture de l'adulte FUCCI miCE combiné avec Vidéomicroscopie vidéo permet l'étude de la dynamique du cycle cellulaire au niveau d'une seule cellule.
Protocole
Ce protocole a été conçu en conformité avec les Communautés européennes Directive du Conseil du 24 Novembre 1986 (86/609 / CEE) et a été approuvé par notre comité institutionnel de protection des animaux (Cetea CEA-DSV IdF).
1. Configuration de base Avant Culture et vidéomicroscopie
- Utilisez verre des plaques de culture de fond ou u-plaques pour la microscopie confocale vidéo. Pour: 1 - 5 x 10 3 cellules / puits, utiliser des plaques à 96 puits et les plaques à 24 puits pendant plus de 5 x 10 3 cellules / puits.
- Au moins un jour avant de commencer l'expérience, la préparation de poly-D-lysine (PDL) stérile plaques revêtues de cultures monocouches adhérentes. Ajouter suffisamment PDL (10 pg / ml dans dH2O) pour recouvrir le fond de chaque puits et incuber O / N à 37 ° C. Retirer la solution PDL et rincer trois fois avec dH 2 O avant de permettre à la plaque sécher dans la hotte pendant au moins 2 heures sous un flux laminaire. Si pas utilisé immédiatement, stocker la plaque revêtue à-20 ° C.
- Préparer le milieu de culture en mélangeant NSC Basal Medium et Supplément NSC prolifération à 9: 1 (voir tableau Matériau) avec 2 ug / ml d'héparine, 20 ng / ml de facteur de croissance épidermique humain recombinant purifié (FEM), et 10 ng / ml facteur humain de croissance des fibroblastes recombinant 2 (FGF-2). Chauffer le milieu de culture à 37 ° C dans un bain d'eau avant utilisation.
- Pour la dissociation SVZ, préparer une solution de papaïne: 1 mg / ml de papaïne (15 UI / ml) dans la balance solution saline de Earl (EBSS) contenant 0,2 mg / ml de L-cystéine, 0,2 mg / ml d'EDTA, et 0,01 mg / ml de DNase I dans du PBS. Stériliser la solution par passage à travers un filtre de 0,2 um. Equilibrer la solution à 37 ° C avant utilisation.
- Pour arrêter la réaction enzymatique, préparer une solution de inhibiteur de la protéase (ovomucoïde): milieu F12 contenant 0,7 mg / ml de trypsine de type II inhibiteur: DMEM. Filtrer la solution à l'aide d'un filtre de 0,2 um.
- Préparer PBS 0,6% solution de glucose à recueillir les cerveaux et PBS 0,15% de BSA sOlution pour les étapes de lavage et pour la coloration des anticorps.
- Préparer les outils de dissection: ciseaux, disséquer et attachant forceps, scalpel. Faites-les tremper dans 70% d'éthanol.
2. La récolte de souris adultes Brains et SVZ Microdissections
- Sacrifice adultes FUCCI souris 23 (2 à 3-month-old et / ou 12-month-old pour des études de vieillissement) effectuer une dislocation cervicale conformément aux directives institutionnelles appropriées.
- Vaporiser la souris en utilisant 70% d'éthanol et de couper la tête à l'aide des ciseaux pointus.
- Faire une incision le long du cuir chevelu pour révéler le crâne.
- Effectuer une coupe longitudinale de la ligne médiane à partir de la base du crâne vers les bulbes olfactifs en utilisant une petite paire de ciseaux. Assurez-vous de ne pas endommager le cerveau sous-jacente avec les lames de ciseaux. Retirer la partie supérieure ouverte du crâne avec des pinces courbes pour exposer le cerveau.
- Recueillir le cerveau dans une boîte de Pétri de 15 mm contenant 0,6% de glucose dans du PBS.
- réissect loin les bulbes olfactifs. Placez le cerveau sur sa surface dorsale et faire une coupe coronale à travers le chiasma optique utilisant un scalpel.
- Sous un microscope de dissection, positionner la partie rostrale de la section du cerveau avec la surface coronale coupe vers le haut vers l'expérimentateur.
- Pour disséquer le SVZ, retirez la cloison avec une pince fine courbes puis insérez une pointe d'une pince fine dans le striatum immédiatement adjacente au ventricule et détacher le SVZ du tissu environnant. Pour plus de détails, reportez-vous à Azari et al. 24. Placer la SVZ disséqué dans une boîte de Pétri contenant 1 ml de PBS-0,6% de glucose.
3. SVZ dissociation tissulaire
- Émincer le SVZ disséqué dans la boîte de Pétri jusqu'à ce qu'aucun gros morceaux restent.
- Transférer le tissu haché avec le% de glucose PBS-0,6 dans un tube de 15 ml et centrifuger à 200 g pendant 5 min.
- Jeter le surnageant et ajouter 1 ml de papaïne préchauffé (1mg / ml, préparé à l'étape 1.4) additionné de 0,01 mg / ml de DNase I. Incuber pendant 10 min dans un bain-marie à 37 ° C. Utiliser 1 ml de papaïne par souris.
- Centrifuger à 200 g pendant 5 min et jeter le surnageant.
- Ajouter 1 ml de pré-chauffé ovomucoïde (0,7 mg / ml, préparé à l'étape 1.5) pour arrêter l'activité de la papaïne. Mécaniquement dissocier le tissu haché plus loin dans une suspension à cellule unique par pipetage doucement monter et descendre 20 fois à travers une pointe de micropipette P1000. Évitez les bulles d'air.
- Faire passer la suspension de cellules à travers un filtre stérile de 20 um dans un nouveau tube de 15 ml. Assurez-vous de laver le filtre cellulaire avec du PBS 0,15% de BSA pour éviter de perdre des cellules.
- Centrifuger à 200 g pendant 10 min et jeter le surnageant. Remettre en suspension les cellules dans 100 ul de PBS contenant 0,15% de BSA.
4. immunofluorescence pour Tri cellulaire
Pour le tri de cellules en utilisant FUCCI-Rouge souris (figure 2A), utilisez la commande suivante: anticorps CD24 conjugué à la phycoérythrine cyanine7 [PC7]; CD15 / LeX isothiocyanate de fluorescéine [FITC] conjugué et Ax647 ligand EGF conjugué.
Remarque: LEX + EGFR + et les cellules EGFR + cellules ne sont pas abondantes dans la SVZ adulte: ≈ 600 et 1500 cellules / souris respectivement 9. Nous recommandons la mise en commun des cellules SVZ de 2 à 3 souris d'avoir assez de matériel. Ne pas travailler avec plus de 12 souris, le même jour de sorte que la durée de tri cellulaire ne dépasse pas 3 heures. Gardez à l'esprit que le travail avec trop de souris sur le même jour conduira à une augmentation de la durée de tri cellulaire qui peut entraîner une augmentation de la mort cellulaire et / ou la différenciation cellulaire.
- Effectuer la coloration FACS dans 100 ul de PBS 0,15% de BSA par souris (ou dans 200 pl d'un groupe de 2 à 3 souris pour la coloration optimale).
- Préparer les tubes témoins. Utilisez des perles de compensation pour préparer des tubes de contrôle de la couleur unique selon le fabricantLe protocole; 9. Sélectionnez une fraction de cellules (1/10 des cellules extraites d'une souris est suffisant) et le séparer en 4 tubes pour préparer 1 tube de contrôle négatif (cellules non marquées) et 3 fluorescence moins un (FMO) tubes de contrôle. Resuspendre les cellules dans 200 ul de PBS 0,15% de BSA par tube.
Astuce: Pour un contrôle LEX-FITC FMO, étiqueter les cellules avec CD24-PC7 (01h50) et le ligand EGF Ax647-conjugué (1: 200); pour le contrôle CD24-PC7 FMO, étiqueter les cellules avec CD15 / LEX-FITC (1:50) et Ax647 conjugué EGF ligand (1: 200) et pour Ax647 conjugué contrôle de la FMO ligand EGF, étiqueter les cellules avec CD15 / Lex- FITC (01:50) et CD24-PC7 (1:50). - Pour les tubes utilisés pour le tri de cellules, utiliser les anticorps suivants à la dilution indiquée dans du PBS 0,15% de BSA: CD24-PC7 (01:50), CD15 / LEX-FITC (01:50) et le ligand EGF Ax647-conjugué (1: 200).
- Incuber pendant 20 min à 4 ° C dans l'obscurité. Laver avec 1 ml de PBS 0,15% de BSA et centrifuger à 200 g pendant 10 min. Reprendre les cellules dans 20081; l de PBS 0,15% de SAB par le cerveau. Gardez les tubes de tri de cellules sur la glace et procéder immédiatement à la tri cellulaire.
- Si vous utilisez la souris FUCCI-Vert, fractions LEX-positifs et négatifs LEX-séparés en utilisant des colonnes de séparation avant le tri de cellules que les actions anticorps LEX-FITC la même longueur d'onde d'émission de la fluorescence FUCCI-vert (figure 3A, B).
- Tout d'abord, marquer les cellules avec un LEX-anticorps anti-humain de souris (1:50) pendant 15 minutes à 4 ° C dans l'obscurité dans 100 ul de PBS 0,15% de BSA.
- Laver les cellules avec 1 ml de PBS 0,15% de BSA et centrifuger à 200 g pendant 10 min, puis marquer les cellules avec des microbilles IgM anti-souris (1:10) pendant 15 minutes à 4 ° C dans l'obscurité.
- Laver les cellules avec 1 ml de PBS 0,15% de BSA et centrifuger à 200 g pendant 10 min. Resuspendre les cellules dans 500 ul de PBS 0,15% de BSA et les cellules d'écoulement à travers la colonne de séparation dans un champ magnétique comme schématisé sur la figure 3 C. Laver la colonne avec 1 ml de PBS 0,15% de BSA d'obtenir LeX fraction négative.
- Pour obtenir fraction LEX-positif, supprimer la colonne de séparation du champ magnétique et éluer les cellules avec 2 ml de PBS 0,15% de BSA.
- Passez à CD24-PC7 et Ax647 conjugué ligand EGF coloration comme indiqué en 4.2.
5. Tri cellulaire
Note: Les cellules ont été triées sur un trieur FACS à 40 psi avec un noozle 86 um. La fluorescence a été recueillie à l'aide de l'ensemble de filtre suivant: 520 / 35nm (FITC), 575 / 26nm (PE), 670 / 20nm (Ax647) et 740LP (PC7). La rémunération est nécessaire pour empêcher des signaux faux positifs comme un chevauchement est découvert entre les spectres d'émission de la fluorescence FUCCI-rouge et le colorant PC7.
- Immédiatement avant le tri de cellules, ajouter un colorant vital de discriminer en direct à partir de cellules mortes. Nous avons utilisé HO (voir tableau des matériaux) à 2 pg / ml de concentration finale. Exécutez le tube de contrôle négatif (cellules non marquées) à travers le trieur FACS et sélectionnez ecellules e utilisant la diffusion latérale (SSC) et diffusion vers l'avant (FSC) paramètres (figure 1A).
REMARQUE: Les cellules mortes ont été exclus par gating seule la fraction HO-négative (figure 1A) puis doublets ont été exclues par la sélection de la largeur d'impulsion fraction négative (figure 1A ''). - Exécutez les commandes de couleur simples préparés à l'étape 4.2 et ajuster le tube photomultiplicateur (PMT) tensions (échelle de cellules-à-dire la population négative trop élevées et / ou positifs off) si nécessaire. Effectuer la compensation de couleur dans la fenêtre de compensation du logiciel.
- Exécuter FMO contrôle préparé à l'étape 4.2 (LEX-FITC contrôle FMO, CD24-PC7 contrôle FMO et le contrôle de la FMO ligand EGF Ax647-conjugué) et tirer les portes de tri (Figure 1). Trier les cellules directement dans 100 pi de milieu de culture dans 1,5 ml microtubes.
6. Préparation des cellules pour la microscopie
- Plaque la cellule fraîchement triés à une densité de 1-3 x 10 3 cellules / puits de poly-D-revêtus de lysine 96 puits μ-Plate avec 300 pi de milieu de culture.
- Avant la microscopie vidéo, incuber les plaques de culture à 37 ° C et 5% de CO 2 pendant au moins 1 heure pour permettre l'adhésion cellulaire.
7. Configuration de microscope et l'acquisition d'images
- Effectuer une imagerie en temps réel en utilisant un objectif 20x Plan Apo VC DIC (NA: 0,75) sur un système de microscope à balayage laser à foyer commun fixé à une chambre thermostatée renversé à 37 ° C sous 5% de CO 2 atmosphère.
- Positionner le 96 puits μ-Plate intérieur de la chambre thermostatée préchauffé et équilibrée et remplacer le couvercle par un couvercle thermostaté.
- Ouvrez le logiciel NIS-Elements et cliquez dans la barre de menu sur "Acquérir / Acquisition contrôle / acquisition ND" pour sélectionner les options du time-lapse (longueur, les positions de la scène, z-sections confocale, ...), «acquérir / contrôles d'acquisition / Pad Ti221; pour sélectionner les objectifs et «Acquérir / contrôles d'acquisition / A1plus Paramètres" pour sélectionner le niveau de PMT pour chaque fluorescence dans la barre de menu. Sélectionnez un dossier pour enregistrer les fichiers de données.
- Utilisation de la fenêtre d'acquisition ND, définir le centre de chaque puits comme une position de scène et sélectionnez l'option de grande image pour 7 x 7 mm². Ceci créera une image mosaïque autour du centre de chaque puits. Réglez le recouvrement de la grande mosaïque d'images à 5%. Prenez des photos toutes les 20 min pendant 24 heures. Sélectionnez l'objectif Plan Apo VC 20x DIC (NA: 0,75) dans la fenêtre Ti Pad.
- Dans la fenêtre Paramètres A1plus, acquérir des images à l'aide de résonance scanner haute vitesse à un format de 512 x 512 pixels avec une résolution de 1,26 um / pixel. Utilisez fond clair de visualiser des formes cellulaires. Dans le cas des souris FUCCI-Rouge, exciter la fluorescence rouge à 561 nm et de recueillir l'aide d'un filtre 595/50 nm. Dans le cas des souris FUCCI-Vert, exciter la fluorescence verte à 488 nm et de recueillir l'aide d'un filtre 530/40 nm. Déterminer le PM optimaleNiveau de T, le décalage et la puissance du laser pour chaque longueur d'onde.
NOTE: Nous vous recommandons d'utiliser la fonction de mise au point automatique pour le canal de fond clair pour permettre au logiciel mise au point automatique à chaque position de scène avant chaque acquisition. Astuce: Un objectif Plan Apo VC 20x DIC (NA: 0,75) a été utilisé pour son excellente résolution sans la nécessité pour le pétrole. D'autres objectifs peuvent être utilisés en fonction de la résolution optique souhaitée. - Sélectionnez le bouton "Exécuter maintenant" sur la fenêtre d'acquisition ND pour commencer l'acquisition.
Astuce: Suivez le travail de l'ordinateur pour une boucle pour être sûr que tout fonctionne correctement.
8. Traitement et analyse d'images
- Analyser les données directement sur le logiciel NIS-Elements en suivant les cellules individuellement. Astuce: Pour gagner du temps, économiser de chaque position au format .avi utilisant le logiciel NIS-Elements et d'analyser les films avec ImageJ.
- Dans le logiciel ImageJ, le suivi des cellules individuelles subissant au moins 2 divisions (ie une cellule àune colonie à quatre cellules). Recadrage d'une petite zone autour de la cellule et sélectionnez 'image / Dupliquer'.
- Sélectionnez 'image / Piles / Faire Montage »dans la barre de menu pour faire un montage. Spécifiez les vues à inclure, la taille des images et enregistrez le montage comme un fichier .tif pour une résolution optimale.
- Pour calculer le premier SG 2 / m de longueur de phase (figure 2C, D), sélectionnez une seule cellule rouge fluorescent (en G 1), puis réglez de T = 0 (phase S débutera une fois que la fluorescence rouge éteint). Comptez le nombre de trames jusqu'à ce que la cellule se divise pour estimer la longueur SG 2 / M.
NOTE: Le temps calculé dépend de l'intervalle de temps entre chaque trame. - Pour calculer la phase G1 suivante (figure 2C, D), continuer à suivre la cellule qui vient divisé. Si la cellule en phase G1 divisé entre, il y aura une accumulation de la protéine fluorescente rouge-CDT1. Calculer le nombre de trames jusqu'à fluorescence rouge éteint agaen pour chaque cellule.
Astuce: Au début de G 1 la fluorescence rouge pourrait être faible afin de choisir le début de la phase G 1 sur le cadre où la cellule a divisé pour éviter les approximations.
Résultats
La capacité de distinguer de manière fiable entre les différents populations de cellules de la souris adulte cellules souches SVZ lignée est primordial pour étudier leurs propriétés fonctionnelles. Pour cette fin, nous avons développé un / EGFR / CD24 stratégie triple étiquetage LeX permettant la purification de populations spécifiques de cellules de la SVZ adulte: CNS repos (lex lumineuses), NSCs activés (LEX + EGFR +), TAC (EGFR +) , neuroblastes immatures et migrateurs (CD24 + CD24 + et EGFR +, respectivement) 9 (Figure 1). Appliqué à des souris transgéniques FUCCI, la cellule technique de tri permet l'imagerie en temps réel des phases du cycle cellulaire des différentes populations neurogéniques au niveau unicellulaire 25. Souris FUCCI-Rouge ont été utilisés pour suivre la phase G 1 avec la fluorescence rouge à l'aide vidéo time-lapse microscopie (figure 2A). Cellules neg FUCCI-rouges représentent les cellules de S-G 2 / M phases du cycle cellulaire, les cellules pos FUCCI-G 1 sont rouges et les cellules brillantes FUCCI-rouges sont des cellules ou sortant hors du cycle cellulaire (figure 2B) 23,26. LeX + EGFR + et EGFR + cellules de jeune adulte (figure 2C) et des souris d'âge moyen (figure 2D) ont été étalées comme des cellules adhérentes sur des plaques de culture revêtues de poly-D-lysine. Le SG 2 / M première phase a été identifié sur des cellules individuelles une fois que la fluorescence rouge éteint jusqu'à ce que la cellule se divise. Comme observé précédemment SG 2 / m de longueur de phase n'a montré aucune différence entre LeX + EGFR + et + cellules EGFR, soit chez les souris jeunes ou d'âge moyen. Ensuite, nous avons calculé le prochain G 1 longueur de la phase de la première division jusqu'à la fluorescence rouge éteint. Fait intéressant, une phase allongement G 1 a été trouvé au cours du vieillissement LEX + EGFR + cellules mais pasEGFR dans les cellules + 25 (figure 2C, D). En conséquence, les neurosphères obtenus après 5 jours de placage sont plus petits dans les cellules EGFR + + LeX obtenus à partir de souris âgées comme représenté sur la Figure 2E.
Souris-Green FUCCI peut également être utilisé pour visualiser le SG 2 / M en phase avec la fluorescence verte (figure 3A, B) mais les cellules doivent être pré-triés en utilisant des colonnes de séparation comme anticorps LEX-FITC a partagé la même longueur d'onde d'émission de la FUCCI- fluorescence verte (figure 3C). Un exemple de fluorescence FUCCI-vert pour la première SG 2 / M phase du jeune adulte LeX + + EGFR et l'EGFR + cellules est représenté sur la figure 3D.
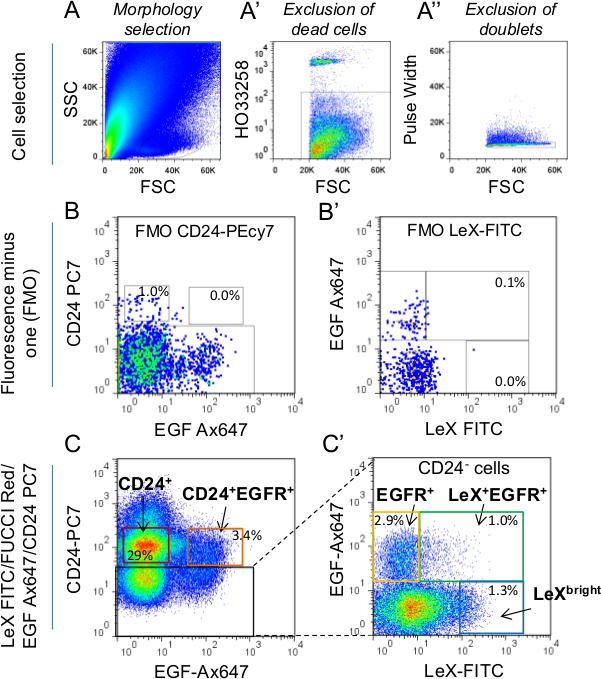
Figure 1:. Stratégie de sélection de cellules par FACS (A) Les cellules ont été d'abord sélectionnés en fonction de tla morphologie de l'héritier en utilisant la diffusion latérale (SSC) vs prodiffusion paramètres (FSC). Pour plus de détails sur la morphologie sélection de grille, se réfèrent à Daynac et al. 9 (A ') Les cellules mortes ont été marqués en utilisant le marqueur HO et exclus de la sélection. (A' ') doublets ont été exclus en utilisant le paramètre de largeur d'impulsion. Afin de mettre en place les grilles de tri, Fluorescence moins un (FMO) Les commandes de CD24-PC7 (LEX-FITC / FUCCI-Rouge / FEM-Ax647 étiquetage; B) et Lex-FITC (FUCCI-Rouge / FEM-Ax647 / CD24 étiquetage -PC7; B ') ont été utilisés (C, C.) Puis, portes de tri ont été déterminées dans LEX-FITC / FUCCI-Rouge tubes étiquetés / FEM-Ax647 / CD24-PC7 avec des contrôles FMO. Les pourcentages moyens de cellules totales sont représentés dans les portes. Si la sélection CD24 + cellules (neuroblastes), être prudent d'exclure CD24 des cellules exprimant vives de la porte. En effet, CD24 correspondent brillant pour CE épendymairells 2,9. C 'représente les cellules CD24 négatives (de carrés noir dans C). Seulement LeX + EGFR + et + EGFR (C ') portes de tri ont été utilisés pour cette étude.
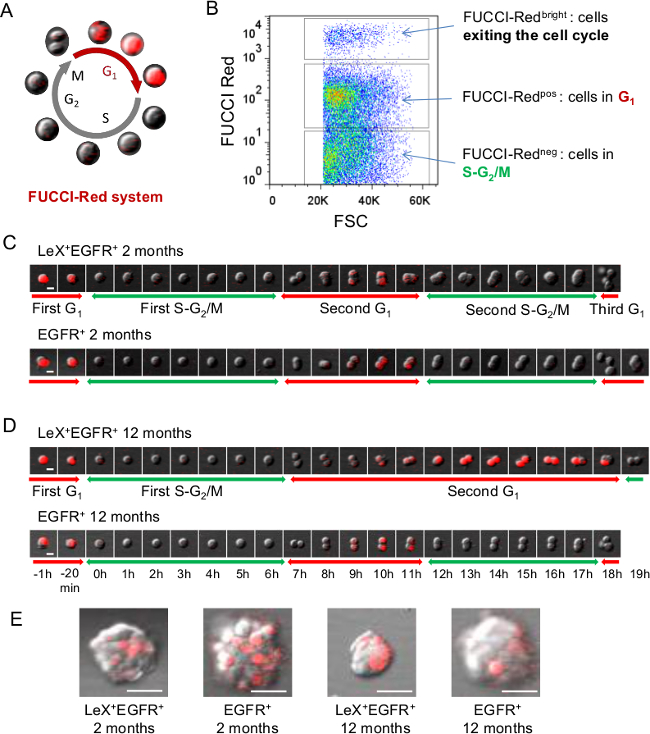
Figure 2: analyses en direct de cycle cellulaire utilisant des souris FUCCI-Rouge (A) Représentation schématique du cycle cellulaire FUCCI-Rouge où les cellules sont rouge fluorescent lors de la phase G1 et incolore pendant SG 2 / M phases 23 de représentation (B) FACS de.. fluorescence FUCCI-Rouge sur les cellules SVZ. (C, D) la microscopie vidéo Lex + EGFR + et EGFR + cellules triés du plus jeune (C) et d'âge moyen (D) souris FUCCI-Rouge permet le suivi de la phase G 1 avec fluorescence rouge alors que le SG 2 / M phases peuvent être déduites when la fluorescence rouge éteint. Des images successives sont représentées avec une échelle de temps présentée dans D. (E) des images représentatives de colonies (de neurosphères) obtenus 5 jours après placage. Barre d'échelle:. 10 pm (C, D), 30 nm (E) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
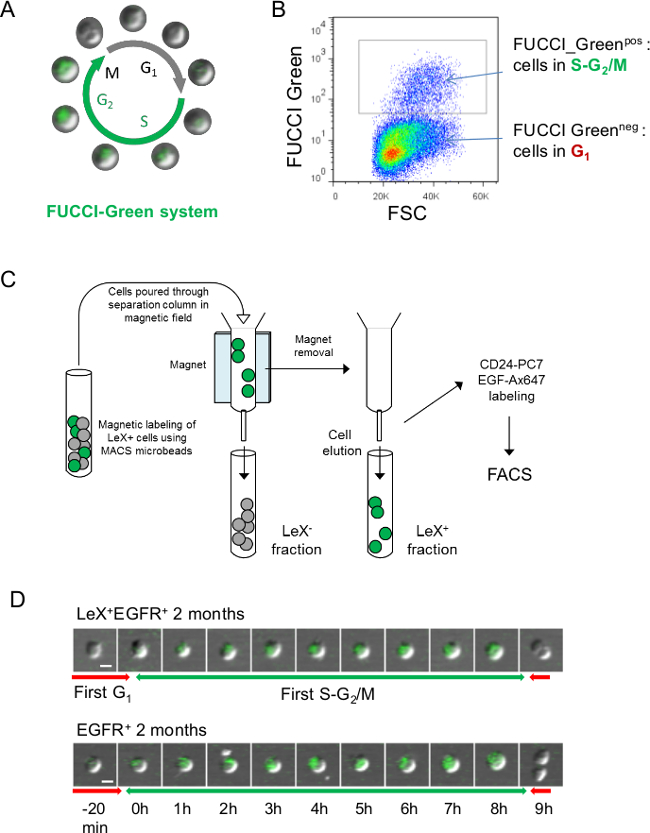
Figure 3:.. Stratégie pour les analyses en direct de cycle cellulaire utilisant des souris FUCCI-vert (A) Représentation schématique du cycle cellulaire FUCCI-Vert où les cellules sont vert pendant SG 2 / phase M et incolore lors de phase G 1 23 (B) Représentation FACS de la fluorescence FUCCI-Vert: cellules neg FUCCI-verts représentent les cellules en phase G1 du cycle cellulaire en FUCCI-Green cellules POS sont des cellules dans SG 2 / M 23. (C) Afin de suivre l'SG vert fluorescent 2 / M phases de la lex + EGFR + et les cellules EGFR +, cellules SVZ devaient être pré-triés avec des colonnes de séparation. Les cellules ont été marquées avec des anticorps anti-souris LEX et fraction LeX + a été retenue sur la colonne en utilisant des microbilles anti-souris (voir protocole 4.). Ensuite, LeX + et Lex - fractions ont été élues et marquées avec des anticorps CD24-PC7 pour tri FACS EGF-Ax647 et (D) la microscopie vidéo de la lex + EGFR + et EGFR + cellules triées de jeunes souris FUCCI-Vert permet le suivi des. Le SG 2 / M phases avec une fluorescence verte. Des images successives sont représentées avec une échelle de temps présentée dans D. Barre d'échelle: 10 um (D).
Discussion
La technique de tri cellulaire décrit ici permet la discrimination fiable entre NSCs repos, NSCs activés et leurs études de descendance permettant de leurs propriétés et de la dynamique dans le cerveau adulte 9. Couplé à la technologie FUCCI qui permet la visualisation de la progression du cycle cellulaire dans des cellules vivantes 23, nous avons développé une technique rapide et efficace de suivre les G 1 et SG 2 / M phases du cycle cellulaire à partir de jeunes adultes et les cellules du cerveau de la souris âgées.
La technique de tri cellulaire utilisé dans ce protocole était la première combinaison de marqueurs validés permettant la purification des cinq principales populations neurogène de la SVZ 9. Il a également été la première technique validée permettant la distinction de NNC de repos et activés. Il est à noter que cette technique ne nécessite pas l'utilisation de souris transgéniques en soi, qui est nécessaire lorsqu'il est adapté à des modèles de souris transgéniques such que FUCCI. Depuis lors, Codega et al. 10 ont utilisé une combinaison triple étiquetage GFAP-GFP / CD133 / EGFR à distinguer NSCs repos de leur homologue activé mais il ne peut pas être adapté à la technologie FUCCI car elle nécessite l'utilisation de souris transgéniques GFAP-GFP. Mich et al. 11 ont développé un / EGFR / CD24 stratégie d'étiquetage triple Glast qui partage des résultats communs avec la technique utilisée dans cette étude 9. En effet, une forte corrélation entre Lex et marqueurs Glast NSC a déjà été observé dans Daynac et al. 9 étudier. Cependant, l'anticorps utilisé dans la Glast technique Mich et al. Est couplé à la phycoérythrine et ne peut donc pas être adapté à l'utilisation de souris FUCCI-rouges.
Il ya plusieurs points techniques importants qui nécessitent une attention avant de trier les cellules SVZ. Tout d'abord, l'étape de dissociation est très important que le tissu cérébral doit être dissociée en cellules individuelles tout en préservant la structure enintégrité des protéines utilisées pour la stratégie de marquage de l'anticorps. 0,05% de trypsine-EDTA a été montré pour être très efficace pour dissocier SVZ tissu mais 27 l'antigène LeX a été jugée très sensible à la quasi-totalité LEX-FITC a été perdu immunofluorescence (données non présentées). Ainsi, la papaïne a été utilisée telle qu'elle était plus efficace et moins destructeur que d'autres proteases sur le tissu cérébral. Par ailleurs, ni LeX ni EGFR ni CD24 ont été affectés par le traitement de la papaïne. Il convient de noter que le marquage de l'anticorps a été modifié si le traitement à la papaïne a dépassé 15 min. Nous avons obtenu les meilleurs résultats avec un traitement à la papaïne de 10 min avec une dissociation associé mécanique (pipette de haut en bas 20 fois).
Le revêtement de poly-D-Lysine permet la culture de cellules adhérentes et la formation de colonies après plusieurs jours de culture. Il est maintenant largement admis que des essais in vitro est livré avec leurs limitations 28,29. Nous vous recommandons de déterminer que le premier cycle de cellule pourles cellules subissant au moins une division ultérieure de rester aussi près que possible du phénotype in vivo dans des cellules.
Il convient de mentionner que les protéines Geminin (fluorescence verte) et CDT1 (fluorescence rouge) utilisée pour concevoir le système FUCCI 23 ont été précédemment indiqué comme étant abondamment exprimé par les cellules progénitrices neurales pendant la neurogenèse précoce chez la souris 30 dans le cerveau et les tissus adultes 9,25 . Bien que le mKO2-hCdt1 (30/120) construction a été principalement utilisé dans la présente étude pour suivre la phase G1 à fluorescence rouge, l'utilisation des deux constructions [mKO2-hCdt1 (30/120) et Mag-hGem (1/110) ] pourrait être envisagé pour permettre la visualisation des principales phases du cycle cellulaire (G 1 et 2 SG / M) ainsi que le G 1 / S 23 transition. Le principal inconvénient de l'imagerie à double couleur est les jeux compatibles limitées de fluorescence qui peuvent encore être utilisés pour le marquage des cellules. Une solution consiste à utiliser separatisur des colonnes. Par exemple, nous avons appauvri avec succès la fraction CD24-positif à partir de cellules en utilisant des colonnes de séparation avant le tri de cellules et de vivre-imagerie que nous avons utilisé un anticorps CD24-PE qui partageait la même longueur d'onde d'émission de la fluorescence FUCCI-Rouge 25.
Peu d'études se sont penchées sur la longueur du cycle cellulaire des populations de SVZ de souris adultes. La longueur totale du cycle cellulaire obtenue avec notre technique est proche de celle estimée in vitro par Costa et al. 21, mais nous avons réussi pour la première fois à distinguer les différentes phases du cycle cellulaire. Dans une étude in vivo, Ponti et al. 22 utilisé l'incorporation d'analogues de la thymidine pour déterminer la dynamique de la prolifération des différentes populations de cellules SVZ. Cependant, ils ne pouvaient ni effectuer une surveillance continue de cycle cellulaire, ni suivre les cellules au niveau d'une seule cellule. Cela pourrait être un problème, car il a été montré qu'une forte hétérogénéité existe esprithin un SVZ population cellulaire donnée 22,25. Nous décrivons ici une alternative technique in vitro, facile à installer, qui permet l'imagerie en temps réel des phases du cycle cellulaire de différentes populations adultes neurogéniques au niveau d'une seule cellule.
Comprendre la régulation du cycle cellulaire des cellules et progéniteurs souches neurales reste un défi pour le développement de nouvelles approches thérapeutiques dans le contexte du vieillissement ou du cerveau pathologies. Notre protocole peut donc avoir un large éventail d'applications. Dans le contexte du vieillissement, cette technique pourrait également se révéler utile pour comprendre les effets du vieillissement sur la différenciation CNS. En effet, il est possible d'identifier les cellules souches / progénitrices neurales différenciation comme entrant dans leur intensité de fluorescence rouge est typiquement supérieur 26. Enfin, il pourrait aussi être d'intérêt pour exploiter le imagerie en temps réel continue à un niveau cellule unique pour étudier les processus intrinsèques et extrinsèques la cellule responsable de la pro de la lignéeprogression de NNC adultes.
Déclarations de divulgation
The authors declare that they have no conflict of interest.
Remerciements
Nous sommes redevables à C Joubert, V Neuville, V Barroca, J Tilliet et tout le personnel des installations pour les animaux; J à N et Baijer Dechamps pour le tri cellulaire; O. Etienne pour l'assistance technique, et A. Gouret pour son aide administrative. La cytométrie en flux et tri cellulaire ont été réalisées à l'IRCM cytométrie en flux de ressources partagées, établi par les subventions d'équipement de DIM-STEM-Pôle, INSERM, Fondation ARC, et le CEA. Ce travail a été financé par des subventions de Electricité de France (EDF). MD a une bourse de La Ligue Contre le Cancer et le LM de la Région Ile-de-France (DIM Biothérapies). Marc-André et François Mouthon D. Boussin de paternité part co-senior.
matériels
| Name | Company | Catalog Number | Comments |
| 96-well uncoated glass bottom culture plates | MatTek Corp. | P96G-1.5-5-F | |
| µ-Plates 96-well | Ibidi | 89626 | |
| Poly-D-Lysine | Millipore | A003E | |
| NeuroCult NSC Basal Medium | STEMCELL Technologies | 5700 | |
| NeuroCult NSC Proliferation Supplement | STEMCELL Technologies | 5701 | |
| Heparin | STEMCELL Technologies | 7980 | |
| EGF | Millipore | GF144 | |
| FGF-2 | Millipore | GF003 | |
| Papain | Worthington | LS003119 | |
| EBSS | Invitrogen | 24010-043 | |
| L-cysteine | Sigma | C-7352 | |
| 0.5M EDTA, pH 8.0 | Promega | V4231 | |
| DNase I | Sigma | D5025-15KU | |
| Trypsin inhibitor type II | Sigma | T9128 | Ovomucoid |
| DMEM:F12 medium | Life Technologies | 31330-038 | |
| 20 µm filter | BD Medimachine Filcon | 340622 | |
| Eppendorf microtubes 3810X | Sigma | Z606340-1000EA | |
| BSA | Sigma | A1595 | Bovine serum albumin solution |
| CD24 phycoerythrin-cyanine7 conjugate [PC7] | Life Technologies | A14776 | Mouse IgM; clone MMA. 1:50 |
| CD15/LeX fluorescein isothiocyanate [FITC] - conjugated | BD Biosciences | 332778 | Rat IgG2b; clone M1/69. 1:50 |
| Mouse anti-human LeX antibody | BD Pharmingen | 559045 | Mouse IgM; clone MAM. 1:50 |
| Alexa647 - conjugated EGF ligand | Life Technologies | E35351 | 1:200; Ax647-conjugated EGF ligand in the text |
| CompBeads | BD Biosciences | 644204 | |
| MACS LS separation columns | Miltenyi Biotec | 130-042-401 | separation columns (in the manuscript) |
| Anti-mouse IgM microbeads | Miltenyi Biotec | 130-047-301 | |
| Hoechst 33258 | Sigma | 861405 | HO (in the manuscript) |
| INFLUX cell sorter | BD Biosciences | FACS sorter (in the text) | |
| Nikon A1R confocal laser scanning microscope system attached to an inverted ECLIPSE Ti | Nikon Corp. | confocal laser scanning microscope (in the manuscript) | |
| NIS-Elements AR.4.13.01 64-bit software | Nikon Corp. | NIS-Elements software (in the manuscript) | |
| Plan Apo VC 20x DIC objective (NA: 0.75) | Nikon Corp. | ||
| ECLIPSE Ti thermostated chamber | Nikon Corp. | thermostated chamber (in the manuscript) | |
| ImageJ | RBS | ||
| FlowJo | Tree Star, Ashland, OR | ||
| FUCCI mice | RIKEN BioResource Center, JAPAN | Sakaue-Sawano et al. 2008 |
Références
- Morshead, C. M., et al. Neural stem cells in the adult mammalian forebrain a relatively quiescent subpopulation of subependymal cells. Neuron. 13, 1071-1082 (1994).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proc Natl Acad Sci USA. 106, 6387-6392 (2009).
- Doetsch, F., Caille, I., Lim, D. A., Garcia Verdugo, J. M., Alvarez Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 97, 703-716 (1999).
- Kriegstein, A., Alvarez Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Lois, C., Garcia Verdugo, J. M., Alvarez Buylla, A. Chain migration of neuronal precursors. Science. 271, 978-981 (1996).
- Fuentealba, L. C., Obernier, K., Alvarez Buylla, A. Adult neural stem cells bridge their niche. Cell stem cell. 10, 698-708 (2012).
- Rietze, R. L., et al. Purification of a pluripotent neural stem cell from the adult mouse brain. Nature. 412, 736-739 (2001).
- Fischer, J., et al. Prospective isolation of adult neural stem cells from the mouse subependymal zone. Nat Protoc. 6, 1981-1989 (2011).
- Daynac, M., et al. Quiescent neural stem cells exit dormancy upon alteration of GABAAR signaling following radiation damage. Stem Cell Res. 11, 516-528 (2013).
- Codega, P., et al. Prospective identification and purification of quiescent adult neural stem cells from their in vivo niche. Neuron. 82, 545-559 (2014).
- Mich, J. K., et al. Prospective identification of functionally distinct stem cells and neurosphere-initiating cells in adult mouse forebrain. Elife. 3, e02669 (2014).
- Capela, A., Temple, S. LeX ssea 1 is expressed by adult mouse CNS stem cells identifying them as nonependymal. Neuron. 35, 865-875 (2002).
- Calaora, V., Chazal, G., Nielsen, P. J., Rougon, G., Moreau, H. mCD24 expression in the developing mouse brain and in zones of secondary neurogenesis in the adult. Neuroscience. 73, 581-594 (1996).
- Pineda, J. R., et al. Vascular derived TGF-beta increases in the stem cell niche and perturbs neurogenesis during aging and following irradiation in the adult mouse brain. EMBO Mol Med. 5, 548-562 (2013).
- Lugert, S., et al. Quiescent and active hippocampal neural stem cells with distinct morphologies respond selectively to physiological and pathological stimuli and aging. Cell stem cell. 6, 445-456 (2010).
- Blackmore, D. G., Golmohammadi, M. G., Large, B., Waters, M. J., Rietze, R. L. Exercise increases neural stem cell number in a growth hormone dependent manner augmenting the regenerative response in aged mice. Stem cells. 27, 2044-2052 (2009).
- Bouab, M., Paliouras, G. N., Aumont, A., Forest Berard, K., Fernandes, K. J. Aging of the subventricular zone neural stem cell niche evidence for quiescence associated changes between early and mid adulthood. Neuroscience. 173, 135-149 (2011).
- Enwere, E., et al. Aging results in reduced epidermal growth factor receptor signaling diminished olfactory neurogenesis and deficits in fine olfactory discrimination. The Journal of neuroscience the official journal of the Society for Neuroscience. 24, 8354-8365 (2004).
- Maslov, A. Y., Barone, T. A., Plunkett, R. J., Pruitt, S. C. Neural stem cell detection characterization and age related changes in the subventricular zone of mice. The Journal of neuroscience the official journal of the Society for Neuroscience. 24, 1726-1733 (2004).
- Tropepe, V., Craig, C. G., Morshead, C. M., van der Kooy, D. Transforming growth factor alpha null and senescent mice show decreased neural progenitor cell proliferation in the forebrain subependyma. The Journal of neuroscience the official journal of the Society for Neuroscience. 17, 7850-7859 (1997).
- Costa, M. R., et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138, 1057-1068 (2011).
- Ponti, G., et al. Cell cycle and lineage progression of neural progenitors in the ventricular-subventricular zones of adult mice. Proc Natl Acad Sci U S A. 110, 1045-1054 (2013).
- Sakaue Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell cycle progression. Cell. 132, 487-498 (2008).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of visualized experiments JoVE. , (2010).
- Daynac, M., et al. TGFbeta lengthens the G1 phase of stem cells in aged mouse brain. Stem cells. 32, 3257-3265 (2014).
- Roccio, M., et al. Predicting stem cell fate changes by differential cell cycle progression patterns. Development. 140, 459-470 (2013).
- Walker, T. L., Kempermann, G. One mouse two cultures isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice. Journal of visualized experiments JoVE. , e51225 (2014).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres re evaluating the relationship. Nat Methods. 2, 333-336 (2005).
- Pastrana, E., Silva Vargas, V., Doetsch, F. Eyes wide open a critical review of sphere formation as an assay for stem cells. Cell stem cell. 8, 486-498 (2011).
- Spella, M., et al. Licensing regulators Geminin and Cdt1 identify progenitor cells of the mouse CNS in a specific phase of the cell cycle. Neuroscience. 147, 373-387 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon