A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تنقية وRefolding إلى اميلويد الألياف من (صاحب)
In This Article
Summary
A two-step chromatographic method is described for the purification of recombinant Shadoo protein expressed as inclusion bodies in Escherichia coli, as well as a protocol to fibrillate purified Shadoo into amyloid structures.
Abstract
نظام كولاي القولونية التعبير هو أداة قوية لإنتاج بروتينات حقيقية النواة المؤتلف. نستخدمها لإنتاج Shadoo، وهو بروتين عائلة بريون. وأعرب طريقة الكروماتوغرافي لتنقية (صاحب) 6 -tagged Shadoo المؤتلف كما هو وصفها الهيئات إدراج. وsolubilized الهيئات إدراجها في 8 M اليوريا وملزمة لني 2+ العمود -charged لأداء أيون التقارب اللوني. ومزال البروتينات ملزمة متدرجة من إميدازول. يتعرض الكسور التي تحتوي على البروتين Shadoo إلى استبعاد حجم اللوني للحصول على بروتين عالي النقاء. في خطوة تنقية النهائي Shadoo والمحلاة لإزالة الأملاح واليوريا وإميدازول. البروتين Shadoo المؤتلف هو كاشف المهم للدراسات الفيزيائية الحيوية والكيميائية الحيوية من اضطرابات التشكل البروتين التي تحدث في أمراض البريون. أظهرت العديد من التقارير أن الأمراض العصبية بريون تنشأ من ترسب طعنةلو أمرت الألياف اميلويد. / ترد بالوسط الأساسية عينة البروتوكولات التي تصف كيفية fibrillate Shadoo إلى الألياف اميلويد في الحمضية ومحايدة. الطرق حول كيفية إنتاج وfibrillate Shadoo يمكن أن تسهل البحوث في المختبرات العاملة في مجال الأمراض بريون، لأنه يسمح لإنتاج كميات كبيرة من البروتين بطريقة سريعة ومنخفضة التكلفة.
Introduction
أمراض الاعصاب بريون، التي تشمل البقري مرض جنون البقر في، سكرابي في الأغنام ومرض كروتزفيلد جاكوب في البشر، هي قاتلة وغير قابل للشفاء. تتميز أمراض البريون من قبل التغييرات متعلق بتكوين من بروتين بريون الخلوي تتكون أساسا من α-اللوالب، إلى منطقة β ورقة عبر التخصيب اميلويد الملتزم 1،2. عبر β-هياكل تحتوي على المكتظ وأمر غاية β اوراق مثل البلورية استقرت مع الروابط الهيدروجينية 3،4. amyloids بريون يمكن نسخ الذاتي المناسب إلى خيوط β على حافة المتزايدة التي توفر نموذجا لتوظيف وتحويل وحدة البروتين أحادى.
وفقا لفرضية "البروتين فقط"، والملتزم اميلويد من بروتين بريون هي الوكيل الوحيد المعدية. ومع ذلك، فقد تم اقتراح بعض الجزيئات الحيوية الأخرى على أنها ضرورية لاضطرابات بريون. على سبيل المثال، يعتقد أن أغشية الخلايا لتكون مكانا حيث conversiعلى سيقام وقد أظهرت بعض الدهون سالبة الشحنة لتعزيز 5،6 عملية التحويل. وبالإضافة إلى ذلك، قد تكون بعض البروتينات أيضا تشارك في أمراض البريون. على وجه التحديد، هناك اثنين آخرين من أعضاء الأسر من البروتين بريون: Doppel وShadoo 7،8. Doppel لديها بنية جامدة نسبيا استقر مع الجسور دى كبريتيد وفشل لبلمرة الذات ومجموع المباراتين لييفات اميلويد 9. في المقابل، على غرار بروتين بريون، يمكن Shadoo اعتماد هيكل المخصب ورقة β-والزميلة الذاتي في الهياكل ييف اميلويد. تبين أن Shadoo يمكن fibrillate في ظل ظروف الأم أو على الأغشية ملزمة سالبة الشحنة 10،11. تحويل Shadoo إلى ألياف تشبه اميلويد قد تترافق مع أمراض. في الواقع، وغير مفهومة الآليات التي هياكل تشبه اميلويد تسبب المرض.
Shadoo يتحمل مجال مسعور (HD)، وسلسلة من جنبا إلى جنب الارجنتين / الغليسين يكرر ر مماثلس الجزء N-محطة للبروتين بريون (الشكل 1A). كما-N محطة جزء من بروتين بريون، وغاية اتهم Shadoo بشكل إيجابي ويبدو أن غير منظم أصلا البروتين 11،12. يبدو Shadoo أن تكون ذات صلة وظيفيا إلى اضطرابات بريون أنه يمكن ربط مباشرة بروتين بريون. بالإضافة إلى ذلك، ينظم التعبير إلى أسفل أثناء بريون أمراض 13،14. ومع ذلك، لم يثبت حتى الآن دور Shadoo في مرض بريون.
وضعنا البلازميد التي تحمل تسلسل ترميز الجين الماوس Shadoo. تم استخدام البلازميد لتحويل E. القولونية لإنتاج N-صاحب محطة 6 الانصهار البروتين Shadoo. تم تأسيس هذا النظام التعبير بشكل جيد في مختبرنا ويستخدم عادة في مشاريعنا الجارية 6،15،16. قضية مهمة للتعبير عن Shadoo هو اختيار E. سلالة القولونية. بينما يستخدم BL21 المختصة سلالة بكتيرية عادة للتعبير عن المؤيد المؤتلفوأعرب عن البروتينات Shadoo بنجاح وتنقيته فقط من سلالة بكتيرية تحول SoluBL21. SoluBL21 E. المختصة القولونية هي متحولة تحسين BL21 سلالة المضيف المتقدمة لإنتاج البروتينات التي التعبير في BL21 الأم أعطى أي منتج قابل للذوبان يمكن كشفها. التعبير عن مستوى عال من Shadoo في SoluBL21 E. القولونية يؤدي إلى تراكم البروتين في الهيئات إدراج. كسمة عامة، عندما يتم التعبير عن درجة عالية من بروتين غير الناطقين بها في E. القولونية، هذا البروتين يميل إلى تتراكم في الهيئات إدراج غير قابلة للذوبان. Shadoo ربما المجاميع من خلال التفاعلات غير التساهمية مسعور أو الأيونية (أو مزيج من الاثنين معا) إلى البنى الدينامية التخصيب التي شكلتها البروتين مطوية بدرجات متفاوتة. ونتيجة لذلك، تتكون تنقية اثنين على الأقل من الخطوات التالية: (أ) فصل انتقائي من البروتين من الجزيئات الحيوية الأخرى في وسط تمسخ، و (ثانيا) من استعادة الطبيعة من البروتين النقي يستخدم في المختبر للطيالتقنيات.
وقد تحقق الفصل الانتقائي للShadoo في حل العازلة التي تحتوي على اليوريا 8M (أو بدلا من ذلك 6M الجوانيدين حمض الهيدروكلوريك). ويمكن أن يتم إزالة اليوريا واستعادة الطبيعة من البروتين عن طريق تطبيق بروتوكولات مختلفة: (ط) استعادة الطبيعة في محلول درجة الحموضة الحمضية للحصول على غير منظم البروتين Shadoo أحادى، أو (ب) استعادة الطبيعة في حل من الرقم الهيدروجيني ≥ 7 للحصول على Shadoo بلمرة إلى ألياف الأميلويد مستقرة بزخارف عبر β ورقة مميزة.
Protocol
1. جيل من البلازميد وShadoo التعبير
ملاحظة: ترميز الجين الفئران البروتين Shadoo (Shadoo 25-122)، وsubcloned في التعبير ناقلات PET-28 11. تحولت هذه نسخة إلى E. القولونية SoluBL21 سلالة بكتيرية، للتعبير عن البروتين Shadoo مع علامة hexahistidine N-المحطة، (HHHHHHHHHHSSGHIDDDDKHMKGGRGGARGSARGVRGGARGASRVRVRP APRYGSSLRVAAAGAAAGAAAGVAAGLATGSGWRRTSGPGELGLEDDENGAMGGNGTDRGVYSYWAWTSG) كما هو موضح سابقا (11). يمكن طلب البلازميد من المؤلفين. الوزن الجزيئي للShadoo تحسب من تسلسل الأحماض الأمينية منه هو 12،243.2 دا.
ملاحظة: تنفيذ كافة التلاعب مع البكتيريا تحت غطاء تدفق laminal أو بالقرب من بنسن لهب.
- تحويل البكتيريا SoluBL21 المختصة مع PET-28-صاحب 6 -Shadoo البلازميد، وذلك باستخدام بروتوكول الصدمة الحرارية القياسية. لهذا المزيج 1-5 ميكرولتر من البلازميد (عادة 10 خريج إلى 100نانوغرام) في 50 ميكرولتر من البكتيريا في أنبوب. أداء الصدمة الحرارية في 42 درجة مئوية لمدة 45 ثانية.
- الثقافة تتحول البكتيريا عند 37 درجة مئوية حتى A 600 من 0،5-0،7 في لوريا، Bertani المتوسطة تستكمل مع 40 ملغ / مل الكانامايسين (الشكل 1B).
- حمل Shadoo التعبير O / N بإضافة 240 ميكروغرام / مل الآيزوبروبيل-β-D-thiogalactopyranoside، ITPG، إلى الثقافة. البكتيريا الثقافة تحت تهتز في 150 دورة في الدقيقة عند 37 درجة مئوية. ملاحظة: عادة، تصل ثقافة البكتيرية A 600 من 3 O / N.
ويمكن تخزين تحولت البكتيريا في -80 ° C لإنتاج البروتين في المستقبل: مذكرة. لهذا، إضافة 10٪ -50٪ (ت / ت) الجلسرين معقم إلى قسامات الثقافة البكتيرية وتجميدها في -80 ° C.

الشكل 1. مخطط Shadoo التعبير بناء، والبكتيريا تحول وتحريض Shadoo التعبير (كما هو موضح في الخطوة 1). (A) وبناء التعبير عن Shadoo بترميز علامة hexahistidine تنصهر إلى N-محطة من البروتين، NT. ويبين المخطط أن بروتين Shadoo يحتوي يكرر الأساسية أرجينين / الجلايسين (اسطوانة الخضراء)، مجال مسعور (HD)، وموقع N-بالغليكوزيل واحد (CHO)، تليها محطة-C (ط). تتحول (B) PET-28-صاحب 6 -Shadoo البلازميد في البكتيريا SoluBL21 بواسطة الصدمة الحرارية لمدة 45 ثانية في 42 ° C. ومطلي البكتيريا تتحول على أجار انتقائية تحتوي على 40 ميكروغرام / مل الكانامايسين. ويستخدم مستعمرة واحدة من لوحة لتطعيم ثقافة في 1،000-3،000 مل شاكر القارورة. هو فعل التعبير عن بروتين المؤتلف مع IPTG 1 ملم. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تنقية Shadoo البروتين عن طريق انخفاض ضغط اللوني السائل (LPLC)
- تحلل الخلايا وفيclusion إعداد الهيئات
- جمع تعليق البكتيرية ونقله في أنابيب الطرد المركزي (الشكل 2).
- تدور في 2500 x ج، لمدة 20 دقيقة في 4 درجات مئوية. إزالة طاف بواسطة الصب والكريات resuspend في 15 مل العازلة (50 ملي تريس، 10 ملي EDTA، ودرجة الحموضة 8 مع مكافحة البروتيني كوكتيل) لكل بيليه المستمدة من 500 مل من ثقافة الخلية.
ملاحظة: الكريات معلق يمكن تجميد وتخزين في -20 درجة مئوية لعدة أيام. تجميد يسهل الخلايا البكتيرية تحلل. - تحقق من الإفراط في التعبير عن البروتين المؤتلف باستخدام البكتيريا الكريات الخام عن طريق تحليل SDS-PAGE وCoomassie تلطيخ.
- لهذا، الطرد المركزي 1 مل من ثقافة البكتيرية لتكوير الخلايا. إضافة 100 ميكرولتر حل Laemmli تمسخ (277.8 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 6.8، 4.4٪ SDS، 44.4٪ ث / ت الجلسرين، 0.02٪ برموفينول الأزرق) لتكوير والحرارة عند 100 درجة مئوية لمدة 5 دقائق.
- تحميل 10 ميكرولتر من العينة إلى 12٪ هلام الأكريلاميد، تشغيل SDS-PAGE وVISUفصل اليز البروتينات التي Coomassie تلطيخ.
- إضافة تريتون X-100 إلى 0.5٪ تركيز النهائي لبيليه معلق تماما من 2.1.2).
- احتضان تعليق في حمام مائي عند 37 درجة مئوية لمدة 30 دقيقة.
- يصوتن تعليق لمدة 5 دقائق في 6-12 ميكرون الذروة إلى الذروة السعة في الماء المثلج لليز الخلايا البكتيرية.
- نقل sonicated تعليق في نظيفة 50 مل أنابيب الطرد المركزي.
- أنابيب الطرد المركزي في 15000 x ج لمدة 15 دقيقة على 4 درجات مئوية.
- إزالة طاف بواسطة الصب وإضافة 5 مل من العازلة ملزمة (20 ملي تريس، حمض الهيدروكلوريك العازلة، ودرجة الحموضة 7.4، 0.5 M كلوريد الصوديوم، 8 M اليوريا، 5 ملي إيميدازول) في أنبوب.
- مكان الأنابيب على عجلة دوارة O / N ل resuspend تماما البروتينات من الهيئات إدراج.
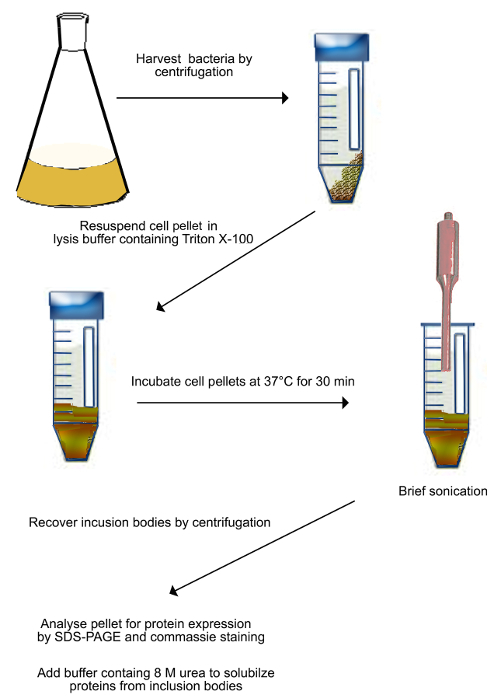
الشكل 2. مخطط تنقية إدراجويتم حصاد الهيئات (كما هو موضح في الخطوة 2.1). تحولت البكتيريا معربا عن Shadoo بواسطة الطرد المركزي ومعلق في المخزن المؤقت تحلل. وحضنت تعليق عند 37 درجة مئوية لمدة 30 دقيقة، ثم sonicated لكسر ميكانيكيا الخلايا البكتيرية. يتم صوتنة على الجليد لمنع عينة التدفئة. ويتم حصاد الخلايا المكسورة بواسطة الطرد المركزي ومعلق في العازلة التي تحتوي على 8 M اليوريا لإذابة البروتينات من الهيئات إدراج. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم. - ني 2+ -affinity اللوني
ملاحظة: يتم تنفيذ اللوني على نظام FPLC باستخدام -charged ني 2+، 5 مل سيفاروز العمود خالب (الشكل 3A). يتم تحميل جميع الحلول على عمود مع معدل التدفق من 1 مل / دقيقة.- ضخ 10 مل من 0.2 M NISO حل 4 الماء في العمود سيفاروز من أجل توجيه الاتهام لمع -ions ني 2+.
- تتوازن العمود المكلفة ني 2+ -ions عن طريق حقن 30-50 مل من العازلة ملزمة تحتوي على تركيز منخفض من إميدازول (20 ملي تريس، حمض الهيدروكلوريك العازلة، ودرجة الحموضة 7.4، 0.5 M كلوريد الصوديوم، 8 M اليوريا، 5 ملي إيميدازول).
- تحميل البروتينات solubilized اليوريا مع حقن حلقة 50 مل.
- استرداد جزء التدفق من خلال من خلال غسلها جيدا العمود مع 10 مل منخفض إميدازول العازلة ملزمة (20 ملي تريس، حمض الهيدروكلوريك العازلة، ودرجة الحموضة 7.4، 0.5 M كلوريد الصوديوم، 8 M اليوريا، 5 ملي إيميدازول) من أجل إزالة الحد الأقصى من البروتينات غير منضم من العمود.
- غسل العمود مع 50-100 مل من العازلة الغسيل (20 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 7.4، 0.5 M كلوريد الصوديوم، 8 M اليوريا، و 80 ملي إميدازول) لأزل البروتينات غير ملزمة على وجه التحديد إلى العمود.
- تطبيق الانحدار الخطي 15 دقيقة من 80-800 ملي إيميدازول في المنطقة العازلة التي تحتوي على 20 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 7.4، 0.5 M كلوريد الصوديوم، 8 M اليوريا. جمع 1 مل الكسور أثناء تطبيق التدرج. ملاحظة: يتم مزال البروتينات صاحب الموسومة الطرافةها التدرج من العازلة التي تحتوي على إميدازول (المستخدمة كمنافس).
- اتخاذ قسامة 8 ميكرولتر من كل جزء وإضافة 4 ميكرولتر 4X Laemmli حل تمسخ (انظر 2.1.3.1). الحلول الحرارة عند 100 درجة مئوية لمدة 5 دقائق.
- تحميل 10 ميكرولتر من حجم البروتين علامة و 10 ميكرولتر من كل عينة إلى 12٪ هلام الأكريلاميد، تشغيل SDS-PAGE وتصور البروتينات مفصولة Coomassie تلطيخ. ملاحظة: الوزن الجزيئي للShadoo تحسب تشكل تسلسل الأحماض الأمينية هو 12،243.2 دا.
- تجمع جميع الكسور التي تحتوي Shadoo.
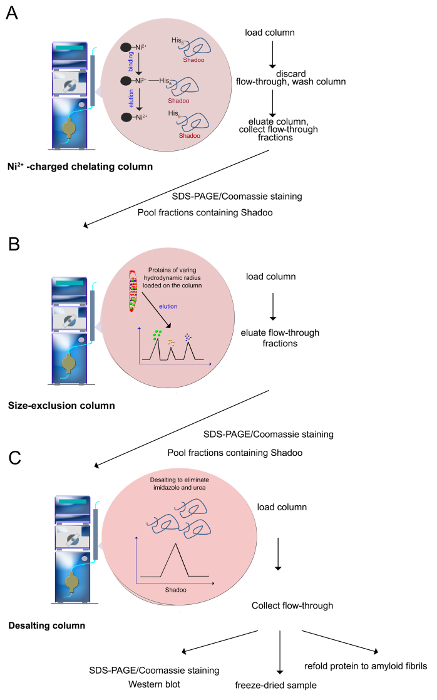
الشكل 3. إجراء تنقية (كما هو موضح في الخطوات 2،2-2،4). (A) ني 2+ -ions يمكن تنسيقها بواسطة بقايا الحامض الاميني، مما يسمح للانتقائية تنقية البروتينات الموسومة polyhistidine. يستخدم إميدازول إلى أزل البروتين، من خلالقدرته على التنسيق مع ني 2+ أيون وتهجير البروتين منضم. (B) والبروتينات متفاوتة دائرة نصف قطرها الهيدروديناميكية التي تم الإبقاء على ني 2+ -column يتم فصل على عمود حجم الإقصاء. ومزال البروتينات من أكبر إلى أصغر حجما. (C) قبل الاستخدام، يتم تجميع الكسور التي تحتوي Shadoo والمحلاة لإزالة اليوريا، إميدازول والأملاح. وتشمل فحوصات مراقبة الجودة SDS-PAGE / Coomassie تلطيخ، النشاف الغربي. تنقيته Shadoo يمكن تجميد المجفف. مجفف بالتجميد Shadoo غير مستقر لعدة أشهر عند تخزينها في -20 ° C. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم. - استبعاد حجم اللوني
ملاحظة: تتكون الخطوة الثانية في تنقية اللوني حجم الإقصاء الذي يفصل البروتين Shadoo من بروتينات أخرى شارك مزال خلال الخطوة الأولى تنقية(الشكل 3B).- تتوازن العمود Superdex 120 مل إجمالي حجم السرير عن طريق حقن 250 مل من 20 ملي تريس، حمض الهيدروكلوريك العازلة، ودرجة الحموضة 7.4، 0.5 M كلوريد الصوديوم، 8 M اليوريا بمعدل تدفق 1.5 مل / دقيقة.
- تحميل الكسور المجمعة التي تحتوي على Shadoo من 2.2.9 على العمود معايرتها. جمع 1 مل الكسور بعد حجم عمود باطل من 40 مل على تدفق مستمر من المخزن المؤقت المذكور أعلاه.
- اتخاذ قسامة 10 ميكرولتر من كل جزء وإجراء تحليل SDS-PAGE Coomassie وتلطيخ كما هو موضح أعلاه لمعرفة الكسور التي تحتوي على Shadoo.
- الكسور التي تحتوي على بركة سباحة Shadoo.
- تحلية
ملاحظة: إجراء تحلية يزيل الأملاح، إميدازول واليوريا للحصول على البروتين Shadoo المؤتلف في منطقة عازلة مناسبة لإجراء المزيد من الدراسات الفيزيائية الحيوية والكيمياء الحيوية (الشكل 3C). يمكن الحصول على النتيجة نفسها dialyzing عينات ضد المخزن المؤقت.- تتوازن عمود إزالة الملوحة من 53 مل مع 150 ملمن 10 ملي العازلة خلات الأمونيوم، ودرجة الحموضة 5، بمعدل تدفق 5 مل / دقيقة.
- تحميل تجميع الكسور Shadoo على العمود. على حقن المخزن المؤقت خلات الأمونيوم جمع يدويا الكسور التي تظهر زيادة في إشارة عند 280 نانومتر في إخراج كاشف الأشعة فوق البنفسجية.
- تجميد تجفيف Shadoo المحلاة وتخزينها في -20 ° C.
- حل Shadoo مجفف بالتجميد في وقائية كافية، مثل 10 ملي العازلة خلات الصوديوم، ودرجة الحموضة 5، قبل استخدامها.
ملاحظة: يمكن إزالة العلامة polyhistidine مع إنتيروكيناز.
3. في المختبر تجميع Shadoo إلى اميلويد الألياف في الفسيولوجية ودرجة الحموضة
ملاحظة: المجاميع البروتين Shadoo وعفوية تشكل الألياف في الرقم الهيدروجيني ≥ 7 11.

الرقم 4. مخطط Shadoo refolding إلى الألياف اميلويد (كما descriالسرير في الخطوة 3). تحويل تنقية Shadoo تلقائيا إلى الألياف اميلويد عندما يذوب في المخزن الرقم الهيدروجيني ≥ 7. في حالة المحاليل الحمضية، Shadoo يعتنق الألياف اميلويد على الحضانة مع 1 M شبكة التنمية العالمية، حمض الهيدروكلوريك في حين تهتز. وتشمل فحوصات مراقبة الجودة المجهر الإلكتروني وتى اتش تى تلطيخ. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- تمييع Shadoo إلى تركيز النهائي من 2 ميكرومتر في منطقة عازلة 20 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 7.4. قياس تركيز من خلال قياس الكثافة البصرية من الحل عند 280 نانومتر وباستخدام معامل الانقراض استنتاجها من تكوين Shadoo الأحماض الأمينية 20970.
- احتضان 500 ميكرولتر من الحل في أنبوب من البلاستيك مخروطي الشكل في 4 درجة مئوية لمدة بضعة أسابيع، للسماح عفوية تحويل البروتين إلى هياكل اميلويد (الشكل 4).
- إضافة الطازجة thioflavin T (تى اتش تى) إلى بغية دراسته واقراره النهائيةntration من 10 ميكرومتر إلى قسامة 100 ميكرولتر من الحل Shadoo. احتضان الحل لمدة 5 دقائق على RT. قياس الانبعاثات مضان 460-520 نانومتر باستخدام الطول الموجي الإثارة من 435 نانومتر إلى التحقق من وجود هياكل اميلويد 17.
4. في المختبر تجميع Shadoo إلى اميلويد الألياف في حمضي بالوسط
- تمييع Shadoo في 1 M GdnHCl، عازلة 20 ملي نا-خلات، ودرجة الحموضة 5 إلى تركيز النهائي من 2 ميكرومتر.
- احتضان 500 ميكرولتر من هذا الحل في أنبوب مخروطي مع الهز المستمر عند 37 درجة مئوية، لمدة 3-7 أيام.
- تحقق من وجود الألياف اميلويد بإضافة تى اتش تى لقسامة من الحل كما هو الحال في 3.3.
- Dialyze تعليق تم الحصول عليها مقابل 10 العازلة ملي نا-خلات، ودرجة الحموضة 5.0، لتنقية Shadoo الألياف اميلويد.
- تخزين الألياف النقاء في +4 درجة مئوية.

الشكل 5. ممثل النتائج. الكسور بروتين مزال من ني 2+ -charged العمود خالب (A) والعمود استبعاد حجم (B) تم تحليلها باستخدام SDS-PAGE وCoomassie تلطيخ. تم تقييم وتحديد Shadoo النقي باستخدام SPRN مكافحة Shadoo الأجسام المضادة (C). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يتم الحصول على حوالي 5-10 ملغ من البروتين المنقى Shadoo للتر الواحد من ثقافة البكتيرية. وهناك حاجة إلى تنقية من خطوتين للحصول على Shadoo المؤتلف عالية النقاء. يتم تنفيذ الخطوة الأولى من قبل اللوني تقارب مع العمود -charged ني 2+ أن يحتفظ صاحب-البروتينات الموسومة. يتعرض كسور م...
Discussion
ويرد بروتوكول سهلة وفعالة لكلا التعبير وتنقية كمية كبيرة من الماوس المؤتلف البروتين Shadoo. الطريقة الموصوفة يسمح ذوبان ناجحة وتنقية (صاحب 6) -tagged البروتين Shadoo المؤتلف. من المهم، كما ورد في العنوان، وأنه عندما أعرب في بكتيريا E. بدائيات النواة القولونية Sha...
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to acknowledge Natalie Doude and David Westerway (University of Alberta) for providing us Sho cDNA, Christophe Chevalier (INRA) for plasmid construction, Michel Brémont (INRA) for providing us BL21Sol bacteria; Christine Longin (INRA) for TEM assistance and Edith Pajot-Augy (INRA) for comments and proofreading.
Materials
| Name | Company | Catalog Number | Comments |
| AKTA FPLC | GE, Amersham | # 1363 | |
| HiLoad 16/60 Superdex | GE Healthcare | 17-1069-01 | |
| HiTrap IMAC | GE Healthcare | GE17-0920-05 | |
| HiPrep26/10 Desalting column | GE Healthcare | GE17-5087-01 | |
| SoluBL21 Competent E. coli | Genlantis | C700200 | |
| pET-28b+ | Novogen | 69865-3 | |
| IPTG | Sigma-Aldrich | I6758 | |
| LB-Broth medium | Sigma-Aldrich | L3022 | |
| Eppendorf Biophotometar | Eppendorf | 550507804 | |
| Trito X-100 | Life Technologies | 85111 | |
| NiSO4 | Sigma-Aldrich | 656895 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Tris-HCl | Sigma-Aldrich | RES3098T | |
| Protease Inhibitor Cocktail Tablets | Roche | 4693116001 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Imidazol | Sigma-Aldrich | I5513 | |
| Gdn-HCl | Sigma-Aldrich | G4505 | |
| protein size marker | Thermo Fisher Scientific | 26620 |
References
- Biasini, E., Turnbaugh, J. A., Unterberger, U., Harris, D. A. Prion protein at the crossroads of physiology and disease. Trends in Neurosciences. 35, 92-103 (2012).
- Colby, D. W., Prusiner, S. B. De novo generation of prion strains. Nature Reviews. Microbiology. 9, 771-777 (2011).
- Chiti, F., Dobson, C. M. Protein misfolding, functional amyloid, and human disease. Annual Review of Biochemistry. 75, 333-366 (2006).
- Nelson, R., et al. Structure of the cross-beta spine of amyloid-like fibrils. Nature. 435, 773-778 (2005).
- Murphy, R. M. Kinetics of amyloid formation and membrane interaction with amyloidogenic proteins. Biochimica et Biophysica Acta. 1768, 1923-1934 (2007).
- Steunou, S., Chich, J. F., Rezaei, H., Vidic, J. Biosensing of lipid-prion interactions: insights on charge effect, Cu(II)-ions binding and prion oligomerization. Biosensors & Bioelectronics. 26, 1399-1406 (2010).
- Watts, J. C., Westaway, D. The prion protein family: diversity, rivalry, and dysfunction. Biochimica et Biophysica Acta. 1772, 654-672 (2007).
- Westaway, D., Daude, N., Wohlgemuth, S., Harrison, P. The PrP-like proteins Shadoo and Doppel. Topics in Current Chemistry. 305, 225-256 (2011).
- Baillod, P., Garrec, J., Tavernelli, I., Rothlisberger, U. Prion versus doppel protein misfolding: new insights from replica-exchange molecular dynamics simulations. Biochemistry. 52, 8518-8526 (2013).
- Daude, N., et al. Wild-type Shadoo proteins convert to amyloid-like forms under native conditions. Journal of Neurochemistry. 113, 92-104 (2010).
- Li, Q., et al. Shadoo binds lipid membranes and undergoes aggregation and fibrillization. Biochemical and Biophysical Research Communications. 438, 519-525 (2013).
- Watts, J. C., et al. The CNS glycoprotein Shadoo has PrP(C)-like protective properties and displays reduced levels in prion infections. The EMBO Journal. 26, 4038-4050 (2007).
- Watts, J. C., et al. Protease-resistant prions selectively decrease Shadoo protein. PLoS Pathogens. 7, e1002382 (2011).
- Westaway, D., et al. Down-regulation of Shadoo in prion infections traces a pre-clinical event inversely related to PrP(Sc) accumulation. PLoS Pathogens. 7, e1002391 (2011).
- Chevalier, C., et al. PB1-F2 influenza A virus protein adopts a beta-sheet conformation and forms amyloid fibers in membrane environments. The Journal of Biological Chemistry. 285, 13233-13243 (2010).
- Tarus, B., et al. Oligomerization paths of the nucleoprotein of influenza A virus. Biochimie. 94, 776-785 (2012).
- Biancalana, M., Koide, S. Molecular mechanism of Thioflavin-T binding to amyloid fibrils. Biochimica et Biophysica Acta. 1804, 1405-1412 (2010).
- Minic, J., Sautel, M., Salesse, R., Pajot-Augy, E. Yeast system as a screening tool for pharmacological assessment of g protein coupled receptors. Current Medicinal Chemistry. 12, 961-969 (2005).
- Schein, C. H. A cool way to make proteins. Nature Biotechnology. 22, 826-827 (2004).
- Sorensen, H. P., Mortensen, K. K. Advanced genetic strategies for recombinant protein expression in Escherichia coli. Journal of Biotechnology. 115, 113-128 (2005).
- Zhang, J., et al. Disruption of glycosylation enhances ubiquitin-mediated proteasomal degradation of Shadoo in Scrapie-infected rodents and cultured cells. Molecular Neurobiology. 49, 1373-1384 (2014).
- Englund, P. T. The structure and biosynthesis of glycosyl phosphatidylinositol protein anchors. Annual Review of Biochemistry. 62, 121-138 (1993).
- Puig, B., Altmeppen, H., Glatzel, M. The GPI-anchoring of PrP: implications in sorting and pathogenesis. Prion. 8, 11-18 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved