需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
纯化及复性的淀粉样纤维(他)
摘要
A two-step chromatographic method is described for the purification of recombinant Shadoo protein expressed as inclusion bodies in Escherichia coli, as well as a protocol to fibrillate purified Shadoo into amyloid structures.
摘要
大肠杆菌表达系统是一种强大的工具,用于生产重组真核蛋白。我们用它来生产Shadoo,属于家庭朊病毒蛋白。作为包涵体被描述为(他)6 -tagged重组Shadoo纯化的色谱法表示。包涵体溶解于8M尿素和结合到镍离子-charged柱进行离子亲和层析。结合的蛋白质通过咪唑的梯度洗脱。含有Shadoo蛋白质级分进行尺寸排阻色谱法,以获得高度纯化的蛋白质。在最后的步骤纯化Shadoo脱盐以除去盐,脲和咪唑。重组Shadoo蛋白是用于在朊病毒病发生的蛋白质构象疾病的生物物理和生物化学研究的重要试剂。许多报告表明,朊病毒神经退行性疾病,从刺的沉积起源乐,有序的淀粉样纤维。描述如何纤化Shadoo成淀粉样纤维在酸性和中性样品协议/碱性pH值呈现。关于如何产生和原纤化Shadoo可以促进研究在实验室中工作的朊病毒疾病,因为它允许生产的快速和低成本的方式大量蛋白质的方法。
引言
朊病毒神经变性疾病,其中包括牛海绵状脑病在牛,羊瘙痒在绵羊和Creutzfeldt-Jakob病在人类,是致命的,无法治愈的。朊病毒病的特征在于细胞朊病毒蛋白的构象变化主要由α螺旋的,进入交叉β-片富含淀粉样蛋白构象1,2-。交叉β-结构包含密集和高度有序的结晶状β片具有稳定的氢键3,4。朊病毒淀粉样蛋白可以自我复制由于β链的生长边缘提供招募的模板和转换单体蛋白质单元。
据"唯一蛋白质"假说,朊病毒蛋白的淀粉样蛋白构象是唯一的感染因子。然而,一些其它生物分子已经被提出是必不可少的朊病毒病。例如,细胞膜被认为是一个地方,conversi上发生与一些负电荷的脂质已经显示出增强了转换过程5,6。此外,某些蛋白质也可以是参与朊病毒病症。具体来说,有朊蛋白家族的另外两名成员:Doppel和Shadoo 7,8。 Doppel具有相对刚性的结构稳定化与二硫醚桥,未能自聚合和聚合到淀粉样蛋白原纤维9。与此相反,类似于朊病毒蛋白,Shadoo可以采用一个β片层富集结构和自缔成淀粉样蛋白纤维的结构。它表明,Shadoo可在天然条件下或在结合带负电荷的膜10,11原纤化。转换Shadoo成淀粉样纤维可以与病理相关联。事实上,通过淀粉样蛋白样结构引起疾病的机理知之甚少。
Shadoo熊疏水结构域(HD)等一系列串联精氨酸/甘氨酸的重复类似的牛逼Ø朊蛋白( 图1A)的N末端 部分。如朊病毒蛋白的N-端部分,Shadoo高度正电,似乎是一个本地非结构化蛋白11,12。 Shadoo似乎是功能上相关的朊病毒疾病,因为它可以直接绑定朊病毒蛋白。另外,它的表达被向下期间朊病毒病理13,14调节。然而,Shadoo的朊病毒疾病中的作用尚未建立。
我们开发了一种质粒携带鼠标Shadoo基因的编码序列。将质粒用于转化大肠杆菌大肠杆菌生产N端他的6融合Shadoo蛋白质。该表达系统是公认的在我们的实验室和我们正在进行的项目6,15,16常用。为Shadoo的表达的一个重要问题是大肠杆菌的选择大肠杆菌菌株 。而感受态BL21细菌菌株通常用于重组亲表达teins Shadoo已成功表达并只从转化SoluBL21菌株纯化。 SoluBL21主管E.大肠杆菌是BL21宿主菌株的改进的突变体,用于生产蛋白质的表达在父BL21给没有可检测的可溶性产物开发的。 Shadoo的SoluBL21 大肠杆菌高效表达大肠杆菌导致的蛋白质的积累中包涵体。作为一般特征,当非天然蛋白质高表达在大肠杆菌大肠杆菌 ,这种蛋白质往往积聚在不溶性包涵体。 Shadoo大概粒料通过非共价的疏水性或离子相互作用(或两者的组合),以通过折叠到不同程度的蛋白质形成的高度富集的动态结构。由此,纯化包括至少两个步骤:(i)从在变性介质其它生物分子的蛋白的选择性分离,以及(ii) 使用体外折叠纯化蛋白的复性技术。
Shadoo的选择性分离物在含有8M尿素(或者6M胍-HCl)的缓冲溶液来实现。 (ⅰ)复性在酸性pH溶液中,得到的非结构化单体Shadoo蛋白质,或(ii)复性pH值≥的溶液7,得到Shadoo聚合:尿素去除和蛋白质的复性可以通过应用不同的协议来实现成稳定的淀粉样蛋白纤维特性交叉β折叠基序。
研究方案
1.代质粒和Shadoo表达
注:基因编码鼠Shadoo蛋白(Shadoo 25-122),亚克隆到表达载体pET-28 11。该克隆转化 E. 大肠杆菌 SoluBL21菌株,表达Shadoo蛋白质与N-末端六组氨酸标签,(HHHHHHHHHHSSGHIDDDDKHMKGGRGGARGSARGVRGGARGASRVRVRP APRYGSSLRVAAAGAAAGAAAGVAAGLATGSGWRRTSGPGELGLEDDENGAMGGNGTDRGVYSYWAWTSG)如先前11说明。质粒可以从作者索取。 Shadoo的分子量从它的氨基酸序列计算出是12,243.2沓。
注:执行下一个分层的流罩或接近本生灯火焰与细菌的所有操作。
- 转化感受SoluBL21细菌与PET-28-他6 -Shadoo质粒,使用标准的热休克协议。对于这种混合料1〜5微升质粒(通常为10pg至100纳克)到50微升的细菌在管的。进行热休克在42℃为45秒。
- 培养转化的细菌,在37℃,直至在的Luria-Bertani培养基A 600 0.5-0.7补充有40毫克/毫升卡那霉素( 图1B)。
- 诱导Shadoo表达O / N通过加入240微克/毫升异丙基β-D-硫代半乳糖苷,ITPG,向培养。下以150rpm摇动,在37℃培养细菌。注:通常情况下,细菌培养达到600 3 O / N中。
注意:转化的细菌可以被储存在-80℃下以供将来的蛋白质生产。对于这一点,添加10%-50%(体积/体积)的无菌甘油进细菌培养等分试样并冷冻在-80℃。

图1.方案Shadoo表达Shadoo表达构建,细菌转化和诱导的(如步骤1所述)。 >(A),参考 Shadoo的表达构建体编码融合到蛋白质,Nt个的N-末端六组氨酸标签。该方案表明Shadoo蛋白含有碱性精氨酸/甘氨酸重复(绿色气缸),疏水性结构域(HD)和一个单一的N-糖基化位点(CHO),接着是C末端数(Ct)。 (B)的PET-28-他6 -Shadoo质粒在42℃下转化到SoluBL21细菌通过热休克45秒。转化的细菌铺板于含有选择性琼脂40微克/毫升卡那霉素。从板的单菌落被用于接种培养在1,000-3,000毫升摇瓶中。重组蛋白的表达诱发用1mM IPTG。 请点击此处查看该图的放大版本。
2.净化Shadoo蛋白的低压液相色谱(LPLC)
- 细胞裂解和在包涵体机构编制
- 收集细菌悬浮液,并将其转移到离心管中(图2)。
- 自旋在2500 XG,20分钟,在4℃。通过倾析和在15ml缓冲液(50mM的Tris,10mM EDTA的,pH值8与抗蛋白酶混合物)重悬粒料为从500 ml的细胞培养物衍生的每个颗粒除去上清液。
注意:重悬粒料可以冷冻并储存在-20℃下数天。冷冻利于细菌细胞裂解。 - 检查重组蛋白的使用粗细菌粒料通过SDS-PAGE分析和考马斯染色的过表达。
- 对于这一点,离心机1 ml的细菌培养物以沉淀细胞。加入100微升的Laemmli变性溶液(277.8毫摩尔Tris盐酸,pH值6.8,4.4%SDS中,44.4%w / v的甘油,0.02%溴酚蓝)以沉淀和热在100℃下5分钟。
- 负载10微升样品至12%的丙烯酰胺凝胶,运行SDS-PAGE和VISU艾莉婕考马斯亮蓝染色分离的蛋白质。
- 加入的Triton X-100至0.5%的终浓度为完全再悬浮颗粒从2.1.2)。
- 孵育悬浮液在水浴中于37℃进行30分钟。
- 超声处理该悬浮液5分钟,在6-12微米的冰冷水峰 - 峰振幅以裂解细菌细胞。
- 转移超声悬浮到50 mL的干净离心管。
- 离心管以15,000rpm×g离心15分钟,在4℃。
- 通过倾析除去上清液,加入5 ml的每管的结合缓冲液(20mM的Tris-HCl缓冲液,pH 7.4,0.5M氯化钠,8M尿素,5mM咪唑)的。
- 在旋转轮O / N将管完全悬浮的包涵体蛋白。
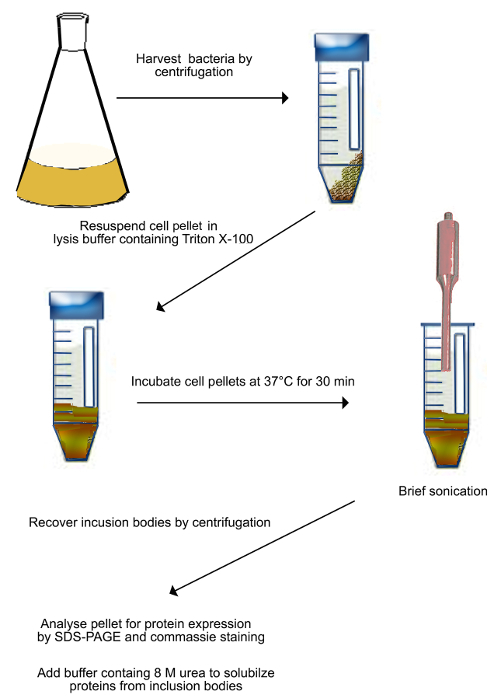
夹杂物的纯化图2.方案体(如在步骤2.1中所述)。转化的细菌表达Shadoo通过离心收集,并再悬浮于裂解缓冲液。将悬浮液在37℃下进行30分钟,然后超声处理以机械方式破坏细菌细胞。超声处理完成在冰上,以防止样品加热。破碎的细胞通过离心收集并重新悬浮于含8M尿素溶解的包涵体蛋白的缓冲。 请点击此处查看该图的放大版本。 - 镍离子-affinity色谱
注意:色谱是使用Ni 2+ -charged,加入5ml琼脂糖螯合柱(图3A)上的FPLC系统进行。所有解决方案,是与1毫升/分钟的流速的柱上。- 注入溶于10ml 0.2M的制备NiSO 4水溶液放入琼脂糖柱,以充电与镍离子-离子。
- 通过注入30〜50毫升含有咪唑的低浓度(20毫摩尔Tris-HCl缓冲液,pH值7.4,0.5M氯化钠,8M尿素,5mM咪唑)的结合缓冲液平衡装入镍2+ -离子的柱。
- 加载脲溶解出的蛋白用50毫升的注射环。
- 通过彻底清洗,用10ml低咪唑结合缓冲液(20mM的Tris-HCl缓冲液,pH 7.4,0.5M氯化钠,8M尿素,5mM咪唑)柱以除去最大未结合的蛋白质的回收流出级分从柱。
- 用50-100毫升的洗涤缓冲液(20mM的Tris-HCl,pH值7.4,0.5M氯化钠,8M尿素,80 mM咪唑)洗脱蛋白质非特异性结合到柱上的洗柱。
- 在含有20mM的Tris-HCl,pH值7.4,0.5M氯化钠,8M尿素的缓冲液适用的80-800 mM咪唑一个15分钟线性梯度。梯度应用过程中收取1毫升级分。注意:His-标记的蛋白被洗脱机智的含咪唑的缓冲公顷梯度(用作竞争者)。
- 取每个级分的8微升等分试样,并添加4μl的4倍的Laemmli变性溶液(见2.1.3.1)。热溶液在100℃下5分钟。
- 负载10微升蛋白大小标记物和10μl各样品的12%丙烯酰胺凝胶上,运行SDS-PAGE和可视化分离的蛋白质通过考马斯染色。注意:Shadoo的分子量计算出形成其氨基酸序列是12,243.2沓。
- 池包含Shadoo的所有分数。
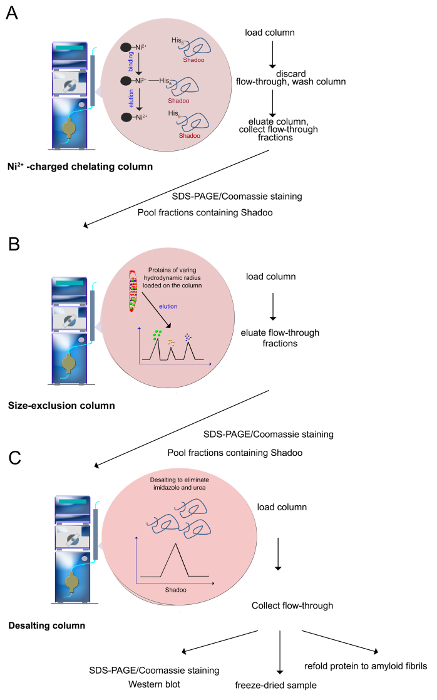
图3. 纯化步骤(如步骤2.2-2.4中描述)。 (一) 镍离子-离子可以通过组氨酸残基,这使得多组氨酸标记蛋白的选择性纯化进行协调。咪唑来洗脱蛋白质,通过其协调与镍离子-离子和取代结合蛋白质的能力。(二)不同流体力学半径被保留对Ni 2+ -column分离到一个尺寸排阻柱的蛋白质。蛋白从最大到最小的那些洗脱。(C)的使用前,含有Shadoo级分汇集和脱盐以除去尿素,咪唑和盐。质量控制实验包括SDS-PAGE /考马斯染色,免疫印迹。纯化的Shadoo可以冷冻干燥。冻干Shadoo稳定了几个月储存在-20°C下。 请点击此处查看该图的放大版本。 - 尺寸排阻色谱法
注意:第二个纯化步骤包括在尺寸排阻色谱法从该其它蛋白质在第一个纯化步骤中共同洗脱分离Shadoo蛋白(图3B)。- 平衡120ml的总床体积的Superdex柱通过注入250个毫升的20mM的Tris-HCl缓冲液,pH 7.4,0.5M氯化钠,8M的尿素以1.5毫升/分钟的流速。
- 负载合并的级分含Shadoo从2.2.9上的平衡列。为40ml时上述缓冲液的流量恒定的柱空隙容积后收集1毫升级分。
- 每次取分数的10微升等份与上述找出哪些部分包含Shadoo进行SDS-PAGE分析和考马斯亮蓝染色。
- 池部分含Shadoo。
- 脱盐
注意:脱盐过程删除的盐,咪唑和尿素以获得重组Shadoo蛋白在适合于进一步的生物物理和生物化学研究(图3C)的缓冲器。相同的结果可通过透析样品对缓冲器来获得。- 平衡53 ml的用150ml脱盐柱的10mM乙酸铵缓冲液,pH 5中,在5毫升/分钟的流速。
- 负荷集中在柱上Shadoo馏分。在注射的乙酸铵缓冲的手动收集,显示增加了信号的280nm处的UV检测器的输出的级分。
- 冷冻干燥该脱盐Shadoo并储存在-20℃。
- 溶解冻干Shadoo在适当的缓冲液,如10mM醋酸钠缓冲液,pH 5,在使用之前。
注意:聚组氨酸标签可以用肠激酶除去。
3.在体外组装Shadoo进入淀粉样蛋白原纤维在生理pH值
注:Shadoo蛋白聚集体和自发形成纤维在pH≥7月11日。

图4. 计划Shadoo复性淀粉样纤维(如descri床在步骤3)。将纯化的Shadoo自发转换成淀粉样蛋白纤维溶解在pH值≥7的缓冲器。在酸性溶液时,Shadoo温育后用1M GDN盐酸转换为淀粉样蛋白原纤维,同时摇动。质量控制检测包括电子显微镜和ThT的染色。 请点击此处查看该图的放大版本。
- 稀Shadoo至2微米的20mM的Tris-HCl缓冲液,pH 7.4的终浓度。通过测量溶液在280nm处的光密度,并使用从20970 Shadoo氨基酸组成推断的消光系数测量的浓度。
- 孵育500微升在锥形塑料管将溶液在4℃下为几个星期,以允许自发蛋白质转化为淀粉样蛋白的结构(图4)。
- 加入新鲜制备的硫磺素T(ThT的)到最终conce为10μMntration到Shadoo溶液的100μl等分的。孵育5分钟,在室温的溶液中。使用的435纳米的激发波长,以验证淀粉样结构 17的存在下测量荧光发射从460到520纳米。
4.在Shadoo 体外组装到淀粉样纤维酸性pH
- 在1M盐酸胍,20mM的醋酸钠缓冲液,pH 5稀释Shadoo到的2μM的终浓度。
- 孵育将500μl此溶液在锥形管连续振荡的,在37℃,3-7天。
- 通过加入的ThT到该溶液的等分试样在3.3检查淀粉样蛋白原纤维的存在。
- 透析得到的悬浮液对10毫乙酸钠缓冲液,pH 5.0,以纯化Shadoo淀粉样蛋白原纤维。
- 存储纯化纤维在+ 4℃。

选自Ni 2+洗脱图5 代表性的结果。蛋白馏分-charged螯合柱(A)和尺寸排阻柱( 乙 ),使用SDS-PAGE和考马斯染色进行分析。使用SPRN抗Shadoo抗体(C)纯化Shadoo的鉴定评估。 请点击此处查看该图的放大版本。
结果
每升细菌培养物中获得约5-10毫克纯化Shadoo蛋白质。两步净化需要获得高纯度的重组Shadoo。第一步骤是通过亲和层析利用Ni 2+ -charged柱,其保存His-标记的蛋白进行的。洗脱级分进行SDS-PAGE和用考马斯亮蓝(图5A)。含有Shadoo蛋白的级分汇集并通过大小排阻层析其中根据其大小分离蛋白质(Shadoo分子量为约12 kDa的)进一步纯化。在洗脱收集的级分通过SDS-PAGE /考马斯分析(
讨论
一个简单的,高效的协议为表达和大量重组小鼠Shadoo蛋白的纯化给出。所描述的方法可以成功溶解和(他的6)-tagged重组Shadoo蛋白的纯化。重要的是,如在标题所指出的,当在原核细菌大肠杆菌表达大肠杆菌 Shadoo积聚在包涵体。之前Shadoo纯化,细菌必须通过超声处理在含有的Triton X-100的缓冲液裂解。接着包涵体可溶于8M尿素变性溶液。此外,整个纯化过程必须在8M尿素缓冲液?...
披露声明
The authors have nothing to disclose.
致谢
The authors would like to acknowledge Natalie Doude and David Westerway (University of Alberta) for providing us Sho cDNA, Christophe Chevalier (INRA) for plasmid construction, Michel Brémont (INRA) for providing us BL21Sol bacteria; Christine Longin (INRA) for TEM assistance and Edith Pajot-Augy (INRA) for comments and proofreading.
材料
| Name | Company | Catalog Number | Comments |
| AKTA FPLC | GE, Amersham | # 1363 | |
| HiLoad 16/60 Superdex | GE Healthcare | 17-1069-01 | |
| HiTrap IMAC | GE Healthcare | GE17-0920-05 | |
| HiPrep26/10 Desalting column | GE Healthcare | GE17-5087-01 | |
| SoluBL21 Competent E. coli | Genlantis | C700200 | |
| pET-28b+ | Novogen | 69865-3 | |
| IPTG | Sigma-Aldrich | I6758 | |
| LB-Broth medium | Sigma-Aldrich | L3022 | |
| Eppendorf Biophotometar | Eppendorf | 550507804 | |
| Trito X-100 | Life Technologies | 85111 | |
| NiSO4 | Sigma-Aldrich | 656895 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Tris-HCl | Sigma-Aldrich | RES3098T | |
| Protease Inhibitor Cocktail Tablets | Roche | 4693116001 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Imidazol | Sigma-Aldrich | I5513 | |
| Gdn-HCl | Sigma-Aldrich | G4505 | |
| protein size marker | Thermo Fisher Scientific | 26620 |
参考文献
- Biasini, E., Turnbaugh, J. A., Unterberger, U., Harris, D. A. Prion protein at the crossroads of physiology and disease. Trends in Neurosciences. 35, 92-103 (2012).
- Colby, D. W., Prusiner, S. B. De novo generation of prion strains. Nature Reviews. Microbiology. 9, 771-777 (2011).
- Chiti, F., Dobson, C. M. Protein misfolding, functional amyloid, and human disease. Annual Review of Biochemistry. 75, 333-366 (2006).
- Nelson, R., et al. Structure of the cross-beta spine of amyloid-like fibrils. Nature. 435, 773-778 (2005).
- Murphy, R. M. Kinetics of amyloid formation and membrane interaction with amyloidogenic proteins. Biochimica et Biophysica Acta. 1768, 1923-1934 (2007).
- Steunou, S., Chich, J. F., Rezaei, H., Vidic, J. Biosensing of lipid-prion interactions: insights on charge effect, Cu(II)-ions binding and prion oligomerization. Biosensors & Bioelectronics. 26, 1399-1406 (2010).
- Watts, J. C., Westaway, D. The prion protein family: diversity, rivalry, and dysfunction. Biochimica et Biophysica Acta. 1772, 654-672 (2007).
- Westaway, D., Daude, N., Wohlgemuth, S., Harrison, P. The PrP-like proteins Shadoo and Doppel. Topics in Current Chemistry. 305, 225-256 (2011).
- Baillod, P., Garrec, J., Tavernelli, I., Rothlisberger, U. Prion versus doppel protein misfolding: new insights from replica-exchange molecular dynamics simulations. Biochemistry. 52, 8518-8526 (2013).
- Daude, N., et al. Wild-type Shadoo proteins convert to amyloid-like forms under native conditions. Journal of Neurochemistry. 113, 92-104 (2010).
- Li, Q., et al. Shadoo binds lipid membranes and undergoes aggregation and fibrillization. Biochemical and Biophysical Research Communications. 438, 519-525 (2013).
- Watts, J. C., et al. The CNS glycoprotein Shadoo has PrP(C)-like protective properties and displays reduced levels in prion infections. The EMBO Journal. 26, 4038-4050 (2007).
- Watts, J. C., et al. Protease-resistant prions selectively decrease Shadoo protein. PLoS Pathogens. 7, e1002382 (2011).
- Westaway, D., et al. Down-regulation of Shadoo in prion infections traces a pre-clinical event inversely related to PrP(Sc) accumulation. PLoS Pathogens. 7, e1002391 (2011).
- Chevalier, C., et al. PB1-F2 influenza A virus protein adopts a beta-sheet conformation and forms amyloid fibers in membrane environments. The Journal of Biological Chemistry. 285, 13233-13243 (2010).
- Tarus, B., et al. Oligomerization paths of the nucleoprotein of influenza A virus. Biochimie. 94, 776-785 (2012).
- Biancalana, M., Koide, S. Molecular mechanism of Thioflavin-T binding to amyloid fibrils. Biochimica et Biophysica Acta. 1804, 1405-1412 (2010).
- Minic, J., Sautel, M., Salesse, R., Pajot-Augy, E. Yeast system as a screening tool for pharmacological assessment of g protein coupled receptors. Current Medicinal Chemistry. 12, 961-969 (2005).
- Schein, C. H. A cool way to make proteins. Nature Biotechnology. 22, 826-827 (2004).
- Sorensen, H. P., Mortensen, K. K. Advanced genetic strategies for recombinant protein expression in Escherichia coli. Journal of Biotechnology. 115, 113-128 (2005).
- Zhang, J., et al. Disruption of glycosylation enhances ubiquitin-mediated proteasomal degradation of Shadoo in Scrapie-infected rodents and cultured cells. Molecular Neurobiology. 49, 1373-1384 (2014).
- Englund, P. T. The structure and biosynthesis of glycosyl phosphatidylinositol protein anchors. Annual Review of Biochemistry. 62, 121-138 (1993).
- Puig, B., Altmeppen, H., Glatzel, M. The GPI-anchoring of PrP: implications in sorting and pathogenesis. Prion. 8, 11-18 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。