Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Saflaştırma ve Amiloid fibrillerin kadar yeniden katlama (His)
Bu Makalede
Özet
A two-step chromatographic method is described for the purification of recombinant Shadoo protein expressed as inclusion bodies in Escherichia coli, as well as a protocol to fibrillate purified Shadoo into amyloid structures.
Özet
Escherichia coli sentezleme sistemi rekombinant ökariyotik proteinlerin üretimi için güçlü bir araçtır. Biz Shadoo prion familyasına ait bir proteini üretmek için kullanılır. Katma kütleleri tarif edildiği gibi (His) 6-etiketli rekombinant Shadoo saflaştırılması için bir kromatografik yöntem olarak ifade edilmiştir. Inklüzyon cisimcikleri, 8 M üre içinde çözülür ve iyon afinite kromatografisi gerçekleştirmek için bir Ni2 + -yüklü kolona bağlanmıştır. Bağlanmış proteinler imidazol gradyanı ile elüe edilir. Shadoo proteinini ihtiva eden fraksiyonlar bir yüksek ölçüde saflaştırılmış proteini elde etmek üzere boyut çıkarma kromatografisine tabi tutulur. Son adım saflaştırılmış Shadoo tuzlar, üre ve imidazol kaldırmak için HCl. Rekombinant Shadoo proteini prion hastalıklarda ortaya çıkan protein konformasyon bozukluklarının biyofiziksel ve biyokimyasal çalışmalar için önemli bir reaktiftir. Birçok rapor prion nörodejeneratif hastalıklar bıçak birikimi kaynaklı olduğunu gösterdile, amiloid fibrilleri emretti. Asidik ve nötr olarak amiloid fibrilleri içine Shadoo fibrillate açıklayan örnek protokoller / temel pHs sunulmuştur. Üretilmesi ve bir hızlı ve düşük maliyetli bir şekilde proteinin büyük miktarlarda üretilmesine imkan verir çünkü Shadoo, prion hastalıkları üzerinde çalışan laboratuarlarında araştırma kolaylaştırabilir liflenme ile ilgili yöntemler.
Giriş
İnsanlarda koyun ve Creutzfeldt-Jakob hastalığında sığır süngersi sığır ensefalopati, skrapisini dahil prion nörodejeneratif hastalıklar, ölümcül ve çaresiz. Prion hastalıkları esas olarak çapraz β-tabaka içine α-helisler oluşan hücresel prion proteininin konformasyonel değişiklikler ile karakterize edilen 1,2 konformer amiloid zenginleştirilmiş. Çapraz β-yapılar yoğun paketlenmiş içeren ve son derece düzenli kristal benzeri β-yaprak hidrojen bağları 3,4 ile stabilize. Prion amiloidleri işe bir şablon sağlamak ve bir monomerik protein birimi dönüştürme büyüyen kenarında β-ipliklerini nedeniyle kendini kopyalayan yapabilirsiniz.
"Protein sadece" hipotezine göre, prion proteininin amiloid konformer tek bulaşıcı ajandır. Bununla birlikte, başka bir biyomoleküllerin prion bozukluklarına gerekli olduğu önerilmiştir. Örneğin, hücre zarları, bir yer burada conversi olduğu düşünülmektediryer alır ve bazı negatif yüklü lipidler dönüştürme işlemi, 5,6 artırmak için gösterilmiştir. Buna ek olarak, bazı proteinler de prion patolojilerinde dahil olabilir. Doppel ve Shadoo 7,8: Spesifik olarak, prion proteini ailesinin iki diğer üyeleri vardır. Doppel di-sülfit köprüler ile stabilize nispeten rijit bir yapıya sahiptir ve Amiloid fibrillerin 9 kendi kendine polimerleşme ve agrega başarısız olur. Bunun aksine, prion proteinine benzer Shadoo amiloid fibril yapılarına bir β-tabaka zenginleştirilmiş bir yapı ve kendi kendine ilişkilendirmek alabilir. Bu Shadoo doğal koşullar altında, veya negatif yüklü membranlar 10,11 bağlanması üzerine liflenme denetlenebilir olduğu gösterilmiştir. Amiloid benzeri lif haline Shadoo dönüştürülmesi patolojileri ile ilişkili olabilir. Nitekim, amiloid benzeri yapılar hastalığa neden olan mekanizmalar tam olarak anlaşılamamıştır.
Shadoo bir hidrofobik domain (HD) ve tandem Arg / Gly dizisi yer almaktadır içindeki t tekrarlarPrion proteininin (Şekil 1A) N-terminal parçası o. Prion proteininin N-terminal parçası olarak, Shadoo yüksek pozitif yüklü ve doğal olarak yapılandırılmamış bir protein 11,12 olduğu görünür. Doğrudan prion proteininin bağlanabildiği yana Shadoo prion bozukluklarına işlevsel olarak ilişkili gibi görünmektedir. Buna ek olarak, ifade aşağı prion patoloji 13,14 sırasında düzenlenir. Ancak, prion hastalığı Shadoo rolü henüz kurulmuş değildir.
Bu fare Shadoo geninin kodlama dizilimini taşıyan bir plazmit geliştirdi. Plasmid E. dönüştürmek için kullanılmış E. coli, N-terminal His 6 füzyon Shadoo proteinin üretimi için. Bu sentezleme sistemi de laboratuvarımızda kurulan ve yaygın devam eden projelerde 6,15,16 kullanılır. Shadoo ekspresyonu için önemli bir husus, E. seçimdir coli suşu. Yetkili BL21 bakteri suşu, rekombinant pro ekspresyonu için kullanılır ikenproteinlerinin Shadoo başarılı bir şekilde eksprese ve transforme SoluBL21 bakteri suşunun sadece saflaştırılmıştır. SoluBL21 yeterli E. E. coli ekspresyonu üst BL21 tespit edilebilir çözünebilir ürün elde proteinlerin üretimi için geliştirilmiş BL21 konak suşunun geliştirilmiş bir mutantıdır. SoluBL21 E. Shadoo yüksek düzeyde tanımlama E. coli katma kütlelerinin protein birikimine yol açar. Olmayan bir doğal proteinin, oldukça E. ifade edilir için genel bir özellik olarak, E. coli, bu protein, erimez içerik korları toplanma eğilimindedir. Shadoo muhtemelen farklı derecelerde katlanmış protein ile oluşturulan zenginleştirilmiş dinamik yapılara kovalent olmayan bir hidrofobik ya da iyonik etkileşimler (ya da her ikisinin bir kombinasyonu) ile toplanır. (I) denatürasyon ortamı içindeki diğer biyomoleküllerin proteinin bir seçici olarak ayrılması, ve (ii) saflaştırılmış proteinin bir renatürasyon in vitro katlanmasına kullanılarak: Sonuç olarak, en azından iki saflaştırma adımları içerirteknikleri.
Shadoo seçici ayrılması 8 M üre elde edilmiştir (ya da seçenek olarak 6M Guanidin-HCl) ihtiva eden bir tampon çözeltisi içinde sağlanmıştır. (I) renatürasyon bir asidik pH çözelti içinde polimerize edilmiş Shadoo elde etmek için pH ≥ eden bir çözeltiye, 7 bir yapısal olmayan monomerik Shadoo proteini, ya da (ii) renatürasyon elde etmek üzere üre uzaklaştırılması ve protein renatürasyon çeşitli protokoller uygulanarak yapılabilir Karakteristik çapraz β-yaprak motifleri ile istikrarlı amiloid liflerinin içine.
Protokol
Plazmid ve Shadoo İfade 1. Üretim
Not: Gen kodlayan sıçangil Shadoo protein (Shadoo 25-122), ekspresyon vektörü pET-28 11 içine alt klonlandı. Bu klon, E. dönüştürüldü Daha önce açıklandığı gibi, 11 coli, bir N-ucu heksahistidin etiketi, (HHHHHHHHHHSSGHIDDDDKHMKGGRGGARGSARGVRGGARGASRVRVRP APRYGSSLRVAAAGAAAGAAAGVAAGLATGSGWRRTSGPGELGLEDDENGAMGGNGTDRGVYSYWAWTSG) ile Shadoo proteinini ifade etmek için, bir bakteri suşunun SoluBL21. Plazmid yazarlarından talep edilebilir. Amino asit dizisinden hesaplanan Shadoo molekül ağırlığı 12,243.2 Da'dır.
Not: Bir laminal akış kaputu altında veya yakınında Bunsen aleve bakteriler ile tüm manipülasyonlar gerçekleştirin.
- Standart ısı şok protokolü kullanarak, pET-28-His 6 -Shadoo plazmid ile yetkili SoluBL21 bakteri Transform. Plazmid 1 5 ul bu karışıma için (tipik olarak 10 pg ile 100Bir tüp içinde bakteri 50 ul halinde ng). 45 saniye için 42 ° C 'de bir ısı şoku gerçekleştirin.
- Kültür 40 mg / ml kanamisin (Şekil 1B) ile takviye edilmiş Luria-Bertani ortamında 0.5-0.7 arasında bir 600 kadar 37 ° C 'de bakteri dönüştürdü.
- Kültür, 240 ug / ml izopropil-β-D-tiogalaktopiranosid, ITPG ekleyerek Shadoo sentezleme O / N neden. 37 ° C'de 150 rpm'de çalkalanarak kültür bakterileri. Not: Genellikle, bakteri kültürü 600 3 O / N ulaşır.
Not: Transforme bakteriler sonraki protein üretimi için -80 ° C 'de muhafaza edilebilir. Bunun için, bakteri kültürü kısma 10% -50% (v / v) steril gliserol ekleyin ve -80 ° C'de dondurmak.

Shadoo ifade Shadoo sentezleme konstruktu, bakteri dönüşüm ve indüksiyon Şekil 1, Şema (aşama 1 olarak tarif edilmiştir). (A) Shadoo için ekspresyon yapısı, bir protein, Nt N-terminalinde kaynaşmış bir hekzahistidin etiketi kodlar. Düzeni Shadoo proteini C-ucu (Ct), ardından bazik arginin / glisin tekrarları (yeşil silindir), bir hidrofobik domain (HD), ve tek bir N-glikosilasyon sitesi (CHO) içerdiğini göstermektedir. (B), pET-28-His 6 -Shadoo plazmid 42 ° C'de 45 saniye boyunca ısı şoku ile SoluBL21 bakterilerin içine transforme edilir. Dönüştürülen bakteriler, seçici agar / ml kanamisin ihtiva eden 40 ug ekilir. Levhasından tek bir koloni, bir 1,000-3,000 ml'lik bir çalkalama şişesinde bir kültürü inoküle etmek için kullanılır. Rekombinant proteinin ifadesi 1 mM IPTG ile uyarılır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Düşük Basınçlı Sıvı Kromatografisi Shadoo Protein 2. saflaştırma (LPLC)
- Hücre parçalama ve deetme gövdelerinin hazırlık
- Bakteri süspansiyonu toplayın ve santrifüj tüpleri (Şekil 2) içine aktarın.
- 4 ° C'de 20 dakika boyunca 2500 x g'de Spin. Dekantasyon ve hücre kültürü 500 ml elde edilen her bir pelet için tekrar süspansiyon peletler (anti-proteaz kokteyli ile 50 mM Tris, 10 mM EDTA, pH 8) 15 ml tampon maddesi içinde süpernatantı.
Not: Tekrar süspansiyon haline getirilen topaklar dondurulmuş ve birkaç gün boyunca -20 ° C'de saklanabilir. Donma bakteri hücreleri lizisini kolaylaştırır. - SDS-PAGE analizi ve Coomassie boyama Ham bakteri pelet kullanılarak rekombinant proteinin aşırı ekspresyonunu kontrol edin.
- Bunun için, bakteri kültürü santrifüj 1 mi pelet hücreleri. 5 dakika boyunca 100 ° C 'de 100 ul Laemmli denatürasyon: pelet çözeltisi (277,8 mM Tris-HCl, pH 6.8,% 4.4 SDS,% 44.4 w / v gliserol,% 0.02 bromofenol) ile ısıtılır.
- % 12 akrilamid jeline Yük örnek 10 ul, çalışma SDS-PAGE ve visualize Coomassie boyaması proteinleri ayrıldı.
- ) 2.1.2 tamamen yeniden süspanse pelet% 0.5 nihai konsantrasyona kadar Triton X-100 ekleyin.
- 30 dakika boyunca 37 ° C'de su banyosu içinde süspansiyon inkübe edin.
- Bakteriyel hücreler lize edildi, buz soğukluğunda su içinde 6-12 mikron tepe-tepe genlik 5 dakika boyunca bir süspansiyon sonikasyon.
- Aktarım, temiz 50 ml'lik santrifüj tüpleri içine süspansiyon sonike edilmiştir.
- 4 ° C'de 15 dakika boyunca 15.000 x g'de santrifüje tüpleri.
- Boşaltma yoluyla Süpernatantı ve tüp başına bağlanma tamponu (20 mM Tris-HCl tamponu, pH 7,4, 0,5 M NaCl, 8 M Üre, 5 mM İmidazol) kullanılarak, 5 ml ilave edin.
- Dönen tekerlek O / N yerleştirin tüpleri tamamen cisimcikler proteinleri tekrar süspansiyon.
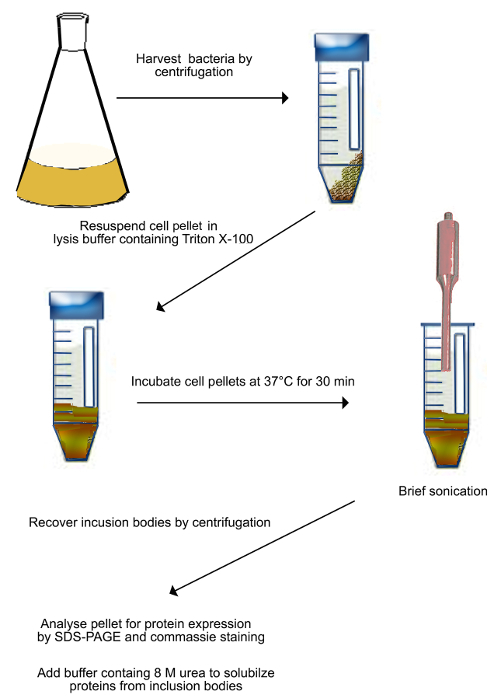
Içerme arınma Şekil 2. ŞemaShadoo eksprese organları (adım 2.1 de tarif edildiği gibi). Transforme bakteriler santrifüje tabi tutularak toplanmış ve liziz tamponunda yeniden süspanse edilir. Süspansiyon 30 dakika için 37 ° C sıcaklıkta inkübe edilir ve daha sonra mekanik olarak bakteriyel hücreler kırmak için ses dalgalarına tabi tutulur. Sonikasyon örnek ısınmasını önlemek için buz üzerinde yapılır. Kırık hücreler santrifüj ile toplanır ve inklüzyon cisimciklerinin proteinleri çözünür 8 M üre ihtiva eden bir tampon içinde tekrar süspanse edilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız. - Ni2 + -affinity kromatografisi
Not: Kromatografi 5 mi Sefaroz kenetleme kolonu (Şekil 3A), bir Ni 2+ -yüklü kullanılarak FPLC Sistemi üzerinde gerçekleştirilmiştir. Bütün çözeltiler 1 ml / dakika bir akış oranı ile sütun üzerine yüklenir.- Şarj etmek için Sepharose sütuna 0.2 M Niso 4 su çözeltisi 10 ml enjekteNi 2+ -ions ile.
- Imidazol düşük konsantrasyonda (20 mM Tris-HCl tamponu, pH 7,4, 0,5 M NaCl, 8 M Üre, 5 mM İmidazol) ihtiva eden bağlama tamponu 30-50 ml enjekte edilmesi ile Ni2 + -ions görevli sütun dengelenmesi.
- 50 ml'lik enjeksiyon döngüsü ile üre çözünebilir proteinleri yükleyin.
- İyice bağlanmamış proteinin maksimum çıkarmak için 10 mi, düşük imidazol bağlanma tamponu (20 mM Tris-HCl tamponu, pH 7.4, 0.5 M NaCI, 8 M Üre, 5 mM İmidazol) ile yıkanması sureti ile akış geçiş kısmını kurtarma kolondan.
- (MM Tris-HCI, pH 7.4, 0.5 M NaCl, 8 M üre, 80 mM imidazol 20) spesifik olmayan Sütuna bağlanmış proteinler elüt edilmesi için yıkama tamponu 50-100 ml sütun yıkayın.
- 20 mM Tris-HCl, pH 7.4, 0.5 M NaCl, 8 M üre ihtiva eden tampon maddesi içinde 80-800 mM imidazol 15 dakika lineer gradyan uygulanır. Degrade uygulama sırasında 1 ml kesirler toplayın. Not: His-etiketli proteinleri wit elüte edilir(a rakip olarak kullanılabilir) imidazol ihtiva eden tampon ha gradyanı.
- (2.1.3.1 bakınız) Her bir fraksiyonun bir 8 ul tablet alın ve 4 ul 4x Laemmli denatürasyon çözeltisi ilave edilir. 5 dakika boyunca 100 ° C'de ısı çözümler.
- Yük Coomassie boyama ile protein boyut işaretleyici 10 ul% 12 akrilamid jeline her numunenin 10 ul, çalışma SDS-PAGE ve görselleştirmek ayrılan proteinler. Not: hesaplanan Shadoo molekül ağırlığı, amino asit sekansı 12,243.2 Da'dır oluştururlar.
- Havuz Shadoo içeren tüm fraksiyonlar.
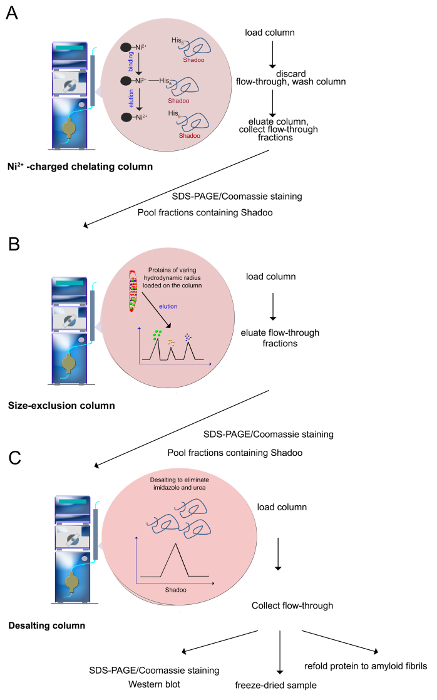
(Adımları 2.2-2.4 de tarif edildiği gibi) 3. saflaştırma prosedürü Şekil. (A) Ni2 + -ions polihistidin ile işaretlenmiş olan proteinlerin seçici olarak temizlenmesini mümkün kılmaktadır histidin artığının koordine edilebilir. İmidazol ile, protein elüt edilmesi için kullanılmaktadırNi2 + -iyon ile koordine ve bağlı proteinin yerini yeteneğidir. (B) bir ebat eksklüzyon kolonu üzerine ayrılır Sütunlu Ni 2+ üzerinde tutulan edildi değişen hidrodinamik radius proteinler. Proteinler küçük olanlar büyük elüte edilir. (C) Kullanımdan önce, Shadoo ihtiva eden fraksiyonlar bir araya toplanmış ve üre, imidazol ve tuzları yok etmek için tuzdan arındırılmıştır edilir. Kalite kontrol deneyleri SDS-PAGE / Coomassie lekeleme, Western blotlama içerir. Saflaştırılmış Shadoo dondurularak kurutulabilir. -20 ° C'de saklandığında Liyofilize Shadoo ay boyunca stabildir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız. - Ebat eksklüzyon kromatografı
Not: İkinci bir saflaştırma adımı diğer proteinler, birinci saflaştırma aşaması sırasında birlikte elüt gelen Shadoo proteini ayıran boyut dışlama kromatografisi oluşur(Şekil 3B).- 1,5 ml / dakika akış hızında 20 mM Tris-HCI tamponu, pH 7.4, 0.5 M NaCI, 8 M Üre, 250 ml enjekte edilerek toplam yatak hacmi 120 ml Superdex sütunu dengelenmesi.
- Dengelenmiş sütun üzerinde 2.2.9 den Shadoo ihtiva eden yükleme Bir araya toplanan fraksiyonlar. Yukarıda bahsedilen tampon maddenin sürekli bir akımının meydana getirilmesi üzerine 40 ml sütun boşluk hacmi sonra, 1 ml'lik fraksiyonların toplayın.
- Her bir fraksiyonun bir 10 ul tablet alın ve fraksiyonlar Shadoo içeren olduğunu öğrenmek için yukarıda tarif edildiği gibi SDS-PAGE analizi ve Coomassie boyama yapar.
- Shadoo ihtiva eden fraksiyonlar Havuz.
- Tuzdan arındırma
Not: tuz giderme işlemi daha biyofiziksel ve biyokimyasal çalışmalar (Şekil 3C) için uygun olan bir tampon maddesi içinde rekombinant Shadoo proteini elde etmek üzere tuzlar, imidazol ve üre kaldırır. Aynı sonuç tampon maddesine karşı diyaliz örnekleri ile elde edilebilir.- 150 ml 53 ml 'lik bir tuz giderme kolonu dengeye/ dakika, 5 ml akış hızında 10 mM amonyum asetat tamponu, pH 5, arasında.
- Yük kolonu üzerinde Shadoo fraksiyonlar havuzlandı. Amonyum asetat tamponu enjeksiyonu üzerine elle UV detektörü çıkışında 280 nm'de sinyal bir artış olduğunu göstermektedir fraksiyonlarım toplamak.
- -Freeze kurutmak tuzu giderilmiş Shadoo ve -20 ° C'de saklayın.
- Uygun bir tampon maddesi içinde liyofilize Shadoo, örneğin 10 mM sodyum asetat tamponu, pH 5 içinde çözündürülür, kullanımdan önce.
Not: polihistidin etiketi enterokinaz ile temizlenebilir.
Fizyolojik pH'da Amiloid fibrillerin içine Shadoo in vitro bir araya 3.
Not: kendiliğinden Shadoo Protein topakları gece boyunca pH ≥ 7 11 de fibriller oluşturur.

Shadoo amiloid fibrillere refolding Şekil 4. Programı (descri olarakÇalkalarken bir asidik çözeltinin pH ≥ 7 tampon içinde çözüldüğünde Adım 3'te yatak). Saflaştırılmış Shadoo kendiliğinden amiloid fibrillere dönüştürür Shadoo 1 M Gdn-HCl ile kuluçkaya yatırıldıktan sonra amiloid fibrillere dönüştürür. Kalite kontrol deneyleri, elektronik mikroskop ve ThT boyama bulunmaktadır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- 20 mM Tris-HCI tampon maddesi, pH 7.4 içinde 2 uM'lik bir son konsantrasyona Shadoo seyreltilir. 280 nm 'de çözeltinin optik yoğunluğu ölçmek ve 20,970 arasında Shadoo amino asit bileşimi çıkarsanan sönüm katsayısı kullanarak konsantrasyonu ölçümü.
- Amiloid yapılarına (Şekil 4) kendiliğinden protein dönüşümü sağlamak için, bir kaç hafta boyunca 4 ° C 'de konik bir plastik tüp içinde solüsyon 500 ul inkübe edin.
- Taze nihai conce, T (ThT), Tioflavin hazırlanabilir ekleShadoo solüsyonu, 100 ul bölüntüde 10 uM ntration. Oda sıcaklığında 5 dakika boyunca çözelti inkübe edin. Amiloid yapılarına 17 varlığını doğrulamak için 435 nm'lik bir eksitasyon dalga boyu kullanılarak 460 520 nm floresan emisyon ölçün.
Asidik pH'larda Amiloid fibrillerin için Shadoo in vitro bir araya 4.
- 2 uM nihai konsantrasyona kadar 1 M GdnHCl, 20 mM Na-asetat tampon, pH 5 Shadoo seyreltilir.
- 3-7 gün boyunca, 37 ° C'de sürekli çalkalanarak konik bir tüp içinde, bu çözeltinin 500 ul inkübe edin.
- 3.3 olarak çözeltisinin bir alikotuna THT ekleyerek Amiloid fibrillerin varlığını kontrol edin.
- Shadoo amiloid fibrillerine arındırmak için, 10 mM Na-asetat tamponu, pH 5.0 karşı elde edilen süspansiyonun Dialyze.
- 4 ° C'de saflaştırılmış fibriller saklayın.

Ni2 + elüt Şekil 5. Örnek sonuçlanır. Protein fraksiyonlar kenetleme kolonu (A) ve boyut dışlama kolonu (B), SDS-PAGE ve Coomassie boyama ile analiz edilmiştir -yüklü. Saflaştırılmış Shadoo tanımlanması SPRN anti-Shadoo antikoru (C) kullanılarak değerlendirildi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Sonuçlar
Saflaştınldı Shadoo proteinin yaklaşık 5-10 mg bakteri kültürü litresinde elde edilir. Bir iki-aşamalı saflaştırma yüksek saflıkta rekombinant Shadoo elde etmek için gereklidir. İlk adım, His-etiketli-proteinleri muhafaza eden bir Ni 2+ -yüklü kolon ile afinite kromatografisi ile gerçekleştirilir. Elüsyona uğratılan kısımlar SDS-PAGE tabi tutulur ve Coomassie Brilliant Blue (Şekil 5A) ile boyanır. Shadoo proteini ihtiva eden fraksiyonlar bir araya toplanmış ve da...
Tartışmalar
İfade ve rekombinant fare Shadoo proteininin büyük miktarda saflaştırılması hem de kolay ve etkin bir protokol verilmektedir. Anlatılan yöntem başarılı çözülmesini ve (O'nun 6) etiketli rekombinant Shadoo proteinin saflaştırılması verir. Başlığında belirttiği gibi bu, önemli bir prokaryotik bakterinin E. olarak ifade edildiğinde E. coli katma kütlelerinin Shadoo birikir. Shadoo arıtılmadan önce, bakteri Triton X-100 içeren bir tampon içinde sonifikasyon il...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
The authors would like to acknowledge Natalie Doude and David Westerway (University of Alberta) for providing us Sho cDNA, Christophe Chevalier (INRA) for plasmid construction, Michel Brémont (INRA) for providing us BL21Sol bacteria; Christine Longin (INRA) for TEM assistance and Edith Pajot-Augy (INRA) for comments and proofreading.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AKTA FPLC | GE, Amersham | # 1363 | |
| HiLoad 16/60 Superdex | GE Healthcare | 17-1069-01 | |
| HiTrap IMAC | GE Healthcare | GE17-0920-05 | |
| HiPrep26/10 Desalting column | GE Healthcare | GE17-5087-01 | |
| SoluBL21 Competent E. coli | Genlantis | C700200 | |
| pET-28b+ | Novogen | 69865-3 | |
| IPTG | Sigma-Aldrich | I6758 | |
| LB-Broth medium | Sigma-Aldrich | L3022 | |
| Eppendorf Biophotometar | Eppendorf | 550507804 | |
| Trito X-100 | Life Technologies | 85111 | |
| NiSO4 | Sigma-Aldrich | 656895 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Tris-HCl | Sigma-Aldrich | RES3098T | |
| Protease Inhibitor Cocktail Tablets | Roche | 4693116001 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Imidazol | Sigma-Aldrich | I5513 | |
| Gdn-HCl | Sigma-Aldrich | G4505 | |
| protein size marker | Thermo Fisher Scientific | 26620 |
Referanslar
- Biasini, E., Turnbaugh, J. A., Unterberger, U., Harris, D. A. Prion protein at the crossroads of physiology and disease. Trends in Neurosciences. 35, 92-103 (2012).
- Colby, D. W., Prusiner, S. B. De novo generation of prion strains. Nature Reviews. Microbiology. 9, 771-777 (2011).
- Chiti, F., Dobson, C. M. Protein misfolding, functional amyloid, and human disease. Annual Review of Biochemistry. 75, 333-366 (2006).
- Nelson, R., et al. Structure of the cross-beta spine of amyloid-like fibrils. Nature. 435, 773-778 (2005).
- Murphy, R. M. Kinetics of amyloid formation and membrane interaction with amyloidogenic proteins. Biochimica et Biophysica Acta. 1768, 1923-1934 (2007).
- Steunou, S., Chich, J. F., Rezaei, H., Vidic, J. Biosensing of lipid-prion interactions: insights on charge effect, Cu(II)-ions binding and prion oligomerization. Biosensors & Bioelectronics. 26, 1399-1406 (2010).
- Watts, J. C., Westaway, D. The prion protein family: diversity, rivalry, and dysfunction. Biochimica et Biophysica Acta. 1772, 654-672 (2007).
- Westaway, D., Daude, N., Wohlgemuth, S., Harrison, P. The PrP-like proteins Shadoo and Doppel. Topics in Current Chemistry. 305, 225-256 (2011).
- Baillod, P., Garrec, J., Tavernelli, I., Rothlisberger, U. Prion versus doppel protein misfolding: new insights from replica-exchange molecular dynamics simulations. Biochemistry. 52, 8518-8526 (2013).
- Daude, N., et al. Wild-type Shadoo proteins convert to amyloid-like forms under native conditions. Journal of Neurochemistry. 113, 92-104 (2010).
- Li, Q., et al. Shadoo binds lipid membranes and undergoes aggregation and fibrillization. Biochemical and Biophysical Research Communications. 438, 519-525 (2013).
- Watts, J. C., et al. The CNS glycoprotein Shadoo has PrP(C)-like protective properties and displays reduced levels in prion infections. The EMBO Journal. 26, 4038-4050 (2007).
- Watts, J. C., et al. Protease-resistant prions selectively decrease Shadoo protein. PLoS Pathogens. 7, e1002382 (2011).
- Westaway, D., et al. Down-regulation of Shadoo in prion infections traces a pre-clinical event inversely related to PrP(Sc) accumulation. PLoS Pathogens. 7, e1002391 (2011).
- Chevalier, C., et al. PB1-F2 influenza A virus protein adopts a beta-sheet conformation and forms amyloid fibers in membrane environments. The Journal of Biological Chemistry. 285, 13233-13243 (2010).
- Tarus, B., et al. Oligomerization paths of the nucleoprotein of influenza A virus. Biochimie. 94, 776-785 (2012).
- Biancalana, M., Koide, S. Molecular mechanism of Thioflavin-T binding to amyloid fibrils. Biochimica et Biophysica Acta. 1804, 1405-1412 (2010).
- Minic, J., Sautel, M., Salesse, R., Pajot-Augy, E. Yeast system as a screening tool for pharmacological assessment of g protein coupled receptors. Current Medicinal Chemistry. 12, 961-969 (2005).
- Schein, C. H. A cool way to make proteins. Nature Biotechnology. 22, 826-827 (2004).
- Sorensen, H. P., Mortensen, K. K. Advanced genetic strategies for recombinant protein expression in Escherichia coli. Journal of Biotechnology. 115, 113-128 (2005).
- Zhang, J., et al. Disruption of glycosylation enhances ubiquitin-mediated proteasomal degradation of Shadoo in Scrapie-infected rodents and cultured cells. Molecular Neurobiology. 49, 1373-1384 (2014).
- Englund, P. T. The structure and biosynthesis of glycosyl phosphatidylinositol protein anchors. Annual Review of Biochemistry. 62, 121-138 (1993).
- Puig, B., Altmeppen, H., Glatzel, M. The GPI-anchoring of PrP: implications in sorting and pathogenesis. Prion. 8, 11-18 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır