Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Reinigung und Rückfaltung an Amyloidfibrillen von (His)
In diesem Artikel
Zusammenfassung
A two-step chromatographic method is described for the purification of recombinant Shadoo protein expressed as inclusion bodies in Escherichia coli, as well as a protocol to fibrillate purified Shadoo into amyloid structures.
Zusammenfassung
Der Escherichia-coli-Expressionssystem ist ein leistungsfähiges Werkzeug für die Herstellung von rekombinanten eukaryotischen Proteinen. Wir verwenden es, um Shadoo, ein Protein, an das Prion-Familie gehören, zu erzeugen. Ein chromatographisches Verfahren zur Reinigung von (His) 6 -markierten rekombinanten Shadoo ausgedrückt als Einschlußkörper beschrieben. Die Einschlusskörper in 8 M Harnstoff solubilisiert und auf eine Ni 2+ -charged Säule gebunden zu Ionen-Affinitätschromatographie durchzuführen. Gebundenen Proteine werden mit einem Gradienten von Imidazol eluiert. Fraktionen Shadoo Protein enthalten, werden Größenausschlußchromatographie unterzogen wird, eine hoch gereinigte Protein zu erhalten. Im letzten Schritt gereinigt Shadoo entsalzt, um Salze, Harnstoff und Imidazol zu entfernen. Rekombinante Shadoo Protein ist ein wichtiges Reagenz zur biophysikalischen und biochemischen Studien der Proteinkonformation Störungen bei Prionenerkrankungen auftreten. Viele Berichte gezeigt, dass neurodegenerative Erkrankungen Prion stammen aus der Ablagerung von Stichle, bestellt Amyloidfibrillen. Musterprotokolle beschreiben, wie Shadoo in Amyloidfibrillen bei sauren und neutralen fibrillieren / basischen pH-Werten dargestellt. Die Methoden, wie man produzieren und fibrillieren Shadoo kann Forschung in Labors arbeiten an Prionenerkrankungen zu erleichtern, da es für die Produktion von großen Mengen an Protein in eine schnelle und kostengünstige Weise.
Einleitung
Prion neurodegenerativen Erkrankungen, die bovine spongiforme Enzephalopathie bei Rindern, Scrapie bei Schafen und Creutzfeldt-Jakob-Krankheit beim Menschen, sind tödlich und unheilbar. Prion-Krankheiten durch Konformationsänderungen des zellulären Prionproteins im Wesentlichen aus α-Helices in die Quer β-Faltblatt gekennzeichnet angereichert Amyloid Konformer 1,2. Cross-β-Strukturen enthalten dicht gepackt und hochgeordnete kristalline artigen β-sheets stabilisiert mit 3,4-Wasserstoffbrücken. Prion Amyloide sich selbst replizieren aufgrund der β-Stränge an die wachsende Kante, die eine Vorlage für die Rekrutierung geben und Umwandeln eines monomeren Proteineinheit.
Nach Angaben der "Nur-Protein-Hypothese", die Amyloid-Konformer des Prionprotein der einzige Infektionserreger. Jedoch einige andere Biomoleküle wurden vorgeschlagen wesentlich, Prion-Erkrankungen sein. Zum Beispiel werden die Zellmembranen gedacht, ein Ort, wo conversi seinauf erfolgt und einige negativ geladene Lipide sind gezeigt worden, um die Konvertierung zu 5,6 zu erhöhen. Darüber hinaus können einige Proteine auch im Prion-Erkrankungen beteiligt. Insbesondere gibt es zwei weitere Mitglieder des Prionproteinfamilie: Doppel und Shadoo 7,8. Doppel weist eine relativ steife Struktur mit Di-Sulfidbrücken stabilisiert zu werden, keine spontan polymerisieren und Aggregat an Amyloidfibrillen 9. Im Gegensatz dazu, ähnlich wie bei Prion-Protein, Shadoo eine β-Faltblatt-angereicherten Struktur und Selbstassoziation in Amyloidfibrillen Strukturen erlassen. Es konnte gezeigt werden, dass Shadoo kann unter nativen Bedingungen oder bei der Bindung negativ geladenen Membranen 10,11 fibrillieren. Umwandlung von Shadoo in amyloidartigen Fasern können mit Krankheiten in Verbindung gebracht werden. Tatsächlich sind die Mechanismen, durch die Amyloid-ähnliche Strukturen Krankheiten verursachen kaum verstanden.
Shadoo trägt eine hydrophobe Domäne (HD) und eine Reihe von Tandem Arg / Gly wiederholt ähnliche to den N-terminalen Teil des Prion-Proteins (1A). Als die N-terminalen Teil des Prionproteins wird Shadoo stark positiv und scheint eine nativ unstrukturierte Protein 11,12 sein. Shadoo scheint funktionell auf Prionen-Erkrankungen sein, da es direkt binden Prionprotein. Zusätzlich ist seine Expression unten während Prion Pathologie 13,14 geregelt. Jedoch ist die Rolle von Shadoo Prionenerkrankungen noch nicht etabliert.
Wir entwickelten ein Plasmid, das die codierende Sequenz der Maus Shadoo Gens. Das Plasmid wurde verwendet, um E.-Transformation coli zur Herstellung von N-terminalen His-6-Fusionsprotein Shadoo. Dieses Expressionssystem ist in unserem Labor etabliert und wird häufig in unserer laufenden Projekte 6,15,16 verwendet. Ein wichtiges Thema für die Expression von Shadoo ist die Wahl des E. coli-Stamm. Während kompetente BL21 Bakterienstamm wird häufig für die Expression von rekombinanten Pro verwendetProteine Shadoo wurde erfolgreich exprimiert und nur aus der transformierten SoluBL21 Bakterienstamm gereinigt. SoluBL21 kompetente E. coli ist eine verbesserte Mutante BL21 Wirtsstamm für die Produktion von Proteinen, deren Expression in der Mutter BL21 gab keinen nachweisbaren löslichen Produkt entwickelt. High-Level-Expression Shadoo in SoluBL21 E. coli führt zu einer Akkumulation des Proteins in Einschlusskörpern. Als eine allgemeine Funktion, wenn ein nicht-native Protein ist stark in E. ausgedrückt coli neigt dieses Protein in unlöslicher Einschlußkörper akkumulieren. Shadoo Aggregate vermutlich durch nicht-kovalente oder ionische Wechselwirkungen hydrophobe (oder einer Kombination von beiden), um hoch angereichertes dynamischen Strukturen durch das Protein in unterschiedlichem Maße gefaltet ist. Folglich umfasst die Reinigung wenigstens zwei Schritte: (i) eine selektive Trennung des Proteins von anderen Biomolekülen in einer Denaturierung Medium und (ii) eine Renaturierung des gereinigten Proteins mit in vitro FaltungsTechniken.
Die selektive Abtrennung von Shadoo wurde in einer Pufferlösung, enthaltend 8 M Harnstoff (oder alternativ 6 M Guanidin-HCl) gelöst. (I) die Renaturierung in einem sauren pH-Lösung eine unstrukturierte monomeren Shadoo Protein oder (ii) die Renaturierung in einer Lösung mit pH ≥ 7 bis Shadoo polymerisierten erhalten: Die Harnstoffentfernung und die Renaturierung des Proteins kann durch Anwendung verschiedener Protokolle durchgeführt werden in stabile Amyloidfasern mit charakteristischen Quer β-Blatt-Motive.
Protokoll
1. Erzeugung von Plasmid und Expression Shadoo
Hinweis: Das Gen, das murine Shadoo Protein (Shadoo 25-122), wurde in den Expressionsvektor pET-28 11 subkloniert. Dieser Klon wurde in den E. transformierten coli SoluBL21 Bakterienstamm, um Shadoo Protein mit einem N-terminalen Hexahistidin-Tag, (HHHHHHHHHHSSGHIDDDDKHMKGGRGGARGSARGVRGGARGASRVRVRP APRYGSSLRVAAAGAAAGAAAGVAAGLATGSGWRRTSGPGELGLEDDENGAMGGNGTDRGVYSYWAWTSG) zum Ausdruck bringen, wie zuvor 11 erläutert. Das Plasmid kann von den Autoren angefragt werden. Das Molekulargewicht des Shadoo aus seiner Aminosäuresequenz berechneten 12,243.2 Da.
Hinweis: Führen Sie alle Manipulationen mit Bakterien unter dem laminal Flow-Haube oder in der Nähe Bunsenflamme.
- Transformieren kompetenter SoluBL21 Bakterien mit dem pET-28-His 6 -Shadoo Plasmid, mit einem Standard-Hitzeschockprotokoll. Für diese Mischung 1 bis 5 & mgr; l der Plasmid (typischerweise 10 bis 100 pgng) in 50 & mgr; l der Bakterien in einem Rohr. Führen Sie den Hitzeschock bei 42 ° C für 45 sec.
- Kultur transformierter Bakterien bei 37 ° C, bis ein 600 0,5-0,7 in Luria-Bertani-Medium mit 40 mg / ml Kanamycin (1B) ergänzt.
- Induzieren Shadoo Expression O / N durch Zugabe von 240 & mgr; g / ml Isopropyl-β-D-thiogalactopyranosid, ITPG, zu der Kultur. Kultur des Bakteriums unter Schütteln bei 150 Upm bei 37 ° C. Anmerkung: In der Regel reicht von 3 A 600 O / N-Bakterienkultur.
Anmerkung: Die transformierten Bakterien können bei -80 ° C für zukünftige Proteinproduktion gespeichert werden. Dazu fügen Sie 10% -50% (v / v) steriles Glycerin in Bakterienkultur Aliquots und frieren Sie sie bei -80 ° C.

Abbildung 1. Schema der Shadoo Expressionskonstrukt, Bakterien Transformation und Induktion von Shadoo Ausdruck (wie in Schritt 1 beschrieben). (A) Das Expressionskonstrukt für Shadoo codiert ein Hexahistidin-Tag an den N-Terminus des Proteins, Nt fusioniert. Das Schema zeigt, dass Shadoo Protein enthält grundlegende Arginin / Glycin-Repeats (grünen Zylinder), eine hydrophobe Domäne (HD) und eine einzige N-Glykosylierungsstelle (CHO), gefolgt von einem C-Terminus (Ct). (B) pET-28-His 6 -Shadoo Plasmid in SoluBL21 Bakterien durch Hitzeschock für 45 Sekunden bei 42 ° C umgesetzt. Transformierten Bakterien werden auf selektivem Agar, der 40 ug / ml Kanamycin ausplattiert. Eine einzelne Kolonie von der Platte verwendet, um eine Kultur in einem 1000-3000 ml-Schüttelkolben zu inokulieren. Die Expression des rekombinanten Proteins ist mit 1 mM IPTG induziert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
2. Reinigung von Shadoo Protein durch Niederdruck-Flüssigchromatographie (LPLC)
- Zell-Lyse und Inschluss Gremien Vorbereitung
- Sammeln Sie die Bakteriensuspension und übertragen sie in Zentrifugenröhrchen (Abbildung 2).
- Schleudern bei 2.500 xg für 20 min bei 4 ° C. Überstand durch Dekantieren zu entfernen und resuspendieren Pellets in 15 ml Puffer (50 mM Tris, 10 mM EDTA, pH 8 mit Anti-Protease-Cocktail) für jeden Pellets aus 500 ml Zellkultur abgeleitet ist.
Anmerkung: Die resuspendierten Pellets können eingefroren und bei -20 ° C für mehrere Tage gelagert werden. Freezing erleichtert Bakterienzellen-Lyse. - Überprüfen Sie die Überexpression des rekombinanten Proteins mit rohen Bakterien Pellets durch SDS-PAGE-Analyse und Coomassie-Färbung.
- Hierzu Zentrifugen 1 ml Bakterienkultur pelleZellen. 100 ul Laemmli Denaturierungslösung (277,8 mM Tris-HCl, pH 6,8, 4,4% SDS, 44,4% w / v Glycerol, 0,02% Bromphenolblau) pelletiert und Wärme bei 100 ° C für 5 min.
- Last 10 ul der Probe auf einem 12% Acrylamidgel laufen SDS-PAGE und visualize getrennten Proteine durch Coomassie-Färbung.
- Hinzufügen Triton X-100 auf 0,5% Endkonzentration in die vollständig resuspendierten Pellets 2.1.2).
- Inkubieren der Suspension in einem Wasserbad bei 37 ° C für 30 min.
- Beschallen der Suspension für 5 min bei 6-12 & mgr; m Spitze-zu-Spitze-Amplitude in eiskaltem Wasser, um bakterielle Zellen zu lysieren.
- Transfer beschallte Suspension in sauberen 50 ml Zentrifugenröhrchen.
- Zentrifugenröhrchen bei 15.000 xg für 15 min bei 4 ° C.
- Überstand entfernen durch Dekantieren und 5 ml des Bindungspuffers (20 mM Tris-HCl-Puffer, pH 7,4, 0,5 M NaCl, 8 M Harnstoff, 5 mM Imidazol) pro Röhrchen.
- Die Röhrchen auf dem sich drehenden Rad O / N komplett resuspendieren Proteine aus Einschlusskörpern.
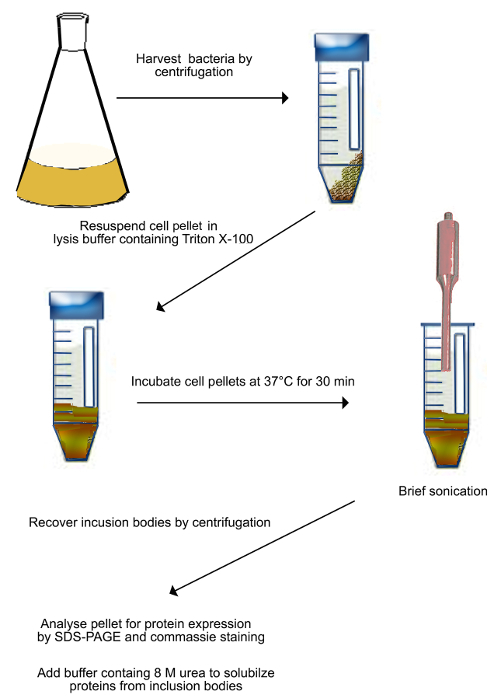
Abbildung 2. Schema der Reinigung von EinschlussKörpern (wie in Schritt 2.1 beschrieben). Die transformierten Bakterien exprimiert Shadoo werden durch Zentrifugation geerntet und in Lysepuffer resuspendiert. Die Suspension wird bei 37 ° C für 30 min inkubiert und dann beschallt, um Bakterienzellen mechanisch zu brechen. Beschallung auf Eis durchgeführt, um Probenerwärmung zu verhindern. Gebrochenen Zellen werden durch Zentrifugation geerntet und in einem Puffer, der 8 M Harnstoff, um Proteine aus Einschlusskörper solubilisiert resuspendiert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen. - Ni 2+ -Affinitätschromatographie
Anmerkung: Die Chromatographie an FPLC-System unter Verwendung einer Ni 2+ -charged, 5 ml Sepharose chelatbildende Säule (3A) durchgeführt. Alle Lösungen werden auf die Säule mit einer Fließgeschwindigkeit von 1 ml / min geladen.- Injizieren von 10 ml 0,2 M NiSO 4 Wasserlösung in die Säule Sepharose, um sie aufzuladenmit Ni 2+ -Ionen.
- Äquilibrieren der Säule mit Ni 2+ -Ionen geladenen durch Injektion von 30-50 ml des Bindungspuffers, der eine niedrige Konzentration an Imidazol (20 mM Tris-HCl-Puffer, pH 7,4, 0,5 M NaCl, 8 M Harnstoff, 5 mM Imidazol).
- Laden Sie die Harnstoff solubilisiert Proteine mit einer 50 ml Injektionsschleife.
- Wiederherstellung der Durchflussfraktion durch gründliches Waschen der Säule mit 10 ml niedrig Imidazol Bindungspuffer (20 mM Tris-HCl-Puffer, pH 7,4, 0,5 M NaCl, 8 M Harnstoff, 5 mM Imidazol), um ein Maximum von ungebundenen Proteine zu entfernen von der Säule.
- Mit 50-100 ml des Waschpuffers (20 mM Tris-HCl, pH 7,4, 0,5 M NaCl, 8 M Harnstoff, 80 mM Imidazol), Proteine unspezifisch an die Säule gebunden eluieren Die Säule wird.
- Anwenden eines 15 min Gradienten von 80-800 linearen mM Imidazol in Puffer, der 20 mM Tris-HCl, pH 7,4, 0,5 M NaCl, 8 M Harnstoff. Sammeln Sie 1-ml-Fraktionen während der Gradienten-Anwendung. Hinweis: His-Tag-Proteine eluiert witha Gradienten von Imidazol enthaltenden Puffer (als Konkurrent verwendet).
- Werfen Sie einen 8-ul-Aliquot jeder Fraktion und fügen Sie 4 ul 4x Laemmli Denaturierungslösung (siehe 2.1.3.1). Hitzelösungen bei 100 ° C für 5 min.
- Last 10 ul Proteingrößenmarker und 10 ul jeder Probe auf den 12% igen Acrylamidgel laufen SDS-PAGE und sichtbar getrennten Proteine durch Coomassie-Färbung. Hinweis: Das Molekulargewicht Shadoo berechnet bilden seine Aminosäuresequenz ist 12,243.2 Da.
- Pool alle Fraktionen, die Shadoo.
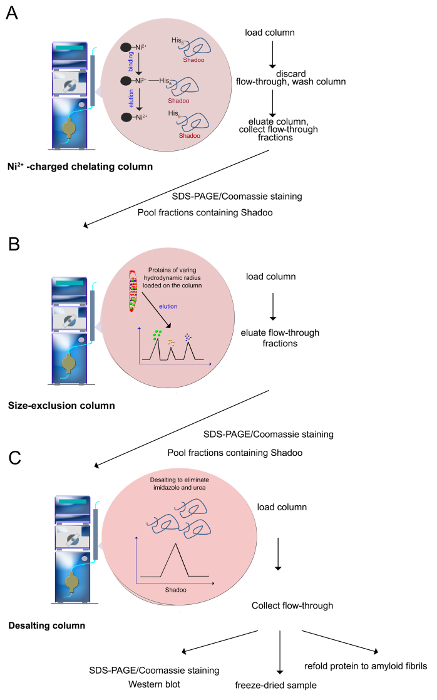
Abbildung 3. Reinigungsverfahren (wie in den Schritten 2.2-2.4 beschrieben). (A) Ni 2+ -Ionen durch Histidinreste, die die selektive Reinigung von Polyhistidin-markierte Proteine können koordiniert werden. Imidazol wird verwendet, um das Protein zu eluieren, durchseine Fähigkeit, mit der Ni 2+ -Ionen koordinieren und verdrängen das gebundene Protein. (B) Proteine mit unterschiedlichen hydrodynamischen Radius, der auf der Ni 2+ -Säule auf einer Größenausschluss-Säule zurückgehalten wurden. Proteine werden von der größten bis zur kleinsten, eluiert. (C) Vor dem Gebrauch enthaltenden Fraktionen werden vereinigt und Shadoo entsalzt Harnstoff, Imidazol und Salze zu entfernen. Qualitätskontrolle Tests umfassen SDS-PAGE / Coomassie-Färbung, Western-Blot. Gereinigtes Shadoo kann gefriergetrocknet werden. Lyophilisierte Shadoo ist über Monate stabil, wenn sie bei -20 ° C gelagert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen. - Größenausschlusschromatographie
Hinweis: Eine zweite Reinigungsschritt besteht in der Größenausschluß-Chromatographie, die Shadoo Proteins von anderen Proteinen in der ersten Reinigungsstufe coeluierte trennt(3B).- Äquilibrieren Superdex-Säule von 120 ml gesamten Bettvolumens durch die Injektion 250 ml 20 mM Tris-HCl-Puffer, pH 7,4, 0,5 M NaCl, 8 M Harnstoff mit einer Fließgeschwindigkeit von 1,5 ml / min.
- Last vereinigten Fraktionen, Shadoo von 2.2.9 auf die äquilibrierte Säule. Sammeln 1 ml-Fraktionen nach der Säule-Hohlraumvolumen von 40 ml auf die konstante Strömung des obigen Puffers.
- Nehmen Sie ein 10 ul-Aliquot jeder Fraktion und führen Sie eine SDS-PAGE-Analyse und Coomassie-Färbung wie oben beschrieben, um herauszufinden, welche Fraktionen enthalten Shadoo.
- Pool Fraktionen, Shadoo.
- Entsalzung
Anmerkung: Entsalzungsverfahren entfernt Salze, Imidazol und Harnstoff rekombinante Shadoo Protein in einer für die weitere biophysikalische und biochemische Untersuchungen (3C) Puffer erhalten. Das gleiche Ergebnis kann durch Dialysieren Proben gegen den Puffer erhalten werden.- Äquilibrieren eine Entsalzungssäule von 53 ml mit 150 mlvon 10 mM Ammoniumacetat-Puffer, pH 5, mit einer Fließgeschwindigkeit von 5 ml / min.
- Last gepoolt Shadoo Fraktionen auf die Säule. Bei Injektion des Ammoniumacetatpuffer sammeln manuell Fraktionen, die eine Erhöhung des Signals bei 280 nm am Ausgang des UV-Detektors zeigen.
- Gefrierzutrocknen der entsalzten Shadoo und speichern Sie sie bei -20 ° C.
- Aufzulösen lyophilisierten Shadoo in ausreichender Puffer, wie 10 mM Natriumacetatpuffer, pH 5, vor der Verwendung.
Hinweis: Die Polyhistidin-Tag kann mit Enterokinase entfernt werden.
3. In-vitro-Montage von Shadoo in Amyloidfibrillen bei physiologischen pH-
Hinweis: Die Shadoo Proteinaggregate und Fibrillen bildet spontan bei pH ≥ 7 11.

Abbildung 4. Schema der Shadoo Rückfaltung an Amyloidfibrillen (wie beschrieBett im Schritt 3). Gereinigtes Shadoo wandelt spontan an Amyloidfibrillen als in Puffer pH ≥ 7, gelöst in einer sauren Lösung, wandelt Shadoo an Amyloidfibrillen bei Inkubation mit 1 M Gdn-HCl unter Schütteln. Qualitätskontrolle Tests umfassen Elektronenmikroskopie und THT-Färbung. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Verdünnter Shadoo bis zu einer Endkonzentration von 2 & mgr; M in 20 mM Tris-HCl-Puffer, pH 7,4. Messen der Konzentration durch Messen der optischen Dichte der Lösung bei 280 nm und unter Verwendung des Extinktionskoeffizienten von Shadoo Aminosäurezusammensetzung von 20.970 abgeleitet.
- Inkubieren 500 ul der Lösung in einem konischen Kunststoffröhrchen bei 4 ° C für ein paar Wochen, um eine spontane Umwandlung Protein Amyloid-Strukturen (Figur 4) zu ermöglichen.
- Hinzufügen frisch Thioflavin T (THT) bis zu einer endgültigen conce vorbereitetntration von 10 um bis 100 & mgr; l Aliquot der Lösung Shadoo. Inkubieren der Lösung für 5 Minuten bei RT. Messung der Fluoreszenzemission von 460 bis 520 nm unter Verwendung einer Anregungswellenlänge von 435 nm, um das Vorhandensein von Amyloid-Strukturen 17 zu verifizieren.
4. In-vitro-Montage von Shadoo an Amyloidfibrillen bei sauren pH-Werten
- Verdünnter Shadoo in 1 M GdnHCl, 20 mM Na-Acetatpuffer, pH 5 zu einer Endkonzentration von 2 uM.
- Inkubieren 500 ul dieser Lösung in einem konischen Röhrchen unter ständigem Schütteln bei 37 ° C für 3-7 Tage.
- Prüfen Sie das Vorhandensein von Amyloidfibrillen durch Zugabe ThT zu einem aliquoten Teil der Lösung nach 3.3.
- Dialyse erhaltene Suspension gegen 10 mM Na-Acetat-Puffer, pH 5,0, zu Shadoo Amyloidfibrillen zu reinigen.
- Bewahren Sie gereinigte Fibrillen bei +4 ° C.

Figur 5. Repräsentative Ergebnisse. Proteinfraktionen aus Ni 2+ eluiert -charged chelatbildende Säule (A) und Größenausschluss-Säule (B) wurden unter Verwendung von SDS-PAGE und Coomassie-Färbung analysiert. Bezeichnung des gereinigten Shadoo wurde mit SPRN Anti Shadoo Antikörper (C) bewertet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Ergebnisse
Etwa 5-10 mg gereinigtes Shadoo Protein pro Liter Bakterienkultur erhalten. Ein Zwei-Schritt-Reinigung ist notwendig, um rekombinante Shadoo hoher Reinheit zu erhalten. Der erste Schritt ist durch Affinitätschromatographie mit einem Ni 2+ -charged Spalte, die His-Tag-Proteine behält geführt. Eluierten Fraktionen werden der SDS-PAGE unterworfen und mit Coomassie Brilliant Blue (5A) angefärbt. Fraktionen Shadoo Protein enthalten, werden vereinigt und weiter durch Grßenausschlußchrom...
Diskussion
Ein einfaches und effizientes Protokoll sowohl für die Expression und Reinigung einer großen Menge an rekombinantem Maus Shadoo Protein präsentiert. Das beschriebene Verfahren ermöglicht erfolgreiche Solubilisierung und Reinigung von (His 6) -markierte rekombinanten Shadoo Protein. Es ist wichtig, wie in dem Dokument darauf hingewiesen, dass, wenn in einem prokaryontischen Bakteriums E. ausgedrückt coli Shadoo sammelt sich in Einschlusskörpern. Vor Shadoo Reinigung haben Bakterien, dur...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors would like to acknowledge Natalie Doude and David Westerway (University of Alberta) for providing us Sho cDNA, Christophe Chevalier (INRA) for plasmid construction, Michel Brémont (INRA) for providing us BL21Sol bacteria; Christine Longin (INRA) for TEM assistance and Edith Pajot-Augy (INRA) for comments and proofreading.
Materialien
| Name | Company | Catalog Number | Comments |
| AKTA FPLC | GE, Amersham | # 1363 | |
| HiLoad 16/60 Superdex | GE Healthcare | 17-1069-01 | |
| HiTrap IMAC | GE Healthcare | GE17-0920-05 | |
| HiPrep26/10 Desalting column | GE Healthcare | GE17-5087-01 | |
| SoluBL21 Competent E. coli | Genlantis | C700200 | |
| pET-28b+ | Novogen | 69865-3 | |
| IPTG | Sigma-Aldrich | I6758 | |
| LB-Broth medium | Sigma-Aldrich | L3022 | |
| Eppendorf Biophotometar | Eppendorf | 550507804 | |
| Trito X-100 | Life Technologies | 85111 | |
| NiSO4 | Sigma-Aldrich | 656895 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Tris-HCl | Sigma-Aldrich | RES3098T | |
| Protease Inhibitor Cocktail Tablets | Roche | 4693116001 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Imidazol | Sigma-Aldrich | I5513 | |
| Gdn-HCl | Sigma-Aldrich | G4505 | |
| protein size marker | Thermo Fisher Scientific | 26620 |
Referenzen
- Biasini, E., Turnbaugh, J. A., Unterberger, U., Harris, D. A. Prion protein at the crossroads of physiology and disease. Trends in Neurosciences. 35, 92-103 (2012).
- Colby, D. W., Prusiner, S. B. De novo generation of prion strains. Nature Reviews. Microbiology. 9, 771-777 (2011).
- Chiti, F., Dobson, C. M. Protein misfolding, functional amyloid, and human disease. Annual Review of Biochemistry. 75, 333-366 (2006).
- Nelson, R., et al. Structure of the cross-beta spine of amyloid-like fibrils. Nature. 435, 773-778 (2005).
- Murphy, R. M. Kinetics of amyloid formation and membrane interaction with amyloidogenic proteins. Biochimica et Biophysica Acta. 1768, 1923-1934 (2007).
- Steunou, S., Chich, J. F., Rezaei, H., Vidic, J. Biosensing of lipid-prion interactions: insights on charge effect, Cu(II)-ions binding and prion oligomerization. Biosensors & Bioelectronics. 26, 1399-1406 (2010).
- Watts, J. C., Westaway, D. The prion protein family: diversity, rivalry, and dysfunction. Biochimica et Biophysica Acta. 1772, 654-672 (2007).
- Westaway, D., Daude, N., Wohlgemuth, S., Harrison, P. The PrP-like proteins Shadoo and Doppel. Topics in Current Chemistry. 305, 225-256 (2011).
- Baillod, P., Garrec, J., Tavernelli, I., Rothlisberger, U. Prion versus doppel protein misfolding: new insights from replica-exchange molecular dynamics simulations. Biochemistry. 52, 8518-8526 (2013).
- Daude, N., et al. Wild-type Shadoo proteins convert to amyloid-like forms under native conditions. Journal of Neurochemistry. 113, 92-104 (2010).
- Li, Q., et al. Shadoo binds lipid membranes and undergoes aggregation and fibrillization. Biochemical and Biophysical Research Communications. 438, 519-525 (2013).
- Watts, J. C., et al. The CNS glycoprotein Shadoo has PrP(C)-like protective properties and displays reduced levels in prion infections. The EMBO Journal. 26, 4038-4050 (2007).
- Watts, J. C., et al. Protease-resistant prions selectively decrease Shadoo protein. PLoS Pathogens. 7, e1002382 (2011).
- Westaway, D., et al. Down-regulation of Shadoo in prion infections traces a pre-clinical event inversely related to PrP(Sc) accumulation. PLoS Pathogens. 7, e1002391 (2011).
- Chevalier, C., et al. PB1-F2 influenza A virus protein adopts a beta-sheet conformation and forms amyloid fibers in membrane environments. The Journal of Biological Chemistry. 285, 13233-13243 (2010).
- Tarus, B., et al. Oligomerization paths of the nucleoprotein of influenza A virus. Biochimie. 94, 776-785 (2012).
- Biancalana, M., Koide, S. Molecular mechanism of Thioflavin-T binding to amyloid fibrils. Biochimica et Biophysica Acta. 1804, 1405-1412 (2010).
- Minic, J., Sautel, M., Salesse, R., Pajot-Augy, E. Yeast system as a screening tool for pharmacological assessment of g protein coupled receptors. Current Medicinal Chemistry. 12, 961-969 (2005).
- Schein, C. H. A cool way to make proteins. Nature Biotechnology. 22, 826-827 (2004).
- Sorensen, H. P., Mortensen, K. K. Advanced genetic strategies for recombinant protein expression in Escherichia coli. Journal of Biotechnology. 115, 113-128 (2005).
- Zhang, J., et al. Disruption of glycosylation enhances ubiquitin-mediated proteasomal degradation of Shadoo in Scrapie-infected rodents and cultured cells. Molecular Neurobiology. 49, 1373-1384 (2014).
- Englund, P. T. The structure and biosynthesis of glycosyl phosphatidylinositol protein anchors. Annual Review of Biochemistry. 62, 121-138 (1993).
- Puig, B., Altmeppen, H., Glatzel, M. The GPI-anchoring of PrP: implications in sorting and pathogenesis. Prion. 8, 11-18 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten