Method Article
دراسة ناقلات فيروسية في الكبد نموذج إسكانها ثلاثي الأبعاد مع الخط خلية الإنسان سرطان الكبد HepG2
In This Article
Summary
The recellularized extracellular matrix of a decellularized rat liver can be used as a humanized, three-dimensional ex vivo model to study the distribution and transgene expression of a virus or viral vector.
Abstract
يصف هذا البروتوكول جيل من ثلاثي الأبعاد (3D) فيفو السابقين نموذج الكبد وتطبيقه على دراسة وتطوير أنظمة النواقل الفيروسية. يتم الحصول على النموذج من خلال إعادة إسكانها المصفوفة خارج الخلية من كبد الفئران decellularized مع خط الخلية الكبدية البشري. يسمح نموذج دراسات في نظام خلية 3D أوعية دموية، لتحل محل التجارب يمكن أن تكون ضارة بالحيوانات الحية. ميزة أخرى هي طبيعة أنسنة النموذج، الذي هو أقرب إلى علم وظائف الأعضاء البشرية من النماذج الحيوانية.
في هذه الدراسة، ونحن لشرح تنبيغ هذا النموذج الكبد مع ناقل فيروسي المستمدة من الفيروسات الغدة المرتبطة (ناقلات AAV). الدائرة نضح التي تزود نموذج الكبد 3D مع وسائل الإعلام توفر وسيلة سهلة لتطبيق النواقل. ويسمح نظام رصد المعلمات الأيض الرئيسية للكبد. من التحليل النهائي، وعينات الأنسجة التي يمكن اتخاذها لتحديد مدى recellularizaنشوئها من خلال تقنيات النسيجية. توزيع ناقلات الفيروس والتعبير عن التحوير تسليمها يمكن تحليلها بواسطة PCR الكمي (QPCR)، غرب النشاف والمناعية. العديد من التطبيقات للنموذج متجه في البحوث الأساسية وتطوير التطبيقات العلاجية الجينات يمكن تصوره، بما في ذلك تطوير علاجات مضادة للفيروسات جديدة، وأبحاث السرطان، ودراسة النواقل الفيروسية والآثار الجانبية المحتملة.
Introduction
Most current biomedical research relies on one of two approaches, either two-dimensional (2D) cell culture experiments or animal models, which are three-dimensional (3D) by their very nature. However, these approaches have some severe drawbacks. Cells grown in 2D culture have been shown to differ in gene expression patterns and cell physiology from those cultivated under 3D conditions.1 Animal models, in addition to being associated with ethical concerns, often do not model human physiology well. Although the lack of obvious toxic effects of a compound must be confirmed in animal models prior to the first dosing in humans, multiple cases have been documented in which severe, sometimes fatal, adverse effects have occurred in clinical trials.2
To overcome these shortcomings, humanized 3D ex vivo organ models have become important research tools. When cultivated under suitable conditions, cells self-assemble into 3D structures known as spheroids. However, these spheroids lack a vascular system, which limits the distribution of small molecular compounds, large biologics and viral vectors alike. For example, adenoviral vectors only transduced the outer cell layers of spheroids prepared from human glioblastomas.3 A solution to this problem is the use of an organ model containing a vascular system. To this end, the organ of interest can be explanted from an animal, and the animal cells can be replaced by human cells. Various methods for decellularization of animal livers by treatment with detergents or sodium cholate have been described.4-6 The resulting extracellular matrix (ECM) harbors cytokines and growth factors which regulate various cellular processes.7 It can be used as a scaffold for recellularization with human cells to obtain a functional organ model.
In a recent study, we used a humanized 3D liver model to study distribution and transgene expression of an adeno-associated virus (AAV) vector.8 AAV vectors belong to the most promising viral vectors for gene therapeutic applications.9 The first, and to date only, approved gene therapeutic intervention in the Western world uses an AAV vector for the transfer of lipoprotein lipase.10
Protocol
ملاحظة: تم الحصول عليها RL الموافقة الأخلاقية للexplantation الأجهزة من Landesamt FÜR Gesundheit اوند Soziales (LaGeSo). تم explanted أكباد الفئران ويستر. ومقنى الوريد الأجوف السفلي والوريد البابي للكبد مع قنية 22 G. وقد وصفت وسائل لdecellularization من كبد explanted سابقا. 4،5 مصفوفات خارج الخلية المستخدمة هنا تم الحصول عليها عن طريق نضح المفرط للكبد الفئران مع 1٪ deoxycholate الصوديوم.
1. Recellularization من خارج الخلية مصفوفة (ECM) من الجرذ الكبد
- التوسع في الكبد HepG2 خط الخلية
- ثقافة الكبد خط خلية سرطان HepG2 في معهد روزويل بارك التذكاري (RPMI) 1640 المتوسطة تستكمل مع 10٪ مصل العجل الجنين، الجلوتامين 2 مم، و 2 ملم من البنسلين والستربتومايسين، لكل منهما.
- البذور 1.5 × 10 7 خلايا في زجاجات T175 وتنمو الخلايا عند 37 درجة مئوية و 5٪ CO 2 . حصاد الخلايا بعد 4 أيام من قبل trypsinization لمدة 5 دقائق عند 37 درجة مئوية، و 5٪ CO 2.
- تدور أسفل الخلايا في 300 x ج و resuspend لهم في 4 مل برنامج تلفزيوني وعدد الخلايا مع غرفة نويباور تحت المجهر. واحد زجاجة T175 تسفر عن حوالي 4.5 × 10 7 الخلايا.
ملاحظة: تأكد الثقافة تحتوي على أرقام الخلية كافية لrecellularization من ECM كبد الفئران مع 6 × 10 8 خلايا HepG2 في ECM (10 × 175 سم 2 قوارير الثقافة مع 4-5 × 10 8 خلايا لكل منهما).

الشكل 1. نظام مفاعل حيوي. أ) وكان هذا النظام مفاعل حيوي حسب الطلب. فإنه يحافظ على نماذج الجهاز عند 37 درجة مئوية و 5٪ CO 2. معدلات تدفق مضخات تحوي يمكن تنظيم على حدة. ب) يتم وضع الكبد في غرفة النمو والاتصالإد إلى الدائرة نضح، الذي يتكون من مضخة تحوي، وخزان المتوسط، فخ فقاعة وجهاز استشعار الضغط. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- Recellularization من ECM
- إعداد نظام مفاعل حيوي، تحتوي على غرفة الكبد نضح، نظام نضح، وخزان المتوسطة وفخ فقاعة. تعقيم نظام مفاعل حيوي (121 درجة مئوية، لمدة 15 دقيقة).
- ربط نظام مفاعل حيوي مع مضخة تحوي ووضعه في الحاضنة التي توفر الظروف الملائمة (37 درجة مئوية، و 5٪ CO 2). وضع decellularized الفئران السقالات الكبد 8 في غرفة نضح الكبد من نظام مفاعل حيوي (الشكل 1).
- ربط الوريد البابي مقنى والوريد الأجوف باستخدام مقاطع أنبوب لنظام الارواء. تتوازن سقالة مع 150 مل RPMI المتوسطة (كما هو موضح في 1.1)أكثر من 5 د مع معدل التدفق من 1.25 مل / دقيقة.
- فصل سقالة الكبد من دائرة الإعلام وتطعيم السقالة مع 3 × 10 8 خلايا HepG2 (في 5 مل) عن طريق الوريد البابي باستخدام حقنة 5 مل، وتجنب تشكيل فقاعة الهواء وتسمح للخلايا لإعادة ملء ECM التي يحتضنها منهم ل تحولت 1 ساعة في سقالة مع مضخة خارج.
- زيادة تدريجية في معدل التدفق عن طريق ضبط مضخة، بدءا من 1.25 مل / دقيقة لمدة 10 دقيقة. 2.5 مل / دقيقة لمدة 20 دقيقة، وأخيرا 3.75 مل / دقيقة لمدة 30 دقيقة.
- كرر الخطوات من 1.2.4-1.2.5 للوصول إلى عدد الخلايا الكلي لل6 × 10 8.
- تشغيل نظام مفاعل حيوي في معدل التدفق من 3.75 مل / دقيقة. ثقافة كبد الفئران recellularized لمدة 2 أسابيع.
ملاحظة: استبدال ثلث المتوسطة مع المتوسطة الطازجة (50 مل) كل يوم. أخذ عينات من مستنبت لقياس المعلمات الفسيولوجية، مثل النشاط اللاكتات نازعة، ودرجة الحموضة لعينات المتوسطة وتركيز الجلوكوز واللاكتات.
2. تنبيغ من Recellularized الجرذ الكبد
- إنتاج واسع النطاق من AAV المتجهات
- إنتاج وتنقية، وتحديد ناقلات AAV كما هو موضح سابقا: 11
- لفترة وجيزة، وإنتاج ناقلات AAV في زجاجات الأسطوانة وتنقيتها بواسطة الطرد المركزي iodixanol التدرج. إزالة iodixanol المتبقية عن طريق الترشيح على PD10 أعمدة هلام الترشيح. تحديد تركيز ناقلات AAV التي كتبها QPCR باستخدام الجيني DNA AAV كمعيار.
ملاحظة: مكمل النفس، pseudotyped AAV2 / 6 ناقلات المستخدمة في هذه الدراسة ترميز EmGFP كمراسلة لإثبات كفاءة ترنسدوكأيشن وتعبيرا الكاسيت shRNA لضربة قاضية لجين أعرب التطور الطبيعي (cyclophilin البشري ب (hCycB)، الشكل 2) . ضمان كمية كافية من ناقلات scAAV pseudotyped من المصلي 6 (2.7 × 10 13 ناقلات AAV في نموذج الكبد).
- لفترة وجيزة، وإنتاج ناقلات AAV في زجاجات الأسطوانة وتنقيتها بواسطة الطرد المركزي iodixanol التدرج. إزالة iodixanol المتبقية عن طريق الترشيح على PD10 أعمدة هلام الترشيح. تحديد تركيز ناقلات AAV التي كتبها QPCR باستخدام الجيني DNA AAV كمعيار.
- إنتاج وتنقية، وتحديد ناقلات AAV كما هو موضح سابقا: 11

الشكل 2. خريطة، pseudotyped مكملة النفس AAV2 / 6 ناقلات المستخدمة في هذه الدراسة. ويتكون الجينوم من يكرر محطة مقلوب (ITR) من AAV2 وبترميز EmGFP تحت سيطرة المروج CMV فضلا عن shRNA تحت السيطرة المروج U6. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- تنبيغ الكبد نموذج
- ضبط الحل ناقلات AAV إلى تركيز النهائي من 2.7 × 10 13 الجينوم ناقلات في 5 مل بإضافة حجم كل منها من برنامج تلفزيوني.
- قطع الكبد من الدائرة الإعلامية عن طريق إزالة أنابيب من قنية. توصيل حقنة 5 مل لقنية في الوريد البابي وحقن الحل ناقلات AAV الكامل (5 مل).
ملاحظة: اختيارياذ، إضافة أحمر الفينول (5 ميكروغرام / مل) لمتابعة توزيع الحل ناقلات AAV في جميع أنحاء الكبد. - احتضان لمدة 1 ساعة دون ضخ. زيادة تدريجيا معدل التدفق، بدءا من 1.25 مل / دقيقة لمدة 10 دقيقة. 2.5 مل / دقيقة لمدة 20 دقيقة و 3.75 مل / دقيقة لمدة 30 دقيقة. ثقافة كبد الفئران recellularized أكثر من 6 أيام.
ملاحظة: استبدال ثلث المتوسط على النحو الوارد في ملاحظة تحت 1.2.7
3. تقييم الكبد Recellularized Transduced الجرذ
- الهيماتوكسيلين ويوزين (سعادة) تلطيخ وتحليل المناعى
- أخذ عينات (0.5 X 0.5 X 1.5-2 سم) من كل فص الكبد باستخدام مشرط.
- احتضان عينات (من 3.1.1) في 4٪ بارافورمالدهيد (PFA) + 4٪ محلول السكروز مقابل 1.5 ساعة عند 4 درجات مئوية. (تحذير: PFA غير سامة ومسرطنة احتفظ PFA داخل غطاء الدخان وارتداء الملابس الواقية المناسبة.) غسل ثلاث مرات مع برنامج تلفزيوني (1 دقيقة لكل خطوة غسل) واحتضان في 8٪بين عشية وضحاها السكروز في 4 درجات مئوية.
- صب تحديد المتوسطة في cryomolds البلاستيك، ووضع العينات في تحديد مجانا المتوسطة من فقاعات الهواء. إضافة تحديد متوسطة حتى يتم تغطية العينة جيدا. متجر جزءا لا يتجزأ من العينات في -80 درجة مئوية حتى استخدامها مرة أخرى.
- إعداد المقاطع البرد (10 ميكرون) مع مبضع بردي 12. تقييم recellularization التي كتبها الهيماتوكسيلين + يوزين تلطيخ 8. تقييم كفاءة تنبيغ من تلطيخ المناعى لمصلحة الجينات من (هنا: EmGFP).
- أخذ العينات البيولوجية الجزيئية
- تذوق كل فص الكبد مع لكمة خزعة (4 مليمتر في القطر). عزل الحمض النووي الريبي مجموع والحمض النووي والبروتينات وفقا لتعليمات الشركة الصانعة لتقييم التعبير التحوير من EmGFP، وhCycB بهدم 8.
النتائج
لتقييم مدى recellularization، أعدت المقاطع البرد من كل فص من كل نموذج الكبد recellularized. ثم جرى تحليل الأقسام التي كتبها الهيماتوكسيلين وتلطيخ يوزين. كما يمكن أن يرى في الشكل (3)، ولكل فص من النماذج الكبد الثلاث، كما تدل TLM1، TLM2 (transduced نماذج الكبد 1 +2) والسيطرة (نموذج الكبد التحكم التي تم recellularized، ولكن ليس transduced)، وتم إسكانها مع خلايا HepG2. أنشئ هذا الخط خلية سرطان الكبد من نسيج الورم صبي الأرجنتيني البالغ من العمر 15 عاما. تم recellularized بعض المناطق من النماذج الكبد أكثر كثافة من غيرها. لا يزال يتعين تحديد أسباب هذه الاختلافات.

الشكل 3. الهيماتوكسيلين ويوزين وصمة عار لكل فص من ثلاثة تحليل نماذج الكبد TLM1 + 2: الكبد transducedنماذج 1 و 2؛ السيطرة: نموذج التحكم الكبد الذي recellularized لكن لا transduced. شريط مقياس: 200 ميكرون. (إعادة طبع بإذن من المرجع 8.) الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
في الخطوة التالية، وجرى تقييم تنبيغ من النماذج الكبد. ولهذه الغاية، تم إعداد الحمض النووي من 28 الخزعات لكمة من كل من النماذج الكبد وكان كميا عيار ناقلات عن طريق QPCR. في المتوسط، تم قياس 55 و 90 المنضوية الجينوم ناقلات لكل خلية (VG / خلية) لمدة نماذج الكبد transduced. وقد أظهرت التجارب في زراعة الخلايا 2D 30 VG / خلية كافية للتعبير عن التحوير قوية وإسكات بوساطة رني. تم تحليل إنتاج EmGFP بواسطة RT-PCR والنشاف الغربية. في الواقع، تم الكشف عن التعبير عن مراسل في 80-90٪ من الخزعات على مستويات مرنا والبروتين، على التوالي.8 للحصول على صورة شاملة عن كفاءة تنبيغ، وقد تم تحليل immunohistologically المقاطع البرد. كما يمكن أن يرى في الشكل (4)، ومناطق للنموذج الكبد التي تم recellularized بنجاح، كما تصور من قبل تلطيخ دابي، وقدم أيضا إشارات فلوري قوية في التحليل المناعى التعبير EmGFP. كما هو متوقع، ونموذج الكبد السيطرة، لا تعامل مع ناقلات AAV، لم تظهر أي تعبير EmGFP.
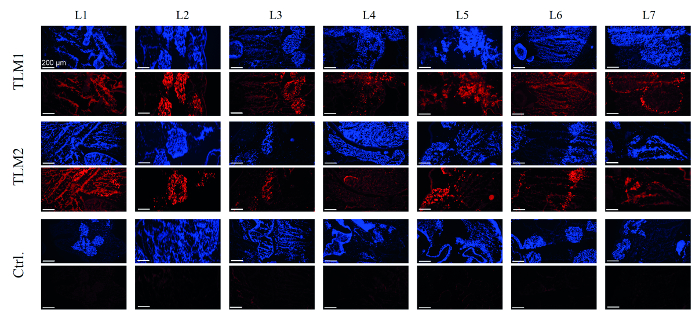
الشكل 4. تحليل المناعى التعبير EmGFP الخلايا التي إسكانها وتصور نماذج الكبد عن طريق تلطيخ دابي (الأزرق)؛ وقد تصور التعبير EmGFP من تلطيخ immunochemical (الحمراء). TLM1 + 2: transduced نماذج الكبد 1 و 2؛ السيطرة: نموذج التحكم الكبد الذي recellularized لكن لا transduced. شريط مقياس: 200 ميكرون. (إعادة طبع بإذنمن المرجع. 8.) الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
في الاختبار النهائي، تم تحليل ضربة قاضية بوساطة AAV من hCycB التي كتبها QRT-PCR. تم العثور على ضربة قاضية من hCycB أن يكون بين 70 و 90٪، وبلغ متوسط على كل فصوص من النموذجين الكبد transduced (الشكل 5).

تم تحديد الشكل 5. ضربة قاضية بوساطة رني من hCycB في نماذج الكبد 3D-transduced AAV. إسكات hCycB التي كتبها QRT-PCR. تم حساب متوسط القيم والانحرافات المعيارية (SD) لجميع العينات من كل نموذج 3D الكبد transduced (TLM1 و 2 على التوالي) وتطبيع القيمة المتوسطة للسيطرة غير transduced (السيطرة). (إعادة طبع بإذن من REF. 8.) الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
كبد 3D أعيد الموصوفة هنا تقدم نموذجا لدراسة ناقلات فيروسية في نظام إنساني. إعادة تعمير ECM من كبد الفئران مع خط خلايا سرطان الكبد البشري يولد نظام أوعية دموية الذي يسمح للدراسة البيولوجية الكبيرة. وتوفر هذه النتائج إثبات صحة مفهوم أن النموذج الكبد أعيد يمكن transduced بكفاءة مع ناقل فيروسي.
لالتجارب هو موضح هنا، تم transduced كل فص من الكبد عن طريق ناقلات AAV. ومع ذلك، في بعض التجارب الأولية، لم إسكانها الفصوص واحدة مع الخلايا. ولذلك فمن المهم لمنع الحطام الخلية أو المكونات الأخرى من يسد الأوعية الدموية. لاختبار ما إذا كانت جميع فصوص يمكن perfused، صبغة غير سامة مثل الفينول الأحمر يمكن أن يتم مسح من خلال نموذج الكبد.
مسألة حاسمة أخرى هو الحفاظ على سقالة الكبد عقيمة. بينما العلاج مع الإيثانول أو المضادات الحيوية هي disadvantageous لنظام الأوعية الدموية، تشعيع المصفوفة خارج الخلية مع γ للإشعاع الحفاظ على السفن وتعقيم العينة.
وعلاوة على ذلك، فإن حجم كبد explanted تختلف، لذلك قد يكون عدد الخلايا المستخدمة لإجراء recellularization والوقت إعادة تعمير لتعديلها للحصول على نتائج قابلة للتكرار.
أكباد الفئران المستخدمة في الدراسة الحالية هي كبيرة نسبيا وتحتاج إلى كميات كبيرة من الخلايا والكواشف الاختبار (على سبيل المثال، ناقلات AAV). وبالإضافة إلى ذلك، اتخذ إجراءات إعادة تعمير أكثر من أسبوعين. وهذا يحد من عدد من مكررات الذي يمكن القيام به مع جهد معقول. نحن حاليا بإنشاء نموذج للكبد الفأر، والتي هي فقط ما يقرب من خمس حجم كبد الفئران، والسماح باستخدام عدد أقل من الخلايا وأقل الكواشف الاختبار. على الرغم من أن يتناسب حجم أسفل من عدد الخلايا يبدو معقولا، تحتاج إلى أن تحدد في furt المبالغ الدقيقةتجارب لها.
وثمة عيب آخر من النموذج الحالي هو استخدام خط الخلية HepG2 الكبد. التجارب مستمرة لتطوير استخدام خلايا الكبد متباينة من الخلايا الجذعية المحفزة التي يسببها، والتي سوف تقدم نموذجا من الناحية الفسيولوجية أكثر أهمية. وعلاوة على ذلك، والكبد يتكون من أنواع الخلايا متعددة بالإضافة إلى خلايا الكبد، على سبيل المثال، خلايا كوبفر وsinosoids. ونحن نفترض أن أنواع مختلفة من الخلايا وإعادة النشرات بيئاتها الطبيعية عند recellularized إدارة المحتوى في المؤسسة مع أنواع خلايا متعددة.
نموذج الكبد 3D يجمع العديد من المزايا. والعيب الرئيسي للالتقليدية في النماذج الحية هو أن فسيولوجيا الحيوان يختلف كثيرا عن علم وظائف الأعضاء البشرية. وبالتالي قد تبقى الآثار الجانبية السامة لعلاج المريض البشري التي لم يتم كشفها. هذا القصور يمكن التغلب عليها عن طريق إعادة تشكيل نموذج الكبد 3D مع الخلايا البشرية التي تعكس بشكل وثيق بيولوجيا هو جين تاوالمرضى الرجل.
الميزة الثانية من طراز الكبد هي مساهمته في رعاية الحيوان. على الرغم من أن مكونات الحيوان مطلوبة من أجل التجارب إعادة، ونهج لا يزال يتبع أهداف مبدأ 3R (استبدال، والحد، والصقل)، والحيوانات الفائضة يمكن استخدامها التي ضحى من التجارب على الحيوانات الأخرى، أي هناك حاجة إلى أي الحيوانات إضافية و النهج يتجنب تماما معاناة الحيوانات التي كثيرا ما يرتبط مع التجارب في الجسم الحي. الكروية هي أداة بديلة لدراسة العمليات الخلوية في نظام 3D. ومع ذلك، لا أوعية دموية الكروية ذلك أن المواد الكبيرة والبيولوجية لا تخترق عميقا في الأجزاء الداخلية للهيكل. وقد تم التغلب على هذه المشاكل مع نموذج الكبد 3D أوعية دموية.
في التجارب وصفها هنا، تم التحقيق ناقلات AAV، لأنها هي من بين المرشحين الواعدين لالعلاجية الجينالتطبيقات. كما تهدف النهج العلاجية العديد من الجينات في استهداف الكبد، على سبيل المثال، لعلاج العدوى بفيروسات التهاب الكبد أو نقص ألفا 1-انتيتريبسين، والكبد 3D يمكن استخدامها في عملية تطوير هذه ناقلات AAV. هو، بطبيعة الحال، ومناسبة أيضا لدراسة ناقلات أخرى كبدي التوجه الفيروسية، على سبيل المثال، وناقلات الفيروسة الغدانية. وبالإضافة إلى ذلك، يمكن استخدامه لدراسة فيروسات التهاب الكبد المعدية مثل التهاب الكبد B أو C الفيروس. ويمكن، على سبيل المثال، أن تستخدم لتصميم الاستراتيجيات المضادة للفيروسات جديدة. وعلاوة على ذلك، ونماذج الجهاز 3D تمثل أدوات واعدة لتطوير علاجات تثبيط الخلايا الجديدة لعلاج السرطان وإجراء دراسات السمية. على المدى الطويل، الكبد الاصطناعي يمكن استخدامها في الطب التجديدي كما زرع. معا، ونموذج الكبد 3D يقدم مجموعة واسعة من التطبيقات في مجال البيولوجيا العدوى وغيرها من مجالات البحوث الطبية الحيوية.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Bernd Krostitz for technical assistance, Radoslaw Kedzierski for initial contributions to the project, Erik Wade for proofreading and giving helpful comments, and Prof. Heike Walles for providing the bioreactor and sharing her valuable experience with organ decellularization. We are also thankful for funding of the project and publication by the Berlin University of Technology.
Materials
| Name | Company | Catalog Number | Comments |
| Incubator | Fraunhofer | / | |
| Peristaltic Pump | Fraunhofer | / | |
| Flange with groove | Duran | 2439454 | modified by gaffer |
| O-Ring Transparent | Duran | 2922551 | |
| Quick Release Clamp | Duran | 2907151 | |
| Flat Flange Lid | Duran | 2429857 | modified by gaffer |
| Screw thread Tube | Duran | 2483802 | modified by gaffer |
| Screw thread Tube | Duran | 2483602 | modified by gaffer |
| Silicone sealing Ring | Duran | 2862012 | |
| Screw Cap | Duran | 2924013 | |
| Screw Cap | Duran | 2924008 | |
| Screw Cap with aperture | Duran | 2922709 | |
| Screw Cap with aperture | Duran | 2922705 | |
| Filter | Sarstedt | 831,826,001 | |
| Silicone Tubing | VWR | 228-1500 | |
| Tube connector | Ismatec | ISM556A | |
| Biocompatible Tubing | Ismatec | SC0736 | |
| T175 culture flasks | Greiner bio-one | 660 160 | |
| RPMI 1640 | BioWest SAS (Th. Geyer) | L0501-500 | |
| glutamine | BioWest SAS (Th. Geyer) | X0551-100 | |
| Trypsin | BioWest SAS (Th. Geyer) | L0940-100 | |
| penicillin/streptomycin | BioWest SAS (Th. Geyer) | L0022-100 | |
| fetal calf serum | cc pro | S-10-M | |
| Tissue-Tek O.C.T. | Weckert-Labortechnik | 600001 | |
| HepG2 | DSMZ | ACC 180 | |
| Cryomold 15 x 15 x 5 mm | Sakura | 4566 | |
| Biopsy punch 4 mm | pfm medical | 48401 | |
| Nucleospin miRNA | Macherey & Nagel | 740971.10 | |
| Nucleospin RNA/DNA Buffer Set | Macherey & Nagel | 740944 |
References
- Chang, T. T., Hughes-Fulford, M. Monolayer and spheroid culture of human liver hepatocellular carcinoma cell line cells demonstrate distinct global gene expression patterns and functional phenotypes. Tissue Eng. Part A. 15 (3), 559-567 (2009).
- Butler, D., Callaway, E. Scientists in the dark after French clinical trial proves fatal. Nature. 529 (7586), 263-264 (2016).
- Enger, P. O., Thorsen, F., Lonning, P. E., Bjerkvig, R., Hoover, F. Adeno-associated viral vectors penetrate human solid tumor tissue in vivo more effectively than adenoviral vectors. Hum. Gene Ther. 13 (9), 1115-1125 (2002).
- Uygun, B. E., et al. Decellularization and recellularization of whole livers. J. Vis. Exp. (48), e2394(2011).
- Hillebrandt, K., et al. Procedure for Decellularization of Rat Livers in an Oscillating-pressure Perfusion Device. J. Vis. Exp. (102), e53029(2015).
- Baptista, P. M., et al. The use of whole organ decellularization for the generation of a vascularized liver organoid. Hepatology. 53 (2), 604-617 (2011).
- Yagi, H., et al. Human-scale whole-organ bioengineering for liver transplantation: a regenerative medicine approach. Cell Transplant. 22 (2), 231-242 (2013).
- Wagner, A., et al. Use of a three-dimensional humanized liver model for the study of viral gene vectors. J. Biotechnol. 212, 134-143 (2015).
- Kay, M. A. State-of-the-art gene-based therapies: the road ahead. Nat. Rev. Genet. 12 (5), 316-328 (2011).
- Yla-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Mol. Ther. 20 (10), 1831-1832 (2012).
- Wagner, A., Röhrs, V., Kedzierski, R., Fechner, H., Kurreck, J. A novel method for the quantification of adeno-associated virus vectors for RNA interference applications using quantitative polymerase chain reaction and purified genomic adeno-associated virus DNA as a standard. Hum. Gene Ther. Methods. 24 (6), 355-363 (2013).
- Takagi, H., et al. Microdissected region-specific gene expression analysis with methacarn-fixed, paraffin-embedded tissues by real-time RT-PCR. J. Histochem. Cytochem. 52 (7), 903-913 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved