Method Article
인간의 간세포 암 세포주 인 HepG2와 3 차원 간 모델 다시 채워에서 바이러스 성 벡터의 연구
요약
The recellularized extracellular matrix of a decellularized rat liver can be used as a humanized, three-dimensional ex vivo model to study the distribution and transgene expression of a virus or viral vector.
초록
이 프로토콜은 3 차원 (3D)의 발생 생체 간 모델 및 바이러스 벡터 시스템의 연구 및 개발에의 응용을 설명한다. 이 모델은 인간 간세포 세포주와 decellularized 래트 간 세포 외 기질을 다시 채우기에 의해 얻어진다. 이 모델은 살아있는 동물에 유해한 실험을 대체하는 혈관 3D 전지 시스템 연구를 허용한다. 또 다른 장점은 동물 모델보다 인간 생리에 가까운 모델의 인간화 특성이다.
본 연구는 아데노 - 관련 바이러스 (AAV 벡터) 유래의 바이러스 벡터와이 간 모델의 전달을 입증한다. 미디어와 3D 간 모델을 공급하는 관류 회로는 벡터를 적용 할 수있는 쉬운 방법을 제공합니다. 시스템 간 주요 대사 파라미터의 모니터링을 허용한다. 최종 분석을 위해, 조직 샘플은 recellulariza의 범위를 결정하기 위해 수행 될 수있다조직 학적 기술에 의해 기. 전달 된 유전자의 바이러스 벡터와 표현의 분포를 정량적 PCR (qPCR에), 웨스턴 블롯 및 면역 조직 화학 염색에 의해 분석 될 수있다. 기초 연구 및 유전자 치료 응용 개발 벡터 모델의 다수의 애플리케이션은 신규 한 항 바이러스 치료법의 개발, 암 연구 및 바이러스 벡터에 관한 연구 및 잠재적 부작용을 포함하여 구상 할 수있다.
서문
Most current biomedical research relies on one of two approaches, either two-dimensional (2D) cell culture experiments or animal models, which are three-dimensional (3D) by their very nature. However, these approaches have some severe drawbacks. Cells grown in 2D culture have been shown to differ in gene expression patterns and cell physiology from those cultivated under 3D conditions.1 Animal models, in addition to being associated with ethical concerns, often do not model human physiology well. Although the lack of obvious toxic effects of a compound must be confirmed in animal models prior to the first dosing in humans, multiple cases have been documented in which severe, sometimes fatal, adverse effects have occurred in clinical trials.2
To overcome these shortcomings, humanized 3D ex vivo organ models have become important research tools. When cultivated under suitable conditions, cells self-assemble into 3D structures known as spheroids. However, these spheroids lack a vascular system, which limits the distribution of small molecular compounds, large biologics and viral vectors alike. For example, adenoviral vectors only transduced the outer cell layers of spheroids prepared from human glioblastomas.3 A solution to this problem is the use of an organ model containing a vascular system. To this end, the organ of interest can be explanted from an animal, and the animal cells can be replaced by human cells. Various methods for decellularization of animal livers by treatment with detergents or sodium cholate have been described.4-6 The resulting extracellular matrix (ECM) harbors cytokines and growth factors which regulate various cellular processes.7 It can be used as a scaffold for recellularization with human cells to obtain a functional organ model.
In a recent study, we used a humanized 3D liver model to study distribution and transgene expression of an adeno-associated virus (AAV) vector.8 AAV vectors belong to the most promising viral vectors for gene therapeutic applications.9 The first, and to date only, approved gene therapeutic intervention in the Western world uses an AAV vector for the transfer of lipoprotein lipase.10
프로토콜
참고 : RL은 Landesamt 대 아퍼 싶게 Soziales (LaGeSo)에서 장기의 외식에 대한 윤리적 승인을 획득했습니다. 간은 스터 쥐에서 외식되었다. 대정맥과 간 포털 정맥은 22 G 정맥에 삽관 하였다. 외식 간의 탈세 포화하는 방법은 이전에 설명되었다. 1 % 나트륨 데 옥시 콜레이트와 쥐 간 과도한 관류에 의해 수득 된 4,5- 여기서 사용 세포 외 매트릭스.
쥐 간의 세포 외 기질 (ECM) 1. Recellularization
- 간 세포주 인 HepG2의 확장
- 배양 된 로스웰 파크 메모리얼 연구소 (RPMI) 10 % 소 태아 혈청 및 2 mM 글루타민 및 페니실린 및 스트렙토 마이신이 mM의 각각의 보충 1640의 간암 세포주 인 HepG2.
- T175 병 1.5 × 10 7 세포를 시드 및 37 ℃, 5 % CO 2에서 세포 성장 . 37 ° C에서 5 분 동안 트립신에 의해 사일 후 수확 세포, 5 % CO 2.
- 300 XG에서 세포를 스핀 다운 4 ml의 PBS에서 그들을 재현 탁하고 현미경 아래 노이 바 우어 챔버와 세포를 계산합니다. 하나 T175 병은 약 4.5 × 10 7 세포를 얻을 것입니다.
참고 : 문화 ECM 당 6 × 10 8 인 HepG2 세포 (4-5 × 10 8 세포 각각 10 × 175cm 2 배양 플라스크)와 쥐의 간 ECM의 recellularization 충분한 세포 수를 포함해야합니다.

그림 1. 생물 반응기 시스템. A)이 생물 반응기 시스템은 주문 제작했다. 그것은 37 ° C와 5 % CO 2의 장기 모델을 유지합니다. 연동 펌프의 유량 간은 성장 챔버 내에 배치된다) B. 개별적으로 조절하고 연결할 수있다연동 펌프, 중간 저장, 버블 트랩 및 압력 센서로 구성 관류 회로에 에디션. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 전자 재료의 Recellularization
- 간 관류 챔버, 관류 시스템, 매체의 저장 및 버블 트랩을 포함, 생물 반응기 시스템을 설정합니다. 생물 반응기 시스템 (121 ° C, 15 분) 소독.
- 연동 펌프와 생물 반응기 시스템을 연결하고 인큐베이터가 적절한 조건을 제공하는 배치 (37 ° C, 5 % CO 2). 생물 반응기 시스템 (그림 1)의 간 관류 챔버에서 decellularized 쥐의 간 비계 8 놓습니다.
- 관류 시스템에 관 클립을 사용하여 유관 포털 정맥과 대정맥을 연결합니다. (1.1에서 설명) 150 ml의 RPMI 배지로 발판을 평형/ 분 1.25 mL의 유속으로 5 D 이상.
- 미디어 회로로부터 간 발판을 분리하고 5 ML의 주사기를 사용하여 포털 정맥 (5 ㎖)에 3 × 10 8 인 HepG2 세포와 지지체를 접종, 공기 방울 형성을 방지하고 세포가 그들을 배양하여 ECM을 다시 채울 수 있도록 펌프와 발판에 1 시간은 꺼져.
- 점차적으로 10 분 동안 125 ml / 분으로 시작 펌프를 조정함으로써, 유량을 증가; 20 분 동안 250 ml / 분 최종적 3.75 ㎖ / 분으로 30 분간.
- 반복은 6 × 10 (8)의 총 세포 수에 도달 1.2.4-1.2.5 단계를 반복합니다.
- / 분 3.75 ml의 유속으로 바이오 리액터 시스템을 실행. 문화 이주에 대한 recellularized 쥐의 간.
참고 : 새로운 배지 (50 ㎖) 매일과 매체의 3 분의 1을 교체합니다. 이러한 락 테이트 탈수소 효소 활성 매체 샘플의 pH 및 글루코스 및 락 테이트의 농도 등의 생체 변수를 측정하기 위하여 배양액 샘플.
Recellularized 쥐 간 2. 형질 도입
- AAV 벡터의 대규모 생산
- 전술 한 바와 같이 생산 정제 및 AAV 벡터를 정량화 : 11
- 간략하게, 롤러 병에서 AAV 벡터를 생성하고 iodixanol 구배 원심 분리에 의해이를 정제. PD10 겔 여과 컬럼을 통해 여과하여 잔류 iodixanol를 제거합니다. 표준으로 게놈 AAV의 DNA를 사용하여 qPCR에 의한 AAV 벡터의 농도를 결정합니다.
참고 : 본 연구에 사용 된 자기 보완, pseudotyped AAV2 / 6 벡터 전달 효율 및 내생 적 발현 유전자의 최저 대한 shRNA를 발현 카세트 (인간의 시클로 필린의 B (hCycB), 그림 2)을 보여주기 위해 기자로 EmGFP 인코딩 . 혈청 형 6 (간 모델 당 2.7 × 10 13 AAV 벡터)의 pseudotyped scAAV 벡터의 충분한 양을 확인합니다.
- 간략하게, 롤러 병에서 AAV 벡터를 생성하고 iodixanol 구배 원심 분리에 의해이를 정제. PD10 겔 여과 컬럼을 통해 여과하여 잔류 iodixanol를 제거합니다. 표준으로 게놈 AAV의 DNA를 사용하여 qPCR에 의한 AAV 벡터의 농도를 결정합니다.
- 전술 한 바와 같이 생산 정제 및 AAV 벡터를 정량화 : 11

본 연구에 사용 된 자기 보완, pseudotyped AAV2 / 6 벡터 그림 2.지도. 게놈은 AAV2의 반전 터미널 반복 (ITR) 구성 및 제어 아래의 shRNA뿐만 아니라 CMV 프로모터의 제어하에 EmGFP를 인코딩 U6 프로모터의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 간 모델의 형질 도입
- PBS의 각각의 양을 첨가하여 5 ㎖ 2.7 × 10 13 벡터 게놈의 최종 농도로 AAV 벡터 용액을 조정한다.
- 정맥에서 튜브를 제거하여 미디어 회로로부터 간을 분리합니다. 포털 정맥의 정맥에 5 ML의 주사기를 연결하고 전체 AAV 벡터 용액 (5 ml)에 주입.
참고 : OptionallY는 간 걸쳐 AAV 벡터 용액의 분배를 수행하는 페놀 레드 (5 μg의 / ㎖)을 추가한다. - 펌핑없이 1 시간 동안 품어. 서서히 10 분 / 125 ㎖로 분부터 유량을 증가; 2.5 ㎖ / 20 분, 30 분 3.75은 ㎖ / 분 분간. 문화 육일 동안 recellularized 쥐의 간.
주 : 매체의 3 분의 1을 교체 1.2.7에 따라 주에 주어진
Recellularized 형질 쥐 간 3. 평가
- 헤 마톡 실린 및 에오신 (HE) 염색 및 면역 조직 화학적 분석
- 메스를 사용하여 각 간 로브에서 샘플 (0.5 × 0.5 × 1.5 cm)를 가져 가라.
- 4 % 파라 포름 알데히드 (PFA), 4 ℃에서 1.5 시간 동안 + 4 % 수 크로스 용액 (3.1.1부터) 샘플을 인큐베이션. (주의 :.. PFA는 항상 흄 후드 내에서 PFA를 유지하고 적절한 보호 복을 착용 독성 및 발암) 세척 PBS로 3 회 (세척 단계 당 1 분) 8 %에 품어4 ℃에서 자당 하룻밤.
- 플라스틱 cryomolds에 매체를 고정 부어 기포의 매체 무료 고정에 샘플을 배치합니다. 샘플이 잘 덮여 때까지 고정 매체를 추가합니다. 스토어 더 사용할 때까지 -80 ° C에서 샘플을 포함.
- cryotome (12) 냉동 섹션 (10 μm의)를 준비합니다. 헤 마톡 실린 + 에오신 염색 8 recellularization을 평가합니다. (: EmGFP 여기) 유전자-의 이익에 대한 면역 조직 화학 염색에 의해 전달 효율을 평가합니다.
- 분자 생물학적 시료 채취
- 생검 펀치 (직경 4mm)와 각 간 로브 샘플. EmGFP의 유전자 발현의 평가를위한 제조업체의 지침에 따라 전체 RNA, DNA와 단백질을 분리, 8을 노크 hCycB.
결과
recellularization 정도의 평가를 위해, 크라이 섹션은 각각 recellularized 간 모델의 각 로브로부터 제조 하였다. 그런 다음 섹션을 헤 마톡 실린 및 에오신 염색으로 분석 하였다. 도 3에서 알 수있는 바와 같이, TLM1, TLM2로 표시된 세 간 모델은 각 로브는 (recellularized하지만 형질 도입되지 않은 제어 간 모델) Ctrl 키 (간 모델 일 +2를 형질) 인 HepG2 세포의 증식을 하였다. 이 간세포 암 세포주는 15 세의 아르헨티나 소년의 종양 조직에서 설립되었다. 간 모델의 일부 영역을보다 집중적으로 다른 사람보다 recellularized했다. 이러한 차이에 대한 이유가 결정될 남아있다.

그림 3. 헤 마톡 실린과 세 가지의 각 엽의 에오신 염색 간 모델을 분석 TLM1 + 2 :. 형질 간모델 1, 2; recellularized하지만 형질 도입되지 않은 Ctrl 키 : 컨트롤 간 모델입니다. 스케일 바 : 200 μm의. (참고 허가를 재 인쇄. 8) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
다음 단계에서, 간 모델의 전달을 평가 하였다. 이를 위해, DNA를 간이 모델의 각각의 펀치 생검 28로부터 제조하고, 벡터 역가 qPCR에 의해 정량화 하였다. 평균 셀 (VG / 셀) 당 55에서 90 내재화 벡터 게놈 두 형질 간 모델에서 측정되었다. 2D 세포 배양 실험에서 30 VG / 셀 강한 유전자 발현 및 RNAi를 매개 된 침묵 충분 보여준다. EmGFP의 생산은 RT-PCR 및 웨스턴 블롯으로 분석 하였다. 사실, 리포터의 발현은 각각의 mRNA와 단백질 수준에서 생검 80-90 %가 검출되었다.도 8은 전달 효율의 포괄적 인 사진을 얻기 위해 극저온 섹션 immunohistologically 분석 하였다. 도 4에서 알 수있는 바와 같이, DAPI 염색으로 가시화로 성공적 recellularized 된 간 모델의 영역도 EmGFP 발현의 면역 조직 화학적 분석에서 강한 형광 신호를 주었다. 예상대로되지 AAV 벡터로 처리 제어 간 모델은 임의 EmGFP 발현을 나타내지 않았다.
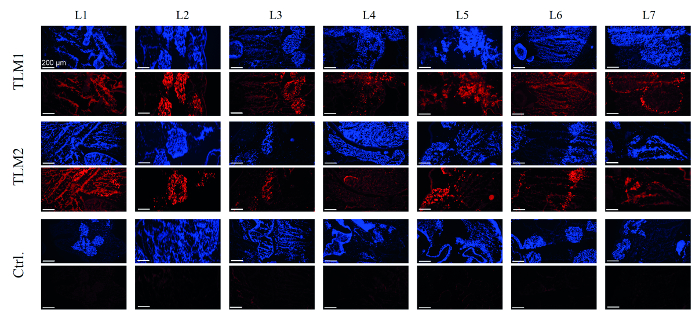
EmGFP 표현의 그림 4. 면역 조직 화학적 분석 간 모델을 DAPI 염색 (파란색)에 의해 가시화했다 다시 채워 세포.; EmGFP 발현은 면역 화학적 염색 (적색)에 의해 가시화되었다. TLM1 + 2 : 형질 간 모델 (1)과 (2); recellularized하지만 형질 도입되지 않은 Ctrl 키 : 컨트롤 간 모델입니다. 스케일 바 : 200 μm의. (허가를 재 인쇄참고 문헌에서. 8) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
최종 테스트에서 hCycB의 AAV 매개 된 녹다운을 QRT-PCR로 분석 하였다. hCycB의 최저 70 ~ 90 % 사이 인 것으로 밝혀 두 형질 간 모델의 모든 돌출부 (도 5)에 대하여 평균 하였다.

hCycB의 그림 AAV-형질 3D 간 모델 hCycB 5. RNAi를 매개 최저. 음소거는 QRT-PCR에 의해 결정되었다. 평균값과 표준 편차 (SD)를 비 형질 제어의 평균 값 (각각 TLM1 2) 각각의 형질 3D 간 모델의 모든 샘플에 대해 계산 된 정규화 된 (Ctrl 키.). (R의 허가를 다시 인쇄EF. 8) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명 된 재구성 차원 간은 인간화 시스템에서 바이러스 벡터를 연구하는 모델을 제공합니다. 인간의 간세포 암 세포주와 쥐의 간의 ECM의 다시 채우기가 큰 바이오 의약품의 연구를 허용하는 혈관 시스템을 생성합니다. 이러한 결과는 개념 증명 재구성 간 모델을 효율적으로 바이러스 벡터로 형질 도입 될 수있다 제공한다.
여기에 도시 된 실험에서 간 각자 로브는 AAV 벡터에 의해 형질 도입 하였다. 그러나, 몇 가지 예비 실험에서, 단일 엽 세포 증식을하지 않았다. 이 혈관 폐색 시스템에서 세포 파편 또는 다른 구성 요소를 방지하는 것이 중요하다. 모든 돌출부가 관류 될 수 있는지 여부를 시험하기 위해, 페놀 레드 등의 무독성 염료 간 모델을 플러싱 할 수있다.
또 다른 중요한 문제는 멸균 간 골격을 유지하고있다. 에탄올 또는 항생제 치료는 disadv 동안antageous 혈관 시스템, γ-방사선의 세포 외 기질의 조사가 혈관을 보존 시료를 멸균.
recellularization 절차 및 시간 다시 채우기 위해 사용되는 세포의 수는 재현 가능한 결과를 얻기 위해 조정되어야 할 수 있도록 또한, 이식 된 간 크기가 다르다.
본 연구에 사용 된 쥐 간은 비교적 큰 셀 테스트 시약 (예컨대, AAV 벡터)의 대용량을 필요로한다. 또한, 다시 채우기 절차는 2 주 이상 걸렸다. 이것은 합리적인 노력을 함께 할 수있는 복제의 수를 제한합니다. 현재는보다 적은 세포 적은 테스트 시약의 사용을 허용 쥐 간 부피의 약 오분있는 마우스 간을위한 모델을 설정한다. 세포 수의 비례 미세화는 타당하지만, 정확한 양은 작고에 결정되어야그녀의 실험.
본 모델의 또 다른 단점은 간세포 인 HepG2 세포주를 사용하는 것이다. 실험은 생리 학적 관련성이 모델을 제공 유도 다 능성 줄기 세포로부터 분화 된 간세포의 사용을 개발하는 것이 계속된다. 또한, 간은 간세포, 예를 들면, 쿠퍼 세포 및 sinosoids 외에도 여러 종류의 세포로 구성된다. 우리는 ECM이 여러 세포 유형으로 recellularized 때 다른 세포 유형의 자연 환경을 다시 채워야한다고 가정합니다.
차원 간 모델은 몇 가지 장점을 결합한다. 생체 내 모델에서 기존의 가장 큰 단점은 동물 생리학은 인간의 생리 실질적으로 차이가 있다는 것입니다. 인간 환자의 치료 독성 부작용 때문에 미결 남아있다. 이러한 단점은 더 가깝게 후 생물학 반영 인간 세포 간 차원 모델을 재구성함으로써 극복 될 수있다남자 환자.
간 모델의 두 번째 장점은 동물 복지에 기여한다. 동물 성분이 재구성 실험 요구되지만 잉여 동물 즉 즉, 추가적인 동물은 필요하지 않다, 다른 동물 실험을 위해 희생되었다 사용될 수있는 바와 같이, 방법은 여전히 3R 원칙 (여분 환원, 정제)의 목적을 따른다 접근 방식은 완전히 자주 생체 실험과 연관된 동물의 고통을 피할 수 있습니다. 구 상체는 3D 시스템에서 세포 과정을 연구하기위한 대체 수단이다. 많은 생물학적 물질이 구조의 내측 부분에 깊이 침투하지 않도록하지만, 타원체는 혈관 아니다. 이러한 문제는 혈관 간 3D 모델로 극복되었다.
가 유전자 치료에 가장 유망한 후보 중에서 때문에 여기에 설명 된 실험에서 AAV 벡터는 조사했다응용 프로그램. 수많은 유전자 치료 접근법 간염 바이러스 또는 알파 -1- 항 트립신 결핍증 감염의 치료를 위해, 예를 들면, 간을 표적 겨냥은 3D 간암이 AAV 벡터를 개발하는 과정에서 사용될 수있다. 또한, 물론, 다른 hepatotropic 바이러스 벡터, 예를 들어, 아데노 바이러스 벡터의 조사에 적합하다. 또한, 이러한 간염 B 또는 C 바이러스 감염성 간염 바이러스를 연구하기 위해 사용될 수있다. 또, 예를 들면, 바이러스의 새로운 전략을 설계하는데 이용 될 수있다. 또한, 3D 모델 기관의 암을 치료 및 독성 학적 연구를 수행하기 위해 새로운 세포 증식 치료법을 개발하는 유망한 도구를 나타낸다. 긴 안목에서 인공 간은 이식 등 재생 의학에 이용 될 수있다. 함께, 차원 간 모델은 감염 생물학에 응용 프로그램 및 생물 의학 연구의 다른 분야의 넓은 범위를 제공합니다.
공개
The authors have nothing to disclose.
감사의 말
The authors thank Bernd Krostitz for technical assistance, Radoslaw Kedzierski for initial contributions to the project, Erik Wade for proofreading and giving helpful comments, and Prof. Heike Walles for providing the bioreactor and sharing her valuable experience with organ decellularization. We are also thankful for funding of the project and publication by the Berlin University of Technology.
자료
| Name | Company | Catalog Number | Comments |
| Incubator | Fraunhofer | / | |
| Peristaltic Pump | Fraunhofer | / | |
| Flange with groove | Duran | 2439454 | modified by gaffer |
| O-Ring Transparent | Duran | 2922551 | |
| Quick Release Clamp | Duran | 2907151 | |
| Flat Flange Lid | Duran | 2429857 | modified by gaffer |
| Screw thread Tube | Duran | 2483802 | modified by gaffer |
| Screw thread Tube | Duran | 2483602 | modified by gaffer |
| Silicone sealing Ring | Duran | 2862012 | |
| Screw Cap | Duran | 2924013 | |
| Screw Cap | Duran | 2924008 | |
| Screw Cap with aperture | Duran | 2922709 | |
| Screw Cap with aperture | Duran | 2922705 | |
| Filter | Sarstedt | 831,826,001 | |
| Silicone Tubing | VWR | 228-1500 | |
| Tube connector | Ismatec | ISM556A | |
| Biocompatible Tubing | Ismatec | SC0736 | |
| T175 culture flasks | Greiner bio-one | 660 160 | |
| RPMI 1640 | BioWest SAS (Th. Geyer) | L0501-500 | |
| glutamine | BioWest SAS (Th. Geyer) | X0551-100 | |
| Trypsin | BioWest SAS (Th. Geyer) | L0940-100 | |
| penicillin/ streptomycin | BioWest SAS (Th. Geyer) | L0022-100 | |
| fetal calf serum | cc pro | S-10-M | |
| Tissue-Tek O.C.T. | Weckert-Labortechnik | 600001 | |
| HepG2 | DSMZ | ACC 180 | |
| Cryomold 15x15x5mm | Sakura | 4566 | |
| Biopsy punch 4mm | pfm medical | 48401 | |
| Nucleospin miRNA | Macherey & Nagel | 740971.10 | |
| Nucleospin RNA/DNA Buffer Set | Macherey & Nagel | 740944 |
참고문헌
- Chang, T. T., Hughes-Fulford, M. Monolayer and spheroid culture of human liver hepatocellular carcinoma cell line cells demonstrate distinct global gene expression patterns and functional phenotypes. Tissue Eng. Part A. 15 (3), 559-567 (2009).
- Butler, D., Callaway, E. Scientists in the dark after French clinical trial proves fatal. Nature. 529 (7586), 263-264 (2016).
- Enger, P. O., Thorsen, F., Lonning, P. E., Bjerkvig, R., Hoover, F. Adeno-associated viral vectors penetrate human solid tumor tissue in vivo more effectively than adenoviral vectors. Hum. Gene Ther. 13 (9), 1115-1125 (2002).
- Uygun, B. E., et al. Decellularization and recellularization of whole livers. J. Vis. Exp. (48), e2394 (2011).
- Hillebrandt, K., et al. Procedure for Decellularization of Rat Livers in an Oscillating-pressure Perfusion Device. J. Vis. Exp. (102), e53029 (2015).
- Baptista, P. M., et al. The use of whole organ decellularization for the generation of a vascularized liver organoid. Hepatology. 53 (2), 604-617 (2011).
- Yagi, H., et al. Human-scale whole-organ bioengineering for liver transplantation: a regenerative medicine approach. Cell Transplant. 22 (2), 231-242 (2013).
- Wagner, A., et al. Use of a three-dimensional humanized liver model for the study of viral gene vectors. J. Biotechnol. 212, 134-143 (2015).
- Kay, M. A. State-of-the-art gene-based therapies: the road ahead. Nat. Rev. Genet. 12 (5), 316-328 (2011).
- Yla-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Mol. Ther. 20 (10), 1831-1832 (2012).
- Wagner, A., Röhrs, V., Kedzierski, R., Fechner, H., Kurreck, J. A novel method for the quantification of adeno-associated virus vectors for RNA interference applications using quantitative polymerase chain reaction and purified genomic adeno-associated virus DNA as a standard. Hum. Gene Ther. Methods. 24 (6), 355-363 (2013).
- Takagi, H., et al. Microdissected region-specific gene expression analysis with methacarn-fixed, paraffin-embedded tissues by real-time RT-PCR. J. Histochem. Cytochem. 52 (7), 903-913 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유