Method Article
לחקר ויראלי וקטורים בתוך אוכלס מחדש תלת מימדי הכבד דגם עם הקו Cell Carcinoma Hepatocellular האדם HepG2
In This Article
Summary
The recellularized extracellular matrix of a decellularized rat liver can be used as a humanized, three-dimensional ex vivo model to study the distribution and transgene expression of a virus or viral vector.
Abstract
פרוטוקול זה מתאר את הדור של (3D) תלת מימדי מודל כבד vivo לשעבר ויישומו במחקר ופיתוח של מערכות וקטור ויראלי. המודל מתקבל על ידי repopulating המטריצה התאית של כבד עכברוש decellularized עם קו תא hepatocyte אנושי. המודל מאפשר לימודי מערכת תאי 3D vascularized, החלפת ניסויים מזיקים עם בעלי חיים. יתרון נוסף הוא הטבע האנושי של המודל, שדומה יותר פיזיולוגיה אנושית מאשר במודלים של בעלי חיים.
במחקר זה, אנו מדגימים את התמרה של מודל הכבד הזה עם וקטור ויראלי נגזר וירוסים adeno הקשורים (וקטור AAV). מעגל זלוף המספק המודל הכבד 3D עם תקשורת מספק אמצעי קל ליישום הווקטור. המערכת מאפשרת ניטור של פרמטרים מטבוליים העיקריים של הכבד. עבור בסופו של דבר, דגימות רקמה שניתן לנקוט כדי לקבוע את מידת recellularization ידי טכניקות היסטולוגית. הפצה של וקטור וירוס וביטוי של transgene נמסר יכול להיות מנותח על ידי PCR כמותי (qPCR), סופג אימונוהיסטוכימיה המערבי. יישומים רבים של מודל הווקטור במחקר בסיסי בפיתוח יישומים רפואיים גן יכולים להיות שחזה, כוללים פיתוח תרופות אנטי רומן, חקר הסרטן, ואת המחקר של וקטורים ויראליים ותופעות הלוואי האפשריות שלהן.
Introduction
Most current biomedical research relies on one of two approaches, either two-dimensional (2D) cell culture experiments or animal models, which are three-dimensional (3D) by their very nature. However, these approaches have some severe drawbacks. Cells grown in 2D culture have been shown to differ in gene expression patterns and cell physiology from those cultivated under 3D conditions.1 Animal models, in addition to being associated with ethical concerns, often do not model human physiology well. Although the lack of obvious toxic effects of a compound must be confirmed in animal models prior to the first dosing in humans, multiple cases have been documented in which severe, sometimes fatal, adverse effects have occurred in clinical trials.2
To overcome these shortcomings, humanized 3D ex vivo organ models have become important research tools. When cultivated under suitable conditions, cells self-assemble into 3D structures known as spheroids. However, these spheroids lack a vascular system, which limits the distribution of small molecular compounds, large biologics and viral vectors alike. For example, adenoviral vectors only transduced the outer cell layers of spheroids prepared from human glioblastomas.3 A solution to this problem is the use of an organ model containing a vascular system. To this end, the organ of interest can be explanted from an animal, and the animal cells can be replaced by human cells. Various methods for decellularization of animal livers by treatment with detergents or sodium cholate have been described.4-6 The resulting extracellular matrix (ECM) harbors cytokines and growth factors which regulate various cellular processes.7 It can be used as a scaffold for recellularization with human cells to obtain a functional organ model.
In a recent study, we used a humanized 3D liver model to study distribution and transgene expression of an adeno-associated virus (AAV) vector.8 AAV vectors belong to the most promising viral vectors for gene therapeutic applications.9 The first, and to date only, approved gene therapeutic intervention in the Western world uses an AAV vector for the transfer of lipoprotein lipase.10
Protocol
הערה: RL קיבלה אישור האתי של explantation של האיברים מן Landesamt für Gesundheit und Soziales (LaGeSo). כבדים היו explanted חולדות וויסטר. הווריד הנבוב הנח וריד השער של הכבד היו cannulated עם צינורית 22 G. שיטות עבור decellularization של כבדי explanted תוארו בעבר. 4,5 מטריצות תאיים משמשות כאן התקבלו על ידי זלוף המוגזם של כבד עכברוש עם deoxycholate נתרן 1%.
1. Recellularization של תאי מטריקס (ECM) של כבד עכברוש
- הרחבת HepG2 שורת תאים בכבד
- תרבות הקו הסלולרי קרצינומה hepatocellular HepG2 רוזוול פרק מכון זיכרון (RPMI) בינוני 1640 בתוספת 10% בסרום עוברי עגל, 2 מ"מ גלוטמין, ו 2 מ"מ של פניצילין סטרפטומיצין, כל אחד.
- זרעי 1.5 x 10 7 תאים בבקבוקי T175 ולגדל את התאים ב 37 מעלות צלזיוס, 5% CO 2 . קציר תאים לאחר 4 ימים על ידי trypsinization במשך 5 דקות ב 37 מעלות צלזיוס, 5% CO 2.
- ספין למטה התאים ב 300 XG resuspend אותם 4 מ"ל PBS ולספור את התאים עם תא נויבאואר תחת מיקרוסקופ. בקבוק T175 אחת יניב כ 4.5 x 10 7 תאים.
הערה: ודא התרבות מכיל מספרים סלולריים מספיקות recellularization של ECM עכברוש הכבד עם 6 x 10 8 תאים HepG2 לכל ECM (10 x 175 ס"מ 2 צלוחיות תרבות עם 4-5 x 10 8 תאים כל אחת).

מערכת bioreactor באיור 1.. א) זה מערכת bioreactor היה מחוייט. זה שומר על מודלי האיבר ב 37 מעלות צלזיוס, 5% CO 2. שיעורי הזרימה של משאבות פריסטלטיות ניתן לווסת באופן אינדיבידואלי. B) הכבד ממוקם בתא צמיחה ולהתחברed למעגל זלוף, אשר מורכב של משאבת peristaltic, מאגר בינוני, מלכודת בועת חיישן לחץ. לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- Recellularization של ECM
- הגדר את מערכת bioreactor, המכילה תא זלוף כבד, מערכת זלוף, מאגר של מדיום ואת מלכודת בועה. לעקר את מערכת bioreactor (121 ° C, 15 דקות).
- חבר את המערכת bioreactor עם משאבה peristaltic ולמקם אותו באינקובטור מתן תנאים מתאימים (37 מעלות צלזיוס, 5% CO 2). מניח פיגומים כבדים עכברוש decellularized 8 בתא הכבד זלוף של מערכת bioreactor (איור 1).
- חבר את וריד שער cannulated ואת הווריד הנבוב באמצעות קטעי צינור למערכת זלוף. לאזן פיגום עם 150 מ"ל בינוני RPMI (כמתואר 1.1)מעל 5 ד עם קצב הזרימה של 1.25 מ"ל / דקה.
- נתק את הפיגום הכבד מן המעגל התקשורת ולחסן את הפיגום עם 3 x 10 8 תאים HepG2 (5 מ"ל) דרך וריד הפורטל באמצעות מזרק 5 מ"ל, למנוע היווצרות בועת אוויר ולאפשר לתאים כדי לאכלס מחדש את ECM על ידי דוגרים אותם hr 1 ב הפיגום עם המשאבה כבוי.
- בהדרגה להגדיל את קצב הזרימה על ידי התאמת המשאבה, החל 1.25 מ"ל / דקה במשך 10 דקות; 2.5 מ"ל / דקה במשך 20 דקות ולבסוף 3.75 מ"ל / דקה במשך 30 דקות.
- חזור על שלבי 1.2.4-1.2.5 להגיע למספר תא כולל של 6 x 10 8.
- הפעל את מערכת bioreactor בקצב זרימה של 3.75 מ"ל / דקה. תרבות בכבד חולדה recellularized עבור 2 שבועות.
הערה: החלף שליש בינוני עם בינוני טרי (50 מ"ל) פעם ביומיים. בואו לטעום את מדיום התרבות למדוד פרמטרים פיסיולוגיים, כגון פעילות לקטט דהידרוגנאז, ה- pH של דגימות בינוניות ואת הריכוז של הגלוקוז ומיניקה.
2. התמרה של כבד עכברוש Recellularized
- ייצור בקנה מידה גדולה של וקטורי AAV
- Produce, לטהר, ולכמת וקטורים AAV כפי שתואר לעיל: 11
- בקצרה, לייצר וקטורים AAV בקבוקי רולר ולטהר אותם על ידי צנטריפוגה שיפוע iodixanol. הסר iodixanol שיורי על ידי סינון על עמודות סינון ג'ל PD10. קבע את הריכוז וקטור AAV ידי qPCR באמצעות DNA AAV גנומי כסטנדרט.
הערה: וקטור עצמית משלימים, Pseudotyped AAV2 / 6 השתמשו במחקר הנוכחי מקודד EmGFP ככתב להפגין יעילות התמרה ואת קלטת ביטוי shRNA עבור מציאה של גנים הביע באופן אנדוגני (B cyclophilin האדם (hCycB), איור 2) . ודא כמות מספקת של וקטורי scAAV Pseudotyped של סרוטיפ 6 (2.7 x 10 13 וקטורי AAV לפי מודל כבד).
- בקצרה, לייצר וקטורים AAV בקבוקי רולר ולטהר אותם על ידי צנטריפוגה שיפוע iodixanol. הסר iodixanol שיורי על ידי סינון על עמודות סינון ג'ל PD10. קבע את הריכוז וקטור AAV ידי qPCR באמצעות DNA AAV גנומי כסטנדרט.
- Produce, לטהר, ולכמת וקטורים AAV כפי שתואר לעיל: 11

מפת איור 2. של הווקטור העצמי משלימים, Pseudotyped AAV2 / 6 השתמש במחקר הנוכחי. הגנום מורכב החוזר המסוף ההפוך (ITR) של AAV2 ומקודד EmGFP תחת השליטה של אמרגן CMV וכן shRNA תחת שליטה של אמרגן U6. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- תמרה של דגם כבד
- התאם את הפתרון וקטור AAV לריכוז סופי של 2.7 x 10 13 הגנום וקטור ב 5 מ"ל על ידי הוספת נפח בהתאמה של PBS.
- ניתק את הכבד מן מעגל התקשורת על ידי הסרת הצינורות מן הצינורית. חבר מזרק 5 מיליליטר ל הצינורית של וריד השער ולהזריק פתרון וקטור AAV המלא (5 מיליליטר).
הערה: Optionally, להוסיף פנול אדום (5 מיקרוגרם / מ"ל) כדי לעקוב אחר חלוקת הפתרון וקטור AAV בתוך הכבד. - דגירה עבור שעה 1 ללא שאיבה. בהדרגה להגדיל את שיעור הזרימה, החל 1.25 מ"ל / דקה במשך 10 דקות; 2.5 מ"ל / דקה במשך 20 דקות ו 3.75 מ"ל / דקה במשך 30 דקות. תרבות בכבד חולדה recellularized מעל 6 ימים.
הערה: חלף שליש המדיום כפי שהם מתפרסמים הערה תחת 1.2.7
3. הערכה של הכבד Recellularized transduced עכברוש
- Hematoxylin ו eosin (HE) מכתים וניתוח immunohistochemical
- קח דגימות (0.5 x 0.5 x 1.5-2 סנטימטר) מכל אונה כבדה באמצעות אזמל.
- דגירה דגימות (מ 3.1.1) ב paraformaldehyde 4% (PFA) + תמיסת סוכרוז 4% עבור 1.5 שעות ב 4 ° C. (זהירות: PFA הוא רעילים ומסרטנים תמיד לשמור PFA בתוך במנדף וללבוש ביגוד מגן מתאים..) לשטוף שלוש פעמים עם PBS (1 דקות לכל שלב לשטוף) דגירה ב -8%לילה סוכרוז ב 4 ° C..
- יוצקים תיקון בינוני לתוך cryomolds פלסטיק, למקם את הדגימות לתוך תיקון בינוני ללא בועות אוויר. הוסף בינוני לתקן עד מדגם מכוסה היטב. חנות מוטבעת דגימות ב -80 ° C עד לשימוש נוסף.
- כן-סעיפי קריו (10 מיקרומטר) עם cryotome 12. להעריך recellularization ידי מכתים hematoxylin + eosin 8. להעריך את היעילות התמרה על ידי מכתים immunohistochemical עבור הגן של עניין (כאן: EmGFP).
- דגימה ביולוגית מולקולרית
- בואו לטעום כל אונה כבדה עם ביופסיה (4 מ"מ קוטר). לבודד הכולל RNA, DNA וחלבונים על פי הוראות היצרן להערכת ביטוי transgene של EmGFP, ו hCycB להפיל 8.
תוצאות
להערכת מידת recellularization, קריו-סעיפים הוכנו מכל אונה של כל דגם כבד recellularized. הסעיפים נותחו לאחר מכן על ידי hematoxylin ו eosin מכתים. כפי שניתן לראות באיור 3, כל תנוך השלושה הדגמים הכבדים, המסומן כמו TLM1, TLM2 (transduced מודלים כבדים 1 +2) ו- Ctrl (דגם כבד פקד היה recellularized, אבל לא transduced), אוכלס מחדש עם תאי HepG2. שורת תאי קרצינומה hepatocellular זו הוקמה מרקמת הגידול של ילד ארגנטיני בן 15 שנה. באזורים מסוימים של המודלים הכבדים היו recellularized יותר אינטנסיבי יותר מאחרים. סיבות הווריאציות הללו להישאר שייקבעו.

איור 3. Hematoxylin ו eosin כתם של כל אונה של השלוש נתחו מודלים כבדים TLM1 + 2:. כבד transducedמודלים 1 ו -2; מודל הכבד מלא .: Ctrl כי היה recellularized אבל לא transduced. סרגל קנה מידה: 200 מיקרומטר. (Re-מודפס באישור Ref. 8.) אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
בשלב הבא, התמרה של המודלים הכבדים הוערכה. לשם כך, DNA הוכן מ -28 ביופסיות אגרוף של כל אחד מן המודלים כבדים כייל הווקטור היה לכמת ידי qPCR. בממוצע, 55 ו -90 הגנום וקטור הפנימו לכל תא (VG / תא) נמדדו עבור שני המודלים הכבדים transduced. ניסויי תרבית תאי 2D הראו 30 VG / תא מספיק ביטוי transgene חזק והשתקה בתיווך RNAi. הפקה של EmGFP נותחה על ידי RT-PCR ו מערבי סופג. למעשה, הביטוי של עיתונאי זוהה 80-90% של ביופסיות על רמות ה- mRNA וחלבונים, בהתאמה.8 על מנת לקבל תמונה מקיפה של יעילות התמרה, קריו-סעיפים נותחו immunohistologically. כפי שניתן לראות באיור 4, באזורים של המודל הכבד שהיו recellularized בהצלחה, כמו מדמיינים ידי מכתים DAPI, גם נתנו אותות ניאון חזקים בניתוח immunohistochemical ביטוי EmGFP. כצפוי, המודל הכבד השליטה, שלא טופל ב- וקטורי AAV, לא הראה שום ביטוי EmGFP.
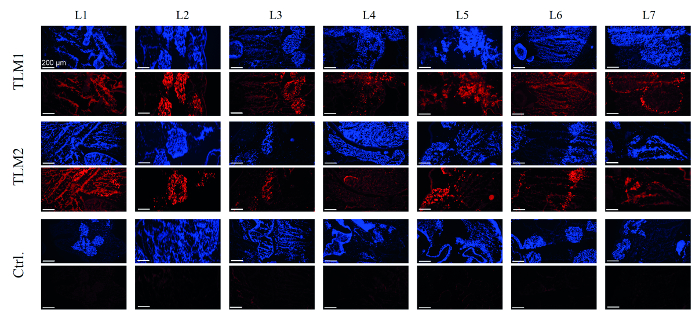
איור 4. ניתוח immunohistochemical ביטוי EmGFP תאים אוכלסו מחדש המודלים הכבדים היו דמיינו ידי מכתים DAPI (כחול).; ביטוי EmGFP היה דמיין ידי מכתים חיסון ייחודי (אדום). TLM1 + 2: מודלים כבדים transduced 1 ו -2; מודל הכבד מלא .: Ctrl כי היה recellularized אבל לא transduced. סרגל קנה מידה: 200 מיקרומטר. (Re-מודפס באישורמ Ref. 8.) אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
במבחן סופי, מציאה בתיווך AAV של hCycB נותחה על ידי qRT-PCR. המציאה של hCycB נמצאה בין 70 ל 90%, בממוצע לכל כל האונות של שני מודלים הכבדים transduced (איור 5).

איור 5. מציאה בתיווך RNAi של hCycB במודלים הכבד 3D-transduced AAV. השתקת hCycB נקבע על ידי qRT-PCR. ערכים ממוצעים וסטיות תקן (SD) חושבו עבור כל הדגימות של כל דגם כבד 3D transduced (TLM1 ו -2, בהתאמה) ו מנורמל הערך הממוצע של השליטה הלא transduced (Ctrl.). (Re-מודפס באישור REF. 8.) אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
כבדי 3D מחדש המתוארים כאן לספק מודל ללמוד וקטורים ויראליים במערכת אנושית. ואכלוס של ECM של כבד עכברוש עם קו תא קרצינומה אדם hepatocellular מייצר מערכת כלי דם המאפשרת חקר תרופות ביולוגיים גדולות. תוצאות אלה מספקות הוכחה של קונספט שהמודל הכבד מחדש ניתן transduced ביעילות עם וקטור ויראלי.
עבור הניסויים המוצגים כאן, כל אונה של הכבד הייתה transduced ידי וקטור AAV. עם זאת, בכמה ניסויים ראשוניים, אונות יחידה לא אוכלסה מחדש עם תאים. לכן חשוב למנוע פסולת התא או רכיבים אחרים מהעמוד שאטם את מערכת כלי הדם. כדי לבדוק אם כל האונות ניתן perfused, צבע רעיל כגון פנול אדום יכול להיות סמוק דרך המודל הכבד.
עוד עניין מכריע הוא שמירה על הפיגום הכבד סטרילי. למרות שטיפול עם אתנול או אנטיביוטיקה הוא disadvantageous עבור מערכת כלי הדם, הקרנה של תאי מטריקס עם קרינת γ שמר על כלי ולחטא המדגם.
יתר על כן, בגודל של כבדי explanted יהיה שונה, כך שמספר התאים המשמשים עבור הליך recellularization והזמן והאכלוס עשוי להיות מותאם כדי להשיג תוצאות לשחזור.
כבדי העכברוש השתמשו במחקר הנוכחי הם גדולים יחסית ודורשים כמויות גדולות של תאי ריאגנטים בדיקה (למשל, וקטורי AAV). בנוסף, ההליך ואכלוס לקח יותר משבועיים. זה מגביל את מספר משכפל אשר ניתן לעשות במאמץ סביר. בשלב זה אנו מקימים את המודל עבור כבדי העכבר, שהן רק כחמישית מהיקף כבדי חולדה, המאפשר שימוש של פחות תאים ריאגנטים מבחן פחות. למרות למטה בקנה מידה היחסי של המספר הסלולרי נראה סביר, את הסכומים המדויקים צריכים להיקבע furtהניסויים שלה.
עוד חיסרון של המודל הנוכחי הוא השימוש של הקו הסלולרי HepG2 hepatocellular. ניסויים נמשכים לפתח את השימוש של hepatocytes הבדיל מתאי גזע מושרים, אשר תספק מודל רלוונטי מבחינה פיזיולוגית יותר. יתר על כן, הכבד מורכב של סוגי תאים מרובים בנוסף hepatocytes, למשל, תאי Kupffer ואת sinosoids. אנו מניחים כי תאים מסוגים שונים יהיה לאכלס מחדש בסביבתם הטבעית כאשר ECM הוא recellularized עם סוגי תאים מרובים.
המודל הכבד 3D משלב מספר יתרונות. החיסרון העיקרי של קונבנציונאלי במודלים vivo הוא כי פיזיולוגיה של בעלי חיים שונה באופן מהותי מן הפיזיולוגיה האנושית. תופעות לוואי רעילות של טיפול של חולה אנוש ולכן עשוי להישאר מבלי שיבחינו בו. חיסרון זה ניתן להתגבר על ידי reconstituting המודל הכבד 3D עם תאים אנושיים כי יותר מקרוב משקף את הביולוגיה של huחולי גבר.
היתרון השני של המודל הכבד הוא תרומתה רווחת בעלי החיים. למרות רכיבים מן החי נדרשים עבור ניסויי הכינון מחדש, הגישה עדיין עוקבת אחר המטרות של עיקרון 3R (החלפה, הפחתה, עידון), כחיות עודפות יכולות לשמש כי הוקרבו לניסויים בבעלי חיים אחרים, כלומר, לא חיות נוספות נדרשות ו הגישה לחלוטין תמנע סבל של בעלי חיים אשר מזוהים לעתים קרובות עם ניסויי in vivo. Spheroids הם כלים חלופיים ללמוד תהליכים תאיים במערכת 3D. עם זאת, spheroids אינו vascularized כך חומרים גדולים בתחום תרופות ביולוגיות אינם חודרות עמוק לתוך החלקים הפנימיים של המבנה. בעיות אלה הוכרעו עם המודל הכבד 3D vascularized.
בניסויים שתוארו כאן, וקטורי AAV נחקרו, שכן הם בין המועמדים המבטיחים ביותר עבור טיפולי גןיישומים. כפי גישות טיפוליות רב גן לכוון מיקוד הכבד, למשל, לטיפול בדלקות עם וירוסים הפטיטיס או של אלפא-1-antitrypsin חסר, כבד 3D ניתן להשתמש בתהליך של פיתוח הווקטור אלה AAV. זהו, כמובן, גם מתאים ללימוד וקטורים ויראליים hepatotropic אחרים, למשל, וקטורים adenoviral. בנוסף, ניתן להשתמש בו כדי ללמוד וירוסי צהבת זיהומית כגון הפטיטיס B או C וירוס. זה יכול, למשל, להיות מועסק על מנת לעצב אסטרטגיות נגיפים חדשים. יתר על כן, מודלי איבר 3D מייצגים כלים מבטיחים לפתח תרופת cytostatic חדשה לטיפול בסרטן לבצע מחקרים טוקסיקולוגית. ביום בטווח הארוך, כבדים מלאכותיים עשויים לשמש ברפואה רגנרטיבית כמו השתלות. יחדיו, המודל הכבד 3D מציעה מגוון רחב של יישומים בביולוגיה זיהום ותחומים אחרים של מחקר ביו-רפואי.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Bernd Krostitz for technical assistance, Radoslaw Kedzierski for initial contributions to the project, Erik Wade for proofreading and giving helpful comments, and Prof. Heike Walles for providing the bioreactor and sharing her valuable experience with organ decellularization. We are also thankful for funding of the project and publication by the Berlin University of Technology.
Materials
| Name | Company | Catalog Number | Comments |
| Incubator | Fraunhofer | / | |
| Peristaltic Pump | Fraunhofer | / | |
| Flange with groove | Duran | 2439454 | modified by gaffer |
| O-Ring Transparent | Duran | 2922551 | |
| Quick Release Clamp | Duran | 2907151 | |
| Flat Flange Lid | Duran | 2429857 | modified by gaffer |
| Screw thread Tube | Duran | 2483802 | modified by gaffer |
| Screw thread Tube | Duran | 2483602 | modified by gaffer |
| Silicone sealing Ring | Duran | 2862012 | |
| Screw Cap | Duran | 2924013 | |
| Screw Cap | Duran | 2924008 | |
| Screw Cap with aperture | Duran | 2922709 | |
| Screw Cap with aperture | Duran | 2922705 | |
| Filter | Sarstedt | 831,826,001 | |
| Silicone Tubing | VWR | 228-1500 | |
| Tube connector | Ismatec | ISM556A | |
| Biocompatible Tubing | Ismatec | SC0736 | |
| T175 culture flasks | Greiner bio-one | 660 160 | |
| RPMI 1640 | BioWest SAS (Th. Geyer) | L0501-500 | |
| glutamine | BioWest SAS (Th. Geyer) | X0551-100 | |
| Trypsin | BioWest SAS (Th. Geyer) | L0940-100 | |
| penicillin/streptomycin | BioWest SAS (Th. Geyer) | L0022-100 | |
| fetal calf serum | cc pro | S-10-M | |
| Tissue-Tek O.C.T. | Weckert-Labortechnik | 600001 | |
| HepG2 | DSMZ | ACC 180 | |
| Cryomold 15 x 15 x 5 mm | Sakura | 4566 | |
| Biopsy punch 4 mm | pfm medical | 48401 | |
| Nucleospin miRNA | Macherey & Nagel | 740971.10 | |
| Nucleospin RNA/DNA Buffer Set | Macherey & Nagel | 740944 |
References
- Chang, T. T., Hughes-Fulford, M. Monolayer and spheroid culture of human liver hepatocellular carcinoma cell line cells demonstrate distinct global gene expression patterns and functional phenotypes. Tissue Eng. Part A. 15 (3), 559-567 (2009).
- Butler, D., Callaway, E. Scientists in the dark after French clinical trial proves fatal. Nature. 529 (7586), 263-264 (2016).
- Enger, P. O., Thorsen, F., Lonning, P. E., Bjerkvig, R., Hoover, F. Adeno-associated viral vectors penetrate human solid tumor tissue in vivo more effectively than adenoviral vectors. Hum. Gene Ther. 13 (9), 1115-1125 (2002).
- Uygun, B. E., et al. Decellularization and recellularization of whole livers. J. Vis. Exp. (48), e2394(2011).
- Hillebrandt, K., et al. Procedure for Decellularization of Rat Livers in an Oscillating-pressure Perfusion Device. J. Vis. Exp. (102), e53029(2015).
- Baptista, P. M., et al. The use of whole organ decellularization for the generation of a vascularized liver organoid. Hepatology. 53 (2), 604-617 (2011).
- Yagi, H., et al. Human-scale whole-organ bioengineering for liver transplantation: a regenerative medicine approach. Cell Transplant. 22 (2), 231-242 (2013).
- Wagner, A., et al. Use of a three-dimensional humanized liver model for the study of viral gene vectors. J. Biotechnol. 212, 134-143 (2015).
- Kay, M. A. State-of-the-art gene-based therapies: the road ahead. Nat. Rev. Genet. 12 (5), 316-328 (2011).
- Yla-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Mol. Ther. 20 (10), 1831-1832 (2012).
- Wagner, A., Röhrs, V., Kedzierski, R., Fechner, H., Kurreck, J. A novel method for the quantification of adeno-associated virus vectors for RNA interference applications using quantitative polymerase chain reaction and purified genomic adeno-associated virus DNA as a standard. Hum. Gene Ther. Methods. 24 (6), 355-363 (2013).
- Takagi, H., et al. Microdissected region-specific gene expression analysis with methacarn-fixed, paraffin-embedded tissues by real-time RT-PCR. J. Histochem. Cytochem. 52 (7), 903-913 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved