Method Article
研究病毒载体在三维肝模型重新填充与人肝癌细胞株HepG2
摘要
The recellularized extracellular matrix of a decellularized rat liver can be used as a humanized, three-dimensional ex vivo model to study the distribution and transgene expression of a virus or viral vector.
摘要
这个协议描述了一种三维(3D)的生成体外肝模型及应用病毒载体系统的研究和开发。该模型是通过与人肝细胞系再植去细胞的大鼠肝脏的细胞外基质获得。该模式允许在血管三维电池系统的研究,随着人们动物替代有潜在危害的实验。另一个优点是模型,这是更接近于人类生理比动物模型的人源化的性质。
在这项研究中,我们证明这种肝模型与腺伴随病毒(AAV载体)衍生的病毒载体的转导。与媒体供应3D模型肝脏灌注电路提供了一种简单的方法来应用向量。该系统允许肝脏的主要代谢参数的监控。对于最后的分析,组织样品可采取确定recellulariza的程度通过组织学技术化。交付的转基因的病毒载体和表达的分布可以通过定量PCR(qPCR的),免疫印迹和免疫组织化学进行分析。在基础研究和在基因治疗应用中的发展的矢量模型的许多应用可以设想,包括新颖的抗病毒治疗学的发展,癌症研究,和病毒载体的研究及其潜在的副作用。
引言
Most current biomedical research relies on one of two approaches, either two-dimensional (2D) cell culture experiments or animal models, which are three-dimensional (3D) by their very nature. However, these approaches have some severe drawbacks. Cells grown in 2D culture have been shown to differ in gene expression patterns and cell physiology from those cultivated under 3D conditions.1 Animal models, in addition to being associated with ethical concerns, often do not model human physiology well. Although the lack of obvious toxic effects of a compound must be confirmed in animal models prior to the first dosing in humans, multiple cases have been documented in which severe, sometimes fatal, adverse effects have occurred in clinical trials.2
To overcome these shortcomings, humanized 3D ex vivo organ models have become important research tools. When cultivated under suitable conditions, cells self-assemble into 3D structures known as spheroids. However, these spheroids lack a vascular system, which limits the distribution of small molecular compounds, large biologics and viral vectors alike. For example, adenoviral vectors only transduced the outer cell layers of spheroids prepared from human glioblastomas.3 A solution to this problem is the use of an organ model containing a vascular system. To this end, the organ of interest can be explanted from an animal, and the animal cells can be replaced by human cells. Various methods for decellularization of animal livers by treatment with detergents or sodium cholate have been described.4-6 The resulting extracellular matrix (ECM) harbors cytokines and growth factors which regulate various cellular processes.7 It can be used as a scaffold for recellularization with human cells to obtain a functional organ model.
In a recent study, we used a humanized 3D liver model to study distribution and transgene expression of an adeno-associated virus (AAV) vector.8 AAV vectors belong to the most promising viral vectors for gene therapeutic applications.9 The first, and to date only, approved gene therapeutic intervention in the Western world uses an AAV vector for the transfer of lipoprotein lipase.10
研究方案
注:RL获得来自Landesamt献给GESUNDHEIT UND Soziales(LaGeSo)器官的外植伦理审批。肝脏是从Wistar大鼠植。下腔静脉和肝门静脉与22克导管插管。对于植肝脏的脱细胞的方法先前已被描述。4,5-这里使用通过用1%脱氧胆酸钠大鼠肝脏过量灌注得到的细胞外基质。
1.大鼠肝脏细胞外基质(ECM)的Recellularization
- 肝细胞HepG2扩张
- 培养罗斯韦尔园区纪念研究所(RPMI)补充有10%胎牛血清,2mM谷氨酰胺,以及青霉素的2毫米和链霉素,每1640培养基中的肝癌细胞系HepG2。
- 种子1.5×10 7个细胞在T175瓶中,并在37℃和5%的CO 2生长细胞。收获细胞后第4天通过胰蛋白酶消化5分钟,在37℃,5% 的 CO 2。
- 降速细胞在300 xg离心并在4毫升PBS中重悬并用显微镜下一个纽鲍尔室计数细胞。其中T175瓶将产生约4.5×10 7细胞。
注:确保文化包含了足够的细胞数量为每ECM 6×10 8 HepG2细胞(10×175厘米2培养瓶中,每4-5×10 8个细胞)的大鼠肝脏ECM的recellularization。

图1.生物反应器系统。A)该生物反应器系统是定制。它保持了器官模型,在37℃和5%的CO 2。蠕动泵的流速可以单独调节。B)的肝脏被放置在一个生长室中,并连接ED的灌注回路,它由一个蠕动泵,一个中型水库,泡沫陷阱和压力传感器。 请点击此处查看该图的放大版本。
- ECM的Recellularization
- 设置在生物反应器系统,包含一个肝灌注腔,灌注系统,介质的一个贮存器和一个气泡阱。消毒生物反应器系统(121℃,15分钟)。
- 该生物反应器系统连接用蠕动泵,并将其放置在培养箱中提供适当的条件下(37℃,5%CO 2)。放置脱细胞的大鼠肝支架8中的生物反应器系统( 图1)的肝灌注腔。
- 用连接管夹到灌注系统的空心门静脉和下腔静脉 。平衡支架用150毫升RPMI培养基(如在1.1中描述)超过5天为1.25毫升/分钟的流速。
- 断开从媒体电路肝脏脚手架和使用5毫升注射器经门静脉接种用3×10 8个 HepG2细胞在支架(5毫升)中,避免气泡形成和使细胞通过温育它们重新填充ECM在与泵的支架1小时关闭。
- 逐渐通过调节泵,开始为1.25毫升/分钟进行10分钟,增加流速; 2.5毫升/分20分钟,并最后3.75毫升/分钟进行30分钟。
- 重复步骤1.2.4-1.2.5达到6×10 8细胞总数。
- 在3.75毫升/分钟的流速运行的生物反应器系统。培养recellularized大鼠肝2周。
注意:更换新鲜培养基(50毫升),隔日媒体的三分之一。采样培养基以测量生理参数,如乳酸脱氢酶活性,介质样品的pH值和葡萄糖和乳酸的浓度。
2. Recellularized大鼠肝脏转导
- AAV载体的规模化生产
- 产生,纯化和量化AAV载体如前所述:11
- 简单地说,生产AAV载体在滚瓶和碘克沙醇梯度离心净化他们。通过过滤过PD10凝胶过滤柱去除残留的碘克沙醇。确定通过qPCR使用基因组的AAV DNA作为标准的AAV载体的浓度。
注:在本研究中使用的自互补,假型AAV2 / 6载体编码EmGFP作为报道证明转导效率和用于内源表达的基因的敲除的shRNA表达盒( 人亲环B(hCycB), 图2) 。确保血清型6(每肝模型2.7×10 13 AAV载体)的假scAAV载体的足够量。
- 简单地说,生产AAV载体在滚瓶和碘克沙醇梯度离心净化他们。通过过滤过PD10凝胶过滤柱去除残留的碘克沙醇。确定通过qPCR使用基因组的AAV DNA作为标准的AAV载体的浓度。
- 产生,纯化和量化AAV载体如前所述:11

图2.地图自身互补,假型AAV2 / 6矢量在本研究中所用的该基因组由AAV2的反向末端重复(ITR)的,并在在CMV启动子控制编码EmGFP以及下控制一个shRNA的一个U6启动子的。 请点击此处查看该图的放大版本。
- 肝模型的转导
- 加入的PBS的各音量调整AAV载体溶液,以在5毫升2.7×10 13载体基因组的最终浓度。
- 通过从套管移除管道断开媒体电路肝脏。 5ml的注射器连接到门静脉插管和注射完整的AAV载体溶液(5毫升)中。
注:OptionallY,添加酚红(5微克/毫升),以按照在整个肝脏的AAV载体溶液的分布情况。 - 孵育1小时无抽水。逐渐增加的流速,开始为1.25毫升/分钟进行10分钟; 2.5毫升/分20分钟,30分钟3.75毫升/分。文化recellularized大鼠肝超过6天。
注:如1.2.7下的注给予更换介质的三分之一
3. Recellularized转导的大鼠肝脏评估
- 伊红(HE)染色和免疫组化分析
- 取使用手术刀从每个肝叶样品(0.5×0.5×1.5-2厘米)。
- 孵育样品(从3.1.1)在4%低聚甲醛(PFA)在4℃1.5小时+ 4%的蔗糖溶液。 ( 注意 :PFA是有毒和致癌通风橱内始终保持PFA和穿戴适当的防护服。)洗三次,用PBS(每次洗涤步骤1分钟)和8%孵育在4℃蔗糖过夜。
- 倾定影介质进入塑料cryomolds,将样品放置到定影介质无气泡。添加固定介质直至样品被很好地覆盖。存储在-80°C,直到进一步利用嵌入式样本。
- 用cryotome 12制备冷冻切片(10微米)。苏木+ HE染色8评估recellularization。由该基因的感兴趣(:EmGFP这里)免疫组织化学染色评估转导效率。
- 分子生物取样
- 样每个肝叶用活检穿孔(4毫米直径)。根据制造商的EmGFP的转基因表达的评估指示分离总RNA,DNA和蛋白质,以及hCycB击倒8。
结果
为recellularization的程度的评估,从每个recellularized肝模型的每个叶制备冷冻切片。切片然后通过苏木精和曙红染色分析。如在图3中可以看到,三个肝模型的每个叶表示为TLM1,TLM2(转导的肝模型1 + 2)(这是recellularized,但不能转导的对照肝模型)和Ctrl,被重新填充有HepG2细胞。这肝癌细胞株是从一个15岁的阿根廷男孩的肿瘤组织成立。肝脏车型部分地区更深入recellularized比其他人。这些变化的原因仍有待确定。

图3. 苏木和三个各叶HE染色分析肝模型 TLM1 + 2:肝转模型1和2;这是recellularized但不转Ctrl键:控制肝脏模型。比例尺:200μm左右。 (重新印有许可参考8) 点击此处查看该图的放大版本。
在下一步骤中,肝脏模型的转导了评估。为此,将DNA从每个肝脏模型28钻取活组织检查制备和载体滴度通过qPCR定量。平均来说,对于两个转导肝模型测定每个细胞(VG /细胞)55和90内在载体基因组。在2D细胞培养实验表明30 VG /电池足够强的转基因表达和RNAi介导的沉默。 EmGFP生产用RT-PCR和Western blot分析。事实上,在对mRNA和蛋白水平的活检的80-90%分别检测出的记者的表达。8要获得的转染效率的全面情况,冷冻切片免疫组织进行分析。如在图4中可以看到,已成功recellularized,通过DAPI染色作为可视肝脏模型的区域,也是在EmGFP表达的免疫组织化学分析,得到强的荧光信号。正如所料,在控制肝脏模型,而不是与AAV载体处理的,没有显示任何EmGFP表达。
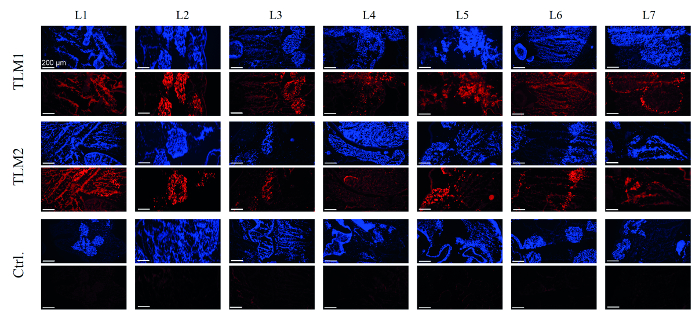
EmGFP表达 图4. 免疫组化分析,认为重新填充肝模型由DAPI染色(蓝色)可视化细胞。 EmGFP表达通过免疫化学染色(红色)可视化。 TLM1 + 2:转导的肝模型1和2;这是recellularized但不转Ctrl键:控制肝脏模型。比例尺:200μm左右。 (重新印有权限从参考。 8) 点击此处查看该图的放大版本。
在最后的试验中,hCycB的AAV介导的敲低被通过qRT-PCR进行分析。 hCycB的击倒被发现是70和90%之间,平均为在两个转导的肝模型所有波瓣( 图5)。

hCycB 图hCycB的AAV转导的3D肝脏模型5. RNAi介导的击倒。沉默通过qRT-PCR测定。计算平均值和标准偏差(SD)为每个转导的3D肝脏模型的所有样品(TLM1和2,分别地)和归一化到非转导控制的平均值(Ctrl键)。 (重新印有从研发许可EF。 8) 点击此处查看该图的放大版本。
讨论
这里所描述的3D重建肝脏提供了一个模型,研究了人性化的系统病毒载体。与人类肝癌细胞株大鼠肝脏ECM的复育生成血管系统,允许大生物制品的研究。这些结果提供了一个验证的概念,即重构的肝脏模型可以用病毒载体可以有效地转导。
对于此处所示的实验中,肝的每一个叶是由AAV载体转导的。然而,在一些初步实验中,单叶未用细胞重新填充。因此重要的是防止细胞碎片或其它部件从阻塞血管系统。测试所有叶是否可灌注,无毒的染料,如酚红可以通过肝脏模型被刷新。
另一个关键问题是保持肝脏支架无菌。虽然用乙醇或抗生素治疗disadvantageous为血管系统,具有γ射线的细胞外基质的照射保留了容器和灭菌的样品。
此外,外植肝脏的大小有所不同,以便用于recellularization程序和复育时间的细胞的数目可能需要进行调整,以获得可再现的结果。
在本研究中使用的大鼠肝脏是比较大的,并需要大量的细胞和测试试剂( 例如,AAV载体)的。此外,复育过程花了两个多星期。这限制了可使用合理的努力来完成重复的数目。我们目前正在建立小鼠肝脏,这是只有大约一大鼠肝脏体积的第五模式,允许使用较少的细胞和少测试试剂。虽然细胞数的比例的缩小似乎是合理的,确切的数额需要furt待确定她的实验。
该模型的另一个缺点是使用了肝癌HepG2细胞的。实验正在进行开发利用从诱导多能干细胞分化的肝细胞,这将提供一个更生理相关模型。此外,肝由多种细胞类型的除了肝细胞, 如枯否氏细胞和sinosoids。我们假设不同的细胞类型将重新填充它们的天然环境时的ECM与多种细胞类型recellularized。
三维肝模式结合几个优点。常规的体内模型的主要缺点是,动物生理学,从人体生理学很大不同。因此人类患者的治疗的毒副作用可能仍然未被发现。这个缺点可以通过重建与人体细胞的三维肝模型更密切地反映胡生物学被克服男人的患者。
肝脏模型的第二个优点是其对动物福利的贡献。虽然所需的重建实验动物成分,该方法仍然遵循的3R原则(替换,还原,细化)的目的,如剩余的动物可以用来处死,对于其他动物的实验中, 即不需要附加的动物和这种方法完全避免了这是经常与体内实验相关动物的痛苦。球粒的替代工具,研究在3D系统的细胞过程。然而,球状体不血管化,使得大的物质和生物不深入到结构的内部部分。这些问题已经克服了血管的三维肝模型。
在这里描述的实验中,AAV载体进行了研究,因为它们是最有希望的候选基因治疗中应用程序。众多的基因治疗方法的目标是靶向肝脏, 例如,对于具有肝炎病毒或α-1-抗胰蛋白酶缺乏的感染的治疗中,3D肝脏可在这些AAV载体发展的过程中被使用。它是,当然,也适用于其它嗜肝病毒载体, 例如腺病毒载体的研究。此外,它可以被用来研究传染性肝炎病毒如乙型或丙型肝炎病毒。它可以,例如,被用来设计新的抗病毒策略。此外,三维器官模型代表有前途的工具来开发新的细胞生长抑制疗法,治疗癌症,并开展毒理学研究。从长远来看,人工肝可在再生医学作为移植使用。综合来看,3D肝模型提供了一个广泛的感染生物学和应用生物医学研究等领域。
披露声明
The authors have nothing to disclose.
致谢
The authors thank Bernd Krostitz for technical assistance, Radoslaw Kedzierski for initial contributions to the project, Erik Wade for proofreading and giving helpful comments, and Prof. Heike Walles for providing the bioreactor and sharing her valuable experience with organ decellularization. We are also thankful for funding of the project and publication by the Berlin University of Technology.
材料
| Name | Company | Catalog Number | Comments |
| Incubator | Fraunhofer | / | |
| Peristaltic Pump | Fraunhofer | / | |
| Flange with groove | Duran | 2439454 | modified by gaffer |
| O-Ring Transparent | Duran | 2922551 | |
| Quick Release Clamp | Duran | 2907151 | |
| Flat Flange Lid | Duran | 2429857 | modified by gaffer |
| Screw thread Tube | Duran | 2483802 | modified by gaffer |
| Screw thread Tube | Duran | 2483602 | modified by gaffer |
| Silicone sealing Ring | Duran | 2862012 | |
| Screw Cap | Duran | 2924013 | |
| Screw Cap | Duran | 2924008 | |
| Screw Cap with aperture | Duran | 2922709 | |
| Screw Cap with aperture | Duran | 2922705 | |
| Filter | Sarstedt | 831,826,001 | |
| Silicone Tubing | VWR | 228-1500 | |
| Tube connector | Ismatec | ISM556A | |
| Biocompatible Tubing | Ismatec | SC0736 | |
| T175 culture flasks | Greiner bio-one | 660 160 | |
| RPMI 1640 | BioWest SAS (Th. Geyer) | L0501-500 | |
| glutamine | BioWest SAS (Th. Geyer) | X0551-100 | |
| Trypsin | BioWest SAS (Th. Geyer) | L0940-100 | |
| penicillin/streptomycin | BioWest SAS (Th. Geyer) | L0022-100 | |
| fetal calf serum | cc pro | S-10-M | |
| Tissue-Tek O.C.T. | Weckert-Labortechnik | 600001 | |
| HepG2 | DSMZ | ACC 180 | |
| Cryomold 15 x 15 x 5 mm | Sakura | 4566 | |
| Biopsy punch 4 mm | pfm medical | 48401 | |
| Nucleospin miRNA | Macherey & Nagel | 740971.10 | |
| Nucleospin RNA/DNA Buffer Set | Macherey & Nagel | 740944 |
参考文献
- Chang, T. T., Hughes-Fulford, M. Monolayer and spheroid culture of human liver hepatocellular carcinoma cell line cells demonstrate distinct global gene expression patterns and functional phenotypes. Tissue Eng. Part A. 15 (3), 559-567 (2009).
- Butler, D., Callaway, E. Scientists in the dark after French clinical trial proves fatal. Nature. 529 (7586), 263-264 (2016).
- Enger, P. O., Thorsen, F., Lonning, P. E., Bjerkvig, R., Hoover, F. Adeno-associated viral vectors penetrate human solid tumor tissue in vivo more effectively than adenoviral vectors. Hum. Gene Ther. 13 (9), 1115-1125 (2002).
- Uygun, B. E., et al. Decellularization and recellularization of whole livers. J. Vis. Exp. (48), e2394(2011).
- Hillebrandt, K., et al. Procedure for Decellularization of Rat Livers in an Oscillating-pressure Perfusion Device. J. Vis. Exp. (102), e53029(2015).
- Baptista, P. M., et al. The use of whole organ decellularization for the generation of a vascularized liver organoid. Hepatology. 53 (2), 604-617 (2011).
- Yagi, H., et al. Human-scale whole-organ bioengineering for liver transplantation: a regenerative medicine approach. Cell Transplant. 22 (2), 231-242 (2013).
- Wagner, A., et al. Use of a three-dimensional humanized liver model for the study of viral gene vectors. J. Biotechnol. 212, 134-143 (2015).
- Kay, M. A. State-of-the-art gene-based therapies: the road ahead. Nat. Rev. Genet. 12 (5), 316-328 (2011).
- Yla-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Mol. Ther. 20 (10), 1831-1832 (2012).
- Wagner, A., Röhrs, V., Kedzierski, R., Fechner, H., Kurreck, J. A novel method for the quantification of adeno-associated virus vectors for RNA interference applications using quantitative polymerase chain reaction and purified genomic adeno-associated virus DNA as a standard. Hum. Gene Ther. Methods. 24 (6), 355-363 (2013).
- Takagi, H., et al. Microdissected region-specific gene expression analysis with methacarn-fixed, paraffin-embedded tissues by real-time RT-PCR. J. Histochem. Cytochem. 52 (7), 903-913 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。