Method Article
ヒト肝細胞癌細胞株HepG2細胞と三次元肝モデルに再増殖におけるウイルスベクターの研究
要約
The recellularized extracellular matrix of a decellularized rat liver can be used as a humanized, three-dimensional ex vivo model to study the distribution and transgene expression of a virus or viral vector.
要約
このプロトコルは、3次元(3D)の生成ex vivoで肝臓モデルおよびウイルスベクター系の研究・開発への応用について説明します。モデルは、ヒト肝細胞系と脱細胞化ラット肝臓の細胞外マトリックスを再構築することによって得られます。モデルは、生きている動物と潜在的に有害な実験を交換し、血管新生した3Dセルシステムの研究を可能にします。別の利点は、動物モデルよりも、ヒトの生理に近いモデルのヒト化性質です。
本研究では、アデノ随伴ウイルス(AAVベクター)に由来するウイルスベクターを使用してこの肝臓モデルの伝達を実証します。メディアと3D肝モデルを供給する灌流回路は、ベクトルを適用するための簡単な手段を提供します。システムは、肝臓の主要な代謝パラメータのモニタリングを可能にします。最終的な分析のために、組織試料はrecellularizaの程度を決定するために撮影することができ組織学的技術によってます。送達導入遺伝子のウイルスベクターおよび発現の分布は、定量的PCR(定量PCR)、ウェスタンブロット法および免疫組織化学によって分析することができます。基礎研究における遺伝子治療用途の開発のベクトルモデルの多数のアプリケーションでは、新規の抗ウイルス治療薬の開発、癌研究、およびウイルスベクターの研究とその潜在的な副作用を含め、想定することができます。
概要
Most current biomedical research relies on one of two approaches, either two-dimensional (2D) cell culture experiments or animal models, which are three-dimensional (3D) by their very nature. However, these approaches have some severe drawbacks. Cells grown in 2D culture have been shown to differ in gene expression patterns and cell physiology from those cultivated under 3D conditions.1 Animal models, in addition to being associated with ethical concerns, often do not model human physiology well. Although the lack of obvious toxic effects of a compound must be confirmed in animal models prior to the first dosing in humans, multiple cases have been documented in which severe, sometimes fatal, adverse effects have occurred in clinical trials.2
To overcome these shortcomings, humanized 3D ex vivo organ models have become important research tools. When cultivated under suitable conditions, cells self-assemble into 3D structures known as spheroids. However, these spheroids lack a vascular system, which limits the distribution of small molecular compounds, large biologics and viral vectors alike. For example, adenoviral vectors only transduced the outer cell layers of spheroids prepared from human glioblastomas.3 A solution to this problem is the use of an organ model containing a vascular system. To this end, the organ of interest can be explanted from an animal, and the animal cells can be replaced by human cells. Various methods for decellularization of animal livers by treatment with detergents or sodium cholate have been described.4-6 The resulting extracellular matrix (ECM) harbors cytokines and growth factors which regulate various cellular processes.7 It can be used as a scaffold for recellularization with human cells to obtain a functional organ model.
In a recent study, we used a humanized 3D liver model to study distribution and transgene expression of an adeno-associated virus (AAV) vector.8 AAV vectors belong to the most promising viral vectors for gene therapeutic applications.9 The first, and to date only, approved gene therapeutic intervention in the Western world uses an AAV vector for the transfer of lipoprotein lipase.10
プロトコル
注:RLはLandesamtのfürお大事にウントSoziales(LaGeSo)からの器官の外植のための倫理的な承認を得ました。肝臓をウィスター系ラットから外植されました。下大静脈および肝臓の門脈は22 Gカニューレでカニューレを挿入しました。外植された肝臓の脱細胞化するための方法は、以前に記載されている。ここで使用される4,5、細胞外マトリックスは、1%デオキシコール酸ナトリウムでラット肝臓の過度の灌流により得ました。
ラット肝臓の細胞外マトリックス(ECM)の1.再細胞化
- 肝細胞株HepG2の拡大
- 培養ロズウェルパーク記念研究所(RPMI)10%ウシ胎児血清、2mMグルタミン、及びペニシリンの2mMのストレプトマイシン、それぞれを補充1640培地中で肝細胞癌細胞株HepG2。
- T175ボトル中1.5×10 7個の細胞を播種し、37℃、5%CO 2で細胞を成長させます。 37℃、5%CO 2で5分間トリプシン処理により4日後に収穫細胞。
- 300×gで細胞をスピンダウンし、4 mlのPBSで再懸濁し、顕微鏡下でノイバウアー室で細胞を数えます。 One T175ボトルは、約4.5×10 7個の細胞が得られます。
注:文化はECMあたり6×10 8 HepG2細胞(4-5×10 8個の細胞それぞれに10×175cm 2の培養フラスコ)を持つラット肝臓ECMの再細胞化のために十分な細胞数が含まれていることを確認してください。

図1.バイオリアクターシステム。A)このバイオリアクターシステムは、カスタムメイドでした。これは、37℃、5%CO 2で、臓器モデルを維持します。蠕動ポンプの流量を個別に調整することができる。B)肝臓成長チャンバとの接続に配置されています蠕動ポンプ、媒体貯蔵、気泡トラップと圧力センサで構成されて灌流回路にエド。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- ECMの再細胞化
- 肝灌流チャンバー、灌流システム、媒体のリザーバと気泡トラップを含む、バイオリアクターシステムを設定します。バイオリアクターシステム(121℃、15分)を滅菌します。
- 蠕動ポンプでバイオリアクターシステムを接続し、適切な条件(37℃、5%CO 2)を提供するインキュベーターに置き。バイオリアクターシステム( 図1)の肝灌流チャンバー内の脱細胞化ラットの肝臓の足場8を配置します。
- 灌流システムにチューブクリップを使用してカニューレを挿入し、門脈と大静脈を接続します 。 (1.1に記載のように)150 mlのRPMI培地で足場の平衡/分1.25ミリリットルの流量で5日間にわたって。
- メディア回路からの肝臓の足場を外し、5ミリリットルの注射器を使用して、門脈を経由して(5ミリリットル中)3×10 8 HepG2細胞と足場に接種、気泡の形成を回避し、細胞がためにそれらをインキュベートすることによって、ECMを再投入することを可能にしますポンプと足場で1時間はオフ。
- 徐々に10分間1.25 ml /分で開始し、ポンプを調整することで流量を増加させます。 20分間、2.5ml /分、最後に3.75ミリリットル/ 30分間分。
- 繰り返しは、6×10 8の全細胞数に到達するために1.2.4-1.2.5を繰り返します。
- /分3.75ミリリットルの流量でバイオリアクターシステムを実行します。文化2週間の再細胞化ラット肝。
注:一日おきに新鮮な培地(50ml)で媒体の三分の一を交換してください。このような乳酸デヒドロゲナーゼ活性、培地試料のpHおよびグルコースおよび乳酸の濃度などの生理学的パラメータを測定するための培地をサンプリングします。
再細胞化ラット肝の2伝達
- AAVベクターの大規模生産
- 前述のように、生成、精製、及びAAVベクターを定量:11
- 簡潔には、ローラーボトルにAAVベクターを生成し、イオジキサノール勾配遠心分離により、それらを精製します。 PD10ゲル濾過カラム上で濾過することにより、残留イオジキサノールを削除します。標準として、ゲノムのAAV DNAを用いて、qPCRによりAAVベクターの濃度を決定します。
注:本研究で使用される自己相補的、偽AAV2 / 6ベクターは、形質導入効率および内因的に発現する遺伝子のノックダウンのためのshRNA発現カセット( ヒトシクロフィリンB(hCycB)、 図2)を実証するためのレポーターとしてEmGFPをコードしていました。血清型6(肝臓モデルあたり2.7×10 13 AAVベクター)の偽scAAVベクトルの十分な量を確保。
- 簡潔には、ローラーボトルにAAVベクターを生成し、イオジキサノール勾配遠心分離により、それらを精製します。 PD10ゲル濾過カラム上で濾過することにより、残留イオジキサノールを削除します。標準として、ゲノムのAAV DNAを用いて、qPCRによりAAVベクターの濃度を決定します。
- 前述のように、生成、精製、及びAAVベクターを定量:11

本研究で使用される自己相補的、偽AAV2 / 6ベクターの図2.地図。ゲノムはAAV2の逆方向末端反復(ITR)で構成され、同様に、CMVプロモーターの制御下EmGFPを符号化するshRNA制御下U6プロモーターの。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 肝臓モデルの導入
- PBSのそれぞれの容量を追加することで、5ミリリットル中に2.7×10 13ベクターゲノムの最終濃度までAAVベクター溶液を調整します。
- カニューレからチューブを除去することにより、メディア回路から肝臓を外します。門脈のカニューレに5ミリリットルの注射器を接続し、完全なAAVベクター溶液(5 ml)を注入します。
注:Optionallyは、肝臓全体のAAVベクター溶液の分布に従うようにフェノールレッド(5μg/ ml)を加えます。 - ポンプなしで1時間インキュベートします。徐々に10分間1.25 ml /分で開始し、流量を増加させます。 2.5ミリリットル/ 20分および30分間3.75はml /分分間。文化6日間の再細胞化ラット肝。
注:1.2.7下の注で与えられる媒体の三分の一を交換してください
再細胞化形質導入ラット肝臓の3評価
- ヘマトキシリンおよびエオシン(HE)染色および免疫組織化学的解析
- メスを用いて、各肝葉からのサンプル(0.5×0.5×1.5〜2センチメートル)を取ります。
- 4%パラホルムアルデヒド(PFA)に4℃で1.5時間、+ 4%スクロース溶液(3.1.1)からのサンプルをインキュベートします。 ( 注意 :PFAは、必ず換気フード内でPFAを維持し、適切な防護服を着用し、有毒で発癌性である)洗浄PBSで3回(洗浄ステップあたり1分)および8%でインキュベート4℃でのスクロース一晩。
- プラスチックcryomoldsに培地を固定注ぎ、気泡を含まない培地中固定にサンプルを置きます。サンプルが十分に覆われるまで固定培地を追加します。ストアは、さらに使用するまで-80℃でサンプルを組み込み。
- cryotome 12で凍結切片(10μm)を準備します。ヘマトキシリン+エオシン染色8によって再細胞化を評価します。 (:EmGFPここでは)目的遺伝子のための免疫組織化学染色により形質導入効率を評価します。
- 分子生物学的サンプリング
- 生検パンチ(直径4mm)で各肝葉をサンプリング。 EmGFPの導入遺伝子発現の評価のための製造元の指示に従って全RNA、DNAやタンパク質を単離、および8をノックダウンhCycB。
結果
再細胞化の程度の評価のために、凍結切片を各再細胞化肝臓モデルの各葉から調製しました。切片を次にヘマトキシリンおよびエオシン染色によって分析しました。 図3に見られるように、TLM1、TLM2(形質導入された肝モデル1 +2)とCtrl(形質再細胞化された肝臓モデルの制御ではなく)として示される3つの肝臓モデルの各ローブは、HepG2細胞で再増殖しました。この肝細胞癌細胞株は、15歳のアルゼンチン人の少年の腫瘍組織から確立されました。肝臓モデルの一部の地域では、より集中的に他のものよりも再細胞化されました。これらの変化の原因を決定することが残っています。

図 3分析肝臓モデルの各ローブの 3 ヘマトキシリンおよびエオシン染色 TLM1 + 2:形質導入された肝臓モデル1および2;再細胞化が、形質導入されていなかったのCtrl:制御肝臓モデル。スケールバー:200μmです。 (参考文献からの許可を得て再印刷。8.) この図の拡大版をご覧になるにはこちらをクリックしてください。
次のステップでは、肝臓のモデルの導入を評価しました。この目的のために、DNAは、肝臓モデルのそれぞれの28のパンチ生検から調製し、ベクターの力価は、qPCRにより定量しました。平均して、セル当たり55および90に内在ベクターゲノム(VG /セル)は、2つの形質導入された肝臓モデルを測定しました。 2D細胞培養における実験は、30 VG /セルを示している強力なトランスジーン発現およびRNAi媒介性サイレンシングのために十分です。 EmGFPの製造は、RT-PCRおよびウェスタンブロッティングによって分析しました。実際には、レポーターの発現は、それぞれ、mRNAおよびタンパク質レベルに対する生検の80〜90%で検出されました。8形質導入効率の全体像を得るために、凍結切片を免疫組織学的に分析しました。 図4に見られるように、DAPI染色により可視化に成功し、再細胞化された肝臓モデルの領域は、また、EmGFP発現の免疫組織化学的分析に強い蛍光シグナルが得られました。予想されるように、AAVベクターで処理されていない対照肝臓モデルは、任意のEmGFP発現を示しませんでした。
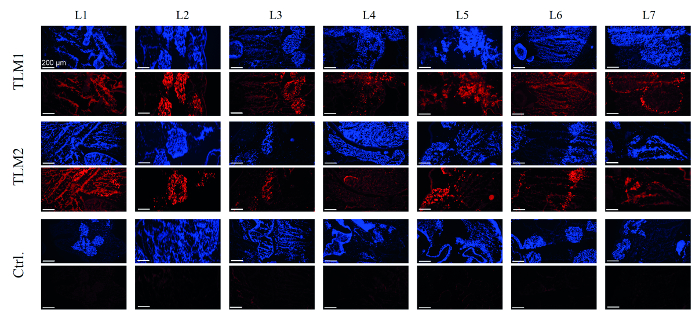
EmGFP式図 4. 免疫組織化学的分析の肝臓モデルを再増殖細胞をDAPI染色(青色)によって可視化しました。 EmGFP発現は免疫化学染色(赤色)で可視化しました。 TLM1 + 2:形質肝臓モデル1及び2を、再細胞化が、形質導入されていなかったのCtrl:制御肝臓モデル。スケールバー:200μmです。 (許可を得て再印刷文献から。 8.) この図の拡大版をご覧になるにはこちらをクリックしてください。
最後の試験では、hCycBのAAV媒介性ノックダウンは、定量RT-PCRによって分析しました。 hCycBのノックダウンは、70〜90%であることがわかっ2形質導入された肝臓モデル( 図5)のすべてのローブを渡って平均しました。

AAV-形質導入した3D肝臓モデルでhCycBの図5. RNAi仲介ノックダウン。hCycBのサイレンシングは、定量RT-PCRによって決定しました。平均値と標準偏差(SD)は、(それぞれ、TLM1及び2)各形質導入された3D肝臓モデルの全てのサンプルについて計算し、非形質導入コントロールの平均値に標準化した(Ctrlキー。)。 (Rからの許可を得て再印刷エフ。 8.) この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
ここで説明する再構成された3D肝臓はヒト化システムにウイルスベクターを研究するためのモデルを提供します。ヒト肝細胞癌細胞株とラットの肝臓のECMの再増殖は、大規模な生物製剤の研究を可能にする血管新生したシステムを生成します。これらの結果は、概念実証再構成された肝臓モデルを効率的にウイルスベクターを用いて形質導入することができます。
ここに示した実験では、肝臓の一人ひとりローブはAAVベクターによって形質導入されました。しかし、いくつかの予備実験では、単一のローブは、細胞を再増殖しませんでした。血管系の閉塞から細胞破片または他のコンポーネントを防止することが重要です。すべてのローブが灌流できるかどうかをテストするには、このようなフェノールレッドなどの非毒性色素が肝臓モデルを通してフラッシュすることができます。
もう一つの重要な問題は、無菌の肝臓の足場を保っています。エタノールまたは抗生物質による治療がdisadvですがantageous血管系のため、γ線と細胞外マトリックスの照射は、血管を保存し、サンプルを滅菌しました。
再細胞化手順および再増殖の時間に使用される細胞の数は、再現性のある結果が得られるように調整する必要ができるように、また、外植肝臓の大きさは、異なります。
本研究で使用したラットの肝臓は、比較的大きく、細胞および試験試薬( 例えば、AAVベクター)を大量に必要とします。また、再増殖の手順は、二つ以上の週間かかりました。これは、合理的な努力で行うことができます反復の数を制限します。我々は現在、少数の細胞と少ないテスト試薬の使用を可能にする、ラットの肝臓のボリュームの唯一の約五分の一であり、マウスの肝臓、のためのモデルを確立しています。細胞数の比例スケールダウンが妥当と思われるが、正確な量はfurtで決定する必要があります彼女の実験。
本モデルの別の欠点は、肝細胞HepG2細胞株の使用です。実験は、生理学的に関連性の高いモデルを提供する人工多能性幹細胞から分化した肝細胞の使用を開発することが継続中です。さらに、肝臓は肝細胞、 例えば 、クッパー細胞とsinosoidsに加えて、複数の細胞型で構成されています。私たちは、ECMが複数の細胞型で再細胞化されたときに異なる種類の細胞は、それらの自然環境を再投入することを前提としています。
3D肝モデルは、いくつかの利点を組み合わせます。 in vivoモデル従来の主な欠点は、動物生理学は人間の生理と実質的に異なるということです。ヒト患者の治療の毒性副作用は、したがって検出されないままであってもよいです。この欠点は、より密接にHUの生物学を反映するヒト細胞と3D肝臓モデルを再構成することによって克服することができます男性患者。
肝臓モデルの第2の利点は、動物福祉への貢献です。動物成分を再構成実験のために必要とされるが、余剰動物はそれはすなわち 、追加の動物が必要とされない、他の動物実験のために屠殺し、使用することができるように、このアプローチは依然として、3R原則(置換、還元、改良)の目的を以下アプローチは完全に頻繁にin vivo実験に関連している動物の苦しみを避けることができます。スフェロイドは、3Dシステムで細胞プロセスを研究するための代替ツールです。大規模な物質や生物製剤は、構造体の内側の部分に深く浸透しないように、しかし、スフェロイドは、血管新生されていません。これらの問題は、血管新生した3D肝臓モデルで克服されました。
彼らは、遺伝子治療のための最も有望な候補の一つであるので、ここで説明した実験では、AAVベクターは、調査しましたアプリケーション。以下のような多数の遺伝子治療アプローチが、肝炎ウイルスによるまたはα-1アンチトリプシン欠損症の感染の治療のため、例えば 、肝臓を標的とすることを目指し、3D肝臓はこれらのAAVベクターの開発の過程で使用することができます。また、当然のことながら、他の肝親和性ウイルスベクター、 例えば 、アデノウイルスベクターの研究に適しています。また、例えば、B型またはC型肝炎ウイルスなどの感染性肝炎ウイルスを研究するために使用することができます。例えば、新たな抗ウイルス戦略を設計するために使用することができます。また、3次元臓器モデルは、癌を治療するため、および毒性試験を実施するために新しい細胞増殖抑制治療薬を開発するための有望なツールを表します。長期的には、人工肝臓を移植などの再生医療で使用することができます。まとめると、3D肝臓モデルは、感染生物学および生物医学研究の他の分野でのアプリケーションの広い範囲を提供しています。
開示事項
The authors have nothing to disclose.
謝辞
The authors thank Bernd Krostitz for technical assistance, Radoslaw Kedzierski for initial contributions to the project, Erik Wade for proofreading and giving helpful comments, and Prof. Heike Walles for providing the bioreactor and sharing her valuable experience with organ decellularization. We are also thankful for funding of the project and publication by the Berlin University of Technology.
資料
| Name | Company | Catalog Number | Comments |
| Incubator | Fraunhofer | / | |
| Peristaltic Pump | Fraunhofer | / | |
| Flange with groove | Duran | 2439454 | modified by gaffer |
| O-Ring Transparent | Duran | 2922551 | |
| Quick Release Clamp | Duran | 2907151 | |
| Flat Flange Lid | Duran | 2429857 | modified by gaffer |
| Screw thread Tube | Duran | 2483802 | modified by gaffer |
| Screw thread Tube | Duran | 2483602 | modified by gaffer |
| Silicone sealing Ring | Duran | 2862012 | |
| Screw Cap | Duran | 2924013 | |
| Screw Cap | Duran | 2924008 | |
| Screw Cap with aperture | Duran | 2922709 | |
| Screw Cap with aperture | Duran | 2922705 | |
| Filter | Sarstedt | 831,826,001 | |
| Silicone Tubing | VWR | 228-1500 | |
| Tube connector | Ismatec | ISM556A | |
| Biocompatible Tubing | Ismatec | SC0736 | |
| T175 culture flasks | Greiner bio-one | 660 160 | |
| RPMI 1640 | BioWest SAS (Th. Geyer) | L0501-500 | |
| glutamine | BioWest SAS (Th. Geyer) | X0551-100 | |
| Trypsin | BioWest SAS (Th. Geyer) | L0940-100 | |
| penicillin/streptomycin | BioWest SAS (Th. Geyer) | L0022-100 | |
| fetal calf serum | cc pro | S-10-M | |
| Tissue-Tek O.C.T. | Weckert-Labortechnik | 600001 | |
| HepG2 | DSMZ | ACC 180 | |
| Cryomold 15 x 15 x 5 mm | Sakura | 4566 | |
| Biopsy punch 4 mm | pfm medical | 48401 | |
| Nucleospin miRNA | Macherey & Nagel | 740971.10 | |
| Nucleospin RNA/DNA Buffer Set | Macherey & Nagel | 740944 |
参考文献
- Chang, T. T., Hughes-Fulford, M. Monolayer and spheroid culture of human liver hepatocellular carcinoma cell line cells demonstrate distinct global gene expression patterns and functional phenotypes. Tissue Eng. Part A. 15 (3), 559-567 (2009).
- Butler, D., Callaway, E. Scientists in the dark after French clinical trial proves fatal. Nature. 529 (7586), 263-264 (2016).
- Enger, P. O., Thorsen, F., Lonning, P. E., Bjerkvig, R., Hoover, F. Adeno-associated viral vectors penetrate human solid tumor tissue in vivo more effectively than adenoviral vectors. Hum. Gene Ther. 13 (9), 1115-1125 (2002).
- Uygun, B. E., et al. Decellularization and recellularization of whole livers. J. Vis. Exp. (48), e2394(2011).
- Hillebrandt, K., et al. Procedure for Decellularization of Rat Livers in an Oscillating-pressure Perfusion Device. J. Vis. Exp. (102), e53029(2015).
- Baptista, P. M., et al. The use of whole organ decellularization for the generation of a vascularized liver organoid. Hepatology. 53 (2), 604-617 (2011).
- Yagi, H., et al. Human-scale whole-organ bioengineering for liver transplantation: a regenerative medicine approach. Cell Transplant. 22 (2), 231-242 (2013).
- Wagner, A., et al. Use of a three-dimensional humanized liver model for the study of viral gene vectors. J. Biotechnol. 212, 134-143 (2015).
- Kay, M. A. State-of-the-art gene-based therapies: the road ahead. Nat. Rev. Genet. 12 (5), 316-328 (2011).
- Yla-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Mol. Ther. 20 (10), 1831-1832 (2012).
- Wagner, A., Röhrs, V., Kedzierski, R., Fechner, H., Kurreck, J. A novel method for the quantification of adeno-associated virus vectors for RNA interference applications using quantitative polymerase chain reaction and purified genomic adeno-associated virus DNA as a standard. Hum. Gene Ther. Methods. 24 (6), 355-363 (2013).
- Takagi, H., et al. Microdissected region-specific gene expression analysis with methacarn-fixed, paraffin-embedded tissues by real-time RT-PCR. J. Histochem. Cytochem. 52 (7), 903-913 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved