Method Article
Studie von viralen Vektoren in einem dreidimensionalen Modell der Leber neu besiedelt mit dem menschlichen hepatozellulären Karzinom-Zelllinie HepG2
In diesem Artikel
Zusammenfassung
The recellularized extracellular matrix of a decellularized rat liver can be used as a humanized, three-dimensional ex vivo model to study the distribution and transgene expression of a virus or viral vector.
Zusammenfassung
Dieses Protokoll beschreibt die Erzeugung eines dreidimensionalen (3D) ex vivo Lebermodell und seine Anwendung auf die Erforschung und Entwicklung von viralen Vektorsystemen. Das Modell wird durch Repopulation die extrazelluläre Matrix eines dezellularisierten Rattenleber mit einem menschlichen Hepatozyten-Zelllinie erhalten. Das Modell ermöglicht Untersuchungen in einem gefäß 3D-Zellsystem zu ersetzen potenziell schädliche Experimente mit lebenden Tieren. Ein weiterer Vorteil ist der humanisierte Natur des Modells, das als Tiermodelle näher an die menschliche Physiologie ist.
In dieser Studie zeigen wir die Transduktion dieser Lebermodell mit einem viralen Vektor von Adeno-assoziierten Viren (AAV-Vektor) abgeleitet. Die Perfusion Schaltung, die das 3D-Lebermodell mit Medien versorgt bietet eine einfache Möglichkeit, den Vektor anzuwenden. Das System ermöglicht die Überwachung der wichtigsten Stoffwechselparameter der Leber. Für die endgültige Analyse können Gewebeproben entnommen werden, um das Ausmaß der recellulariza zu bestimmention durch histologische Techniken. Verteilung des Virus-Vektors und die Expression des Transgen geliefert durch quantitative PCR (qPCR), Western-Blotting und Immunhistochemie analysiert werden. Zahlreiche Anwendungen des Vektormodells in der Grundlagenforschung und der Entwicklung gentherapeutischer Anwendungen kann die Entwicklung neuer antiviraler Therapeutika einschließlich in Betracht gezogen werden, die Krebsforschung und die Untersuchung von viralen Vektoren und deren mögliche Nebenwirkungen.
Einleitung
Most current biomedical research relies on one of two approaches, either two-dimensional (2D) cell culture experiments or animal models, which are three-dimensional (3D) by their very nature. However, these approaches have some severe drawbacks. Cells grown in 2D culture have been shown to differ in gene expression patterns and cell physiology from those cultivated under 3D conditions.1 Animal models, in addition to being associated with ethical concerns, often do not model human physiology well. Although the lack of obvious toxic effects of a compound must be confirmed in animal models prior to the first dosing in humans, multiple cases have been documented in which severe, sometimes fatal, adverse effects have occurred in clinical trials.2
To overcome these shortcomings, humanized 3D ex vivo organ models have become important research tools. When cultivated under suitable conditions, cells self-assemble into 3D structures known as spheroids. However, these spheroids lack a vascular system, which limits the distribution of small molecular compounds, large biologics and viral vectors alike. For example, adenoviral vectors only transduced the outer cell layers of spheroids prepared from human glioblastomas.3 A solution to this problem is the use of an organ model containing a vascular system. To this end, the organ of interest can be explanted from an animal, and the animal cells can be replaced by human cells. Various methods for decellularization of animal livers by treatment with detergents or sodium cholate have been described.4-6 The resulting extracellular matrix (ECM) harbors cytokines and growth factors which regulate various cellular processes.7 It can be used as a scaffold for recellularization with human cells to obtain a functional organ model.
In a recent study, we used a humanized 3D liver model to study distribution and transgene expression of an adeno-associated virus (AAV) vector.8 AAV vectors belong to the most promising viral vectors for gene therapeutic applications.9 The first, and to date only, approved gene therapeutic intervention in the Western world uses an AAV vector for the transfer of lipoprotein lipase.10
Protokoll
HINWEIS: RL erhalten ethische Genehmigung für die Explantation von Organen aus dem Landesamt für Gesundheit und Soziales (LaGeSo). Die Lebern wurden von Wistar-Ratten explantiert. Die untere Hohlvene und die Pfortader der Leber wurden mit einer 22 G Kanüle kanüliert. Verfahren zur Dezellularisierung von explantierten Lebern wurden zuvor beschrieben. 4,5 die extrazellulären Matrizes hier verwendet wurden mit 1% Natriumdesoxycholat durch übermäßige Perfusion eines Rattenleber erhalten.
1. Rezellularisierung der extrazellulären Matrix (ECM) von einer Rattenleber
- Erweiterung der Leberzelllinie HepG2
- Kultur der hepatozellulären Karzinom-Zelllinie HepG2 in Roswell Park Memorial Institute (RPMI) 1640-Medium mit 10% fötalem Kälberserum, 2 mM Glutamin und 2 mM Penicillin und Streptomycin, jede.
- Samen 1,5 x 10 7 Zellen in T175 - Flaschen und wachsen , um die Zellen bei 37 ° C und 5% CO 2 . Ernte Zellen nach 4 Tagen durch Trypsinisierung für 5 min bei 37 ° C, 5% CO 2.
- Drehen Sie die Zellen bei 300 g nach unten und resuspendieren sie in 4 ml PBS und zählen Sie die Zellen mit einer Neubauer-Kammer unter dem Mikroskop. Eine T175 Flasche wird etwa 4,5 x 10 7 Zellen ergeben.
HINWEIS: Sicherstellen , dass die Kultur für Rezellularisierung der Rattenleber ECM ausreichende Zellzahlen enthält mit 6 x 10 8 HepG2 Zellen pro ECM (10 x 175 cm 2 Kulturflaschen mit 4-5 x 10 8 Zellen pro Stück).

Abbildung 1. Bioreactor - System. A) Das Bioreaktorsystem war maßgeschneidert. Es erhält die Organmodelle bei 37 ° C und 5% CO 2. Die Strömungsraten der peristaltischen Pumpen können einzeln geregelt werden. B) Die Leber ist in einer Wachstumskammer angeordnet und verbindened zur Perfusionskreislaufes, die aus einer Schlauchpumpe besteht, ein Mittelreservoir, eine Blasenfalle und einem Drucksensor. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Rezellularisierung des ECM
- Stellen Sie den Bioreaktor-System, eine Leber-Perfusionskammer, eine Perfusions-System, ein Reservoir von Medium und eine Blasenfalle enthält. Sterilisieren des Bioreaktors System (121 ° C, 15 min).
- Schließen Sie das Bioreaktorsystem mit einer Schlauchpumpe und legen Sie sie in einen Inkubator geeigneten Bedingungen die Bereitstellung (37 ° C, 5% CO 2). Platzieren dezellularisiert Rattenleber Gerüste 8 in der Leber Perfusionskammer des Bioreaktorsystems (Abbildung 1).
- Schließen Sie den kanülierten Pfortader und Hohlvene mit Schlauchschellen mit dem Perfusionssystem. Äquilibrieren Gerüst mit 150 ml RPMI-Medium (wie in 1.1 beschrieben)über 5 d mit einer Fließgeschwindigkeit von 1,25 ml / min.
- Trennen Sie das Lebergerüstes aus der Medien Schaltung und impfen das Gerüst mit 3 x 10 8 HepG2 - Zellen (in 5 ml) über die Pfortader eine 5 ml - Spritze, Luftblasenbildung vermieden werden und die Zellen das ECM neu zu besiedeln , indem sie Inkubation 1 Stunde in das Gerüst mit der Pumpe abgeschaltet.
- Erhöhen Sie die Durchflussrate durch die Pumpe eingestellt wird, beginnend mit 1,25 ml / min für 10 min; 2,5 ml / min für 20 min und schließlich 3,75 ml / min für 30 min.
- Wiederholen Sie die Schritte 1.2.4-1.2.5 eine Gesamtzellzahl von 6 x 10 8 zu erreichen.
- Führen Sie die Bioreaktorsystem bei einer Fließgeschwindigkeit von 3,75 ml / min. Kultur der rezellularisiertes Rattenleber für 2 Wochen.
HINWEIS: Ersetzen Sie ein Drittel des Mediums mit frischem Medium (50 ml) jeden zweiten Tag. Probe des Kulturmediums physiologische Parameter, wie Lactat-Dehydrogenase-Aktivität, der pH-Wert von Mediumproben und der Konzentration von Glukose und Laktat zu messen.
2. Transduktion der rezellularisiertes Rat Liver
- Die Großproduktion von AAV-Vektoren
- Produzieren, zu reinigen und zu quantifizieren , AAV - Vektoren , wie zuvor beschrieben: 11
- AAV-Vektoren in Rollflaschen Kurz gesagt, produzieren und reinigen sie von Iodixanol-Zentrifugation. Entfernen Rest Iodixanol durch Filtration über PD10 Gelfiltrationssäulen. Bestimmung der AAV-Vektor-Konzentration durch qPCR unter Verwendung von genomischer DNA AAV als Standard.
HINWEIS: Die selbstkomplementären, pseudotypisierten AAV 2 /6 Vektor in der vorliegenden Studie verwendeten codierten EmGFP als Reporter Transduktionseffizienz und eine shRNA - Expressionskassette für die Zuschlags eines endogen exprimierten Gens (human Cyclophilin B (hCycB), Abbildung 2) zu zeigen , . Achten Sie darauf , eine ausreichende Menge an pseudotypisiertem scAAV Vektoren des Serotyps 6 (2,7 x 10 13 AAV - Vektoren pro Leber - Modell).
- AAV-Vektoren in Rollflaschen Kurz gesagt, produzieren und reinigen sie von Iodixanol-Zentrifugation. Entfernen Rest Iodixanol durch Filtration über PD10 Gelfiltrationssäulen. Bestimmung der AAV-Vektor-Konzentration durch qPCR unter Verwendung von genomischer DNA AAV als Standard.
- Produzieren, zu reinigen und zu quantifizieren , AAV - Vektoren , wie zuvor beschrieben: 11

Abbildung 2. Karte des selbstkomplementären, pseudotypisierten AAV2 / 6 - Vektor in der vorliegenden Studie verwendet. Das Genom besteht aus den Inverted Terminal Repeats (ITR) von AAV2 und codiert EmGFP unter der Kontrolle des CMV - Promotors sowie eine shRNA unter der Kontrolle eines U6 - Promotors. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Transduction von Lebermodell
- Stellen Sie die AAV - Vektor - Lösung auf eine Endkonzentration von 2,7 x 10 13 Vektorgenomen in 5 ml durch das jeweilige Volumen PBS hinzugefügt wird .
- Trennen Sie die Leber aus der Medienkreislauf durch den Schlauch aus der Kanüle entfernen. Schließen Sie eine 5-ml-Spritze mit der Kanüle der Pfortader und injizieren die vollständige AAV-Vektor-Lösung (5 ml).
HINWEIS: Optionally, Phenolrot (5 ug / ml) hinzufügen, um die Verteilung des AAV-Vektor-Lösung in der gesamten Leber zu folgen. - Inkubieren für 1 Stunde, ohne zu pumpen. Nach und nach Strömungsgeschwindigkeit zu erhöhen, mit 1,25 ml Start / min für 10 min; 2,5 ml / min für 20 min und 3,75 ml / min für 30 min. Kultur der rezellularisiertes Rattenleber über 6 Tage.
HINWEIS: Ein Drittel des Mediums ersetzen, wie in Anmerkung unter 1.2.7 gegeben
3. Bewertung des rezellularisiertes transduzierten Rattenleber
- Hematoxylin und Eosin (HE) Färbung und immunhistochemische Analyse
- Nehmen Sie Proben (0,5 x 0,5 x 1,5 bis 2 cm) aus jeder Leberlappen mit einem Skalpell.
- Inkubieren Proben (aus 3.1.1) in 4% Paraformaldehyd (PFA) + 4% Saccharose-Lösung für 1,5 h bei 4 ° C. (Achtung: PFA ist giftig und krebserregend immer PFA halten innerhalb einer Abzugshaube und entsprechende Schutzkleidung tragen..) Waschen dreimal mit PBS (1 min pro Waschschritt) und Inkubation in 8%Saccharose über Nacht bei 4 ° C.
- Gießen Medium in Kunststoff cryomolds Fixierung, legen Sie die Proben in Befestigungsmedium frei von Luftblasen. In Befestigungsmedium, bis Probe wird gut abgedeckt. Lagern Sie die Proben bis zur weiteren Verwendung bei -80 ° C eingebettet.
- Bereiten cryo Schnitte (10 um) mit einem Kryotom 12. Beurteilen Sie Rezellularisierung von Hämatoxylin + Eosin - Färbung 8. Beurteilen Sie Transduktionseffizienz durch immunhistochemische Färbung für das Gen von Interesse (hier: EmGFP).
- Molekularbiologische Probenahme
- Probe jedes Leberlappen mit einem Biopsiestanze (4 mm im Durchmesser). Isolieren der Gesamt - RNA, DNA und Proteine gemäß den Anweisungen des Herstellers für die Beurteilung der transgenen Expression von EmGFP und hCycB knock down 8.
Ergebnisse
Für die Beurteilung des Ausmaßes der Rezellularisierung, Kryo-Schnitte wurden von jeder Keule jedes rezellularisiertes Lebermodell vorbereitet. Die Schnitte wurden dann mit Hämatoxylin und Eosin-Färbung analysiert. Wie in Abbildung 3 zu sehen ist, jeder Lappen der Leber der drei Modelle, bezeichnet als TLM1, TLM2 (transduziert Leber Modelle 1 +2) und Ctrl (Control Lebermodell , das rezellularisiertes wurde, aber nicht transduziert) wurden mit HepG2 - Zellen neu besiedelt. Diese hepatozelluläres Karzinom-Zelllinie wurde aus dem Tumorgewebe eines 15-jährigen argentinischen Jungen etabliert. Einige Bereiche der Leber Modelle wurden intensiver rezellularisiertes als andere. Die Gründe für diese Variationen bleiben bestimmt werden.

Abbildung 3. Hämatoxylin und Eosin - Färbung jeder Keule der drei Leber Modelle analysiert TLM1 + 2:. Transduzierten LeberModelle 1 und 2; Ctrl .: Kontrolle Lebermodell, das rezellularisiertes wurde aber nicht transduziert. Maßstabsbalken: 200 & mgr; m. (Re-gedruckt mit freundlicher Genehmigung von Ref. 8.) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Im nächsten Schritt wurde die Transduktion der Leber Modellen bewertet. Zu diesem Zweck wurde DNA aus 28 Stanzbiopsien von jeder der Leber Modelle vorbereitet und der Vektor-Titer wurde durch qPCR quantifiziert. Im Durchschnitt 55 bis 90 internalisiert Vektorgenome pro Zelle (VG / Zelle) wurden für die zwei transduziert Leber Modelle gemessen. Experimente in der 2D-Zellkultur haben 30 VG / Zelle für starke Transgen-Expression und RNAi-vermittelte Silencing ausreichend sind, gezeigt. Herstellung von EmGFP wurde durch RT-PCR und Western Blotting analysiert. In der Tat, die Expression des Reporter wurde in 80-90% der Biopsien auf der mRNA- und Proteinebene jeweils detektiert.8 Um ein umfassendes Bild der Transduktionseffizienz, Kryo-Schnitte wurden immunhistochemisch analysiert erhalten. Wie in Abbildung 4, Bereiche des Lebermodell gesehen werden , die erfolgreich rezellularisiertes wurden, wie es durch DAPI - Färbung sichtbar gemacht , gab auch eine starke Fluoreszenzsignale in der immunhistochemischen Analyse von EmGFP Expression. Wie erwartet, ist die Kontrolle Lebermodell nicht mit AAV-Vektoren behandelt, zeigten keine EmGFP Ausdruck.
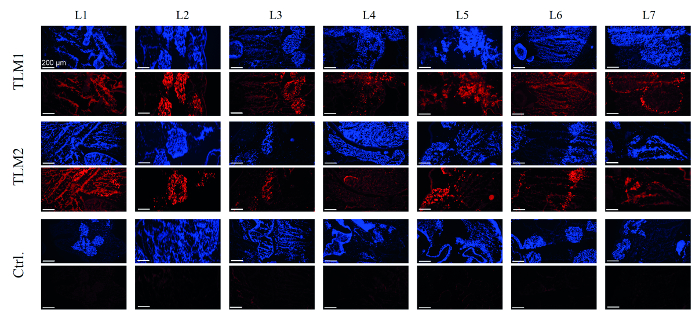
Abbildung 4. Immunhistochemische Analyse von EmGFP Expressionszellen, die die Leber - Modelle neu besiedelt wurden durch DAPI - Färbung sichtbar gemacht (blau). EmGFP Expression wurde durch immunochemische Färbung (rot) sichtbar gemacht. TLM1 + 2: transduziert Leber Modelle 1 und 2; Ctrl .: Kontrolle Lebermodell, das rezellularisiertes wurde aber nicht transduziert. Maßstabsbalken: 200 & mgr; m. (Neu gedruckt mit Erlaubnisvon Ref. 8.) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
In einem abschließenden Test, AAV-vermittelte Knockdown von hCycB wurde durch qRT-PCR analysiert. Der Zuschlag von hCycB wurde zwischen 70 und 90% festgestellt, gemittelt über alle Ausbuchtungen der beiden transduziert Lebermodelle (Abbildung 5).

Abbildung 5. RNAi-vermittelten Knockdown von hCycB in AAV-transduzierten 3D - Leber - Modelle. Silencing von hCycB wurde durch qRT-PCR bestimmt. Mittelwerte und Standardabweichungen (SD) wurden für alle Proben jeder transduziert 3D Lebermodell berechnet (TLM1 bzw. 2) und normalisiert auf den Mittelwert der nicht-transduzierten Steuerung (Ctrl.). (Re-gedruckt mit freundlicher Genehmigung von Ref. 8.) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Die rekonstituierten 3D-Lebern hier beschrieben liefern ein Modell virale Vektoren in einem humanisierten System zu studieren. Wiederaufforstung der ECM einer Rattenleber mit einem menschlichen hepatozellulären Karzinom-Zelllinie erzeugt ein gefäß System, das die Untersuchung großer Biologika ermöglicht. Diese Ergebnisse liefern einen Proof-of-Concept, die das aufgelöste Lebermodell effizient mit einem viralen Vektor transduziert werden.
Für die Experimente hier gezeigten jeder Lappen der Leber wurde durch den AAV-Vektor transduziert. Jedoch in einigen Vorversuchen wurden einzelne Lappen nicht mit Zellen neu besiedelt. Es ist daher wichtig, die Zelltrümmer und andere Bestandteile aus Verschließen des Gefäßsystems zu verhindern. Um zu testen, ob alle Lappen perfundiert werden kann, einem nicht-toxischen Farbstoff, wie Phenolrot kann durch das Lebermodell gespült werden.
Ein weiterer entscheidender Angelegenheit hält die Leber Gerüst steril. Während der Behandlung mit Ethanol oder Antibiotika disadvantageous für das Gefäßsystem, Bestrahlen der extrazellulären Matrix mit γ-Strahlung bewahrt die Gefäße und sterilisiert die Probe.
Darüber hinaus unterscheiden sich die Größe der explantierten Lebern, so dass die Anzahl der Zellen für die Rezellularisierung Verfahrens und der Repopulation Zeit verwendet wird, kann eingestellt werden, um reproduzierbare Ergebnisse zu erhalten.
Die Rattenlebern in der vorliegenden Studie verwendet werden , sind vergleichsweise groß und erfordern große Mengen an Zellen und Testreagenzien (zB AAV - Vektoren). Darüber hinaus nahm die Neubesiedlung Verfahren mehr als zwei Wochen. Dies begrenzt die Anzahl der Wiederholungen, die mit vertretbarem Aufwand durchgeführt werden kann. Wir schaffen derzeit das Modell für Mäuselebern, die nur etwa ein Fünftel des Volumens des Rattenlebern werden, was die Verwendung von weniger Zellen und weniger Testreagenzien. Obwohl proportional Verkleinerungs der Zellzahl sinnvoll erscheint, müssen die genauen Beträge in furt bestimmt werdenihre Experimente.
Ein weiterer Nachteil des vorliegenden Modells ist die Verwendung des hepatozellulären HepG2-Zelllinie. Die Experimente sind noch nicht abgeschlossen, die Verwendung von Hepatozyten aus induzierten pluripotenten Stammzellen differenziert zu entwickeln, die ein physiologisch relevanter Modell bieten. Darüber hinaus besteht die Leber von mehreren Zelltypen zusätzlich zu den Hepatozyten, beispielsweise Kupffer - Zellen und sinosoids. Wir gehen davon aus, dass die verschiedenen Zelltypen werden ihre natürlichen Umgebungen neu zu besiedeln, wenn ein ECM mit mehreren Zelltypen rezellularisiertes wird.
Das 3D-Lebermodell vereint mehrere Vorteile. Ein wesentlicher Nachteil der herkömmlichen in vivo Modellen ist , dass Tierphysiologie wesentlich von menschlichen Physiologie unterscheidet. Toxische Nebenwirkungen der Behandlung eines menschlichen Patienten kann somit unerkannt bleiben. Dieser Mangel kann durch Rekonstitution des 3D-Lebermodell mit menschlichen Zellen überwunden werden, die eng reflektieren mehr die Biologie von huMann Patienten.
Der zweite Vorteil des Lebermodell ist ihr Beitrag zum Tierschutz. Obwohl tierische Bestandteile für die Rekonstitutionsexperimenten erforderlich sind, folgt der Ansatz noch die Ziele des 3R - Prinzips (Replacement, Reduction, Refinement), als überzähligen Tieren verwendet werden können , die für andere Tierversuche geopfert wurden, also keine zusätzlichen Tiere benötigt werden und der Ansatz vollständig vermeidet Leiden der Tiere , die häufig mit in vivo - Experimenten zugeordnet ist. Sphäroide sind ein alternatives Werkzeug zelluläre Prozesse in einem 3D-System zu untersuchen. Jedoch sind Sphäroide nicht vaskularisiert, so daß große Stoffe und Biologika nicht tief in die inneren Teile der Struktur eindringen. Diese Probleme wurden mit dem gefäß 3D Lebermodell überwinden.
In den hier beschriebenen Experimenten wurden die AAV-Vektoren untersucht, da sie zu den vielversprechendsten Kandidaten für gentherapeutische sindAnwendungen. Zahlreiche gentherapeutische Ansätze zielen die Leber bei Targeting, beispielsweise zur Behandlung von Infektionen mit Hepatitisviren oder von alpha-1-Antitrypsin - Mangel, die 3D - Leber kann in dem Verfahren dieser AAV Vektorentwicklung verwendet werden. Es ist natürlich auch geeignet für die Untersuchung von anderen hepatotropen virale Vektoren, beispielsweise adenovirale Vektoren. infektiöse Hepatitis-Viren zu studieren, wie Hepatitis B oder C Virus Zusätzlich kann es verwendet werden. Es kann zum Beispiel verwendet werden, neue antivirale Strategien zu entwickeln. Darüber hinaus repräsentieren 3D Organmodelle viel versprechende Werkzeuge neue Zytostatika-Therapeutika zu entwickeln, um Krebs zu behandeln und toxikologische Untersuchungen durchzuführen. Auf lange Sicht, künstliche Leber kann in der regenerativen Medizin als Transplantate verwendet werden. Zusammengefasst bietet das 3D-Lebermodell eine breite Palette von Anwendungen in der Infektionsbiologie und anderen Bereichen der biomedizinischen Forschung.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors thank Bernd Krostitz for technical assistance, Radoslaw Kedzierski for initial contributions to the project, Erik Wade for proofreading and giving helpful comments, and Prof. Heike Walles for providing the bioreactor and sharing her valuable experience with organ decellularization. We are also thankful for funding of the project and publication by the Berlin University of Technology.
Materialien
| Name | Company | Catalog Number | Comments |
| Incubator | Fraunhofer | / | |
| Peristaltic Pump | Fraunhofer | / | |
| Flange with groove | Duran | 2439454 | modified by gaffer |
| O-Ring Transparent | Duran | 2922551 | |
| Quick Release Clamp | Duran | 2907151 | |
| Flat Flange Lid | Duran | 2429857 | modified by gaffer |
| Screw thread Tube | Duran | 2483802 | modified by gaffer |
| Screw thread Tube | Duran | 2483602 | modified by gaffer |
| Silicone sealing Ring | Duran | 2862012 | |
| Screw Cap | Duran | 2924013 | |
| Screw Cap | Duran | 2924008 | |
| Screw Cap with aperture | Duran | 2922709 | |
| Screw Cap with aperture | Duran | 2922705 | |
| Filter | Sarstedt | 831,826,001 | |
| Silicone Tubing | VWR | 228-1500 | |
| Tube connector | Ismatec | ISM556A | |
| Biocompatible Tubing | Ismatec | SC0736 | |
| T175 culture flasks | Greiner bio-one | 660 160 | |
| RPMI 1640 | BioWest SAS (Th. Geyer) | L0501-500 | |
| glutamine | BioWest SAS (Th. Geyer) | X0551-100 | |
| Trypsin | BioWest SAS (Th. Geyer) | L0940-100 | |
| penicillin/streptomycin | BioWest SAS (Th. Geyer) | L0022-100 | |
| fetal calf serum | cc pro | S-10-M | |
| Tissue-Tek O.C.T. | Weckert-Labortechnik | 600001 | |
| HepG2 | DSMZ | ACC 180 | |
| Cryomold 15 x 15 x 5 mm | Sakura | 4566 | |
| Biopsy punch 4 mm | pfm medical | 48401 | |
| Nucleospin miRNA | Macherey & Nagel | 740971.10 | |
| Nucleospin RNA/DNA Buffer Set | Macherey & Nagel | 740944 |
Referenzen
- Chang, T. T., Hughes-Fulford, M. Monolayer and spheroid culture of human liver hepatocellular carcinoma cell line cells demonstrate distinct global gene expression patterns and functional phenotypes. Tissue Eng. Part A. 15 (3), 559-567 (2009).
- Butler, D., Callaway, E. Scientists in the dark after French clinical trial proves fatal. Nature. 529 (7586), 263-264 (2016).
- Enger, P. O., Thorsen, F., Lonning, P. E., Bjerkvig, R., Hoover, F. Adeno-associated viral vectors penetrate human solid tumor tissue in vivo more effectively than adenoviral vectors. Hum. Gene Ther. 13 (9), 1115-1125 (2002).
- Uygun, B. E., et al. Decellularization and recellularization of whole livers. J. Vis. Exp. (48), e2394(2011).
- Hillebrandt, K., et al. Procedure for Decellularization of Rat Livers in an Oscillating-pressure Perfusion Device. J. Vis. Exp. (102), e53029(2015).
- Baptista, P. M., et al. The use of whole organ decellularization for the generation of a vascularized liver organoid. Hepatology. 53 (2), 604-617 (2011).
- Yagi, H., et al. Human-scale whole-organ bioengineering for liver transplantation: a regenerative medicine approach. Cell Transplant. 22 (2), 231-242 (2013).
- Wagner, A., et al. Use of a three-dimensional humanized liver model for the study of viral gene vectors. J. Biotechnol. 212, 134-143 (2015).
- Kay, M. A. State-of-the-art gene-based therapies: the road ahead. Nat. Rev. Genet. 12 (5), 316-328 (2011).
- Yla-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Mol. Ther. 20 (10), 1831-1832 (2012).
- Wagner, A., Röhrs, V., Kedzierski, R., Fechner, H., Kurreck, J. A novel method for the quantification of adeno-associated virus vectors for RNA interference applications using quantitative polymerase chain reaction and purified genomic adeno-associated virus DNA as a standard. Hum. Gene Ther. Methods. 24 (6), 355-363 (2013).
- Takagi, H., et al. Microdissected region-specific gene expression analysis with methacarn-fixed, paraffin-embedded tissues by real-time RT-PCR. J. Histochem. Cytochem. 52 (7), 903-913 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten