A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصميم تجريبي ليزر تسليخ مجهري RNA تسلسل: دروس من تحليل التنمية الذرة ورقة
In This Article
Summary
Many developmentally important genes have cell- or tissue-specific expression patterns. This paper describes LM RNA-seq experiments to identify genes that are differentially expressed at the maize leaf blade-sheath boundary and in lg1-R mutants compared to wild-type. The experimental considerations discussed here apply to transcriptomic analyses of other developmental phenomena.
Abstract
الجينات مع أدوارا مهمة في تطوير كثير من الأحيان يكون أنماط التعبير مقيدة مكانيا و / أو الزمان. في كثير من الأحيان لا يتم الكشف عن هذه النصوص الجين أو لا يتم تحديدها كما أعرب تفاضلي (DE) في التحليلات transcriptomic الأجهزة مصنع كامل. الليزر تسليخ مجهري RNA تسلسل (LM RNA تسلسل) هو أداة قوية لتحديد الجينات التي هي دي في المجالات التنموية المحددة. ومع ذلك، واختيار المجالات الخلوية لmicrodissect ومقارنة، ودقة microdissections حاسمة لنجاح هذه التجارب. هنا، مثالين لتوضيح اعتبارات التصميم للتجارب transcriptomics. وLM تحليل الحمض النووي الريبي وما يليها إلى تحديد الجينات التي DE على طول المحور الداني القاصي ورقة الذرة، والتجربة الثانية لتحديد الجينات التي هي دي في liguleless1-R (LG1-R) المسوخ مقارنة نوع البرية. تم تفصيل العناصر الرئيسية التي ساهمت في نجاح هذه التجارب النسيجي وبحالة الاشتراكيةتو التهجين يحلل المنطقة لتحليلها، واختيار من براعم نبات في مراحل نمو تعادل، واستخدام المعالم المورفولوجية لتحديد المناطق لتسليخ مجهري، وتسليخ مجهري من المجالات قياسها بدقة. وتقدم هذه الورقة بروتوكول مفصلة لتحليل المجالات التنموية التي LM RNA تسلسل. البيانات المقدمة هنا توضح كيف أن المنطقة المحددة لتسليخ مجهري سوف يؤثر على النتائج التي تم الحصول عليها.
Introduction
أوراق الذرة هي نموذج مثالي لدراسة تشكيل المجالات التنموية خلال التشكل، كما أن لديها حدود واضح بين النصل والغمد التي هي قابلة للتشريح الجيني (الشكل 1A). خلال المراحل الأولى من تطوير ورقة، عصابة خطية من الخلايا الصغيرة، والفرقة preligule (PLB)، الإضافي يقسم منشم ورقة إلى ما قبل النصل والغمد قبل المجالات. واللسيناء مثل هامشية والأذين الثلاثي تطوير من PLB (الشكل 1A، C، D). وقد حددت شاشات الوراثية الطفرات التي تعطل الحدود شفرة غمد. على سبيل المثال، liguleless1 المتنحية (LG1) الطفرات بحذف اللسيناء والأذين 1، 2، 3، 4 (الشكل 1B). في الموقع كشفت التهجين التي نص LG1 يتراكم في PLB واللسيناء الناشئة، مما يجعلها علامة ممتازة للتنمية اللسيناء 5، 6 (الشكل 1E).
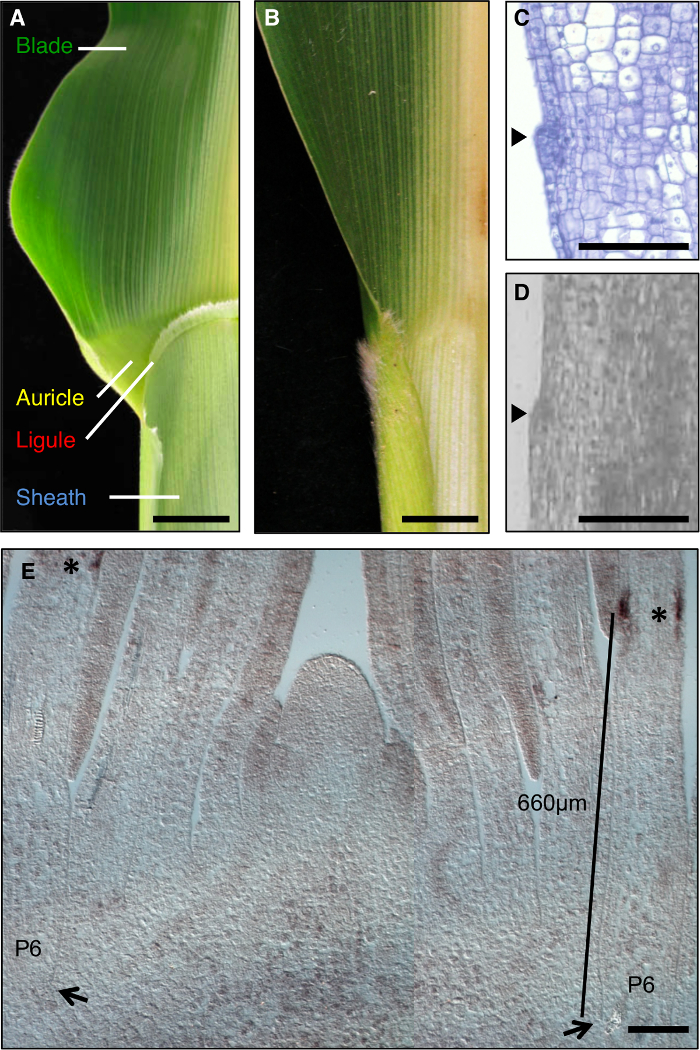
الشكل 1: من النوع البري وأوراق الذرة liguleless1-R. (أ) المنطقة بليد غمد حدود ناضجة ورقة من النوع البري تظهر الهياكل اللسيناء والأذن. (ب) المنطقة بليد غمد حدود ناضجة liguleless1-R ورقة تبين عدم وجود هياكل اللسيناء والأذن. قطعت الأوراق في A و B في نصف طول الضلع الأوسط. (C) الطولي القسم من خلال البرية من نوع ورقة منشم. وقد تم تجهيز عينة وملطخة للتحليل النسيجي. واللسيناء بدء واضح كما عثرة جاحظ من الطائرة من ورقة (رأس السهم). (D) طائفة طوليةايون من خلال البرية من نوع ورقة منشم. وقد تم تجهيز عينة لLM كما هو موضح في النص. يشير السهم الشروع اللسيناء. (E) LG1 في الموقع التهجين من تبادل لاطلاق النار مهيمنة المقطع الطولي الجانبي. وتشير العلامات النجمية تراكم نسخة LG1 في PLB من منشم ورقة P6. وتشير السهام قاعدة P6 منشم. يشير شريط القياس من قاعدة منشم إلى PLB. الحانات النطاق في A و B = 20 مم. الحانات النطاق في م = 100 ميكرون. تم تعديل هذا الرقم من الإشارة 6 (الجمعية الأمريكية حقوق الطبع والنشر علماء الأحياء النباتية). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
في هذه الدراسة، كان يعمل LM RNA تسلسل لتحديد مجموعة من الجينات التي يتم التعبير عنها بشكل مختلف (DE) في شفرة غمد حدود نسبة إلى أجزاء أخرى من منشم ورقة وبيئة تطوير متكاملة الجينات ntify التي هي دي في المسوخ LG1-R قريبة من النوع البري الأشقاء. LM RNA تسلسل هو وسيلة لقياس تراكم نص في خلايا معينة أو المجالات الخلوية 7. نظم LM الجمع بين الليزر والمجهر مع الكاميرا الرقمية. هي التي شنت الأنسجة مقطوع على الشرائح وعرضها من خلال المجهر. البرنامج LM عادة ما تضم أدوات الرسم التي تسمح للمستخدم لمخطط أي منطقة تم اختيارها لتسليخ مجهري. تخفيضات ليزر على طول الخط، والأنسجة المختارة قفزت خارج الشريحة وفي أنبوب معلق فوق الشريحة. LM يسمح للمستخدم لmicrodissect مجالات محددة، بما في ذلك طبقات معينة من الخلايا وحتى الخلايا وحيدة 8 و 9. RNA ومن ثم يمكن استخراجها من أنسجة microdissected. وفي وقت لاحق، المكون RNA يليها يستخدم الجيل القادم التسلسل تسلسل مكتبات كدنا] المتولدة من الحمض النووي الريبي المستخرج 10،= "XREF"> 11.
المزايا الرئيسية لLM RNA وما يليها هي القدرة على قياس تراكم نسخة في مجالات محددة بدقة والقدرة على محة عن Transcriptome على كامل في وقت واحد (7). هذه التقنية هي مناسبة بشكل خاص لسبر الأحداث التنموية في وقت مبكر حيث المنطقة من اهتمام في كثير من الأحيان المجهرية. وقد استخدمت الدراسات السابقة LM جنبا إلى جنب مع تكنولوجيا متطورة لدراسة العمليات التنموية في محطات 9 و 12 و 13. RNA تسلسل لديه ميزة قياس النصوص عبر مجموعة ديناميكية واسعة، بما في ذلك الجينات منخفضة أعرب، وليس مطلوبا من المعلومات تسلسل مسبق 10 و 11. وعلاوة على ذلك، LM RNA تسلسل لديه القدرة على تسليط الضوء على جينات هامة تنمويا قد غاب في شاشات الطفرات بسبب التكرار الجيني أو إلى الفتك من خسارة من-وظيفة متحولة.
جينات هامة تنمويا، مثل sheath1 ضيقة (NS1) وعلى شكل كوب cotyledon2 (cuc2)، وغالبا ما يكون أنماط التعبير محددة من واحد أو عدد قليل من الخلايا 17، 18، 19، 20. وأعرب كثيرون فقط خلال مراحل النمو المبكرة وليس في الجهاز ناضجة. عندما يتم تحليل أجهزة كاملة أو المجالات كبيرة، وتضعف هذه النصوص خلية محددة، ولا يجوز الكشف في التحليلات التقليدية أكثر. من خلال السماح تحليلات مجالات محددة بدقة، وتمكن LM RNA تسلسل هذه الجينات الأنسجة محددة يتم تحديدها وكميا.
ومن العوامل الحاسمة في نجاح هذه التجارب هو موضح هنا تحليل النسيجي الدقيق التي وجهت اختيار المرحلة التنموية المناسبة والمجال لتحليل، وmeasureme دقيقةالإقليم الشمالي من المجالات خلية الأنسجة لLM. لضمان المجالات تعادل وأخذت عينات لجميع مكررات، تم جمع الأنسجة من براعم نبات في هذه المرحلة التنموية نفسها، وكان قياس المجالات microdissected النسبية إلى المعالم المورفولوجية مثل اللسيناء الناشئة (الشكل 2). ومن المعروف أن يتم التعبير عن بعض الجينات في التدرج من طرف إلى قاعدة ورقة. عن طريق قياس المجالات دقيقة، والتباين بسبب أخذ العينات من مواقع مختلفة على طول المحور الداني القاصي ورقة كان في حده الأدنى (الشكل 3A). بواسطة microdissecting المجالات من نفس الحجم، التخفيف من النصوص خلية محددة تم تخفيض أيضا (الشكل 3B) الاختلاف يرجع إلى التفاضلية. واستخدمت المقاطع الطولية الجانبية للقمة تبادل لاطلاق النار لجميع microdissections. هذه هي المقاطع التي هي عمودي على محور الضلع الأوسط الهامش (الشكل 4). باستخدام أقسام الوحيدة التي تشمل SAM يضمن أن المناطق الجانبية ما يعادلويتم تحليل براعم نبات.
في عينات المصنعة ومقطوع عن LM، أول علامة الصرفي من ثمرة اللسيناء هو نتوء على الجانب متجه نحو المحور بسبب انقسامات الخلية periclinal في البشرة متجه نحو المحور (1D الشكل، الشكل 2). تقرر أن اللسيناء الناشئة يمكن تحديدها بشكل موثوق به في فترة تتابع النمو 7 براعم نبات المرحلة. كنا مهتمين الجينات وأعرب في المنطقة اللسيناء بأكملها، بما في ذلك اللسيناء الناشئة والخلايا البعيدة على الفور من شأنها أن تشكل الأذن. من أجل ضمان أن التحديدات الأنسجة تعادل بذلت، تم استخدام عثرة اللسيناء كمعلم الصرفي واختير مستطيل 100 ميكرون تركزت على نتوء اللسيناء لLM (الشكل 2A، 2B). وقد تم اختيار مستطيلات يعادل الحجم من قبل شفرة وقبل غمد من نفس براعم نبات.
قدمت تحليلات للنباتات معدلة وراثيا liguleless وشال مختلفةنجى. LG1-R المسوخ لا تشكل اللسيناء، لذلك لا يمكن استخدام هذه الميزة المورفولوجية لتحديد المنطقة لLM. بدلا من ذلك، تم تحديد مجال تراكم نسخة LG1 في البرية من نوع نبات براعم، وأنها حددت المنطقة التي من شأنها أن تشمل هذا المجال. تم إجراء هذه التحاليل الأولية على الشتلات من نفس زراعة مثل استخدمت في التحليل النهائي، لأن العمل السابقة قد أظهرت أن موقع PLB يختلف باختلاف ظروف النمو. في الموقع أشار التهجين أن النصوص LG1 تتراكم في PLB من P6 رقة براعم (الشكل 1E). اخترنا مجال 400-900 ميكرون من قاعدة براعم نبات أن يشمل مجال التعبير LG1 (المستطيلات الأرجواني، الشكل 2A) واستولت على هذه المناطق ما يعادلها من النوع البري والنباتات LG1-R. لتقليل التباين في ظروف الخلفية والنمو الوراثية عند مقارنة transcripواستخدمت تراكم تي في LG1-R والنباتات البرية من نوع، فصل العائلات من المسوخ والبرية من نوع الأشقاء.
Protocol
ملاحظة: إصلاح الأنسجة للتحليل النسيجي في نفس الوقت أن الأنسجة ثابتة لLM. دراسة المقاطع الملون لميزات المورفولوجية التي ستوجه في وقت لاحق LM. عند مقارنة متحولة إلى البرية من نوع، نفذ في الموقع التهجين أو immunolocalization لتحديد المجال حيث يتم التعبير عن الجينات في المصالح (في هذه الحالة LG1).
1. تثبيت الأنسجة وتجهيز
- تنمو الشقق شتلات الذرة لمدة أسبوعين القديمة في ظل ظروف قياسية 6.
- تشريح قمم تبادل لاطلاق النار لقطاعات جانبية (الشكل 4).
- الشتلات المكوس أسفل خط التربة.
- باستخدام شفرة حلاقة، إزالة شرائح رقيقة من قاعدة الساق (تخفيضات 1، الشكل 4A) حتى بيضاوي من دقاق الفحم محاطة احد أو اثنين من الأوراق الناضجة مرئيا (الشكل 4B).
- جعل خفض آخر ما يقرب من 10 مم فوق قاعدة (قطع 2، الشكل 4A).وسيتضمن هذا القطاع 10 مم وسام وبراعم أوراق الشباب.
- تحويل شريحة 10 مم حتى القاعدة ومواجهة. جعل اثنين من التخفيضات موازية للمحور الأفقي بحيث يتم الحصول على شريحة من النسيج 2-3 مم (تخفيضات 3، و 4، الشكل 4B). تجاهل الخارجية جزأين والإبقاء على شريحة المركزية لتثبيت والتضمين.
ملاحظة: قد يتم قطع الأوراق الخارجي والتخلص منها.
- إصلاح الأنسجة وعملية لدمج.
- التأكد من أن جميع المواد المستخدمة في الخطوات اللاحقة هي ريبونوكلياز مجانا. علاج حلول مع pyrocarbonate اثيل (DEPC) (1 مل DEPC في لتر من المحلول. احتضان بين عشية وضحاها مع اهتزاز في بعض الأحيان، والأوتوكلاف). الأواني الزجاجية يخبز في الفرن على حرارة 200 درجة مئوية أو أعلى لمدة 6 على الأقل ساعة وعلاج وير البلاستيكية التي تحتوي على ريبونوكلياز الحل إزالة التلوث.
- يوم 1: تزج شرائح الأنسجة في ~ 10 مل من الإصلاح المزارعين (3: 1 الايثانول: حامض الخليك) في قارورة زجاجية على الجليد. بعد أن تم تشريح جميع العينات، وتطبيق vacuuم لإزالة فقاعات الهواء والاختراق المعونة من تثبيتي. عقد في ظل فراغ لمدة 10 دقيقة ثم الافراج عن فراغ ببطء. استبدال تثبيتي، واحتضان عند 4 درجات مئوية خلال الليل مع اهتزاز لطيف.
- يوم 2: احتضان في السلسلة التالية من الحلول، ~ 10 مل لكل منهما، 1 ساعة لكل منهما، مع كل طيف تهتز. 85٪ من الإيثانول في 4 درجات مئوية، و 95٪ من الإيثانول في 4 درجات مئوية، و 100٪ من الإيثانول في 4 درجات مئوية، و 100٪ من الإيثانول في 4 درجات مئوية، و 100٪ من الإيثانول في 4 درجات مئوية، 1: 1 الايثانول: الزايلينات في درجة حرارة الغرفة، 100 الزايلينات٪ في درجة حرارة الغرفة، و 100 الزايلينات٪ في درجة حرارة الغرفة.
ملاحظة: الزايلينات سامة عن طريق الاتصال والاستنشاق. العمل في غطاء الدخان واستخدام القفازات المناسبة. - إضافة الأنسجة البارافين تضمين الكريات المتوسطة لحجم نصف تقريبا من الزيلين واحتضان بين عشية وضحاها في درجة حرارة الغرفة مع الهز لطيف.
- يوم 3: نقل القارورة إلى 60 درجة مئوية الفرن حتى تذوب حبيبات. تخلصي من حل واستبدال الأنسجة الطازجة تفوح تضمين المتوسطة. تغيير متوسطة مرتين أخريينخلال اليوم.
- يوم 4: تغيير الأنسجة تضمين المتوسط مرة واحدة في الصباح. العودة إلى 60 درجة مئوية الفرن حتى بعد ظهر اليوم.
- كتل الزهر
- وضع قوالب تضمين على طبق ساخن من محطة التضمين الأنسجة. استخدام ملقط لنقل عينات الأنسجة إلى قوالب تضمين مع سطح قطع أسفل. ملأ القالب مع البارافين ذاب ووضع عصابة التضمين على رأس القالب. نقل إلى لوحة الباردة حتى عزز البارافين. تخزين كتل البارافين في 4 درجات مئوية في وعاء محكم مع هلام السيليكا.
2. باجتزاء وحرك إعداد
- قطع 10 ميكرون المقاطع على مشراح 25.
- فحص أشرطة واختيار المقاطع الوسطية. أقسام متوسط هي تلك التي تشمل SAM، الذي يظهر على شكل قبة من الخلايا محاطة براعم نبات.
- أقسام جبل على الشرائح.
- مكان الشرائح التي هي مناسبة لLM (إما ريبونوكلياز مجانا أوخبز) على 42 درجة مئوية الشريحة الأكثر دفئا وتطبيق عدة قطرات من 50٪ من محلول الإيثانول لتغطية الشريحة.
- تطفو أقسام على حل الإيثانول حتى توسعت الأقسام.
ملاحظة: العائمة أقسام على حل الإيثانول بدلا من الماء يحافظ الحمض النووي الريبي في دولة عجلت الحد من تدهور RNA. - إمالة الشريحة وإزالة الزائد الحل الايثانول بواسطة الشفط مع ماصة نقل القابل للتصرف. استخدام مناديل خالية من الوبر إلى ذبالة بعيدا أي حل الإيثانول إضافية.
- الشرائح الجافة في 42 درجة مئوية لعدة ساعات أو طوال الليل. متجر الشرائح في 4 درجات مئوية في وعاء محكم مع هلام السيليكا.
- Deparaffinize الشرائح في يوم من الاستخدام.
- إعداد ثلاث عبوات زجاجية تحتوي على Coplin. 100٪ الزيلين (الزايلينات الأول)، و 100٪ الزيلين (الزايلينات الثاني)، والإيثانول بنسبة 100٪ (~ 50 مل من كل حل).
- باستخدام ملقط نظيفة لنقل الشرائح، وتزج الشرائح في الزيلين أنا لمدة 2 دقيقة، الزايلينات الثاني لمدة 2 دقيقة، و 100 الإيثانول٪ لمدة 1 دقيقة.
- استنزاف انزلقوفاق على مناديل خالية من الوبر والهواء الجاف في درجة حرارة الغرفة.
3. تسليخ مجهري بليد، اللسيناء وغمد عينات من فترة تتابع النمو 7 ورقة براعم
- تأمين الشرائح على خشبة المسرح المجهر LM. استخدام خمسة أو ستة الشرائح لكل تكرار، وذلك باستخدام خمسة أقسام لكل شريحة.
ويتضح الأنسجة تجميع لتكرار واحد في الشكل (5): ملاحظة. - فحص الشرائح وتحديد الأجزاء الخمسة الأكثر الوسيط في كل شريحة باستخدام SAM قمة كنقطة مرجعية مركزية.
ملاحظة: يمكن أن يتم ذلك في تضخم منخفضة، وعادة ما يكون الهدف 5X كافية. - باستخدام 10X أو 20X الهدف، وتحديد موقف اللسيناء على ورقة منشم فترة تتابع النمو 7 من كل قسم. سوف اللسيناء تكون واضحة كما نتوء بارز من سطح متجه نحو المحور من منشم ورقة. بمناسبة هذا الموقف باستخدام أداة الرسم من البرنامج LM. حدد رمز القلم الرصاص، حرك المؤشر إلى positi المناسبعلى وانقر واسحب الماوس لرسم.
ملاحظة: الهدف 20X 10X أو غير مناسبة لهذا والخطوات اللاحقة. عند استخدام قطاعات جانبية، فإن الجانبين من كل منشم ورقة تكون موجودة في كل قسم (الشكل 2A). - باستخدام أداة الحاكم وأداة رسم مستطيل، قياس 100 ميكرون مستطيلات عالية تتمحور حول اللسيناء من كل قسم (المستطيلات الحمراء، الشكل 2A، 2B). سوف تكون هذه هي "اللسيناء" عينة.
- استخدام أداة الحاكم. حدد رمز المسطرة، تحريك المؤشر إلى نهاية واحدة من الكائن إلى أن تقاس، انقر واسحب لقياس الكائن. وسيتم عرض وطول المسطرة على الشاشة.
- لرسم مستطيل. حدد رمز مستطيل، حرك المؤشر إلى النقطة التي ستكون إحدى زوايا المستطيل، انقر واسحب لرسم مستطيل من الحجم المناسب. بدلا من ذلك، حدد أداة رسم خط مستقيم ورسم أربعة خطوط مستقيمة.
- قياس 100 ميكرون المستطيلات المتمركزة 50 ميكرون فوق وتحت المستطيل "اللسيناء".
ملاحظة: وسوف تكون هذه "بليد" والعينات "غمد"، على التوالي (الأخضر والأزرق المستطيلات، الشكل 2A، 2B). استنادا إلى بيانات النسيجية لدينا، ويشمل مستطيل ميكرون 100 منطقة اللسيناء بأكملها. وقد تم اختيار أجزاء يعادل الحجم من النصل والغمد لضمان كميات مماثلة من الأنسجة جمعت لكل منها. تم استخدام الفواصل من 50 ميكرون لضمان عدم وجود نسيج المنطقة اللسيناء يتم تضمين عن غير قصد في النصل أو غمد microdissections.
- Microdissect قياس المستطيلات (الشكل 2D - 2F) 7، 8، 9، وجمع عينات اللسيناء، بليد وغمد في أنابيب منفصلة. استخدام وظيفة قطع الليزر لقطع طريق قسم الأنسجة على طول الخطوط العريضة للالمجال المحدد. استخدام نحو الأرضوظيفة pult لدفع المستطيل الأنسجة خارج الشريحة وإلى غطاء أنبوب (الشكل 2D - 2F).
4. تسليخ مجهري بليد، اللسيناء وغمد متجه نحو المحور البشرة عينات من فترة تتابع النمو 7 ورقة براعم
- تحديد الأقسام واستخدام أداة المسطرة لقياس 100 ميكرون شرائح عالية تتمحور حول اللسيناء فترة تتابع النمو 7، كما هو موضح في القسم 3 (أعلاه).
- حدد فقط خلايا البشرة متجه نحو المحور من كل 100 ميكرومتر عالية "بليد" و "غمد" الجزء (الأخضر والأزرق التحديدات، الشكل 2C) التي تحدد مع أداة رسم. البشرة هي طبقة الخلايا الخارجي؛ الجانب متجه نحو المحور هو الأقرب إلى SAM.
- للحصول على نموذج "اللسيناء"، حدد فقط خلايا عثرة اللسيناء الناشئة كما هو موضح في القسم 3.3 (اختيار الحمراء، الشكل 2C).
- المناطق Microdissect المحدد، جمع بليد، اللسيناء وشياعشر البشرة العينات في أنابيب منفصلة، كما هو موضح في القسم 3.5.
5. تسليخ مجهري لفترة تتابع النمو 6 ورقة براعم من LG1-R والبرية من نوع الأشقاء
- تنمو فصل عائلات متحولة (LG1-R) والنباتات البرية من نوع.
- إصلاح وتبادل لاطلاق النار العملية قمم للLM، كما هو موضح في أقسام 1،2-1،4. إصلاح من النوع البري وقمم تبادل لاطلاق النار متحولة في قارورة منفصلة من أجل الاحتفاظ بها منفصلة. عينات من نفس زرع ينبغي أن تكون ثابتة ومعالجتها لفي الموقع التهجين.
- تحديد حيث يتم نسخها LG1 في البرية من نوع الأشقاء، عن طريق أداء LG1 في الموقع التهجين 6 و 26 و 27. قياس موقف تراكم نسخة LG1 من قاعدة منشم ورقة في عينات متعددة (الشكل 1E).
- استنادا إلى بيانات التهجين، واختيار جزء من بريمو ورقةrdium تشمل المنطقة حيث كتب LG1. في هذه الحالة، 400-900 ميكرون من قاعدة فترة تتابع النمو 6 أوراق براعم (المستطيلات الأرجواني، الشكل 2A).
- Microdissect اختيار جزء من براعم نبات، كما هو موضح في القسم 3.5، وجمع LG1-R والبرية من نوع العينات في أنابيب منفصلة.
6. تطبيق استخراج الحمض النووي الريبي العازلة
- تطبيق 50 ميكرولتر عازلة استخراج الحمض النووي الريبي إلى الأنسجة microdissected والمضي قدما في استخراج الحمض النووي الريبي. تواصل مع استخراج الحمض النووي الريبي، والتضخيم، RNA، بناء مكتبة، والتسلسل والتحليل المعلوماتية الحيوية كما هو موضح في اشارة 6.
النتائج
باستخدام نظام LM المبين في الشكل 2، ما يقرب من 1،000،000-1،500،000 ميكرون 2 من الأنسجة تم جمعها عن كل تكرار في كل خلية طبقات LM (الشكل 5)، و 200،000 ميكرون 2 في تكرار للبشرة LM متجه نحو المحور. تقريبا تم جمعها 2،500،000 ميكرون 2 من الأن...
Discussion
التصميم التجريبي هو عامل حاسم في تجارب الحمض النووي الريبي وما يليها. الاعتبارات الأساسية هي المجال الدقيق (ق) ومرحلة النمو (ق) ليتم تحليلها، وستبذل ما المقارنات. ومن الأهمية بمكان أن نفكر في المقارنات، لأن الإخراج هو عادة قائمة من الجينات التي DE بين اثنين أو أكثر من ا...
Disclosures
The authors have nothing to disclose.
Acknowledgements
الكتاب أشكر S. نازلي لالجارية التعاون وتحفيز المناقشات حول تنمية اللسيناء. ويؤيد هذا العمل من قبل الوطنية للعلوم منح مؤسسة MCB 1052051 وIOS-1848478.
Materials
| Name | Company | Catalog Number | Comments |
| Diethyl pyrocarbonate | Sigma-Aldrich | 159220 | Used for RNase treatment of solutions |
| Razor blades | Electron Microscopy Sciences | 72000 | |
| RNase Zap | Sigma-Aldrich | R2020-250ML | RNase decontamination solution |
| Ethanol absolute 200 proof | Fisher Scientific | BP28184 | |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | |
| Glass vials - 22 ml | VWR | 470206-384 | |
| Xylenes, histological grade | Sigma-Aldrich | 534056-4L | |
| Paraplast plus | Sigma-Aldrich | P3683-1KG | |
| Disposable base molds, 15 mm x 15 mm x 5 mm | VWR | 15154-072 | |
| Embedding rings | VWR | 15154-303 | |
| Silica gel packets | Electron Microscopy Sciences | 71206-01 | Desiccant for storage of paraffin blocks |
| Oven | Fisher Scientific | 15-103-0503 | Oven must maintain temperature of 60 °C |
| Paraffin embedding station | Leica | EG1160 | |
| Microtome | Leica | RM2235 | |
| Slide warmer | Electron Microscopy Sciences | 71317-10 | |
| Coplin jars | Electron Microscopy Sciences | 70316-02 | |
| Laser microdissector | Zeiss | ||
| KIMWIPES™ Delicate Task Wipers | Kimberly-Clark Professional | 34120 | Lint-free wipes for wicking excess solutions from microscope slides |
| Membrane Slide 1.0 PEN | Zeiss | 415190-9041-000 | Slides for laser microdissection |
| Adhesive Cap 200 opaque | Zeiss | 415190-9181-000 | Tubes for laser microdissection |
| PicoPure RNA Isolation Kit | ThermoFisher Scientific | KIT0204 |
References
- Becraft, P. W., Bongard-Pierce, D. K., Sylvester, A. W., Poethig, R. S., Freeling, M. The liguleless-1 gene acts tissue specifically in maize leaf development. Dev Biol. 141 (1), 220-232 (1990).
- Sylvester, A. W., Cande, W. Z., Freeling, M. Division and differentiation during normal and liguleless-1 maize leaf development. Development. 110 (3), 985-1000 (1990).
- Moreno, M. A., Harper, L. C., Krueger, R. W., Dellaporta, S. L., Freeling, M. liguleless1 encodes a nuclear-localized protein required for induction of ligules and auricles during maize leaf organogenesis. Genes Dev. 11 (5), 616-628 (1997).
- Emerson, R. A. The inheritance of the ligule and auricle of corn leaves. Neb. Agr. Exp. Sta. An. Rep. 25, 81-85 (1912).
- Moon, J., Candela, H., Hake, S. The Liguleless narrow mutation affects proximal-distal signaling and leaf growth. Development. 140 (2), 405-412 (2013).
- Johnston, R., et al. Transcriptomic Analyses Indicate That Maize Ligule Development Recapitulates Gene Expression Patterns That Occur during Lateral Organ Initiation. Plant Cell. 26 (12), 4718-4732 (2014).
- Schmid, M. W., et al. A powerful method for transcriptional profiling of specific cell types in eukaryotes: laser-assisted microdissection and RNA sequencing. PLoS One. 7 (1), e29685 (2012).
- Kerk, N. M., Ceserani, T., Tausta, S. L., Sussex, I. M., Nelson, T. M. Laser capture microdissection of cells from plant tissues. Plant Physiol. 132 (1), 27-35 (2003).
- Nakazono, M., Qiu, F., Borsuk, L. A., Schnable, P. S. Laser-capture microdissection, a tool for the global analysis of gene expression in specific plant cell types: identification of genes expressed differentially in epidermal cells or vascular tissues of maize. Plant Cell. 15 (3), 583-596 (2003).
- Marioni, J. C., Mason, C. E., Mane, S. M., Stephens, M., Gilad, Y. RNA-seq: an assessment of technical reproducibility and comparison with gene expression arrays. Genome Res. 18 (9), 1509-1517 (2008).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: a revolutionary tool for transcriptomics. Nat Rev Genet. 10 (1), 57-63 (2009).
- Brooks, L., et al. Microdissection of shoot meristem functional domains. PLoS Genet. 5 (5), e1000476 (2009).
- Cai, S., Lashbrook, C. C. Stamen abscission zone transcriptome profiling reveals new candidates for abscission control: enhanced retention of floral organs in transgenic plants overexpressing Arabidopsis ZINC FINGER PROTEIN2. Plant Physiol. 146 (3), 1305-1321 (2008).
- Li, P., et al. The developmental dynamics of the maize leaf transcriptome. Nat Genet. 42 (12), 1060-1067 (2010).
- Eveland, A. L., et al. Regulatory modules controlling maize inflorescence architecture. Genome Res. 24 (3), 431-443 (2014).
- Takacs, E. M., et al. Ontogeny of the maize shoot apical meristem. Plant Cell. 24 (8), 3219-3234 (2012).
- Aida, M., Ishida, T., Tasaka, M. Shoot apical meristem and cotyledon formation during Arabidopsis embryogenesis: interaction among the CUP-SHAPED COTYLEDON and SHOOT MERISTEMLESS genes. Development. 126 (8), 1563-1570 (1999).
- Ishida, T., Aida, M., Takada, S., Tasaka, M. Involvement of CUP-SHAPED COTYLEDON genes in gynoecium and ovule development in Arabidopsis thaliana. Plant Cell Physiol. 41 (1), 60-67 (2000).
- Takada, S., Hibara, K., Ishida, T., Tasaka, M. The CUP-SHAPED COTYLEDON1 gene of Arabidopsis regulates shoot apical meristem formation. Development. 128 (7), 1127-1135 (2001).
- Nardmann, J., Ji, J., Werr, W., Scanlon, M. J. The maize duplicate genes narrow sheath1 and narrow sheath2 encode a conserved homeobox gene function in a lateral domain of shoot apical meristems. Development. 131 (12), 2827-2839 (2004).
- Bonner, W. A., Hulett, H. R., Sweet, R. G., Herzenberg, L. A. Fluorescence activated cell sorting. Rev Sci Instrum. 43 (3), 404-409 (1972).
- Birnbaum, K., et al. A gene expression map of the Arabidopsis root. Science. 302 (5652), 1956-1960 (2003).
- Brady, S. M., et al. A high-resolution root spatiotemporal map reveals dominant expression patterns. Science. 318 (5851), 801-806 (2007).
- Carter, A. D., Bonyadi, R., Gifford, M. L. The use of fluorescence-activated cell sorting in studying plant development and environmental responses. Int J Dev Biol. 57 (6-8), 545-552 (2013).
- Ruzin, S. E. . Plant microtechnique and microscopy. , (1999).
- Jackson, D., Veit, B., Hake, S. Expression of maize KNOTTED1 related homeobox genes in the shoot apical meristem predicts patterns of morphogenesis in the vegetative shoot. Development. 120, 405-413 (1994).
- Javelle, M., Marco, C. F., Timmermans, M. In situ hybridization for the precise localization of transcripts in plants. J Vis Exp. (57), e3328 (2011).
- Day, R. C., McNoe, L., Macknight, R. C. Evaluation of global RNA amplification and its use for high-throughput transcript analysis of laser-microdissected endosperm. Int J Plant Genomics. , 61028 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved