需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
激光显微切割RNA测序实验设计:从玉米叶片发展的经验分析
摘要
Many developmentally important genes have cell- or tissue-specific expression patterns. This paper describes LM RNA-seq experiments to identify genes that are differentially expressed at the maize leaf blade-sheath boundary and in lg1-R mutants compared to wild-type. The experimental considerations discussed here apply to transcriptomic analyses of other developmental phenomena.
摘要
在发展重要作用的基因往往有空间和/或时间限制的表达模式。通常这些基因转录物不被检测或作为整个植物器官的转录分析差异表达(DE)不识别。激光显微切割RNA测序(RNA LM-SEQ)是一个强大的工具,以确定被取消的具体发展领域的基因。然而,蜂窝结构域的选择microdissect和比较,以及microdissections的精度是该实验的成功至关重要。在这里,两个例子说明了转录实验设计考虑;个LM的RNA-SEQ分析,以确定沿着玉米叶近端-远端轴DE基因,和第二个实验,以确定是-R liguleless1(LG1-R) 的 DE中的基因 突变体与野生型。 ,对这些实验的成功作出贡献的关键因素进行了详细的组织学和SI该区域的涂杂交分析待分析,在相当于发育阶段叶原基的选择,使用形态的地标选择区域用于显微切割,并精确测量畴的显微解剖。本文提供了通过LM RNA测序发育域分析详细的协议。此处呈现的数据说明了如何选择用于显微切割的区域会影响获得的结果。
引言
玉米叶是研究形态发生过程发展领域的形成一个理想的模型,因为它具有在刀片和鞘是服从遗传解剖( 图1A)之间有明显的边界。期间叶发育,较小的细胞的线性带的早期阶段,preligule带(PLB),细分叶原基成预刀片和预鞘域。刘海状叶舌和三角耳从PLB( 图1A,C,D)制定。遗传筛选已经确定了破坏刀片鞘边界突变。例如,隐性liguleless1(LG1)突变删除叶舌和耳廓1,2,3,4( 图1B)。 原位杂交透露,LG1成绩单积累的PLB和新兴叶舌,使其成为一个很好的标志物叶舌开发5,6( 图1E)。
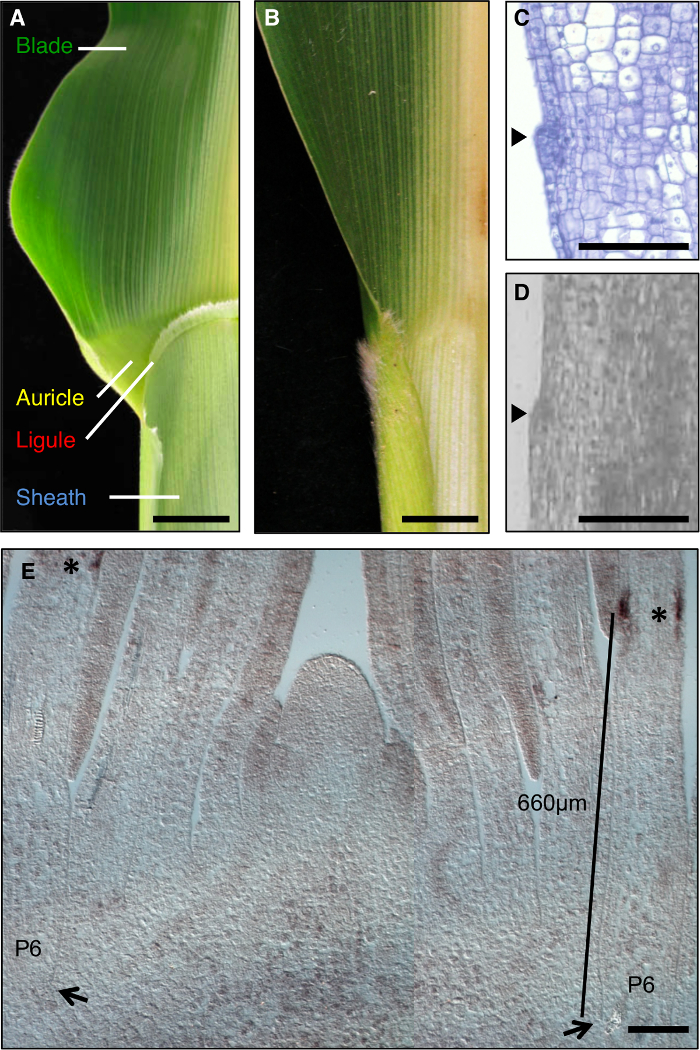
图1:野生型和 liguleless1-R 玉米叶片。 (A)显示叶舌和耳廓的结构成熟的野生型叶刃鞘边界区域。 (B)成熟liguleless1-R叶表现没有叶舌和耳廓结构的叶片,鞘边界区域。在A和B的叶子已经被削减了一半沿中脉。 (C)通过纵野生型叶原基部分。样本已被处理和染色用于组织学分析。发起叶舌是从叶(箭头)的平面中突出的凸起显而易见。 (D)纵向教派通过野生型叶原基离子。如在文本中所描述的样品已被处理为LM。箭头指示发起叶舌。 (E) 在LG1茎尖外侧纵截面的原位杂交。星号表示在P6叶原基的PLB LG1成绩单积累。箭头指示P6原基的基地。律师表示从原基小巴的基本测量。在A和B比例尺= 20毫米。在CE比例尺= 100微米。这个数字已经从6参考(植物生物学家著作权协会)修改。 请点击此处查看该图的放大版本。
在这项研究中,LM RNA测序是采用叶片鞘边界相对于所述叶原基和IDE其他部分在识别基因的套件,差异表达(DE) ntify基因是DE在LG1-R的突变体相对于野生型同胞。 LM RNA测序是在特定细胞或细胞结构域7定量转录物积累的方法。直线运动系统结合了激光器和用数码相机拍摄的显微镜。切片组织被固定在载玻片上,并通过显微镜观察。该软件LM通常包括绘图工具,允许用户在任何勾勒出选定的区域进行显微切割。激光切口沿着线,并且所选组织被弹射出滑动并进入悬挂在滑动上方的管中。 LM允许用户microdissect精确域,包括特定的细胞层和甚至单个细胞8,9。的RNA随后可以从显微组织中提取。随后,RNA测序组件利用下一代测序测序从提取的RNA 10产生cDNA文库,="外部参照"> 11。
LM RNA测序的主要优点是能够量化精确定义的域成绩单的积累能力,来分析整个转录同时7的能力。该技术特别适合于探测早期发育事件,其中所述感兴趣区域是经常微观。先前的研究已利用的LM与微阵列技术相结合,研究在植物9,12,13的发育过程。 RNA测序具有在宽的动态范围,包括低表达基因定量转录物的优点,和现有序列信息不要求10,11。此外,LM RNA-SEQ有突出由于遗传冗余或到的杀伤力损失OF-可以在诱变筛选错过发育的重要基因的潜力功能突变体。
发育重要的基因,如窄护套1(NS1)和杯形cotyledon2(CUC2),通常具有的只是一个具体的表达模式或几个电池单元17,18,19,20。许多仅在早期发育阶段,而不是在成熟器官中表达。当整个器官或大结构域进行了分析,这些细胞特异性转录物稀释并可能无法在更常规的分析进行检测。通过允许精确限定域的分析,LM RNA测序使得这些组织特异性基因被识别和量化。
在这里描述的实验中的成功的关键因素是一个彻底的组织学分析是指导用于分析的合适的发育阶段和域的选择,以及精确measureme对于LM细胞组织域的NT。以确保等效域进行采样的所有重复,组织是从叶原基在相同发育阶段收集和显微结构域诸如新兴叶舌( 图2),测定相对于形态的地标。已知的是某些基因在从尖端到叶的基部的梯度表示。通过测量精确域的变化,由于从沿叶近端-远端轴线的不同位置取样保持为最小( 图3A)。由microdissecting大小相同的域,由于变异差分细胞特异性转录物的稀释也减少( 图3B)。茎尖的外侧纵切片用于所有microdissections。这些是垂直于脉利润率轴线( 图4)的部分。只使用部分包含了SAM确保能等效侧向地区叶原基进行了分析。
在处理和切片用于LM样品,叶舌向外生长的第一形态迹象是在近轴侧的凸点由于在近轴表皮( 图1D, 图2)平周细胞分裂。它被确定新兴叶舌可以在plastochron 7阶段叶原基可靠地识别。我们感兴趣的整个叶舌区域表达的基因,包括新兴叶舌并将细胞立即远侧将形成耳廓。为了确保等效组织的选择进行了改造,所述叶舌凸点被用作形态学里程碑,被选定为LM( 图2A,2B)中心的叶舌凸点100微米的矩形。从同一叶原基被预先选定的叶片和预鞘的等效尺寸矩形。
liguleless突变体的分析提出了不同的challeNGE; LG1-R突变体不形成舌,因此该形态特征不能被用于选择该区域的LM。相反,在野生型叶原基LG1转录积累的域被确定,并且被定义,将包含此结构域的区域。作为被用于最终分析这些初步分析在幼苗从同一种植进行的,因为以前的工作已经表明,PLB的位置取决于生长条件。 原位杂交表明LG1转录本P6的PLB的叶原基( 图1E)累积。我们选择了一个域400-900微米从涵盖LG1表达式的域(紫色长方形, 图2A)和捕获野生型和LG1-R的植物,这些等效区域的叶原基的基础。为了比较转录时尽量减少遗传背景和生长条件的变化在LG1-R和野生型植物,分离的突变体和野生型同胞家属牛逼积累量使用。
研究方案
注意:在同一时间,组织被固定LM修复组织学分析的组织。检查形态特征,将引导后期LM染色切片。当比较突变体与野生型,执行原位杂交或免疫定位以限定的目的基因表达的结构域(在这种情况下,LG1)。
1.组织固定和处理
- 种植玉米苗单位两周标准条件下,6岁。
- 解剖横向截面( 图4)茎尖。
- 消费税只是育苗土壤线以下。
- 用刀片,从杆(削减1, 图4A)的底部除去薄片直到被一个或两个成熟叶片包围秆的椭圆是可见的( 图4B)。
- 进行另一个切割约10mm基部上述(切割2, 图4A)。这10毫米段将包含SAM和年轻的叶原基。
- 转10mm的段,因此基本朝上。使平行于横向轴线两个切口,使得获得的组织2-3毫米厚的片(切口3和4中, 图4B)。丢弃外两部分,并保留中心切片进行固定并包埋。
注:菜帮可能会被裁剪并丢弃。
- 修复组织和流程嵌入。
- 确保在随后的步骤中使用的所有材料都是无RNA酶的。治疗与焦碳酸二乙酯(DEPC)溶液(每升溶液1 DEPC。偶尔晃动,并且高压釜孵育过夜)。烘烤玻璃器皿在200℃的烘箱或至少6小时更高和治疗塑料制品用RNase去污溶液。
- 第1天:在冰上的玻璃小瓶浸入组织切片〜10毫升农民的修复(醋酸3:1乙醇)。所有样品都被解剖后,将VACUU米到除去气泡和固定剂的助剂渗透。真空下保持10分钟,然后释放真空慢。更换固定液,并在4℃下轻轻摇动孵育过夜。
- 第2天:孵育以下一系列的解决方案,〜每次10毫升,每次1小时,所有轻轻摇动;在4℃下,在4℃下,在4℃下,在4℃下,在4℃下100%的乙醇100%的乙醇100%乙醇95%乙醇,1 85%乙醇:1乙醇:在室温下二甲苯,在室温下100%二甲苯中,在室温100%二甲苯。
注:二甲苯是通过接触和吸入有毒。在通风橱中工作,并使用合适的手套。 - 石蜡组织包埋剂粒料添加到二甲苯的大约一半体积,并在室温轻轻摇动孵育过夜。
- 第3天:所述小瓶转移到60℃的烘箱直至粒料熔化。倒出溶液,用新鲜融化的组织包埋剂代替。改变介质两次白天。
- 第4天:改变组织在上午一度包埋剂。回到60℃烘箱中,直到下午。
- 铸造块
- 将嵌入模具上嵌入组织站的热点板块。使用镊子组织样本转移到用切面朝下嵌入模具。顶部与熔化石蜡模具,并放置在嵌入环在模具的顶部。转移到冷板,直到石蜡凝固。存储在用硅胶密闭容器在4℃的石蜡块。
2.切片和幻灯片准备
- 削减切片机25 10微米的部分。
- 检查色带,并选择中间部分。位部分是包括在SAM,显示为通过叶原基包围细胞的圆顶。
- 在幻灯片上安装的部分。
- 地方幻灯片适合于LM(无论是无RNA酶的或烤)上42℃下滑动温暖及申请的50%乙醇溶液几滴以覆盖滑动。
- 浮在乙醇溶液部分,直到部分扩大。
注:乙醇溶液,而不是浮在水面的部分保持RNA的沉淀状态,减少RNA降解。 - 倾斜滑动并取下吸过量的乙醇溶液用一次性移液管。使用不起毛的抹布吸走任何额外的乙醇溶液。
- 在42℃下干燥载玻片数小时或过夜。商店在用硅胶气密容器滑动于4℃。
- Deparaffinize上滑动,使用的当天。
- 准备包含三个玻璃罐子科普林; 100%二甲苯(二甲苯I)中,100%的二甲苯(二甲苯Ⅱ),和100%的乙醇(〜各50毫升溶液)。
- 用清洁的镊子转移幻灯片,在二甲苯浸泡幻灯片我2分钟,二甲苯二为2分钟,1分钟100%的乙醇。
- 排水下滑在室温下无绒抹布和空气干燥上课。
3.从Plastochron 7叶原基叶片,叶舌和护套样品显微切割
- 安全LM显微镜阶段的幻灯片。使用五六个幻灯片每个重复,利用每张幻灯片五个部分。
注:组织汇集为一个复制在图5中示出。 - 检查幻灯片和识别每张幻灯片上五个最中间的部分,采用了SAM顶点为中心参考点。
注意:此可在低倍率进行,通常是5X目标是足够的。 - 使用10X或20X的目标,识别每个部分的plastochron 7叶原基的叶舌的位置。叶舌会从叶原基的近轴面突出凹凸可见。标记使用LM软件的绘图工具这一立场;选择铅笔图标,将光标移动到相应的POSITI上单击并拖动鼠标绘制。
注:10X 20X或目标是合适的,这和后续步骤。当使用侧部,每个叶原基的两侧将存在于每一个部分( 图2A)。 - 使用标尺工具和矩形绘图工具,测量100微米中心上每一节的叶舌高矩形(红色矩形, 图2A,2B)。这些都将是"叶舌"样本。
- 要使用标尺工具;选择标尺图标,将光标移动到物体的一端进行测量,单击并拖动来衡量的对象。尺子的长度将在屏幕上显示。
- 要绘制矩形;选择矩形图标,将光标移动到一个点,这将是矩形的一个角落里,单击并拖动画出适当大小的矩形。或者,选择直线绘图工具,绘制四条直线。
- 措施100微米的矩形定位为50μm以上和以下的"叶舌"矩形。
注意:这些将是"刀锋"和"鞘"的样品,分别为(绿色和蓝色的矩形, 如图2A,2B)。根据我们的组织学数据,一个100微米的矩形包含整个叶舌区域。被选为叶片和叶鞘的等效大小的部分,以保证采集组织类似数额为每个。为50微米间隔物使用,以确保没有叶舌区域组织无意中包含在叶片或鞘microdissections。
- Microdissect测量矩形( 图2D - 2F)7,8,9,收集叶舌,刀片和鞘样品在分开的管中。使用激光切割功能通过沿所选择的域的轮廓的组织部分进行切割。使用CATAPULT功能推动组织的矩形断滑动并进入管( 图2D - 2F)的盖子。
4.从显微切割7 Plastochron叶原基叶片,叶舌和鞘近轴表皮样的
- 选择部分,并用尺子工具测量100微米高段集中在plastochron 7叶舌,在第3节(上图)描述。
- 通过使用绘图工具概述只选择每100微米高的"刀锋"和"鞘"段(绿色和蓝色选择, 图2C)的近轴表皮细胞。表皮是外细胞层;近轴侧是最靠近SAM中之一。
- 对于"叶舌"的样品,选择如第3.3(红色选择, 图2C)中描述的新兴叶舌隆起只有细胞。
- Microdissect选定区域,采集叶片,叶舌和乳木果日表皮分离的试管样品,如3.5节所述。
5. LG1-R和野生型同胞显微切割Plastochron 6叶原基的
- 分离生长突变体(LG1-R)和野生型植物的家庭。
- 修复和处理茎尖为LM,如第1.2-1.4描述。修复,以保持他们单独野生型和单独的小瓶突变茎尖。从相同种植样品应固定和原位杂交处理以。
- 确定LG1在野生型同胞转录, 通过原位杂交6,26,27执行LG1。测量从多个样本( 图1E)在叶原基的基础LG1成绩单积累的位置。
- 原位杂交数据基础上,选择叶普里莫的一部分rdium即包括其中LG1被转录的区域。在这种情况下,从plastochron 6叶原基(紫色矩形, 图2A)的基400-900微米。
- Microdissect选择叶原基的部分,如3.5节所述,在单独的试管收集LG1-R和野生型样本。
6.应用RNA提取液
- 应用50微升RNA提取缓冲显微组织和RNA提取进行。用RNA提取,RNA扩增,文库构建,测序和生物信息学分析继续参考6描述。
结果
使用图2所概述的LM方案中,约1,000,000-1,500,000微米2组织中收集的每个中的所有单元层LM复制( 图5),200,000微米2每复制为近轴表皮LM。大约组织2,500,000微米2收集对每个在LG1-R和野生型叶原基的LM复制。两轮线性RNA扩增得到微克量的RNA的每个重复。从任何给定的显微解剖获得的RNA的量将依赖于细胞大小和转录活性以及所...
讨论
实验设计是在RNA-SEQ实验的关键因素。主要问题是精确域和发育阶段(多个)进行分析,和什么比较将进行。这是认为在比较而言是至关重要的,因为输出是通常被两个或多个条件之间DE基因的列表。如同所有的实验中,在一个时间,以改变只有一个变量是重要的。例如,比较不同的叶域时,叶片的相同年龄和发育阶段,在同样的条件下生长,应比较。
这些实验的目的是,以?...
披露声明
The authors have nothing to disclose.
致谢
作者感谢S.哈克对正在进行的合作,推动就叶舌发展的讨论。这项工作是由美国国家科学基金会资助MCB 1052051和IOS-1848478的支持。
材料
| Name | Company | Catalog Number | Comments |
| Diethyl pyrocarbonate | Sigma-Aldrich | 159220 | Used for RNase treatment of solutions |
| Razor blades | Electron Microscopy Sciences | 72000 | |
| RNase Zap | Sigma-Aldrich | R2020-250ML | RNase decontamination solution |
| Ethanol absolute 200 proof | Fisher Scientific | BP28184 | |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | |
| Glass vials - 22 ml | VWR | 470206-384 | |
| Xylenes, histological grade | Sigma-Aldrich | 534056-4L | |
| Paraplast plus | Sigma-Aldrich | P3683-1KG | |
| Disposable base molds, 15 mm x 15 mm x 5 mm | VWR | 15154-072 | |
| Embedding rings | VWR | 15154-303 | |
| Silica gel packets | Electron Microscopy Sciences | 71206-01 | Desiccant for storage of paraffin blocks |
| Oven | Fisher Scientific | 15-103-0503 | Oven must maintain temperature of 60 °C |
| Paraffin embedding station | Leica | EG1160 | |
| Microtome | Leica | RM2235 | |
| Slide warmer | Electron Microscopy Sciences | 71317-10 | |
| Coplin jars | Electron Microscopy Sciences | 70316-02 | |
| Laser microdissector | Zeiss | ||
| KIMWIPES™ Delicate Task Wipers | Kimberly-Clark Professional | 34120 | Lint-free wipes for wicking excess solutions from microscope slides |
| Membrane Slide 1.0 PEN | Zeiss | 415190-9041-000 | Slides for laser microdissection |
| Adhesive Cap 200 opaque | Zeiss | 415190-9181-000 | Tubes for laser microdissection |
| PicoPure RNA Isolation Kit | ThermoFisher Scientific | KIT0204 |
参考文献
- Becraft, P. W., Bongard-Pierce, D. K., Sylvester, A. W., Poethig, R. S., Freeling, M. The liguleless-1 gene acts tissue specifically in maize leaf development. Dev Biol. 141 (1), 220-232 (1990).
- Sylvester, A. W., Cande, W. Z., Freeling, M. Division and differentiation during normal and liguleless-1 maize leaf development. Development. 110 (3), 985-1000 (1990).
- Moreno, M. A., Harper, L. C., Krueger, R. W., Dellaporta, S. L., Freeling, M. liguleless1 encodes a nuclear-localized protein required for induction of ligules and auricles during maize leaf organogenesis. Genes Dev. 11 (5), 616-628 (1997).
- Emerson, R. A. The inheritance of the ligule and auricle of corn leaves. Neb. Agr. Exp. Sta. An. Rep. 25, 81-85 (1912).
- Moon, J., Candela, H., Hake, S. The Liguleless narrow mutation affects proximal-distal signaling and leaf growth. Development. 140 (2), 405-412 (2013).
- Johnston, R., et al. Transcriptomic Analyses Indicate That Maize Ligule Development Recapitulates Gene Expression Patterns That Occur during Lateral Organ Initiation. Plant Cell. 26 (12), 4718-4732 (2014).
- Schmid, M. W., et al. A powerful method for transcriptional profiling of specific cell types in eukaryotes: laser-assisted microdissection and RNA sequencing. PLoS One. 7 (1), e29685 (2012).
- Kerk, N. M., Ceserani, T., Tausta, S. L., Sussex, I. M., Nelson, T. M. Laser capture microdissection of cells from plant tissues. Plant Physiol. 132 (1), 27-35 (2003).
- Nakazono, M., Qiu, F., Borsuk, L. A., Schnable, P. S. Laser-capture microdissection, a tool for the global analysis of gene expression in specific plant cell types: identification of genes expressed differentially in epidermal cells or vascular tissues of maize. Plant Cell. 15 (3), 583-596 (2003).
- Marioni, J. C., Mason, C. E., Mane, S. M., Stephens, M., Gilad, Y. RNA-seq: an assessment of technical reproducibility and comparison with gene expression arrays. Genome Res. 18 (9), 1509-1517 (2008).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: a revolutionary tool for transcriptomics. Nat Rev Genet. 10 (1), 57-63 (2009).
- Brooks, L., et al. Microdissection of shoot meristem functional domains. PLoS Genet. 5 (5), e1000476 (2009).
- Cai, S., Lashbrook, C. C. Stamen abscission zone transcriptome profiling reveals new candidates for abscission control: enhanced retention of floral organs in transgenic plants overexpressing Arabidopsis ZINC FINGER PROTEIN2. Plant Physiol. 146 (3), 1305-1321 (2008).
- Li, P., et al. The developmental dynamics of the maize leaf transcriptome. Nat Genet. 42 (12), 1060-1067 (2010).
- Eveland, A. L., et al. Regulatory modules controlling maize inflorescence architecture. Genome Res. 24 (3), 431-443 (2014).
- Takacs, E. M., et al. Ontogeny of the maize shoot apical meristem. Plant Cell. 24 (8), 3219-3234 (2012).
- Aida, M., Ishida, T., Tasaka, M. Shoot apical meristem and cotyledon formation during Arabidopsis embryogenesis: interaction among the CUP-SHAPED COTYLEDON and SHOOT MERISTEMLESS genes. Development. 126 (8), 1563-1570 (1999).
- Ishida, T., Aida, M., Takada, S., Tasaka, M. Involvement of CUP-SHAPED COTYLEDON genes in gynoecium and ovule development in Arabidopsis thaliana. Plant Cell Physiol. 41 (1), 60-67 (2000).
- Takada, S., Hibara, K., Ishida, T., Tasaka, M. The CUP-SHAPED COTYLEDON1 gene of Arabidopsis regulates shoot apical meristem formation. Development. 128 (7), 1127-1135 (2001).
- Nardmann, J., Ji, J., Werr, W., Scanlon, M. J. The maize duplicate genes narrow sheath1 and narrow sheath2 encode a conserved homeobox gene function in a lateral domain of shoot apical meristems. Development. 131 (12), 2827-2839 (2004).
- Bonner, W. A., Hulett, H. R., Sweet, R. G., Herzenberg, L. A. Fluorescence activated cell sorting. Rev Sci Instrum. 43 (3), 404-409 (1972).
- Birnbaum, K., et al. A gene expression map of the Arabidopsis root. Science. 302 (5652), 1956-1960 (2003).
- Brady, S. M., et al. A high-resolution root spatiotemporal map reveals dominant expression patterns. Science. 318 (5851), 801-806 (2007).
- Carter, A. D., Bonyadi, R., Gifford, M. L. The use of fluorescence-activated cell sorting in studying plant development and environmental responses. Int J Dev Biol. 57 (6-8), 545-552 (2013).
- Ruzin, S. E. . Plant microtechnique and microscopy. , (1999).
- Jackson, D., Veit, B., Hake, S. Expression of maize KNOTTED1 related homeobox genes in the shoot apical meristem predicts patterns of morphogenesis in the vegetative shoot. Development. 120, 405-413 (1994).
- Javelle, M., Marco, C. F., Timmermans, M. In situ hybridization for the precise localization of transcripts in plants. J Vis Exp. (57), e3328 (2011).
- Day, R. C., McNoe, L., Macknight, R. C. Evaluation of global RNA amplification and its use for high-throughput transcript analysis of laser-microdissected endosperm. Int J Plant Genomics. , 61028 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。