A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مستحلب T7 الحمض النووي الريبي البلمرة بوساطة مولتيجين نظام التعبير، بمغس
In This Article
Summary
وتصف هذه الدراسة طرق للتعبير المشترك بوساطة T7 من جينات متعددة من البلازميد واحد في القولونية الإشريكية باستخدام نظام البلازميد بمغس.
Abstract
ويعتبر التعبير المشترك عن بروتينات متعددة أمرا ضروريا بشكل متزايد للبيولوجيا التركيبية، ودراسة مجمعات البروتينات البروتينية، وتوصيف وتسخير المسارات الحيوية. في هذه المخطوطة، يتم وصف استخدام نظام فعال للغاية لبناء أوبيرونات الاصطناعية مولتيجين تحت سيطرة بوليميراز T7 الحمض النووي الريبي. هذا النظام يسمح العديد من الجينات ليتم التعبير عنها في وقت واحد من البلازميد واحد. هنا، مجموعة من أربعة ناقلات ذات الصلة، بمغس-A، بمغس-هيسا، بمغس-K، و بمغكس-هيسك، مع امبيسلين أو كاناميسين مقاومة اختيار علامة (A و K) وإما امتلاك أو تفتقر إلى N- محطة هيكساهستيدين علامة (له) يتم الكشف عنها. يتم توفير بروتوكولات مفصلة لبناء الأوبرونات الاصطناعية باستخدام هذا النظام المتجه جنبا إلى جنب مع البيانات المقابلة، تبين أن نظام القائم على بمغس تحتوي على خمسة جينات يمكن أن تكون شيدت بسهولة واستخدامها لإنتاج جميع البروتينات المشفرة الخمسة في الإشريكية القولونية . هذا الكيسإم والبروتوكول تمكن الباحثين من التعبير بشكل روتيني عن وحدات معقدة متعددة المكونات والمسارات في E. القولونية .
Introduction
ويعتبر التعبير المشترك عن بروتينات متعددة أمرا ضروريا بشكل متزايد، لا سيما في تطبيقات البيولوجيا التخليقية، حيث يجب التعبير عن وحدات وظيفية متعددة 1 ؛ في دراسة البروتينات المجمعات البروتين، حيث التعبير وظيفة غالبا ما تتطلب تعبير مشترك 2 ، 3 ؛ وفي تحديد وتسخير المسارات الحيوية، حيث يجب التعبير عن كل جين في المسار 4 ، 5 ، 6 ، 7 ، 8 . وقد تم تطوير عدد من النظم للتعبير المشترك، وخاصة في الكائن المضيف الكولي القولونية ، الحصان العمل للتعبير المختبري البروتين المؤتلف 9 . على سبيل المثال، يمكن استخدام البلازميدات متعددة مع علامات اختيار مختلفة للتعبير عن البروتينات الفردية باستخدام ثروة من مختلف السابقين ناقلات بريسيون 10 ، 11 . وقد استخدمت أنظمة البلازميد واحدة لتعبير البروتين متعددة إما المروجين متعددة للسيطرة على التعبير عن كل جين 10 ، 12 ؛ أوبيرونات الاصطناعية، حيث يتم ترميز العديد من الجينات على نص واحد 2 ، 13 ؛ أو، في بعض الحالات، جين واحد ترميز ببتيد التي تتم معالجتها في نهاية المطاف بروتيوليتيكالي، مما أسفر عن البروتينات المطلوبة من الفائدة 14 .
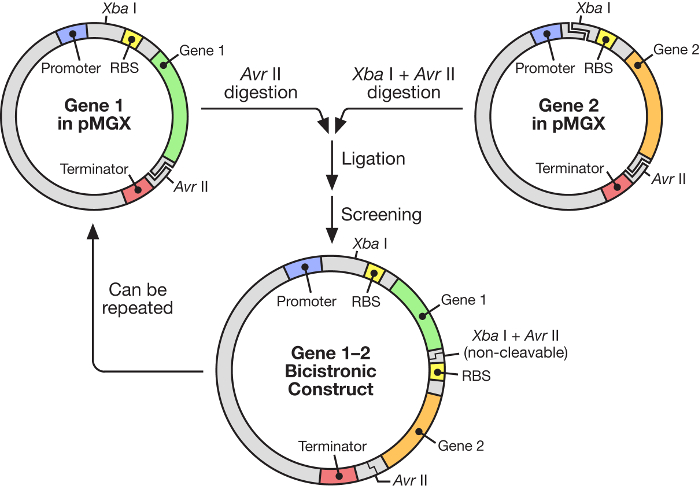
الشكل 1: بمغكس سير العمل تظهر بناء متجه بوليسيسترونيك. يوفر نظام بمغس استراتيجية مرنة وسهلة الاستخدام لبناء الأوبرونات الاصطناعية تحت سيطرة المروج T7 محرض.e.com/files/ftp_upload/55187/55187fig1large.jpg "تارجيت =" _ بلانك "> الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
في هذه المخطوطة، يتم وصف استخدام نظام فعال للغاية لبناء مولدات الجينات الاصطناعية تحت سيطرة T7 الحمض النووي الريبي البلمرة ( الشكل 1 ). هذا النظام يسمح العديد من الجينات ليتم التعبير عنها في وقت واحد من البلازميد واحد. لأنه يقوم على نظام البلازميد، ودعا في الأصل pKH22، التي تم استخدامها بنجاح لعدد من التطبيقات المختلفة 6 ، 7 ، 8 . هنا، يتم توسيع هذه المجموعة البلازميد لتشمل أربعة ناقلات ذات الصلة: بمغس-A، ناقلات التعبير تفتقر إلى أي علامات C- أو N- المحطة ومع علامة مقاومة الأمبيسلين. بمغس-هيسا، ناقلات التعبير ترميز علامة هيكساهستيدين N- محطة ومع علامة مقاومة الأمبيسلين. بمغس-K، ناقلات التعبير lأي علامات C- أو N- محطة ومع علامة مقاومة الكاناميسين. و بمغس-هيسك، ناقلات التعبير ترميز علامة هيكساهستيدين N- محطة ومع علامة المقاومة كانامايسين. في هذه الدراسة، وتظهر طريقة لتوليد ناقلات بوليسيسترونيك التي تحتوي على خمسة الجينات باستخدام نظام بمغكس، تحديدا بمغس-A، جنبا إلى جنب مع الإنتاج الناجح لكل بروتين الفردية في القولونية .
Access restricted. Please log in or start a trial to view this content.
Protocol
1. الحصول على الجينات ذات الاهتمام
- تصميم الجينات الاصطناعية.
- تحسين تسلسل الجينات لتعبير E. القولونية .
- إزالة أي مواقع تقييد مشكلة من تسلسل (أفري، ندي، إكوري، و زباي).
- إدراج مواقع تقييد للاستنساخ؛ موقع 5-ندي و 3'-إكوري الموقع. ويمكن استخدام مواقع أخرى، إذا لزم الأمر؛ الرجوع إلى المنطقة مولتيكلونينغ من البلازميد المحدد ( الشكل S1 -S4 ). إذا رغبت في ذلك، تضمين علامة ترميز 5 'أو 3' للكشف عن البقع الغربية.
- تجاريا ترتيب الجين المصممة.
- إما استنساخ حادة الجين في ناقلات حادة باستخدام مجموعة استنساخ حادة، وفقا لتعليمات الشركة الصانعة. تصميم الاشعال لتضخيم الجين (ثم انتقل إلى الخطوة 1.2.2)؛ أو إضافة 5 'و 3' ينتهي إضافية للاستنساخ المباشر في البلازميد بمغس والانتقال إلى الخطوة 2. هنا، اله النتائج التمثيلية هي من استنساخ حادة الجينات ذات الاهتمام.
- تضخيم الجين المطلوب (من الجينات الاصطناعية مصممة والأمثل أو من الحمض النووي قالب تحتوي على الجين المطلوب) 15 .
- تصميم الاشعال مع مواقع تقييد للاستنساخ. موقع 5-ندي و 3'-إكوري الموقع. ويمكن استخدام مواقع أخرى، إذا لزم الأمر؛ الرجوع إلى المنطقة مولتيكلونينغ من البلازميد المحدد ( الشكل S1 -S4 ). إذا رغبت في ذلك، تضمين إما علامة ترميز 5 'أو 3' للكشف عن لطخة غربية.
- ير تضخيم الجين المطلوب 15 .
- تحليل ير بواسطة أغاروس هلام الكهربائي 16 .
- إذا كان هناك تضخيم غير محددة، وتنظيف الجينات تضخيم عن طريق استخراج هلام. إن لم يكن، استخدم مجموعة تنظيف الانزيم.
- تحديد الحمض النووي باستخدام الطيف عن طريق فحص امتصاصيةe في 260 نانومتر؛ فارغة مع شطف العازلة 17 .
2. استنساخ الجينات ذات الاهتمام في ناقل نظام التعبير مولتيجين، بمغس 18
- تقييد هضم الجينات التي تم الحصول عليها من الفائدة والنواقل المطلوب، بمغس، مع ندي و إكوري.
ملاحظة: إذا تم الحصول على كمية كبيرة من البلازميدات ريسركولاريزد، والسماح للرد فعل ندي على المضي قدما لمدة 1 ساعة قبل إضافة إكوري.- استخدام 40 ميكرولتر هضم رد فعل تحتوي على 0.5-1.5 ميكروغرام من الحمض النووي و 1 ميكرولتر من كل انزيم مع 4 ميكرولتر من العازلة 10X المناسبة.
- للحصول على هضم ندي و إكوري، استخدم المخزن المؤقت إكوري وأول إضافة نديلي نوكلياز. هضم لمدة 1 ساعة عند 37 درجة مئوية. ثم إضافة إكونيلياز إكوري، والسماح لهضم المضي قدما لمدة ساعة إضافية. ندي حساسة للانشقاقات بالقرب من نهاية الحمض النووي، لذلك الهضم الأولي من قبل إكوري يمكن أن تمنع الهضم الفعال من قبل ندي.
- إلكترونياتأوفيوريز الهضم تقييد على هلام الاغاروز (ل 1 كب الجينات، واستخدام هلام الاغاروز 0.7٪ في 110 V لمدة 55 دقيقة؛ لتحديد نسبة من هلام الاغاروز لمختلف أحجام الجينات، الرجوع إلى المرجع 16 .
- إدراج المكوس والعصابات ناقلات باستخدام مشرط نظيفة أو شفرة حلاقة ووضع شريحة هلام استئصال في أنبوب 1.5 مل.
- استخراج الحمض النووي من هلام الاغاروز باستخدام مجموعة استخراج هلام وفقا لبروتوكول الشركة المصنعة.
- ليغات الجين من الفائدة في ناقلات بمغس باستخدام نسبة 3: 1 إدراج إلى متجه. إعداد ربط سلبية من هضم بمغس دون إدراج.
- إعداد 20 ميكرولتر رد فعل ربط تحتوي على 1 ميكرولتر من ليغاز الحمض النووي T4، 0.15-0.5 ميكروغرام من الحمض النووي ناقلات (~ 5 ميكرولتر)، وكمية مناسبة من إدراج على أساس نسبة 3: 1 إدراج إلى متجه وحجم الجين الذي يتم إدراجه. فإن العمود الفقري بمغس بين 5،312 و 5،504 نقطة أساس في الحجم. تضمين رد فعل السيطرة السلبية التي تحتوي على كل شيء بوt الجين الذي يتم إدراجه. تأكد من أن كمية من الحمض النووي متجه ما يعادل في ربط السيطرة السلبية والناقلات بالإضافة إلى إدراج ردود الفعل ربط.
- تحويل ردود الفعل ربط في الخلايا الزرقاء القولونية مختلطة كيميائيا زل 1-الأزرق والبلازميدات ليغاتد pMGX- yfg1 (التي تحتوي على الجينات من الفائدة 1)، PMGX- yfg2 (التي تحتوي على الجينات من الفائدة 2) ... PMGX- يفغن (التي تحتوي على الجينات من الفائدة ن). استخدام تقنية العقيم (داخل مجلس الوزراء السلامة الأحيائية أو تحت لهب).
- ذوبان الجليد 100 أليكوتس ميكرولتر من المختصة كيميائيا XL1-الأزرق E. القولونية على الجليد لمدة 5 دقائق ثم قم بإضافة 5 ميكرولتر من ردود الفعل ربط. احتضان لمدة 30 دقيقة على الجليد.
- الحرارة صدمة الخلايا لمدة 45 ثانية في حمام مائي عقد في 42 درجة مئوية ثم قم بإضافة 200 ميكرولتر من لب الباردة. احتضان لهم على الجليد لمدة 2 دقيقة.
- هز الخلايا عند 37 درجة مئوية، 220 دورة في الدقيقة لمدة 1 ساعة ثم تنتشر لوحة 100 ميكرولتر على لوحة لب-أجار تحتوي على موافقة(إما امبيسيلين أو كانامايسين).
- شاشة استنساخ لمحولات إيجابية.
- قارن التهم مستعمرة على لوحات التحكم والربط السلبية. مطلوب نسبة عدد مستعمرة أكبر من 1: 2. إذا كان هناك عدد كبير من المستعمرات على لوحة التحكم السلبية، والعودة إلى الخطوة 2.1 ومراجعة المذكرة.
- حدد 4-8 المستعمرات الفردية (اعتمادا على السيطرة السلبية: نسبة الربط) من كل رد فعل ربط من الجينات المختلفة المدرجة للفحص (1 ن) وتطعيم 4 مل لب والمضادات الحيوية المناسبة بين عشية وضحاها ثقافة / مستعمرة الفردية. تنمو الثقافات بين عشية وضحاها مع اهتزاز عند 37 درجة مئوية و 220 دورة في الدقيقة.
- عزل الحمض النووي البلازميد باستخدام البلازميد دنا العزلة كيت وفقا لبروتوكول الشركة المصنعة.
- إعداد 20 ميكرولتر ندي + إكوري هضم رد فعل تحتوي على 150-500 نانوجرام من الحمض النووي و 1 ميكرولتر من كل انزيم مع 2 ميكرولتر من العازلة 10X المناسبة. في ثهو حالة، إضافة ندي و إكوري في نفس الوقت أن الجين من الفائدة سيكون بين مواقع تقييد. ويوصى السيطرة السلبية مع ناقلات بمغس فارغة. هضم لمدة 2 ساعة عند 37 درجة مئوية في حمام مائي.
3. إدراج جين 2 في ناقلات بمغس تحتوي على جين 1، PMGX- yfg1
- هضم تقييد PMGX- yfg1 مع أفري وعلاج مع الفوسفاتيز المعوية الساق (سيب).
- استخدام رد فعل هضم 40 ميكرولتر تحتوي على 0.5-1.5 ميكروغرام من الحمض النووي ناقلات (~ 5-10 ميكرولتر من الحمض النووي المعزول) و 1 ميكرولتر من أفري مع 4 ميكرولتر من العازلة 10X المناسبة. هضم لمدة 1.5 ساعة عند 37 درجة مئوية ثم قم بإضافة 1.5 ميكرولتر من سيب. اتركه عند 37 درجة مئوية لمدة 30 دقيقة إضافية.
- تقييد هضم PMGX- yfg2 مع أفري و زباي لتحرير الجين من الفائدة.
- استخدام 40 ميكرولتر هضم رد فعل تحتوي على 0.5-1.5 ميكروغرام من الحمض النووي و 1 μ؛ L من كل انزيم مع 4 ميكرولتر من المخزن المؤقت المناسب10x. هضم لمدة 2 ساعة عند 37 درجة مئوية.
- تقييد هيدروكوريز هضم على نسبة مناسبة (0.7٪) الاغاروز هلام والمكوس إدراج والعناصر ناقلات باستخدام مشرط نظيفة / شفرة حلاقة (راجع الخطوات 2.2-2.3).
- استخراج الحمض النووي باستخدام مجموعة استخراج هلام وفقا لبروتوكول الشركة المصنعة وتحديد الحمض النووي 17 .
- ليغات 2 في pmGX- yfg1 باستخدام نسبة 3: 1 إدراج إلى متجه. إعداد ربط سلبي من PMGX- yfg1 هضمها دون إدراج إضافية. الإعداد كما هو موضح أعلاه في الخطوة 2.5.
- تحويل 5 ميكرولتر من ردود الفعل ربط خلايا XL1-الأزرق المختصة كيميائيا E. القولونية ، ليغاتد البلازميدات pMGX- yfg1،2 (التي تحتوي على الجينات في المصالح 1 و 2)، والسيطرة السلبية PMGX- yfg1 ، كما هو موضح في الخطوة 2.6.
- قارن عدد المستعمرات على لوحات التحكم والربط السلبية. نسبة عدد المستعمرات gريتر من 1: 2 هو المطلوب. إذا كان هناك عدد كبير من المستعمرات على لوحة التحكم السلبية، والعودة إلى الخطوة 3.1 ومراجعة العلاج سيب.
- حدد 4-8 المستعمرات الفردية (اعتمادا على السيطرة السلبية: نسبة الربط) من رد فعل ربط وتطعيم 4 مل من لب بالإضافة إلى المضادات الحيوية المناسبة لكل مستعمرة الفردية وتنمو بين عشية وضحاها في 37 درجة مئوية و 220 دورة في الدقيقة.
- عزل الحمض النووي البلازميد باستخدام البلازميد دنا العزلة كيت وفقا لبروتوكول الشركة المصنعة وتحديد الحمض النووي 17 .
- شاشة الإدراج الفعال للجين الثاني من خلال تنفيذ هضم تقييد pMGX- yfg1،2 مع إكوري.
- استخدام 20 ميكرولتر هضم رد فعل تحتوي على 150-500 نانوغرام من الحمض النووي و 1 ميكرولتر من انزيم إكوري مع 2 ميكرولتر من إكوري العازلة 10X. هضم لمدة 2 ساعة عند 37 درجة مئوية.
- إليكتروفوريز هضم تقييد على نسبة مناسبة هلام الاغاروز. والبحث عن الفرقة التي تتوافقs إلى حجم الجين 2 (انظر الخطوة 2.2). قد يدخل الجين في المتجه في الاتجاه غير المرغوب فيه، عكس.
4. إضافة الجين الثالث في ناقلات بمغس تحتوي على الجينات 1 و 2، PMGX- yfg1،2
- هضم تقييد PMGX- yfg1،2 مع أفري وعلاج مع سيب، كما هو موضح في الخطوة 3.1.
- هيمستريكتيون ديجيست pMGX- yfg3 مع أفري و زباي، كما هو موضح في الخطوة 3.2.
- إليكتروفوريز هضم قيود على نسبة مناسبة هلام الاغاروز والمكوس إدراج والعصابات ناقلات باستخدام مشرط نظيفة / شفرة حلاقة. راجع الخطوات 2.2-2.3.
- استخراج الحمض النووي من هلام الاغاروز باستخدام مجموعة استخراج هلام وتحديد الحمض النووي 17 .
- ليغات 3 في pmGX- yfg1،2 باستخدام نسبة 3: 1 إدراج إلى ناقلات وإنشاء ربط سلبي من هضم PMGX- yfg1،2 دون إدراج إضافية، كما هو موضح في الخطوة 3.5.
- تحويل 5 ميكرولتر من ردود الفعل ربط في زل1-الزرقاء مختصة كيميائيا E. كولاي الخلايا، ليغاتد البلازميد pmGX- yfg1،2،3 (التي تحتوي على الجينات ذات الاهتمام 1 و 2 و 3)، والسيطرة السلبية PMGX- yfg1،2 ، كما هو موضح في الخطوة 2.6.
- قارن عدد المستعمرات على لوحات التحكم والربط السلبية. إذا كان هناك عدد كبير من المستعمرات على لوحة التحكم السلبية، والعودة إلى الخطوة 4.1 ومراجعة العلاج سيب.
- حدد 4-8 المستعمرات الفردية (اعتمادا على السيطرة السلبية: نسبة الربط) من رد فعل ربط وتطعيم 4 مل من لب بالإضافة إلى المضادات الحيوية المناسبة لكل مستعمرة الفردية. تنمو بين عشية وضحاها في 37 درجة مئوية و 220 دورة في الدقيقة.
- عزل الحمض النووي البلازميد باستخدام البلازميد دنا العزلة كيت وفقا لبروتوكول الشركة المصنعة.
- شاشة الإدراج الفعال للجين الثالث من خلال تنفيذ هضم تقييد pmGX- yfg1،2،3 مع إكوري، كما هو موضح في الخطوة 3.10.
- إليكتروفوريز هضم تقييد على نسبة مناسبة هلام الاغاروز. نظرةللعصابات التي تتوافق مع أحجام الجين 2 والجين 3 (انظر الخطوة 2.2). ملاحظة: قد يدخل الجين 3 في المتجه في الاتجاه غير المرغوب فيه، عكس. إذا كانت الجينات 2 و 3 بنفس الحجم، فيجب تحديد موقع آخر لهيكل تقييد مناسب للفحص.
ملاحظة: كرر حسب الحاجة لكل جين جديد.
5. إنتاج بروتينات الفائدة باستخدام نظام التعبير مولتيجين وتقييم الإنتاج من قبل الغربية النشاف
- تحويل استنساخ إيجابي يحتوي على جميع الجينات ذات الاهتمام في كفاءة كيميائيا، والبروتين إنتاج E. القولونية ، مثل BL21- (λDE3).
- ذوبان الجليد 100 قسامة ميكرولتر من BL21- المختصة كيميائيا (λDE3) E. القولونية على الجليد لمدة 5 دقائق ومن ثم إضافة 1 ميكرولتر من الحمض النووي البلازميد المستنسخة إيجابية. احتضان لمدة 30 دقيقة على الجليد.
- صدمة الحرارة الخلايا لمدة 45 ثانية في حمام مائي عقد في 42 درجة مئوية ثم قم بإضافة 200 ميكرولتر من لب الباردة. احتضان على الجليد لمدة 2 دقيقة.
- هز الخلايا عند 37 درجة مئوية و 220 دورة في الدقيقة لمدة 1 ساعة ثم تنتشر لوحة 100 ميكرولتر على لوحة لب-أجار تحتوي على علامة اختيار المناسبة (امبيسيلين أو كانامايسين).
- التعبير عن البروتين عن طريق إيسوبروبيل-β-D-1-ثيوغالاكتوبيرانوسيد (إيبت) الحث.
- حدد مستعمرة معزولة من لوحة التحول B21- (λDE3) وتطعيم 4 مل من لب بالإضافة إلى المضادات الحيوية المناسبة. تنمو بين عشية وضحاها، والهز عند 37 درجة مئوية و 220 دورة في الدقيقة.
- تطعيم 100 مل لب بالإضافة إلى ثقافة المضادات الحيوية المناسبة باستخدام 1 مل من الثقافة بين عشية وضحاها.
- تنمو عند 37 درجة مئوية مع اهتزاز في 220 دورة في الدقيقة إلى أود 600 من 0.6.
- إغناء الثقافة مع 100 ميكرومتر إيبت وتنمو لمدة 15 ساعة عند 25 درجة مئوية و 220 دورة في الدقيقة.
- إزالة 1 مل من الثقافة وأجهزة الطرد المركزي في 13000 x ج لمدة 1 دقيقة. تجاهل طاف.
- ليس الخلايا باستخدام حل تحلل وفقا لتعليمات الشركة الصانعةوتشكيل لطخة غربية من المحللة الخلية القابلة للذوبان لتحديد ما إذا كانت جميع البروتينات أنتجت بنجاح 19 .
Access restricted. Please log in or start a trial to view this content.
النتائج
في هذه الدراسة، كان الهدف هو المشاركة في التعبير عن خمسة بروتينات من البلازميد واحد. وقد تم شراء الشظايا الاصطناعية المثلى المكونة من خمسة كودون والتي ترميز إما علامات هيكساهستيدين N- أو C- الطرفية تجاريا. تم تضخيم الجينات الاصطناعية عن طريق ير واستن...
Access restricted. Please log in or start a trial to view this content.
Discussion
ويعتبر التعبير المشترك عن الجينات المتعددة أمرا ضروريا بشكل متزايد، خاصة في تحديد وإعادة تشكيل مسارات الأيض المعقدة المتعددة الأقطاب 3 و 4 و 5 . نظام بمغس يجعل مولتيجين شارك في التعبير في E. القولونية الروتينية
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وقد دعم هذا العمل من قبل مجلس العلوم الطبيعية والهندسة البحوث في كندا.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Enzymes | |||
| Alkaline Phosphatase, Calf Intestinal (CIP) | New England Biolabs | M0290S | |
| AvrII | New England Biolabs | R0174S | |
| EcoRI | New England Biolabs | R0101S | |
| NdeI | New England Biolabs | R0111S | |
| XbaI | New England Biolabs | R0145S | |
| Herculase II Fusion DNA Polymerase | Agilent Technologies | 600677 | |
| T4 DNA Ligase | New England Biolabs | M0202S | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 1 kb DNA ladder | New England Biolabs | N3232L | |
| 4-20% Mini-PROTEAN TGX Stain-Free Protein Gels | Bio-Rad | 456-8095 | |
| 50x TAE | Fisher Thermo Scientific | BP1332-4 | |
| Agar | Fisher Thermo Scientific | BP1423-500 | |
| Agarose | Fisher Thermo Scientific | BP160-500 | |
| Ampicilin | Sigma-Alrich | A9518-5G | |
| BL21 (DE3) chemically comeptent cells | Comeptent cell prepared in house | ||
| B-PER Bacterial Protein Extraction Reagent | Fisher Thermo Scientific | PI78243 | |
| dNTP mix | Agilent Technologies | Supplied with polymerase | |
| Gel Extraction Kit | Omega | D2500-02 | E.Z.N.A Gel Extraction, supplied by VWR Cat 3: CA101318-972 |
| Glycine | Fisher Thermo Scientific | BP381-1 | |
| His Tag Antibody [HRP], mAb, Mouse | GenScript | A00612 | |
| Immobilon Western Chemiluminescent HRP Substrate | EMD Millipore | WBKLS0100 | |
| IPTG | Sigma-Alrich | 15502-10G | |
| LB | Fisher Thermo Scientific | BP1426-500 | |
| Methanol | Fisher Thermo Scientific | A411-20 | |
| Pasteurized instant skim milk powder | Local grocery store | No-name grocery store milk is adequate | |
| Nitrocellulose membrane | Amersham Protran (GE Healthcare Life Sciences) | 10600007 | Membrane PT 0.45 µm 200 mm x 4 m, supplied by VWR Cat #: CA10061-086 |
| Plasmid DNA Isolation Kit | Omega | D6943-02 | E.Z.N.A Plasmid DNA MiniKit I, supplied by VWR Cat #: CA101318-898 |
| pMGX | Boddy Lab | Request from the Boddy Lab Contact cboddy@uottawa.ca | |
| Primers | Intergrated DNA Technologies | Design primers as needed for desired gene | |
| Synthetic Gene | Life Technologies | Design and optimize as needed | |
| Thick Blot Filter Paper | Bio-Rad | 1703932 | |
| Tris base | BioShop | TRS001.1 | |
| Tween-20 | Sigma-Alrich | P9416-50ML | |
| XL1-Blue chemically competent cells | Comeptent cell prepared in house | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| BioSpectrometer | Eppendorf | RK-83600-07 | |
| Gel box - PAGE | Bio-Rad | 1658005 | Mini-PROTEIN Tetra Vertical Electrophoresis Cell |
| Gel Imager | Alpha Innotech | AlphaImager EC | |
| Incubator-oven | Fisher Thermo Scientific | 11-690-650D | Isotemp |
| Incubator-shaker | Fisher Thermo Scientific | SHKE6000-7 | MaxQ 6000 |
| Personna Razors | Fisher Thermo Scientific | S04615 | |
| Power Pack | Bio-Rad | S65533Q | FB300 |
| Transilluminator | VWR International | M-10E,6W | |
| Thermocylcer | Eppendorf | Z316091 | Mastercycler Personal, supplied by Sigma |
| UV Face-Shield | 18-999-4542 | ||
| Waterbath | Fisher Thermo Scientific | 15-460-2SQ | |
| Western Transfer Apparatus | Bio-Rad | 1703935 | Mini-Trans Blot Cell |
References
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nat. Rev. Mol. Cell Biol. 10 (6), 410-422 (2009).
- Bieniossek, C., et al. Automated unrestricted multigene recombineering for multiprotein complex production. Nat. Methods. 6 (6), 447-450 (2009).
- Jochimsen, B., et al. Five phosphonate operon gene products as components of a multi-subunit complex of the carbon-phosphorus lyase pathway. Proc. Natl. Acad. Sci. USA. 108 (28), 11393-11398 (2011).
- Martin, V. J. J., Pitera, D. J., Withers, S. T., Newman, J. D., Keasling, J. D. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids. Nat. Biotechnol. 21 (7), 796-802 (2003).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Boddy, C. N., Hotta, K., Tse, M. L., Watts, R. E., Khosla, C. Precursor-directed biosynthesis of epothilone in Escherichia coli. J. Am. Chem. Soc. 126 (24), 7436-7437 (2004).
- Lundgren, B. R., Boddy, C. N. Sialic acid and N-acyl sialic acid analog production by fermentation of metabolically and genetically engineered Escherichia coli. Org. Biomol. Chem. 5 (12), 1903-1909 (2007).
- Horsman, M. E., Lundgren, B. R., Boddy, C. N. N-Acetylneuraminic Acid Production in Escherichia coli Lacking N-Acetylglucosamine Catabolic Machinery. Chem. Eng. Commun. 203 (10), 1326-1335 (2016).
- Romier, C., et al. Co-expression of protein complexes in prokaryotic and eukaryotic hosts: experimental procedures, database tracking and case studies. Acta Crystallogr. D, Biol. Crystallogr. 62 (Pt 10), 1232-1242 (2006).
- Tolia, N. H., Joshua-Tor, L. Strategies for protein coexpression in Escherichia coli. Nat. Methods. 3 (1), 55-64 (2006).
- Chanda, P. K., Edris, W. A., Kennedy, J. D. A set of ligation-independent expression vectors for co-expression of proteins in Escherichia coli. Protein Expr. Purif. 47 (1), 217-224 (2006).
- Kim, K. -J., et al. Two-promoter vector is highly efficient for overproduction of protein complexes. Protein Sci. 13 (6), 1698-1703 (2004).
- Tan, S., Kern, R. C., Selleck, W. The pST44 polycistronic expression system for producing protein complexes in Escherichia coli. Protein Expr. Purif. 40 (2), 385-395 (2005).
- Chen, X., Pham, E., Truong, K. TEV protease-facilitated stoichiometric delivery of multiple genes using a single expression vector. Protein Sci. 19 (12), 2379-2388 (2010).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J. Vis. Exp. (63), e3998(2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. (62), (2012).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J. Vis. Exp. (48), (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Molecular Cloning. J. Vis. Exp. , Available from: https://www.jove.com/science-education/5074/molecular-cloning (2016).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. J. Vis. Exp. , Available from: https://www.jove.com/science-education/5065/the-western-blot (2016).
- Laible, M., Boonrod, K. Homemade site directed mutagenesis of whole plasmids. J. Vis. Exp. (27), (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved