Method Article
ومن الطرق المباشرة لGlucosinolate استخراج وتحليل مع الضغط العالي اللوني السائل (HPLC)
In This Article
Summary
Here, we describe in great detail an established and robust protocol for the extraction of glucosinolates from ground plant materials. After an on-column sulfatase treatment of the extracts, the desulfoglucosinolates are eluted and analyzed by high-pressure liquid chromatography.
Abstract
Glucosinolates are a well-studied and highly diverse class of natural plant compounds. They play important roles in plant resistance, rapeseed oil quality, food flavoring, and human health. The biological activity of glucosinolates is released upon tissue damage, when they are mixed with the enzyme myrosinase. This results in the formation of pungent and toxic breakdown products, such as isothiocyanates and nitriles. Currently, more than 130 structurally different glucosinolates have been identified. The chemical structure of the glucosinolate is an important determinant of the product that is formed, which in turn determines its biological activity. The latter may range from detrimental (e.g., progoitrin) to beneficial (e.g., glucoraphanin). Each glucosinolate-containing plant species has its own specific glucosinolate profile. For this reason, it is important to correctly identify and reliably quantify the different glucosinolates present in brassicaceous leaf, seed, and root crops or, for ecological studies, in their wild relatives. Here, we present a well-validated, targeted, and robust method to analyze glucosinolate profiles in a wide range of plant species and plant organs. Intact glucosinolates are extracted from ground plant materials with a methanol-water mixture at high temperatures to disable myrosinase activity. Thereafter, the resulting extract is brought onto an ion-exchange column for purification. After sulfatase treatment, the desulfoglucosinolates are eluted with water and the eluate is freeze-dried. The residue is taken up in an exact volume of water, which is analyzed by high-pressure liquid chromatography (HPLC) with a photodiode array (PDA) or ultraviolet (UV) detector. Detection and quantification are achieved by conducting comparisons of the retention times and UV spectra of commercial reference standards. The concentrations are calculated based on a sinigrin reference curve and well-established response factors. The advantages and disadvantages of this straightforward method, when compared to faster and more technologically advanced methods, are discussed here.
Introduction
وتشير التقديرات إلى أن النباتات تنتج أكثر من 200،000 أنواع مختلفة من المركبات الكيميائية 1. فقط أقلية من هذه المركب يبدو أن تلعب دورا في عملية التمثيل الغذائي الأساسي في النباتات، التي النمو الوقود والاستنساخ. الأغلبية هي ما يسمى الأيض الثانوية. وعلى الرغم من اسمها، المركبات الثانوية غالبا ما تكون حاسمة لبقاء النبات والتكاثر، كما أنها تعمل على جذب الملقحات أو للدفاع عن النبات ضد مسببات الأمراض والحيوانات العاشبة 1.
الجلاكوسينولات هي فئة متنوعة جدا من المركبات الثانوية التي تم دراستها لأكثر من 150 سنة (2). حتى الآن، وقد تم تحديد أكثر من 130 الجلاكوسينولات مختلفة هيكليا 3. على نطاق واسع، الجلاكوسينولات يمكن تقسيم إلى فئات مختلفة على أساس الأحماض الأمينية التي تم تجميعها فيها. الجلاكوسينولات الإندول، على سبيل المثال، تم تجميعها من الأحماض الأمينيةالتربتوفان، في حين يوفر الفنيل الأنين الهيكل العظمي قاعدة لتركيب الجلاكوسينولات العطرية 4. ضمن الطبقات، وهناك مستوى عال من التنوع الهيكلي، التي نتجت عن الخطوات سلسلة متتابعة استطالة في مسارات السكروز، كما هو الحال في فئة من الجلاكوسينولات الأليفاتية، أو عن طريق تعديل سلسلة جانبية (على سبيل المثال، الهيدروكسيل) 4، 5. قد تحتوي على أنواع النباتات glucosinolate ما يصل الى 37 الجلاكوسينولات مختلفة تنتمي إلى الطبقات هيكلية مختلفة 6. على الرغم من الأنواع النباتية لها ملامح glucosinolate نموذجية، وكثيرا ما وجد الاختلاف ضمن النوع لأنواع الجلاكوسينولات بين الأفراد والسكان 6 و 7. يتم تخزين الجلاكوسينولات سليمة في فجوات الخلايا النباتية ويمكن العثور عليها في أي جهاز فوق الأرض أو belowground 7 <سوب الطبقة = "XREF"> 8 و 9. على تمزق الخلية (على سبيل المثال، من خلال آكلات العشب)، يتم الافراج الجلاكوسينولات وتختلط مع ميروزيناز الانزيم، ووضع قنبلة زيت الخردل 10. ويرجع ذلك إلى النشاط من ميروزيناز، واعتمادا على هيكل glucosinolate، وظروف التفاعل، ووجود الأنزيمات تعديل، تتشكل مختلفة مركبات لاذعة، سامة، أو ضارة، مثل النيتريلات و(ايزو) thiocyanates 11. المنتجات رد فعل لها نشاطات بيولوجية عالية. على سبيل المثال، أنها بمثابة طارد الحشرات من الحيوانات العاشبة اختصاصي 12. والتوريث والسكروز مسارات الجلاكوسينولات ومدروسة، وذلك أساسا بسبب أهميتها بالنسبة لآكلات العشب ومقاومة العوامل المسببة للأمراض، وقيمتها كعناصر نكهة الخردل في والكرنب (الملفوف)، والسلبية (progoitrin) و (glucoraphanin) آثار إيجابية على صحة الإنسان 5، 13، 14.
بسبب الاهتمام الكبير في الجلاكوسينولات كمركبات والأساليب الفعالة بيولوجيا استخراج والكشف على أساس المرحلة عكس الضغط العالي اللوني السائل (HPLC) مجهزة الأشعة فوق البنفسجية (UV) أو مجموعة الثنائي الضوئي (PDA) للكشف عن استخدمت بشكل شائع منذ 1980s 15 . وبناء على هذه الطريقة، أصدرت الجماعات الأوروبية بروتوكول قياسي الذي تم اختباره والتحقق من صحتها في العديد من المختبرات لتحليل الجلاكوسينولات في البذور الزيتية (الكرنب napus، السلجم، زيت الكانولا 16). وأضاف آخرون إلى هذا الأسلوب (على سبيل المثال، من خلال تحديد العوامل استجابة إضافية لالجلاكوسينولات التي ليست موجودة في الحبوب الزيتية) 17. وعلى الرغم من تزايد توافر اللوني الكتلة الطيفي (LC-MS) منصات السائلة والبروتوكولات الإنتاجية العالية لتحليل glucosinolate 18 ، 19، لا تزال تستخدم طريقة HPLC للأشعة فوق البنفسجية / المساعد الشخصي الرقمي الأصلي على نطاق واسع من قبل العلماء. الأسباب الرئيسية هي أن هذه الطريقة واضحة وفعالة من حيث التكلفة، ويمكن الوصول إليها نسبيا إلى مختبرات دون بنية تحتية واسعة المعرفة الكيميائية التحليلية. لخدمة هذا المجتمع، ونحن هنا بالتفصيل بروتوكول لاستخراج الجلاكوسينولات من المواد النباتية وتحليل desulfo-أشكالها مع HPLC المساعد الشخصي الرقمي.
Protocol
1. إعداد الحلول اللازمة لاستخراج Glucosinolate
- إعداد 500 مل من 70٪ الميثانول (MeOH) في الماء (عالي النقاوة) في زجاجة. 100 عينات و 5 معايير، 420 مل من 70٪ وهناك حاجة MeOH.
- إعداد 20 ملي خلات الصوديوم (NaOAc) (الرقم الهيدروجيني = 5.5) وذلك بإضافة 0.82 غرام من NaOAc أو 1.36 غرام من NaOAc × 3 H 2 O في 500 مل من الماء. ضبط درجة الحموضة مع كلوريد الهيدروجين (حمض الهيدروكلوريك). تخزين NaOAc في الثلاجة. لليحتاج إلى 100 عينات و 5 معايير، 370 مل من 20 ملي NaOAc (الرقم الهيدروجيني = 5.5) في الماء.
- لإعداد المواد عمود، مزج 10 غراما من هلام ديكستران عبر ربط (نوع G-25) مع 125 مل من الماء عالى النقاء. تخزين الخليط الناتج في الثلاجة (4 درجة مئوية).
- إعداد الحل سلفاتاز
- حل 10،000 وحدة من سلفاتاز أريل (نوع H-1 من اللولب pomatia) في 30 مل من الماء عالى النقاء وإضافة 30 مل من الايثانول المطلق (ETOH). مزيج الحل جيدا وتحويلها إلى واحدة تجمع 250 ملأنبوب trifuge أو عدة أنابيب أصغر، اعتمادا على توافر.
- الطرد المركزي الخليط في 2650 x ج لمدة 20 دقيقة في درجة حرارة الغرفة (RT). نقل طاف (ق) إلى دورق. إضافة 90 مل من ETOH ومزجها. أجهزة الطرد المركزي الخليط في واحد أو أكثر أنابيب الطرد المركزي في 1030 x ج لمدة 15 دقيقة في RT.
- تجاهل supernatants. حل والجمع بين حبيبات في ما مجموعه 25 مل من الماء عالى النقاء. دوامة جيدا، الاستغناء في 1 مل أنابيب، وتخزينها في الثلاجة عند درجة حرارة -20 درجة مئوية؛ وسوف يبقون لمدة سنة على الأقل.
- إعداد الحل sinigrin المرجعية
- تزن في حوالي 9 ملغ من الهيدرات sinigrin مع 1-ميكروغرام دقة (على سبيل المثال، 8،769 ملغ). نقلها إلى قارورة حجمية 10 مل وحل الهيدرات sinigrin في 10.0 مل من الماء عالى النقاء.
- حساب المولية من الحل الأوراق المالية وإعداد خمسة مراجع sinigrin بين 50-750 ميكرومتر تمييع الحل الأسهم. لمثال مفصل، نرى التكميلية S1 الملف .
- الاستغناء عن إشارات sinigrin مختلفة في أنابيب تفاعل 1.5 مل وتجميدها عند 20 درجة مئوية. تشمل سلسلة من خمسة مراجع sinigrin في كل دفعة الاستخراج. دائما استخدام القيم المولية الصحيحة لالمستخدمة حاليا sinigrin المراجع عند حساب تركيزات.
2. إعداد الإعداد استخراج
- إعداد رف عمود للأعمدة ماصة باستير (لإعداد الأعمدة، راجع الخطوة 3.1). تسمية الحامل أو الأعمدة لتتبع أرقام العينة (انظر الشكل 1).
- إعداد كتلة عقد على نفس العدد من المسمى أنابيب microcentrifuge 2 مل (راجع الخطوة 3.3 والشكل 1)
5 / 55425fig1.jpg "/>
الشكل 1: الرف لاستخراج glucosinolate. المشهد الأمامي (اليسار) ورأي كبار (يمين) من رف العمود عصامي وكتلة لاستخراج glucosinolate. الطول: 100 مم، والمسافة بين الثقوب تحول (لعقد الأعمدة ماصة باستير): 30 ملم (محور س) × 15 ملم (المحور الصادي). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. إعداد أعمدة وأنابيب microcentrifuge
- إعداد عمود واحد لكل عينة وخمسة أعمدة إضافية لعينات مرجعية sinigrin خمسة.
- في كل ماصة الزجاج، ضع قطعة من الصوف الزجاجي حوالي 1 سم × 1 سم. استخدام عصا خشبية أو زجاجية لدفع الصوف الزجاجي وصولا الى نقطة حيث يضيق ماصة. الصوف الزجاجي يجب منع المواد عمود من نفاد، ولكن لا تستخدم كثيرا، لأنها سوف تبطئ عملية الاستخراج من الأعمدة. ارتداء قفازات ذوي الخوذات البيضاءأون العمل مع الصوف الزجاجي.
- وضع الأعمدة على الرف العمود (انظر الشكل 1). وضع رف عمود في علبة مختبر (علبة النفايات) للقبض على eluents تستخدم ليغسل العمود متتالية.
- قطع 5 مم الأولى قبالة غيض من البلاستيك 1 مل طرف ماصة وماصة 0.5 مل من المواد عمود مستعدة (G-25 هلام في الماء، راجع الخطوة 1.3) في كل عمود. يهز زجاجة تحتوي على مادة العمود جيدا قبل pipetting ل. تجاهل تسريب الأعمدة (مادة G-25 على التوالي من خلال طبقة الصوف الزجاجي) واستبدالها بأخرى جديدة.
- بعد pipetting لمادة عمود في الأعمدة، إضافة 1 مل من الماء عالى النقاء لمطاردة أسفل المواد.
- إعداد واحد أنبوب رد فعل 2 مل لكل عينة وخمسة أنابيب لعينات مرجعية sinigrin الخمسة؛ تسمية لهم. استخدام إبرة تشريح لجعل ثقوب في مباراة دولية لاحق تجميد التجفيف ووضع أنابيب مستعدة في كتلة أنبوب في نفس النمط بالضبط كما فيالأعمدة (الخطوة 2.2، انظر الشكل 1).
4. استخراج الجلاكوسينولات
- وزن تجميد المجفف والمواد النباتية ناعما الأرض (عادة 50،0-100،0 ملغ من الوزن الجاف، ويجب أن يكون تركيز glucosinolate النهائية في استخراج في مجموعة من منحنى المرجعية) إلى أقرب 0.1 ملغ في 2 مل، وصفت، جولة أنابيب رد فعل القاع. إضافة اثنين من كرات معدنية صغيرة (3 ملم في القطر) كما المغلي مثبطات إلى كل أنبوب.
ملاحظة: يمكن أيضا تطبيق هذا البروتوكول على المواد الطازجة، فلاش المجمدة، التي تم الأرض تحت النيتروجين السائل وأبقى المجمدة حتى الاستخراج. زيادة كمية المواد وزنه لاستخراج ونسبة MeOH في السائل المستخلص إلى 85٪ للتعويض عن التخفيف من الماء في المواد 19. - ماصة 1 مل من 70٪ MeOH في كل أنبوب ودوامة لفترة وجيزة. إغلاق أنابيب وختم لهم قبعات السلامة قبل وضعها في أسرع وقت ممكن إلى حار ثحمام العاطر (90-92 درجة مئوية) لمدة بضع دقائق (~ 5 دقائق)، حتى 70٪ MeOH يغلي فقط. الحذر: ارتداء نظارات السلامة خلال هذه الخطوة!
- وضع أنابيب العينات في حمام بالموجات فوق الصوتية لمدة 15 دقائق. وفي الوقت نفسه، واتخاذ سلفاتاز وعينات مرجعية sinigrin خمسة من الثلاجة لذوبان الجليد لهم في RT.
- بعد فائقة صوتنة، الطرد المركزي أنابيب العينات في 2700 x ج في جهاز للطرد المركزي الفوق لمدة 10 دقيقة في RT. ينبغي أن تشكل بيليه في كل أنبوب. إضافة supernatants إلى الأعمدة وصفت وماصة للعينات مرجعية خمسة على أعمدة منفصلة.
- في حين pipetting لفي supernatants، والحفاظ على الحافة جيدا مدى بيليه لتجنب المواد النباتية pipetting ل. لاحظ أنه عندما يتم استخدام العينات المجففة، وحجم طاف سيكون أقل من 1.0 مل.
- إضافة 1 مل من 70٪ MeOH إلى الكريات المتبقية في أنابيب العينات ودوامة الأنابيب قبل وضعها في حمام بالموجات فوق الصوتية لمدة 15 دقيقة. أنابيب الطرد المركزي مرة أخرى، كما في الخطوة 4.4، وإضافة supernatants إلى الأعمدة منها؛ ويرجع ذلك إلى خصائص المواد عمود، مجموعة سلفات سالبة الشحنة من الجلاكوسينولات سيتم الاحتفاظ تحديدا على العمود.
- غسل الأعمدة مع مقتطفات في ثلاث خطوات متتابعة.
- ماصة 2 × 1 مل من 70٪ MeOH على كل عمود. انتظر العمود لتجف قبل إضافة 1 مل القادمة؛ سيؤدي هذا إلى إزالة مركبات أكثر عديم الأقطاب من مقتطفات (على سبيل المثال، الكلوروفيل).
- طرد MeOH بإضافة 1 مل من الماء عالى النقاء لكل عمود.
- ماصة 2 × 1 مل من 20 ملي NaOAc العازلة إلى كل عمود لتهيئة الظروف المثلى للتفاعل سلفاتاز.
- اتخاذ رف مع الأعمدة من علبة النفايات وتجفيف القدمين الحامل بمنديل ورقي. وضع رف فوق كتلة مع قوارير وأنابيب المسمى. تأكد من أن كل طرف العمود في، المسمى، أنبوب الموافق 2 مل (انظر الشكل 1).
- إضافة 20 ميكرولتر من soluti سلفاتازإلى أعمدة. تأكد من أن سلفاتاز يصل إلى السطح من المواد العمود. ماصة 50 ميكرولتر من NaOAc عازلة على كل عمود لمطاردة أسفل سلفاتاز. تغطية الأعمدة مع رقائق الألومنيوم واسمحوا الوقوف بين عشية وضحاها.
ملاحظة: نظرا لأنشطة سلفاتاز، ستتم إزالة المجموعة كبريتات، والإفراج عن desulfoglucosinolates من العمود بحيث يمكن أزل مع الماء. للحصول على وصف مفصل، انظر Crocoll وآخرون. 19. - في اليوم التالي، أزل في desulfoglucosinolates قبل pipetting 2 × 0.75 مل من الماء عالى النقاء على كل عمود. عندما تشغيل كافة الأعمدة الجافة، ورفع الرف العمود وإزالته من أنابيب رد فعل.
- تتويج الأنابيب (تأكد من أن هناك ثغرات في مباراة دولية) وتجميدها في النيتروجين السائل أو في الفريزر -80 درجة مئوية لمدة 30 دقيقة. تجميد تجفيف العينات لمدة 12-24 ساعة (اعتمادا على عدد من العينات وقدرة التجميد جفافا) لإزالة جميع المياه.
<لى> بعد تجميد التجفيف، وإعادة إذابة بقايا في حجم المحدد (عادة 1.0 مل) من الماء عالى النقاء. نقل العينات والمراجع sinigrin خمسة إلى قارورة HPLC المسمى. الحفاظ على العينات في الثلاجة (4 درجة مئوية) لمدة تصل إلى أسبوعين أو المجمد (-20 درجة مئوية) لمدة سنة واحدة قبل تحليلها مع HPLC. - السماح للزجاج أعمدة تجف تحت غطاء محرك السيارة بين عشية وضحاها والتخلص منها عندما تجف. استرداد كرات معدنية من أنابيب العينات المستخدمة في الخطوة 4.5 لإعادة استخدامها، ووضع الأنابيب في سلة المهملات التخلص من النفايات.
5. قياسات HPLC العينات المستخلصة ومنتجاتها
- فصل الجلاكوسينولات على مراحل عكس C 18 عمود (4.6 س 150 ملم، 3 ميكرون، 300 أ) مع التدرج في الماء الأسيتونتريل (انظر الجدول 1)، وتدفق 0.75 مل / دقيقة ودرجة حرارة العمود 40 ° C . أداء الكشف النوعي والكمي في 229 نانومتر.
- قياس الإشارات sinigrin في نفس العمود ولكن مع التدرج تكييفهاطريقة للحد من استخدام المذيبات (انظر الجدول 2). تبدأ ضخ المراجع sinigrin خمسة، بدءا من إشارة بأقل تركيز. ثم حقن العينات، بما في ذلك حقن الميثانول (فارغة) بعد كل عينة العاشرة لتنظيف الأعمدة ولمنع ترحيله من القمم.
| مرة [دقيقة] | تدفق [مل / دقيقة] | ٪ ماء | ٪ B ACN |
| 1 | 0.750 | 98 | 2 |
| 35 | 0.750 | 65 | 35 |
| 40 | 0.750 | 98 | 2 |
| عمود درجة حرارة 40 درجة مئوية. | |||
الجدول 1: التدرج المياه الأسيتونتريل للانفصال glucosinolate وتحليل سياسيالصورة على مرحلة عكس HPLC.
| مرة [دقيقة] | تدفق [مل / دقيقة] | ٪ ماء | ٪ B ACN |
| 1 | 0.750 | 98 | 2 |
| 10 | 0.750 | 89.3 | 10.7 |
| 11 | 0.750 | 98 | 2 |
| عمود درجة حرارة 40 درجة مئوية. | |||
الجدول 2: تقصير التدرج المياه الأسيتونتريل لتقدير المراجع sinigrin الخمس المستخدمة لتقدير حجم الجلاكوسينولات.
6. Glucosinolate تحديد النوعي والكمي
- هوية
- مقارنة الأشعة فوق البنفسجية أطياف والاحتفاظ مرات من القمم في العينات مع جدوى تجارياتمكنت والمراجع glucosinolate نقية. انظر الشكل 2 للحصول على أمثلة من أطياف الأشعة فوق البنفسجية من مختلف الطبقات glucosinolate.
- تحديد الجلاكوسينولات مجهولة مع المعايير المرجعية أو LC-MS 18، 19، إذا كان ذلك ممكنا.
- تحديد الجلاكوسينولات مجهولة مع الرنين النووي المغناطيسي (NMR)، إذا كان ذلك ممكنا.
- مقارنة الأشعة فوق البنفسجية أطياف والاحتفاظ مرات من قمم مع تلك الموجودة في الشكل 2 والجدول المراجع 3، وقواعد البيانات، أو الأدب.
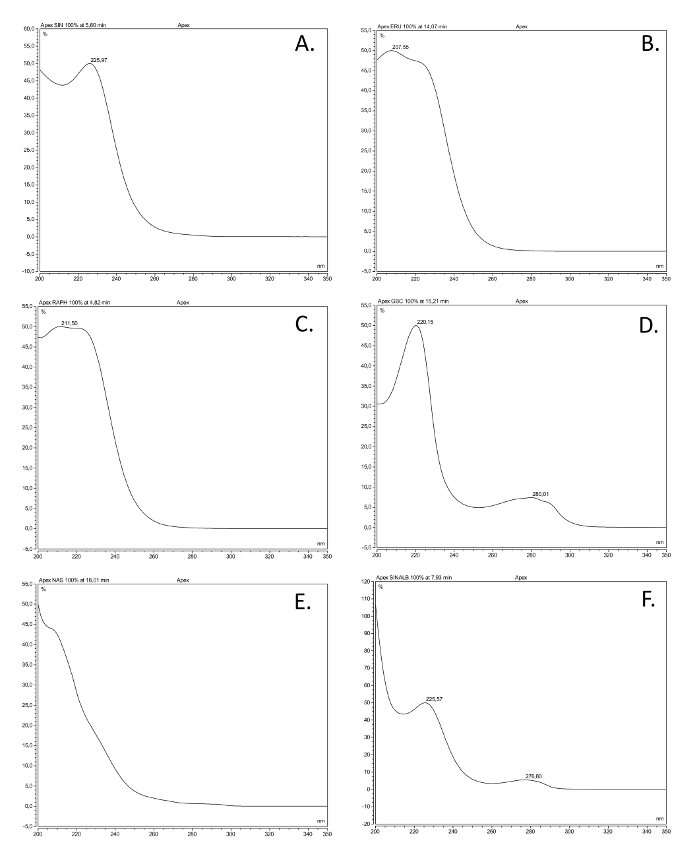
الشكل 2. الأطياف للأشعة فوق البنفسجية من الطبقات glucosinolate الأكثر شيوعا. الأشعة فوق البنفسجية أطياف الامتصاص (200-350 نانومتر) من ستة desulfoglucosinolates (GSL)، استنادا إلى حلول مصنوعة من مركبات المرجعية المتاحة تجاريا استخراج كما هو موضح هنا، تمثل الطبقات الهيكلية الأكثر شيوعا. الاسم الشائع، قيتم إعطاء اسم tructural (بين قوسين)، والطبقة الهيكلية. (A) Sinigrin (2-بروبينيل GSL)، alkenyl. (ب) glucoerucin (4 methylthiobutyl GSL)، thioalkenyl. (C) glucoraphanin (4 methylsulfinlybutyl GSL)، سلفينيل. (D) glucobrassicin (إندول-3-ylmethyl GSL)، الإندول، (E) gluconasturtiin (2-الفنيل GSL) والعطرية. (F) sinalbin (4 hydroxybenzyl GSL) والعطرية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- تحديد الكميات
- دمج المنطقة تحت قمم من المراجع sinigrin خمسة والعينات.
- حساب منحنى معايرة خمسة مراجع sinigrin محسوبا على أساس منطقة متكاملة. استخدام معادلة خط الانحدار (انظر المعادلة 1) لحساب كمية محرف من الجلاكوسينولات (انظر المعادلة 2).
- لحساب تركيز الجلاكوسينولات مختلفة، مضاعفة كمية محرف (خ) من قبل عامل استجابة (M) للكشف على 229 نانومتر من المفوضية الأوروبية (1990) 16، بوخنر (1987) 15، أو براون وآخرون. (1993) 17؛ ونظرا للعوامل استجابة إجماع desulphoglucosinolates الكشف الأكثر شيوعا في الجدول 3.
ملاحظة: عوامل الاستجابة قد تختلف بين نظم هذا قد يكون السبب أن هناك قيم مختلفة قدمها المراجع المختلفة (انظر المراجع 15-17). ومع ذلك، فإن القيم هي في معظمها قريبة جدا وفي مجموعة مماثلة مع الطبقات الهيكلية. بعد اتفاقية، تعيين عامل استجابة الجلاكوسينولات مجهولة الهوية إلى 1، على الرغم من الجلاكوسينولات الإندول مجهولة مع طيف الأشعة فوق البنفسجية مماثلة لتلك التي glucobrassicin وغيرها من الجلاكوسينولات الإندول (الشكل 2)، سيكون من المستحسن استخدام 0.25 كعامل استجابة للحصول علىتقدير واقعي للتركيز (الجدول 3). - لحساب المبلغ النهائي للالجلاكوسينولات (خ ر) في العينة، وأخذ عامل التخفيف (D) وكتلة عينة (ث) المستخدمة للتحليل في الاعتبار (انظر المعادلة 3).
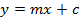 (1)
(1) 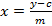 (2)
(2) 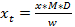 (3)
(3)
ذ = منطقة الذروة
م = المنحدر من المرجع 5 نقاط منحنى الانحدار
ج = اعتراض من خط الانحدار مع المحور الصادي
س = كمية الجلاكوسينولات في استخراج
س ر = تركيز الجلاكوسينولات في العينة النباتية
D = عامل تخفيف
M = معامل إستجابة للكشف على 229 نانومتر من بوخنر (1987) أو براون وآخرون. (1993)
ث = كتلة العينة المستخدمة لاستخراج
النتائج
هذه الطريقة تمكن من كشف وفصل desulfoglucosinolates توجد عادة في جميع الطبقات الهيكلية (الشكل 3). وتضر 2-hydroxyglucosinolate progoitrin يأتي في اللوني في وقت مبكر نسبيا، ويتم فصل بوضوح من glucoraphanin glucosinolate مفيد، وmethylsulfinylglucosinolate فقط في هذه العينة. Sinigrin، تشكيل gluconapin، وglucobrassicanapin سلسلة eluotropic من الجلاكوسينولات alkenyl مع أطوال زيادة جنبا سلسلة (C3، C4، C5 و، على التوالي). سلسلة منطقية مماثلة مرئيا لالجلاكوسينولات methylthioalkenyl اثنين، glucoiberverin (C3) وglucoerucin (C4). قمم ثلاثة الجلاكوسينولات الإندول، glucobrassicin ومشتقاته 4-هيدروكسي و1-methoxyglucobrassicin (neoglucobrassicin)، فهي أيضا مفصولة بشكل واضح. وتجدر الإشارة إلى أن قمم neoglucobrassicin وglucoerucin، وكذلك gluconasturtiin، وgluco العطرية الوحيدsinolate في هذه العينة، مرتفعة بشكل خاص في هذا المقتطف الكرنب نظرا لإضافة مقتطفات الجذر إلى مزيج 9.
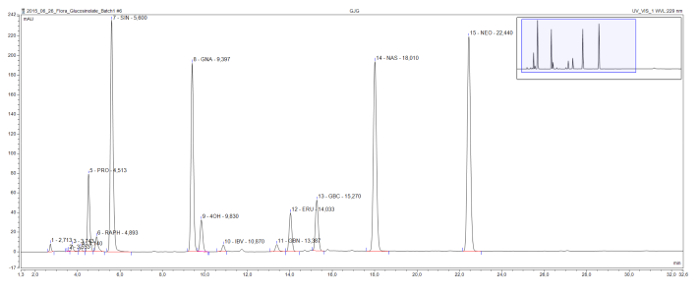
الشكل 3: المخطط الاستشرابي لاستخراج glucosinolate. التفاصيل (1-32 دقيقة) من اللوني HPLC الناتجة عن تحليل العينات المجمعة الجذرية وتبادل لاطلاق النار من الكرنب المادة الرمادية في الدماغ، B. رابا، وباء. OLERACEA. التسميات الذروة تشير إلى الوقت الاحتفاظ والاختصارات لdesulfoglucosinolates المحددة (GSL). PRO = progoitrin (2-OH-3-butenyl GSL)؛ راف = glucoraphanin (4 methylsulfinlybutyl GSL)؛ SIN = sinigrin (2-بروبينيل GSL)، GNA = gluconapin (3-butenyl GSL)؛ 4OH = 4 hydroxyglucobrassicin. IBV = glucoiberverin (3-methylthiopropyl GSL)؛ GBN = glucobrassicanapin (4 pentenyl GSL)؛ وحدات خفض الانبعاثات = glucoerucin (4 methylthiobutyl GSL)؛ GBC = glucobrassicin (إندول-3-ylmethyl GSL). NAS = gluconasturtiin (2-الفنيل GSL)؛ NEO = neoglucobrassicin (1-MeOH-glucobrassicin). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
أطول الجلاكوسينولات methylsulfinyl سلسلة، والتي توجد عادة في المصنع نموذج نبات الأرابيدوبسيس، تظهر أيضا سلسلة eluotropic، كما رأينا في استخراج الجذر من Rorippa austriaca. Glucohesperalin (C6)، glucosiberin (C7)، glucohirsutin (C8)، وglucoarabin (C9) تظهر على فترات منتظمة على اللوني (الشكل 4). جنبا إلى جنب مع أطياف الأشعة فوق البنفسجية من القمم، ويمكن استخدام هذه السلسلة المنطقية eluotropic لتصنيف وتحديد مؤقتا، الجلاكوسينولات مجهولة.
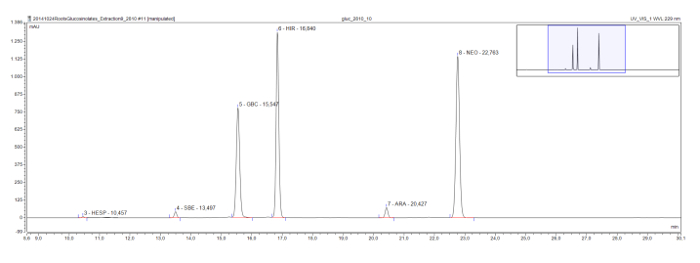
الشكل 4: المخطط الاستشرابي (إطار 9-30 دقيقة) من desulfoglucosinolates في Rorippa استخراج austriaca الجذر. التسميات الذروة تشير إلى الوقت الاحتفاظ والاختصارات لdesulfoglucosinolates المحددة (GSL). HES = glucohesperin (6 methylsulfinylhexyl GSL)؛ SBE = glucosiberin (7 methylsulfinylheptyl GSL)؛ GBC = glucobrassicin (إندول-3-ylmethyl GSL)؛ HIR = glucohirsutin (8 methylsulfinlyoctyl GSL)؛ ARA = glucoarabin (9 methylsulfinylnonylglucosinolate)؛ NEO = neoglucobrassicin (1-MeOH-glucobrassicin). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم شائع | هيكل سلسلة الجانب | غ (دقيقة) * | 229 نانومتر | مرجع# |
| aliphatiالجلاكوسينولات ج | ||||
| Glucocapparin | الميثيل | 3.5 | 1 | بنى |
| Sinigrin | 2-بروبينيل | 5.5 | 1 | البني، والمفوضية الأوروبية |
| Gluconapin | 3-butenyl | 9.5 | 1.11 | المفوضية الأوروبية |
| Glucobrassicanapin | 4-pentenyl | 13.5 | 1.15 | المفوضية الأوروبية |
| Glucoiberverin | 3-methylthiopropyl | 10.9 | 0.8 | بنى |
| Glucoerucin | 4-methylthiobutyl | 14.0 | 0.9 | بنى |
| Glucoiberin | 3-methylsulfinylpropyl | 3.7 | 1.2 | بنى |
| Glucoraphanin | 4-methylsulfinylbutyl | 4.9 | 0.9 | بنى |
| Glucoalyssin | 5-methylsulfinylpentyl | 7.6 | 0.9 | بنى |
| Glucohesperin | 6-methylsulfinylhexyl | 10.5 | 1 | بنى |
| Glucosiberin | 7-methylsulfinylheptyl | 13.5 | 1 | بنى |
| Glucohirsutin | 8-methylsulfinyloctyl | 16.8 | 1.1 | بنى |
| Glucoarabin | 9-methylsulfinylnonyl | 20.5 | 1 | |
| Glucocheirolin | 3-methylsulfonylpropyl | 4.2 | 0.9 | بنى |
| Progoitrin | 2 (R) -OH-3-butenyl | 4.5 | 1.09 | بوخنر، والمفوضية الأوروبية |
| Gluconapoleiferin | 2-OH-5-pentenyl | 8.3 | 1 | المفوضية الأوروبية |
| الجلاكوسينولات الإندول | ||||
| 4-hydroxyglucobrassicin | 4-hydroxyindol-3-ylmethyl | 11.2 | 0.28 | بوخنر، والمفوضية الأوروبية |
| Glucobrassicin | إندول-3-ylmethyl | 15.3 | 0.29 | بوخنر، والمفوضية الأوروبية |
| 4-Methoxyglucobrassicin | 4-methoxyindol-3-ylmethyl | 18.2 | 0.25 | بوخنر، والمفوضية الأوروبية |
| Neoglucobrassicin | 1-methoxyindol-3-ylmethyl | 22.5 | 0.2 | بوخنر، والمفوضية الأوروبية |
| الجلاكوسينولات العطرية | ||||
| Sinalbin | 4-hydroxybenzyl | 8.1 | 0.5 | بوخنر |
| Glucosibarin | 2 (R) -OH-2-الفنيل | 12.1 | رؤية القادم | |
| Glucobarbarin | 2 (S) -OH-2-الفنيل | 12.7 | 0.95 | بوخنر |
| Glucotropaeolin | البنزيل | 13.8 | 0.95 | بوخنر، والمفوضية الأوروبية |
| Gluconasturtiin | 2-الفنيل | 18.0 | 0.95 | بوخنر، والمفوضية الأوروبية |
| غير معروف - الأليفاتية / العطرية مثل طيف الأشعة فوق البنفسجية | 1 | المفوضية الأوروبية | ||
| غير معروف - الإندول مثل الطيف | 0.25 | المفوضية الأوروبية | ||
| * تقريبي الوقت الاحتفاظ (RT) مقربة إلى أقرب 0.1 دقيقة (± 0.3 دقيقة اعتمادا على العمود، والجودة شاطف). يتم تحديد مرات الاحتفاظ على منصات ThermoFisher / DIONEX في نهاية المطاف HPLC مجهزة C 18 عمود (150 × 4.6 مم، و 3 ميكرومتر حجم الجسيمات)، بالإضافة إلى C 18 precolumn (10 × 4.6 مم، و 5 ميكرومتر حجم الجسيمات) مع برنامج التدرج كما في الجدول 1. | ||||
| # المراجع المتعلقة العوامل رد: بوخنر، R. في الجلاكوسينولات في اللفت (إد JP Wathelet) 50-58 (مارتينوس نيهوف للنشر، 1987)؛ البني، PD، Tokuhisa، JG، Reichelt، M. & Gershenzon، J. التغيير من تراكم glucosinolate بين الأجهزة المختلفة ومراحل تطور thaliana نبات الأرابيدوبسيس. كيمياء العقاقير. 62 (3)، 471-481، دوى: 10.1016 / S0031-9422 (02) 00549-6، (2003)؛ المفوضية الأوروبية. البذور الزيتية - تحديد الجلاكوسينولات عالية الأداء اللوني السائل. الجريدة الرسمية للجماعات الأوروبية. L 170/28. المرفق الثامن 03.07.27-34 (1990). | ||||
الجدول 3: العوامل استجابة من أكثر شائع desulfo-الجلاكوسينولات في المستخلصات النباتية ومرات الاحتفاظ التقريبية على C 18 الأعمدة. Eluents، gradienر، ودرجة الحرارة العمود، ومعدل التدفق كما في الجدول 1.
Discussion
أعظم مزايا هذه الطريقة القائمة والمستخدمة على نطاق واسع هي أنها قوية، واضحة إلى حد ما، والتكلفة المنخفضة نسبيا للعينة الواحدة. يجب أن تكون معظم المعدات اللازمة لاستخراج وتحليل متاح في المختبر القياسية أو يمكن أن يكون بناؤه ذاتيا، مع استثناء من HPLC المساعد الشخصي الرقمي. ميزة أخرى هي أن desulfoglucosinolates الذائبة في الماء هي كيميائيا مستقرة تماما عندما حفظه باردا وفي (HPLC) قارورة محكمة الغلق، لذلك يمكن بسهولة شحنها مقتطفات لتحليل HPLC في أي مكان آخر. وعلى النقيض من منصات LC-MS، التي تتطلب التدريب وخبرة واسعة في التدريب العملي على إدارة البرنامج وتحليل البيانات المتخصصة، HPLC للأشعة فوق البنفسجية / أجهزة المساعد الرقمي الشخصي يمكن تشغيلها بسهولة بعد فترة تدريب قصيرة. هذا لا يقلل من تكاليف العملية، ولكن أيضا يجعل هذه الطريقة أكثر في متناول مجموعة واسعة من العلماء، بما في ذلك الطلاب.
عموما، عندما الإجراءات المذكورة أعلاه يتم اتباع يتنبهLLY، يجب أن تحدث بعض المشاكل. بشكل عام، هي قمم glucosinolate فصل بشكل جيد للغاية في اللوني. إذا لم تكن هذه هي الحالة، يمكن تكييف برنامج التدرج من خلال خفض معدل الزيادة في الأسيتونتريل في شاطف. بدلا من ذلك، بناء على عمود قبل الجديد (200-500 الحقن) أو عمود (1500 -2000 الحقن) قد حل هذه القضية. في بعض الأحيان، الاستشرابية عينات واحدة في الدفعة قد تظهر صغيرة جدا أو معدومة القمم. هذا عادة ما يكون بسبب أخطاء pipetting لعند إضافة سلفاتاز (على سبيل المثال، تم تخطي العمود أو كان سلفاتاز لم تغسل بشكل صحيح أسفل في العمود). بدلا من ذلك، التركيز glucosinolate في المواد التجريبية ربما كانت اقل مما كان متوقعا، وكان يستخدم مواد قليلة جدا لاستخراج. إذا كان هذا الأخير هو الحال، يمكن زيادة حجم حقن 100 ميكرولتر، أو يمكن أن تتركز قسامة الدقيقة (على سبيل المثال، 800 ميكرولتر) للاستخراج. هذا الأخير يمكن أن يتحقق عن طريق تجميد الجافةجي استخراج، حل بقايا في حجم أصغر (على سبيل المثال، 100 ميكرولتر) من الماء، وإعادة إعطاء باستخدام نفس منحنى المرجعية. في الحسابات للتركيز الأصلي للاستخراج، يجب أن تتضاعف أعداد من عامل التخفيف. إذا كان هذا لا يحل المشكلة، يجب استخراج المواد مرة أخرى باستخدام المزيد من المواد الانطلاق. إذا كان هذا هو أكثر من 100 ملغ، ينبغي تعديل حجم المذيبات استخراج وحجم الأنابيب نسبيا للحفاظ على كفاءة الاستخراج.
ميزة إضافية هي أن هذا الأسلوب قد تم التحقق جيدا. هذا هو لأنه قد تم وصفها بأنها الطريقة القياسية لتقدير حجم الجلاكوسينولات في بذور اللفت، والتي تم تأكيدها في الإجراءات والدقة في عدة مختبرات (16). وبالإضافة إلى ذلك، الخلفية الوراثية، الحيوي، والوظائف البيولوجية للالجلاكوسينولات تخضع لجهود بحثية مكثفة، في وزارة الدفاعشرم thaliana نبات الأرابيدوبسيس الأنواع النباتية وغيرها 4 و 6 و 12. لذلك، فإن العديد من العوامل استجابة لتقدير الدقيق للdesulfoglucosinolates فيما يتعلق sinigrin تعرف جيدا ومتاحة للجمهور 15،17. على الرغم من البروتوكولات القائمة على LS-MS-أكثر إنتاجية عالية، أكثر حساسية، وقادرة على (مؤقتا) تحديد الجلاكوسينولات التي لا توجد لها معايير المتاحة 18، 19، 20، لعدم وجود عوامل استجابة عالمية لLC-MS يحد من الكمي الدقيق لتركيزات glucosinolate 18. وعلاوة على ذلك، وهذه الأساليب عادة لا تتضمن خطوة التجميد والتجفيف، وكمية المياه في المواد النباتية الطازجة هو في عداد المفقودين في العمليات الحسابية، مما يجعل تقدير دقيق صعبة. وأخيرا، لأن لدينا طريقة استخراج ينطوي على العمود القائمتنقية وتركيز خطوة، فإنه يمكن أيضا أن تطبق على عينات "القذرة" مع تركيزات منخفضة من الجلاكوسينولات، مثل التربة 21.
بالمقارنة مع الطرق القائمة على LC-MS-التي تستخرج عادة طازجة المواد المجمدة، واستخدام لوحات 96-جيدا لاستخراج، ولا تشمل خطوة سلفاتاز 18 و 19 و أسلوبنا هو مضيعة للوقت والعمل المكثف نسبيا. مع رفوف العمود صفها في هذه الورقة، يمكن لشخص واحد استخراج حوالي 100-150 العينات في يوم واحد. شطف (اليوم التالي)، وتجميد التجفيف (بين عشية وضحاها)، وإعادة تذويب يمكن أن تجرى في غضون اليومين التاليين. مع حاقن الآلي HPLC، تشغيل وموازنة الوقت من 40-45 دقيقة لكل الحقن، وأي أحداث غير متوقعة، ان الامر سيستغرق 3-4 أيام للحصول على بيانات لهذه المجموعة عينة. عندما البرنامج HPLC يسمح الكمي التلقائي على أساس منحنى sinigrin، وهو الاختيار اليدوي للالاستشرابية والمؤسسة العامةتعيينات حزب العدالة والتنمية عن 100 عينة قد يستغرق سوى 1 أو 2 ساعة أخرى قبل صدور البيانات يمكن أن تستخدم في التحليلات الإحصائية.
وعلى الرغم من تزايد توافر معايير glucosinolate، سوى جزء صغير من المرشحين أكثر من 130 ويمكن حاليا يمكن شراؤها تجاريا. ومع ذلك، مع عدد قليل من المراجع لكل من الطبقات السكروز. الوصول إلى قواعد البيانات الأدب تحديد المركبات الموجودة سابقا في الأنواع النباتية (على سبيل المثال، فاهي وآخرون 22). المعرفة الأساسية للمبادئ الكروماتوغرافي، مثل منطق سلسلة eluotropic (على سبيل المثال، لزيادة أعداد جيم على سلسلة جنب في مركبات دهنية، أرقام 3 و 4)؛ والتحقق من صحة العينات واحدة في 19 LC-MS أو الجلاكوسينولات معزولة على NMR 23، يمكن للمرء أن التغلب بسهولة على هذا التحديد. معظم بروتوكولات لglucosinolate تحليلات استخدام المنحنيات المرجعية الداخلية(أي تركيز معين لاستخراج sinigrin أو sinalbin إلى الاستخلاص بالمذيبات 16، 17، 19). أساسا، والمنحنيات المرجعية الداخلية هي أكثر مناسبة لتصحيح الأخطاء وتجهيز العينات الفردية، وبالتالي نظريا تسفر عن دقة أعلى. وعلى الرغم من هذه الميزة، ونحن نفضل استخدام خمس نقاط منحنى مرجع خارجي، ونحن في كثير من الأحيان تحليل الأنواع البرية المختلفة، وبعضها تحتوي على مستويات عالية من sinigrin (على سبيل المثال، الكرنب السوداء 24) أو sinalbin (على سبيل المثال، Sinapis ألبا 25)، مرجعين glucosinolate التي تتوفر عوامل استجابة. وعلاوة على ذلك، مضيفا المعايير الداخلية لكل عينة يزيد من تكلفة التحاليل، حسب المعايير glucosinolate إشارة عالية الجودة وعادة ما تكون مكلفة للغاية.
في الختام، على الرغم من الخطوات تستغرق وقتا طويلا، وهذا البروتوكوليوفر طريقة واضحة ويمكن الوصول إليها لاستخراج وتحديد الجلاكوسينولات في عينات النبات. ومع ذلك، فمن المهم النظر إلى أن مستويات glucosinolate نفسها ليست سوى مؤشر على نشاط بيولوجي محتمل، ينظر إليها على أنها ضرورة للتفاعل مع ميروزيناز، والاختلاف في المنتجات رد فعل قد تنشأ من glucosinolate واحد 11. يجب إجراء فحوصات التحقق من الصحة للتأكيد على أهمية بيولوجية.
Disclosures
The authors have nothing to disclose.
Acknowledgements
NMvD thanks Dr. Michael Reichelt (Max-Planck-Institute for chemical Ecology, Jena, Germany) for providing the first reference samples when she started using this method 16 years ago. Ciska Raaijmakers (NIOO-KNAW, Wageningen, the Netherlands), Sebastian Krosse (B-Ware, Nijmegen, the Netherlands), and Christian Ristok (iDiv, Leipzig) are acknowledged for improving the protocol over the course of the years. Mirka Macel and Martine Huberty (University Tübingen, Germany) are acknowledged for their permission to use the Rorippa chromatogram. The authors gratefully acknowledge the support of the German Centre for Integrative Biodiversity Research (iDiv) Halle-Jena-Leipzig, funded by the German Research Foundation (FZT 118).
Materials
| Name | Company | Catalog Number | Comments |
| Methanol HiPerSolv CHROMANORM® gradient grade for HPLC grade | VWR | 20,864,320 | |
| Sodium acetate (NaOAc) | Sigma-Aldrich | W302406-1KG-K | |
| HCL | VWR | 1,090,571,000 | |
| Sephadex | Sigma-Aldrich | A25120-10G | |
| (−)-Sinigrin hydrate from horseradish | Sigma-Aldrich | S1647-500MG | |
| Aryl Sulfatase | Sigma-Aldrich | S9626-10KU | |
| Ethanol | VWR | 20,816,298 | |
| Pasteur Pipette | Carl Roth | 4518.1 | |
| Glass Wool | Carl Roth | 7377.1 | |
| Glass /wooden stick | VWR | HERE1080766 | |
| 2 mL reaction tubes | VWR | 211-2606 | |
| Dissecting needle | Carl Roth | KX93.1 | |
| Rotilabo-lab dishes | Carl Roth | 0772.1 | Waste tray |
| Freeze Dryer Freezone 12 L | Labconco | 7960030 | |
| Acetonitril super gradient grade | VWR | 83,639,320 | |
| Water bath | VWR | 462-5112 | |
| Ultrasonic bath | Fisher Scientific | FB 15061 | |
| PH Electrode | Thermo Fisher Scientific | STARA2115 | |
| Centrifuge Heraeus Multifuge X1 | Thermo Fisher Scientific | 75004210 | |
| Pre-Column | Thermo Fisher Scientific | 69697 | C18 column (4.6 x 10 mm, 5 µm, 300 Å) |
| Column Acclaim 300 | Thermo Fisher Scientific | 60266 | C18 column (4.6 x 150 mm, 3 µm, 300 Å) |
| HPLC Ultimate 3000 | Thermo Fisher Scientific | with column oven and UV or PDA detector | |
| Flask 1000 mL | VWR | 215-1595 | |
| Glucosinolate reference compounds | Phytoplan | various | http://www.phytoplan.de/ |
References
- Hartmann, T. From waste products to ecochemicals: Fifty years research of plant secondary metabolism. Phytochemistry. 68 (22-24), 2831-2846 (2007).
- Will, H., Laubenheimer, A. Ueber das Glucosid des weissen Senfsamens. Justus Liebigs Annalen der Chemie. 199 (1), 150-164 (1879).
- Agerbirk, N., Olsen, C. E. Glucosinolate structures in evolution. Phytochemistry. 77, 16-45 (2012).
- Halkier, B. A., Gershenzon, J. Biology and biochemistry of glucosinolates. Ann Rev Plant Biol. 57, 303-333 (2006).
- Sønderby, I. E., Geu-Flores, F., Halkier, B. A. Biosynthesis of glucosinolates - gene discovery and beyond. TIPS. 15 (5), 283-290 (2010).
- Kliebenstein, D. J., et al. Genetic control of natural variation in Arabidopsis glucosinolate accumulation. Plant Physiol. 126 (2), 811-825 (2001).
- van Leur, H., Raaijmakers, C. E., van Dam, N. M. A heritable glucosinolate polymorphism within natural populations of Barbarea vulgaris. Phytochemistry. 67 (12), 1214-1223 (2006).
- Kelly, P. J., Bones, A., Rossiter, J. T. Sub-cellular immunolocalization of the glucosinolate sinigrin in seedlings of Brassica juncea. Planta. 206 (3), 370-377 (1998).
- van Dam, N. M., Tytgat, T. O. G., Kirkegaard, J. A. Root and shoot glucosinolates: a comparison of their diversity, function and interactions in natural and managed ecosystems. Phytochem Rev. 8 (1), 171-186 (2009).
- Ratzka, A., Vogel, H., Kliebenstein, D. J., Mitchell-Olds, T., Kroymann, J. Disarming the mustard oil bomb. Proc Natl Acad Sci U S A. 99 (17), 11223-11228 (2002).
- Wittstock, U., Kliebenstein, D. J., Lambrix, V., Reichelt, M., Gershenson, J., Romeo, J. T. . Integrative Phytochemistry: From ethnobotany to molecular ecology: Recent Advances in Phytochemistry. 37, (2003).
- Hopkins, R. J., van Dam, N. M., van Loon, J. J. A. Role of glucosinolates in insect-plant relationships and multitrophic interactions. Ann Rev Entomol. 54 (1), 57 (2009).
- Kliebenstein, D. J., Gershenzon, J., Mitchell-Olds, T. Comparative quantitative trait loci mapping of aliphatic, indolic and benzylic glucosinolate production in Arabidopsis thaliana leaves and seeds. Genetics. 159 (1), 359-370 (2001).
- Mithen, R., Bennett, R., Marquez, J. Glucosinolate biochemical diversity and innovation in the Brassicales. Phytochemistry. 71 (17-18), 2074-2086 (2010).
- Buchner, R., Wathelet, J. P. . Glucosinolates in rapeseed. , 50-58 (1987).
- . Oil seeds - determination of glucosinolates High Perfomance Liquid Chromatography. Official Journal of the European Communities. , 27-34 (1990).
- Brown, P. D., Tokuhisa, J. G., Reichelt, M., Gershenzon, J. Variation of glucosinolate accumulation among different organs and developmental stages of Arabidopsis thaliana. Phytochemistry. 62 (3), 471-481 (2003).
- Glauser, G., Schweizer, F., Turlings, T. C. J., Reymond, P. Rapid Profiling of Intact Glucosinolates in Arabidopsis Leaves by UHPLC-QTOFMS Using a Charged Surface Hybrid Column. Phytochem Analysis. 23 (5), 520-528 (2012).
- Crocoll, C., Halkier, B. A., Burow, M. . Current Protocols in Plant Biology. , (2016).
- Griffiths, D. W., Bain, H., Deighton, N., Botting, N. P., Robertson, A. A. B. Evaluation of liquid chromatography-atmospheric pressure chemical ionisation-mass spectrometry for the identification and quantification of desulphoglucosinolates. Phytochem Analysis. 11 (4), 216-225 (2000).
- Gimsing, A. L., Kirkegaard, J. A. Glucosinolates and biofumigation: fate of glucosinolates and their hydrolysis products in soil. Phytochem Rev. 8 (1), 299-310 (2009).
- Fahey, J. W., Zalcmann, A. T., Talalay, P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants. Phytochemistry. 56, 5-51 (2001).
- de Graaf, R. M., et al. Isolation and identification of 4-α-rhamnosyloxy benzyl glucosinolate in Noccaea caerulescens showing intraspecific variation. Phytochemistry. 110, 166-171 (2015).
- van Dam, N. M., Raaijmakers, C. E. Local and systemic induced responses to cabbage root fly larvae (Delia radicum) in Brassica nigra and B. oleracea. Chemoecology. 16 (1), 17-24 (2006).
- Gols, R., et al. Temporal changes affect plant chemistry and tritrophic interactions. Bas Appl Ecol. 8 (5), 421-433 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved