Method Article
高圧液体クロマトグラフィー(HPLC)とグルコシノレートの抽出および分析のための簡単な方法
要約
Here, we describe in great detail an established and robust protocol for the extraction of glucosinolates from ground plant materials. After an on-column sulfatase treatment of the extracts, the desulfoglucosinolates are eluted and analyzed by high-pressure liquid chromatography.
要約
Glucosinolates are a well-studied and highly diverse class of natural plant compounds. They play important roles in plant resistance, rapeseed oil quality, food flavoring, and human health. The biological activity of glucosinolates is released upon tissue damage, when they are mixed with the enzyme myrosinase. This results in the formation of pungent and toxic breakdown products, such as isothiocyanates and nitriles. Currently, more than 130 structurally different glucosinolates have been identified. The chemical structure of the glucosinolate is an important determinant of the product that is formed, which in turn determines its biological activity. The latter may range from detrimental (e.g., progoitrin) to beneficial (e.g., glucoraphanin). Each glucosinolate-containing plant species has its own specific glucosinolate profile. For this reason, it is important to correctly identify and reliably quantify the different glucosinolates present in brassicaceous leaf, seed, and root crops or, for ecological studies, in their wild relatives. Here, we present a well-validated, targeted, and robust method to analyze glucosinolate profiles in a wide range of plant species and plant organs. Intact glucosinolates are extracted from ground plant materials with a methanol-water mixture at high temperatures to disable myrosinase activity. Thereafter, the resulting extract is brought onto an ion-exchange column for purification. After sulfatase treatment, the desulfoglucosinolates are eluted with water and the eluate is freeze-dried. The residue is taken up in an exact volume of water, which is analyzed by high-pressure liquid chromatography (HPLC) with a photodiode array (PDA) or ultraviolet (UV) detector. Detection and quantification are achieved by conducting comparisons of the retention times and UV spectra of commercial reference standards. The concentrations are calculated based on a sinigrin reference curve and well-established response factors. The advantages and disadvantages of this straightforward method, when compared to faster and more technologically advanced methods, are discussed here.
概要
植物は、化学化合物1の20万人を超える異なる種類を生成することが推定されています。これらの化合物の唯一の少数派は、植物の一次代謝、燃料の成長と再生に役割を果たしているようです。大半は、いわゆる二次代謝産物です。彼らは花粉媒介者を引き付けるために、または病原体や草食動物1に対する植物を守るために役立つように、その名前にもかかわらず、二次代謝産物は、多くの場合、植物の生存と再生のために重要です。
グルコシノレートは、150年以上の2のために研究されてきた二次代謝産物の非常に多様なクラスです。現在までに、130以上の構造的に異なるグルコシノレートは、3同定されています。概して、グルコシノレートは、それらが合成されるアミノ酸に基づいて異なるクラスに分けることができます。インドールグルコシノレートは、例えば、アミノ酸から合成されますトリプトファン、フェニルアラニンは芳香族グルコシノレート4の合成のための基本骨格を提供する一方。クラスの中に、高い脂肪族グルコシノレート類のような生合成経路において、または側鎖修飾( 例えば、ヒドロキシル)により逐次鎖伸長工程によってもたらされる構造的多様性のレベル、4、5があります。一つのグルコシノレートの植物種が異なる構造クラス6に属する最大37の異なるグルコシノレートを含有することができます。植物種は、典型的なグルコシノレートのプロファイルを持っているにもかかわらず、グルコシノレートの種類のための種内変異は頻繁に個人や集団6、7の間で発見されました。無傷のグルコシノレートは、植物細胞の液胞に保存され、任意の地上または地下部器官7に記載されています 8、9。細胞破壊( 例えば、草食性によって)されると、グルコシノレートが解放され、マスタードオイル爆弾10をオフに設定し、酵素ミロシナーゼと混合されます。ミロシナーゼの活性、およびグルコシノレートの構造、反応条件、および修飾酵素、異なる刺激、毒性、又は有害な化合物の存在に依存してこのようなニトリル及び(イソ)として、形成された11のチオシアネート。反応生成物は、高い生物学的活性を有します。例えば、彼らはゼネラリスト昆虫草食動物12の忌避剤としての役割を果たす。グルコシノレートの遺伝と生合成経路がよく、主に草食動物と病原体抵抗性、マスタードとキャベツで香味成分としての価値、およびそれらの負(progoitrin)と人間の健康5にプラス(グルコラファニン)効果のためにそれらの重要性、研究されています 13、14。
なぜなら、紫外線(UV)またはフォトダイオードアレイを備えた逆相高圧液体クロマトグラフィーに基づいて、生物学的に活性な化合物、抽出及び検出方法としてグルコシノレートに大きな関心(HPLC)の(PDA)検出器は、一般的に1980 15が使用されています。この方法に基づき、欧州共同体は、油糧種子中のグルコシノレートの分析( セイヨウアブラナ 、セイヨウアブラナ、キャノーラ16)のために、いくつかのラボでテストおよび検証された標準プロトコルを発行しました。その他は17(ナタネには存在しないグルコシノレートのための追加の応答係数を決定することにより、例えば )このメソッドに追加しました。グルコシノレートの分析18のための液体クロマトグラフィー-質量分析(LC-MS)プラットフォーム及びハイスループットプロトコルの増加にもかかわらず、利用可能 19は 、元のHPLC-UV / PDA方法は、まだ広く科学者によって使用されています。主な理由は、この方法が簡単で、費用対効果、および広範な化学分析の知識インフラのないラボに比較的アクセス可能であることです。この地域社会に奉仕するためには、植物材料からグルコシノレートの抽出とHPLC-PDAとのdesulfo-フォームの分析のために、私たちここでは詳細プロトコル。
プロトコル
グルコシノレートの抽出に必要なソリューションの調製
- ガラス瓶中の水に70%のメタノール(MeOH)での500ミリリットル(超高純度)を準備します。 100サンプルおよび5の規格については、70%のMeOH 420 mLを必要とされています。
- 20mM酢酸ナトリウム(のNaOAc)液(pH = 5.5)のNaOAc 0.82gのまたは水500mL中のNaOAc×3 H 2 O 1.36gのを添加することによって調製します。塩化水素(HCl)でpHを調整します。冷蔵庫でのNaOAcを保管してください。 100サンプルおよび5の規格については、水中の20mMのNaOAcの液(pH = 5.5)の370 mLを必要とされています。
- カラム材料を調製するために、超純水125 mLで架橋デキストランゲル(タイプG-25)10gを混合します。冷蔵庫(4℃)で得られた混合物を保管してください。
- スルファターゼ溶液の調製
- 超純水30mLにアリールスルファタ(タイプH-1 のHelix pomatiaから)の1万台を溶解し、無水エタノール(エタノール)の30ミリリットルを追加します。よく溶液を混合し、1 250 mLのCENへの転送trifuge管や可用性に応じて、複数のより小さなチューブ、。
- 室温(RT)で20分間2650×gで混合物を遠心分離します。ビーカーに、上清(S)を転送します。 EtOH 90 mLを加え、それを混ぜます。遠心分離を室温で15分間1,030×gで一つ以上の遠心分離管中の混合物。
- 上清を捨てます。超純水25mLの合計でペレットを溶解し、組み合わせます。よくボルテックス、1-mLチューブに分注し、-20℃の冷凍庫に保管。彼らは、少なくとも1年間維持します。
- シニグリン参照溶液の調製
- 1-μgの精度( 例えば、8.769ミリグラム)でシニグリン一水和物9mgの周りで計量します。 10-mLのメスフラスコにそれを移し、超純水の10.0 mLのシニグリン一水和物を溶解します。
- ストック溶液のモル濃度を計算し、原液を希釈することによって50〜750μMの間の5シニグリン参照を準備します。詳細な例については、を参照してください。 補足ファイルS1 。
- 1.5-mLの反応チューブ内の異なるシニグリン参照を分注し、20℃でそれらを凍結。各抽出バッチ中の5シニグリン参照のシリーズがあります。濃度を計算する際に現在使用されシニグリン参照の正しいモル濃度値を常に使用します。
抽出セットアップの調製
- パスツールピペット列の列ラックを準備します(カラムの作製のために、ステップ3.1を参照してください)。サンプル数を追跡するために、ラックまたは列にラベルを付ける( 図1参照 )。
- ラベルされた2-mlのマイクロ遠心チューブの同じ番号を保持するブロックを準備する(ステップ3.3および図1を参照)
5 / 55425fig1.jpg "/>
図1:グルコシノレート抽出のためにラック。グルコシノレート抽出のための自作の列ラックとブロックの正面図(左)と上面図(右)。高さ100ミリメートル、シフト孔間の距離(パスツールピペットの列を保持する)30ミリ(x軸)を15ミリ(y軸)×。 この図の拡大版をご覧になるにはこちらをクリックしてください。
列およびマイクロ遠心チューブの調製
- サンプルあたり1列と5シニグリン基準サンプルのための5つの余分な列を準備します。
- 各ガラスピペットで、ガラスウール約1cm×1センチ個を配置します。ピペットが狭くポイントにグラスウールを押し下げるために木製やガラス棒を使用してください。グラスウールが不足してからカラム材料を防ぐ必要がありますが、それはカラムの溶出が遅くなりますよう、あまり使用しないでください。 WH手袋を着用してくださいグラスウールでの作業専用。
- 列のラックの列を配置します( 図1を参照)。連続したカラムの洗浄に使用する溶離液をキャッチするためにラボトレイ(廃棄物・トレイ)の列ラックを配置します。
- プラスチック1 mLのピペットチップとピペット準備カラム材料の0.5ミリリットルの先端から最初の5ミリメートルカットし、各列に(水中G-25ゲルを、ステップ1.3を参照してください)。よくピペッティングの前にカラム材料を含むボトルを振ります。漏れたカラム(グラスウール層を介して実行されているG-25材料)を捨て、新しいものと交換してください。
- 列にカラム材料をピペットした後、材料を下にフラッシュするために超純水1mLを追加します。
- サンプルあたり1つの2 mLの反応管と5シニグリン基準サンプルのための5つのチューブを準備します。それらにラベルを付けます。後に凍結乾燥のためのキャップに穴を作り、とまったく同じパターンでチューブブロックに準備された管を配置するために解剖針を使用しますカラム(ステップ2.2、 図1を参照)。
グルコシノレートの4抽出
- ラベルされた2-mLの中0.1mgの、に;(抽出物中の最終グルコシノレート濃度は、基準曲線の範囲内であるべきである乾燥重量の通常50.0から100.0 mg)を、ラウンド凍結乾燥し、微粉砕した植物材料を計量-bottom反応管。各チューブに燃剤を沸騰のように2つの小さな金属球(直径3mm)を追加します。
注:プロトコルは、液体窒素下で粉砕し、抽出するまで、凍結保存されている新鮮な、急速冷凍材料に適用することができます。材料19に水による希釈を補償するために、85%に抽出のために秤量した材料の量と抽出液中のメタノールの割合を増やします。 - 簡単に各チューブとボルテックスに70%のMeOHピペットで1 mLです。チューブを閉じて、ホットワットに可能な限り迅速にそれらを配置する前に、安全キャップでそれらを封印MeOHをちょうど沸騰70%になるまで数分(約5分)のためのATER浴(90-92℃)で、。注意:このステップの間に安全ゴーグルを着用!
- 15分間超音波浴中でサンプルチューブを置きます。一方、スルファターゼを取り、冷凍庫のうち5シニグリン参照サンプルは、室温でそれらを解凍します。
- 超音波処理した後、室温で10分間、卓上遠心機で2,700×gで試料チューブを遠心。ペレットは、各チューブに形成すべきです。ラベルされた列に上清を追加し、別々の列に5参照サンプルをピペット。
- 上清をピペットながら、ピペッティング植物材料を避けるためにも、ペレットの上にチップを保持します。乾燥した試料を使用した場合、上清量が1.0未満mLであることに注意してください。
- 試料管の残りのペレットに70%のMeOH 1 mLを加え、15分間超音波浴中に置く前に、管をボルテックス。ステップ4.4のように、再びチューブを遠心し、supernaを追加各列にtants。カラム材料の特性に起因して、グルコシノレートの負に帯電した硫酸基は、具体的にはカラムに保持されます。
- 3連続ステップで抽出物を用いてカラムを洗浄します。
- 各カラムに70%のMeOHピペット2×1 mLです。次の1ミリリットルを追加する前にドライ実行するには、列を待ちます。これは、抽出物( 例えば、クロロフィル)からより多くの無極性化合物を除去します。
- 各列に超純水1mLを添加することにより、メタノールを洗い流します。
- ピペットスルファターゼ反応のための最適な条件を作成するには、各列に20 mMののNaOAc緩衝液の2×1 mLです。
- 廃棄トレイの外に列を持つラックを取り、組織とラックの足を乾燥させます。バイアルおよび標識された管をブロックの上にラックを置きます。各カラムの先端が対応する、標識された、2 mLチューブであることを確認します( 図1を参照)。
- スルファターゼsolutiの20μLを追加します。列に上。スルファターゼは、カラム材料の表面に到達していることを確認してください。 NaOAcのピペット50μLスルファターゼを下にフラッシュするために、各列の上にバッファ。アルミホイルで列をカバーし、一晩放置。
注:スルファターゼの活動のため、硫酸基は、それらが水で溶出することができるように列からdesulfoglucosinolatesを解放し、削除されます。詳細については、Crocoll らを参照してください。 19。 - 翌日、各カラムに超純水の2×0.75ミリリットルをピペットでdesulfoglucosinolatesを溶出。すべての列が乾燥し実行した場合には、列のラックを持ち上げ、反応チューブから取り外します。
- チューブ(キャップの穴があることを確認してください)キャップと液体窒素中またはそれらを凍結-80℃のフリーザー30分間。凍結乾燥のすべての水を除去する(サンプル数や凍結乾燥機の容量に応じて)12〜24時間のためのサンプルを。
- 凍結乾燥した後に、超純水の正確な量(通常1.0 mL)中に残渣を再溶解します。ラベル付きHPLCバイアルにサンプルと5シニグリン参照を転送します。 2週間まで冷蔵庫(4℃)またはHPLCでそれらを分析する前に、冷凍庫(-20℃)のために1年まででサンプルを保管してください。
- ガラスカラムは一晩フードの下で乾燥させますと、乾燥時にそれらを配置。再利用のためのステップ4.5で使用されているサンプルチューブから金属球を回収し、廃棄物処理容器にチューブを入れます。
抽出サンプルの5 HPLC測定
- アセトニトリル-水勾配( 表1参照)及び0.75 ml /分および40℃のカラム温度の流れと逆相C 18カラム(4.6×150ミリメートル、3ミクロン、300オングストローム)のグルコシノレートを区切ります。 229 nmで検出および定量化を行います。
- 同じ列上のが、適応勾配でシニグリン参照を測定します溶剤の使用を低減する方法( 表2参照)。最も低い濃度の参照で始まり、5シニグリン参照を注入することで起動します。次いで、カラムをきれいにし、ピークのキャリーオーバーを防止するために、10回に1回のサンプル後のメタノール注入(空白)を含む、サンプルを注入。
| 時間[分] | 流量[ml /分] | % 水 | %B ACN |
| 1 | 0.750 | 98 | 2 |
| 35 | 0.750 | 65 | 35 |
| 40 | 0.750 | 98 | 2 |
| カラム温度40°C。 | |||
表1:グルコシノレートの分離とanalysiためのアセトニトリル-水勾配逆相HPLCのS。
| 時間[分] | 流量[ml /分] | % 水 | %B ACN |
| 1 | 0.750 | 98 | 2 |
| 10 | 0.750 | 89.3 | 10.7 |
| 11 | 0.750 | 98 | 2 |
| カラム温度40°C。 | |||
表2:グルコシノレートの定量化のために使用される5シニグリン参照の定量化のための短縮アセトニトリル-水勾配。
6.グルコシノレートの同定と定量
- 識別
- 商業的に無駄でUVスペクトルと試料のピークの保持時間の比較ことができ、純粋なグルコシノレートの参照。様々なグルコシノレートのクラスからのUVスペクトルの例については、 図2を参照してください。
- 可能な場合、参照標準またはLC-MS 18、19日に未知のグルコシノレートを識別します。
- 可能な場合は、核磁気共鳴(NMR)を用いて、未知のグルコシノレートを識別します。
- 図2、 表3、データベース、または参考文献のものとピークのUVスペクトルおよび保持時間を比較。
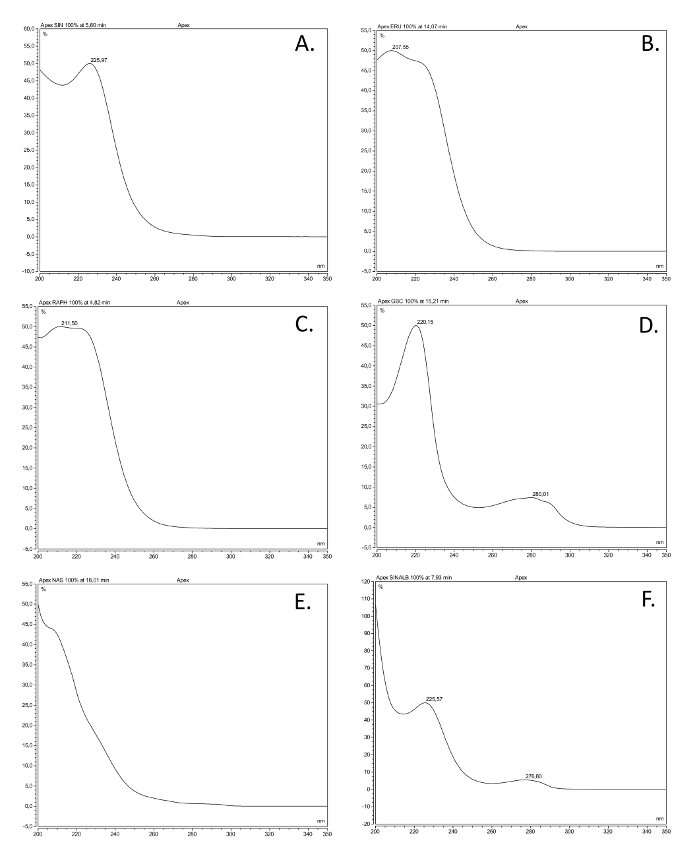
最も一般的なグルコシノレートクラスの図2. UVスペクトル。最も一般的な構造クラスを表す、ここで説明したように抽出された市販の参照化合物で作られたソリューションに基づいて6 desulfoglucosinolates(GSL)のUV吸収スペクトル(200-350 nm)で、。一般名、Structural名(括弧の間)、および構造クラスが与えられています。 (A)シニグリン(2-プロペニルGSL)アルケニル; (B)glucoerucin(4-methylthiobutyl GSL)、チオアルケニル。 (C)グルコラファニン(4- methylsulfinlybutyl GSL)、スルフィニル。 (D)glucobrassicin(インドール-3-イルメチルGSL)、インドール。 (E)gluconasturtiin(2-フェニルエチルGSL)、芳香族。 (F)シナルビン(4-ヒドロキシGSL)、芳香族。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 定量化
- 5シニグリン参照およびサンプルのピーク下の面積を統合します。
- 統合された面積に基づいて5測定シニグリン参照の検量線を計算します。回帰直線の方程式を使用グルコシノレート(式2を参照)の補間された量を算出する(式1参照)。
- 別のグルコシノレートの濃度を計算するために、EC(1990)16、ブフナー(1987)15、またはBrown らから229 nmでの検出に応答因子(M)で補間量(X)を乗算します。 (1993)17。最も一般的に検出さdesulphoglucosinolatesのコンセンサス応答因子は、 表3に示します。
注:応答因子は異なる符号を与えられた異なる値が(参考文献15-17を参照)があることを理由とすることができる。これはシステム間で異なる場合があります。それにもかかわらず、値はほとんどが非常に近く、構造クラスと同様の範囲内にあります。 glucobrassicinおよびその他のインドールグルコシノレート( 図2)と同様のUVスペクトルを持つ未知のインドールグルコシノレートのために、取得する応答係数として0.25を使用することをお勧めだろうが、大会に続いて、1に正体不明のグルコシノレートの応答係数を設定濃度の現実的な推定値( 表3)。 - 試料中のグルコシノレートの最終的な量(のx t)を計算するために、希釈係数(D)とを考慮に入れ、分析に用いた試料の質量(W)を(式3参照)を取ります。
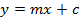 (1)
(1) 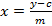 (2)
(2) 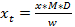 (3)
(3)
Y =ピーク面積
基準5点回帰曲線のメートル=傾き
C = Y軸との回帰直線の切片
抽出物中のグルコシノレートのX =量
植物試料中のグルコシノレートのX トン =濃度
D =希釈係数
らブフナー(1987)またはブラウンから229 nmでの検出のためのMは=応答係数。 (1993)
W =試料の質量を抽出するために使用
結果
このメソッドは、すべての構造クラス( 図3)で一般的に見desulfoglucosinolatesの検出および分離を可能にします。有害な2-hydroxyglucosinolate progoitrinは比較的早いクロマトグラムで来て、明らかに有益なグルコシノレートグルコラファニン、このサンプルで唯一methylsulfinylglucosinolateから分離されています。シニグリン、gluconapin、及びglucobrassicanapinが増加側鎖長(C3、C4、およびC5のそれぞれ)のアルケニルグルコシノレートのeluotropic系列を形成します。同様の論理シリーズは2 methylthioalkenylのグルコシノレート、glucoiberverin(C3)とglucoerucin(C4)用に可視です。 3インドールのグルコシノレート、glucobrassicinおよびその誘導体、4-ヒドロキシおよび1-methoxyglucobrassicin(neoglucobrassicin)のピークは、また明確に分離されています。なお、neoglucobrassicinとglucoerucinのピーク、ならびにgluconasturtiin、唯一の芳香族グルコこのサンプルのsinolateは、原因ミックス9に根抽出物のほかに、このアブラナ属抽出物中の特に高いです。
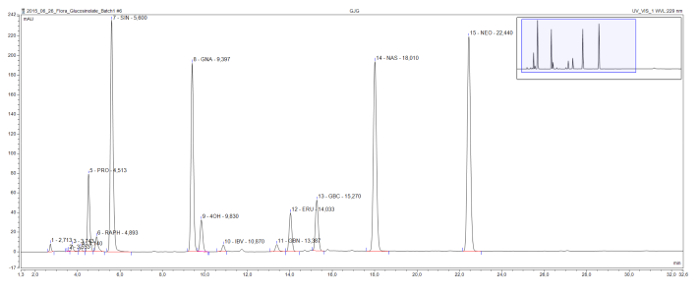
図3:グルコシノレート抽出物のクロマトグラム。 アブラナ属黒質、B.ラパと B.オレラセアからの合成ルートと撮影サンプルの分析から得られたHPLCクロマトグラムの詳細(1-32分)。ピークラベルは、保持時間と識別さdesulfoglucosinolates(GSL)の省略形を示しています。 PRO = progoitrin(2-OH-3-ブテニルGSL)。 RAPH =グルコラファニン(4-methylsulfinlybutyl GSL)。 SIN =シニグリン(2-プロペニルGSL)、GNA = gluconapin(3-ブテニルGSL)。 4OH = 4-hydroxyglucobrassicin。 IBV = glucoiberverin(3-メチルチオプロピルGSL)。 GBN = glucobrassicanapin(4-ペンテニルGSL)。 ERU = glucoerucin(4-methylthiobutyl GSL)。 GBC = glucobrassicin(インドール-3-イルメチルGSL); NAS = gluconasturtiin(2-フェニルエチルGSL)。 NEO = neoglucobrassicin(1-のMeOH-glucobrassicin)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Rorippaのaustriacaの根抽出物に見られるように、一般的にモデル植物シロイヌナズナで発見された長鎖メチルスルフィニルグルコシノレートは、また、eluotropicシリーズを示しています。 Glucohesperalin(C6)、glucosiberin(C7)、glucohirsutin(C8)、およびglucoarabin(C9)は、クロマトグラム( 図4)上に一定の間隔で表示されます。一緒にピークのUVスペクトルと、そのようなeluotropic論理シリーズは、未知のグルコシノレートを分類し、仮識別するために使用することができます。
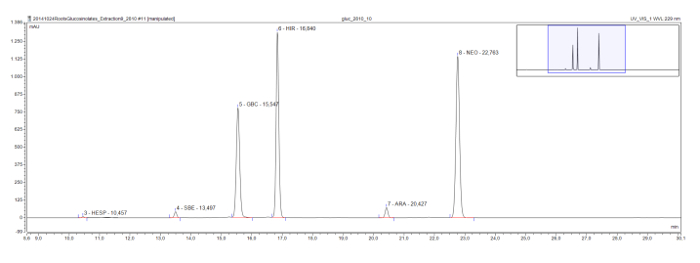
図4:クロマトグラム(フレーム9月30日分)Rorippa austriaca根エキスでdesulfoglucosinolatesの。ピークラベルは、保持時間と識別さdesulfoglucosinolates(GSL)の省略形を示しています。 HES = glucohesperin(6-methylsulfinylhexyl GSL)。 SBE = glucosiberin(7-methylsulfinylheptyl GSL)。 GBC = glucobrassicin(インドール-3-イルメチルGSL)。 HIR = glucohirsutin(8-methylsulfinlyoctyl GSL)。 ARA = glucoarabin(9-methylsulfinylnonylglucosinolate); NEO = neoglucobrassicin(1-のMeOH-glucobrassicin)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| 一般名 | 側鎖構造 | RT(分)* | 229 nmの | 参照# |
| aliphatiCグルコシノレート | ||||
| Glucocapparin | メチル | 3.5 | 1 | 褐色 |
| シニグリン | 2-プロペニル | 5.5 | 1 | ブラウン、EC |
| Gluconapin | 3-ブテニル | 9.5 | 1.11 | EC |
| Glucobrassicanapin | 4-ペンテニル | 13.5 | 1.15 | EC |
| Glucoiberverin | 3 - メチルチオプロピル | 10.9 | 0.8 | 褐色 |
| Glucoerucin | 4-methylthiobutyl | 14.0 | 0.9 | 褐色 |
| Glucoiberin | 3-methylsulfinylpropyl | 3.7 | 1.2 | 褐色 |
| グルコラファニン | 4 - メチルスルフィニルブチル | 4.9 | 0.9 | 褐色 |
| Glucoalyssin | 5-methylsulfinylpentyl | 7.6 | 0.9 | 褐色 |
| Glucohesperin | 6-methylsulfinylhexyl | 10.5 | 1 | 褐色 |
| Glucosiberin | 7-methylsulfinylheptyl | 13.5 | 1 | 褐色 |
| Glucohirsutin | 8-methylsulfinyloctyl | 16.8 | 1.1 | 褐色 |
| Glucoarabin | 9-methylsulfinylnonyl | 20.5 | 1 | |
| Glucocheirolin | 3-methylsulfonylpropyl | 4.2 | 0.9 | 褐色 |
| Progoitrin | 2(R)-OH -3-ブテニル | 4.5 | 1.09 | ブフナー、EC |
| Gluconapoleiferin | 2-OH-5ペンテニル | 8.3 | 1 | EC |
| インドールグルコシノレート | ||||
| 4-hydroxyglucobrassicin | 4-hydroxyindol -3-イルメチル | 11.2 | 0.28 | ブフナー、EC |
| Glucobrassicin | インドール-3-イルメチル | 15.3 | 0.29 | ブフナー、EC |
| 4-Methoxyglucobrassicin | 4-methoxyindol -3-イルメチル | 18.2 | 0.25 | ブフナー、EC |
| Neoglucobrassicin | 1-methoxyindol -3-イルメチル | 22.5 | 0.2 | ブフナー、EC |
| 芳香族グルコシノレート | ||||
| シナルビン | 4-ヒドロキシベンジル | 8.1 | 0.5 | ブフナー |
| Glucosibarin | 2(R)-OH -2-フェニルエチル | 12.1 | 0.95 | 次を見ます |
| Glucobarbarin | 2(S)-OH -2-フェニルエチル | 12.7 | 0.95 | ブフナー |
| Glucotropaeolin | ベンジル | 13.8 | 0.95 | ブフナー、EC |
| Gluconasturtiin | 2-フェニルエチル | 18.0 | 0.95 | ブフナー、EC |
| 不明- UVスペクトルのような芳香族/脂肪族 | 1 | EC | ||
| 不明-スペクトルのようなインドール | 0.25 | EC | ||
| *おおよその保持時間(RT)は(カラム、溶離液の品質に応じて0.3分±)最寄りの0.1分に丸め。保持時間は、C 18カラム(150×4.6ミリメートル、3マイクロメートルの粒子サイズ)を加えたC 18を搭載したThermoFisher /ダイオネックス究極のHPLCプラットフォーム上で決定されています表1のように、勾配プログラムUB>プレカラム(10×4.6 mmの5マイクロメートルの粒子サイズ)。 | ||||
| 応答因子について#参照:菜種におけるグルコシノレートでブフナー、R.(エドJP Wathelet)50-58(マルチネスネイホフ出版、1987)。ブラウン、PD、徳久、JG、ライヒェルト、M.&Gershenzon、異なる器官およびシロイヌナズナの発達段階のうち、グルコシノレート蓄積のJ.バリエーション。植物化学。 62(3)、471-481、DOI:10.1016 / S0031-9422(02)00549から6、(2003)。 EC。油糧種子 - グルコシノレート高速液体クロマトグラフィーの決意。欧州共同体官報。 Lの28分の170。附属書VIII 03.07.27-34(1990)。 | ||||
表3:最も一般的にC 18カラム上の植物抽出物及びそれらのおおよその保持時間にdesulfo-グルコシノレート発見の応答要因。溶離液、gradien表1のようなT、カラム温度、及び流量。
ディスカッション
この確立され、広く使用されている方法の最大の利点は、それが堅牢であることかなり単純であり、サンプルあたりの比較的低コスト。抽出および分析のために必要な機器の大半は、標準的な実験室で利用可能であるべきか、HPLC-PDAを除いて、自己構築することができます。もう一つの利点は、抽出物は、容易に他の場所でHPLC分析のために出荷することができたので、涼しく、気密(HPLC)バイアルに保管時に水に溶解しdesulfoglucosinolatesは、化学的に非常に安定していることです。ソフトウェアを管理し、データを分析するための専門的なトレーニングと豊富な実務経験を必要とし、LC-MSプラットフォームとは対照的に、HPLC-UV / PDAが簡単に、短いトレーニング期間後に実行することができます。これは、手順のコストを削減するだけでなく、学生を含む科学者の幅広い、この方法よりアクセスできるようになりませんのみ。
一般的に、上記の手順はcarefuを追っているときLLY、いくつかの問題が発生する必要があります。一般的には、グルコシノレートのピークが非常によくクロマトグラムで分離されます。そうでない場合、勾配プログラムは、溶出液中のアセトニトリルの増加率を減少させることによって適合させることができます。代わりに、新しいプレカラム(200-500注射)または列(1500 -2000注射)で構築することは、問題を解決することがあります。時折、バッチ内の単一のサンプルのクロマトグラムは、非常に小さい、または全くピークを示してもよいです。これは、スルファターゼを追加するときに起因するピペッティングエラーのために通常である( 例えば、列がスキップされたか、スルファターゼが正しく列にダウンして洗浄しませんでした)。また、実験材料中のグルコシノレート濃度が予想よりも低くされている可能性があり、あまりにも少しの材料を抽出するために使用しました。後者の場合は、注入容量は100μLまで増加させることができる、または抽出物の正確なアリコート( 例えば、800μL)を濃縮することができます。後者は、凍結乾燥することによって達成することができます水の少量( 例えば、100μL)で残留物を溶解し、抽出液をる、と同じ基準曲線を使用して再注入。抽出物の元の濃度の計算では、数字は、希釈率を掛けなければなりません。これで問題が解決しない場合、材料は、出発物質を使用して再度抽出する必要があります。これ以上の100mgの場合には、抽出溶媒の容積、チューブのサイズは、抽出効率を維持するために比例的に調整されるべきです。
さらなる利点は、この方法は、十分に検証されたことです。それは、手順および精度は、いくつかの研究室16で確認されたため菜種におけるグルコシノレートの定量のための標準的な方法として記載されているからです。また、遺伝的背景、生合成、及びグルコシノレートの生物学的機能はモッズに、熱心な研究努力の対象となっています他の4、6、12のうち、エル植物種のシロイヌナズナ 。したがって、シニグリンとの関係でdesulfoglucosinolatesの正確な定量化のための多くの応答因子は十分に定義されており、15,17公的に利用可能。 LS-MSベースのプロトコルは、より感度の高い、より高スループットであり、LC-MSは、制限のために(仮に)、ユニバーサル応答因子の欠如を全く基準が18、19、20用意されていないいるグルコシノレートを識別することができるにもかかわらずグルコシノレート濃度18の正確な定量化。また、これらの方法は、通常、凍結乾燥工程を含まない、新鮮な植物材料中の水の量は、正確な定量化が困難、計算で行方不明です。我々の抽出方法が含まれるため最後に、列ベース精製および濃縮工程、それはまた、土壌21等のグルコシノレートの低い濃度で「汚れた」サンプルに適用することができます。
通常、新鮮に凍結された物質を抽出する抽出のために96ウェルプレートを使用し、スルファターゼステップ18、19を含まないLC-MSベースの方法に比べて、私たちの方法は、比較的時間がかかり、労働激しいです。このホワイトペーパーで説明する列ラックを使用すると、単一の人は1日に約100から150サンプルを抽出することができます。溶出(翌日)、(一晩)凍結乾燥し、再溶解は、次の2日以内に行うことができます。自動化されたHPLCインジェクター、注射当たり40〜45分のランと平衡時、ノー不測の事態で、それはこのサンプルセットのデータを取得するために3-4日かかるだろう。 HPLCソフトウェアはシニグリン曲線、クロマトグラムの手動チェックとPEに基づく自動定量化を可能にする場合データは、統計分析のために使用することができる前に、100サンプルについてのkの割り当ては、他の1または2時間を取ることができます。
グルコシノレートの基準の増加が利用可能であるにもかかわらず、130以上の候補者のわずかな部分だけは、現在、商業的に購入することができます。しかし、生合成の各クラスのためのいくつかの参照を持ちます。化合物を指定する文献データベースへのアクセスは、以前に植物種に見られる( 例えば、フェイヒーら22);このようなeluotropicシリーズのロジックのようなクロマトグラフィーの原則の基本的な知識( 例えば、脂肪族化合物中の側鎖にCsの数を増加させるため、3及び図 4)。およびNMR 23、1のLC-MS 19または単離されたグルコシノレート上の単一のサンプルの検証は簡単にこの制限を克服することができます。グルコシノレートのためのほとんどのプロトコルは内部基準曲線を使用して分析します( すなわち、溶媒抽出16、17、19シニグリンの抽出またはシナルビンある濃度)。主に、内部基準曲線は、個々のサンプルの処理エラーを補正することがより適切であり、従って、理論的に、より高い精度をもたらします。この利点にもかかわらず、我々は、多くの場合( 例えば、クロガラシ 24)またはシナルビン( 例えば、ホワイトマスタード 25)、シニグリンの高レベルが含まれているそのうちのいくつかの異なる野生種を、分析するように、5点外部参照曲線を使用することを好みます2グルコシノレートの参照が対象の応答因子が用意されています。ハイグレードグルコシノレートの参照標準は、通常、非常に高価であるためまた、各サンプルに内部標準を添加して、分析のコストを増大させます。
結論として、時間のかかる手順にも関わらず、このプロトコル植物試料にグルコシノレートを抽出し、定量化するための簡単でアクセス可能な方法を提供します。しかし、グルコシノレートレベル自体がミロシナーゼと反応する必要性と見電位の生物学的活性の唯一の指標である、との反応生成物の変化は、単一のグルコシノレート11から生じ得ることを考慮することが重要です。検証アッセイは、生物学的関連性を確認するために実行する必要があります。
開示事項
The authors have nothing to disclose.
謝辞
NMvD thanks Dr. Michael Reichelt (Max-Planck-Institute for chemical Ecology, Jena, Germany) for providing the first reference samples when she started using this method 16 years ago. Ciska Raaijmakers (NIOO-KNAW, Wageningen, the Netherlands), Sebastian Krosse (B-Ware, Nijmegen, the Netherlands), and Christian Ristok (iDiv, Leipzig) are acknowledged for improving the protocol over the course of the years. Mirka Macel and Martine Huberty (University Tübingen, Germany) are acknowledged for their permission to use the Rorippa chromatogram. The authors gratefully acknowledge the support of the German Centre for Integrative Biodiversity Research (iDiv) Halle-Jena-Leipzig, funded by the German Research Foundation (FZT 118).
資料
| Name | Company | Catalog Number | Comments |
| Methanol HiPerSolv CHROMANORM® gradient grade for HPLC grade | VWR | 20,864,320 | |
| Sodium acetate (NaOAc) | Sigma-Aldrich | W302406-1KG-K | |
| HCL | VWR | 1,090,571,000 | |
| Sephadex | Sigma-Aldrich | A25120-10G | |
| (−)-Sinigrin hydrate from horseradish | Sigma-Aldrich | S1647-500MG | |
| Aryl Sulfatase | Sigma-Aldrich | S9626-10KU | |
| Ethanol | VWR | 20,816,298 | |
| Pasteur Pipette | Carl Roth | 4518.1 | |
| Glass Wool | Carl Roth | 7377.1 | |
| Glass /wooden stick | VWR | HERE1080766 | |
| 2 mL reaction tubes | VWR | 211-2606 | |
| Dissecting needle | Carl Roth | KX93.1 | |
| Rotilabo-lab dishes | Carl Roth | 0772.1 | Waste tray |
| Freeze Dryer Freezone 12 L | Labconco | 7960030 | |
| Acetonitril super gradient grade | VWR | 83,639,320 | |
| Water bath | VWR | 462-5112 | |
| Ultrasonic bath | Fisher Scientific | FB 15061 | |
| PH Electrode | Thermo Fisher Scientific | STARA2115 | |
| Centrifuge Heraeus Multifuge X1 | Thermo Fisher Scientific | 75004210 | |
| Pre-Column | Thermo Fisher Scientific | 69697 | C18 column (4.6 x 10 mm, 5 µm, 300 Å) |
| Column Acclaim 300 | Thermo Fisher Scientific | 60266 | C18 column (4.6 x 150 mm, 3 µm, 300 Å) |
| HPLC Ultimate 3000 | Thermo Fisher Scientific | with column oven and UV or PDA detector | |
| Flask 1000 mL | VWR | 215-1595 | |
| Glucosinolate reference compounds | Phytoplan | various | http://www.phytoplan.de/ |
参考文献
- Hartmann, T. From waste products to ecochemicals: Fifty years research of plant secondary metabolism. Phytochemistry. 68 (22-24), 2831-2846 (2007).
- Will, H., Laubenheimer, A. Ueber das Glucosid des weissen Senfsamens. Justus Liebigs Annalen der Chemie. 199 (1), 150-164 (1879).
- Agerbirk, N., Olsen, C. E. Glucosinolate structures in evolution. Phytochemistry. 77, 16-45 (2012).
- Halkier, B. A., Gershenzon, J. Biology and biochemistry of glucosinolates. Ann Rev Plant Biol. 57, 303-333 (2006).
- Sønderby, I. E., Geu-Flores, F., Halkier, B. A. Biosynthesis of glucosinolates - gene discovery and beyond. TIPS. 15 (5), 283-290 (2010).
- Kliebenstein, D. J., et al. Genetic control of natural variation in Arabidopsis glucosinolate accumulation. Plant Physiol. 126 (2), 811-825 (2001).
- van Leur, H., Raaijmakers, C. E., van Dam, N. M. A heritable glucosinolate polymorphism within natural populations of Barbarea vulgaris. Phytochemistry. 67 (12), 1214-1223 (2006).
- Kelly, P. J., Bones, A., Rossiter, J. T. Sub-cellular immunolocalization of the glucosinolate sinigrin in seedlings of Brassica juncea. Planta. 206 (3), 370-377 (1998).
- van Dam, N. M., Tytgat, T. O. G., Kirkegaard, J. A. Root and shoot glucosinolates: a comparison of their diversity, function and interactions in natural and managed ecosystems. Phytochem Rev. 8 (1), 171-186 (2009).
- Ratzka, A., Vogel, H., Kliebenstein, D. J., Mitchell-Olds, T., Kroymann, J. Disarming the mustard oil bomb. Proc Natl Acad Sci U S A. 99 (17), 11223-11228 (2002).
- Wittstock, U., Kliebenstein, D. J., Lambrix, V., Reichelt, M., Gershenson, J., Romeo, J. T. . Integrative Phytochemistry: From ethnobotany to molecular ecology: Recent Advances in Phytochemistry. 37, (2003).
- Hopkins, R. J., van Dam, N. M., van Loon, J. J. A. Role of glucosinolates in insect-plant relationships and multitrophic interactions. Ann Rev Entomol. 54 (1), 57 (2009).
- Kliebenstein, D. J., Gershenzon, J., Mitchell-Olds, T. Comparative quantitative trait loci mapping of aliphatic, indolic and benzylic glucosinolate production in Arabidopsis thaliana leaves and seeds. Genetics. 159 (1), 359-370 (2001).
- Mithen, R., Bennett, R., Marquez, J. Glucosinolate biochemical diversity and innovation in the Brassicales. Phytochemistry. 71 (17-18), 2074-2086 (2010).
- Buchner, R., Wathelet, J. P. . Glucosinolates in rapeseed. , 50-58 (1987).
- . Oil seeds - determination of glucosinolates High Perfomance Liquid Chromatography. Official Journal of the European Communities. , 27-34 (1990).
- Brown, P. D., Tokuhisa, J. G., Reichelt, M., Gershenzon, J. Variation of glucosinolate accumulation among different organs and developmental stages of Arabidopsis thaliana. Phytochemistry. 62 (3), 471-481 (2003).
- Glauser, G., Schweizer, F., Turlings, T. C. J., Reymond, P. Rapid Profiling of Intact Glucosinolates in Arabidopsis Leaves by UHPLC-QTOFMS Using a Charged Surface Hybrid Column. Phytochem Analysis. 23 (5), 520-528 (2012).
- Crocoll, C., Halkier, B. A., Burow, M. . Current Protocols in Plant Biology. , (2016).
- Griffiths, D. W., Bain, H., Deighton, N., Botting, N. P., Robertson, A. A. B. Evaluation of liquid chromatography-atmospheric pressure chemical ionisation-mass spectrometry for the identification and quantification of desulphoglucosinolates. Phytochem Analysis. 11 (4), 216-225 (2000).
- Gimsing, A. L., Kirkegaard, J. A. Glucosinolates and biofumigation: fate of glucosinolates and their hydrolysis products in soil. Phytochem Rev. 8 (1), 299-310 (2009).
- Fahey, J. W., Zalcmann, A. T., Talalay, P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants. Phytochemistry. 56, 5-51 (2001).
- de Graaf, R. M., et al. Isolation and identification of 4-α-rhamnosyloxy benzyl glucosinolate in Noccaea caerulescens showing intraspecific variation. Phytochemistry. 110, 166-171 (2015).
- van Dam, N. M., Raaijmakers, C. E. Local and systemic induced responses to cabbage root fly larvae (Delia radicum) in Brassica nigra and B. oleracea. Chemoecology. 16 (1), 17-24 (2006).
- Gols, R., et al. Temporal changes affect plant chemistry and tritrophic interactions. Bas Appl Ecol. 8 (5), 421-433 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved