Method Article
שיטה פשוטה עבור Glucosinolate הפקה וניתוח עם כרומטוגרפיה נוזלית בלחץ גבוה (HPLC)
In This Article
Summary
Here, we describe in great detail an established and robust protocol for the extraction of glucosinolates from ground plant materials. After an on-column sulfatase treatment of the extracts, the desulfoglucosinolates are eluted and analyzed by high-pressure liquid chromatography.
Abstract
Glucosinolates are a well-studied and highly diverse class of natural plant compounds. They play important roles in plant resistance, rapeseed oil quality, food flavoring, and human health. The biological activity of glucosinolates is released upon tissue damage, when they are mixed with the enzyme myrosinase. This results in the formation of pungent and toxic breakdown products, such as isothiocyanates and nitriles. Currently, more than 130 structurally different glucosinolates have been identified. The chemical structure of the glucosinolate is an important determinant of the product that is formed, which in turn determines its biological activity. The latter may range from detrimental (e.g., progoitrin) to beneficial (e.g., glucoraphanin). Each glucosinolate-containing plant species has its own specific glucosinolate profile. For this reason, it is important to correctly identify and reliably quantify the different glucosinolates present in brassicaceous leaf, seed, and root crops or, for ecological studies, in their wild relatives. Here, we present a well-validated, targeted, and robust method to analyze glucosinolate profiles in a wide range of plant species and plant organs. Intact glucosinolates are extracted from ground plant materials with a methanol-water mixture at high temperatures to disable myrosinase activity. Thereafter, the resulting extract is brought onto an ion-exchange column for purification. After sulfatase treatment, the desulfoglucosinolates are eluted with water and the eluate is freeze-dried. The residue is taken up in an exact volume of water, which is analyzed by high-pressure liquid chromatography (HPLC) with a photodiode array (PDA) or ultraviolet (UV) detector. Detection and quantification are achieved by conducting comparisons of the retention times and UV spectra of commercial reference standards. The concentrations are calculated based on a sinigrin reference curve and well-established response factors. The advantages and disadvantages of this straightforward method, when compared to faster and more technologically advanced methods, are discussed here.
Introduction
הערכה היא כי צמחים מייצרים למעלה מ -200,000 סוגים שונים של תרכובות כימיות 1. רק המיעוט של תרכובת אלה נראה למלא תפקיד בחילוף החומרים העיקריים של הצמח, אשר דלקי גידול ורבייה; מה שנקרא הרוב הם מטבוליטים משניים. למרות שמם, מטבוליטים משניים הם לעתים קרובות קריטיים להישרדות צמח ורבייה, כפי שהם משרתים למשוך מאביקים או להגן על הצמח מפני פתוגנים ואוכלי עשב 1.
Glucosinolates הם קבוצה מגוונת מאוד של מטבוליטים משניים כי נחקרו למעלה מ -150 שנה 2. נכון להיום, יותר מ -130 glucosinolates שונים מבחינה מבנית זוהו 3. באופן כללי, glucosinolates נחלק לסוגים שונים המבוססים על חומצות אמיניות שממנו הם מסונתזים. glucosinolates אינדול, למשל, מסונתזים מן חומצת אמינוטריפטופן, פנילאלנין ואילו מספק את שלד הבסיס לסינתזה של glucosinolates ארומטיים 4. במסגרת שיעורים, יש רמה גבוהה של גיוון מבני, אשר מובא על ידי צעדי התארכות שרשרת רציפי מסלולי biosynthetic, כגון בכיתה של glucosinolates אליפטיות, או על ידי שינויי שרשרת צד (למשל, hydroxylation) 4, 5. אחת מיני צמחי glucosinolate עשויים להכיל עד 37 glucosinolates שונים השייכים כיתות מבניות שונות 6. למרות מיני צמחים יש פרופילים glucosinolate טיפוסי, וריאציה intraspecific עבור סוגי glucosinolates נמצא לעתים קרובות בקרב אנשים ואוכלוסיות 6, 7. Glucosinolates השלם מאוחסן vacuoles של תאי צמח ניתן למצוא בכל איבר עילי או belowground 7, 8, 9. עם תא קרע (למשל, על ידי herbivory), glucosinolates משתחררת מעורבבות עם האנזים myrosinase בקיזוז פצצת שמן חרדל 10. בשל הפעילות של myrosinase, ו בהתאם למבנה של glucosinolate, תנאי התגובה, ואת הנוכחות של אנזימי שינוי, תרכובות חריפות, רעילות או מזיקים שונות נוצרות, כגון nitriles ו (ISO) thiocyanates 11. מוצרי התגובה יש פעילויות ביולוגיות גבוהות; למשל, הם משמשים דוחים של אוכלי עשב חרק generalist 12. התורשתיות ואת biosynthetic המסלולים של glucosinolates נלמדים היטב, בעיקר בגלל חשיבותם אוכלי עשב והתנגדות הפתוגן, ערכם כרכיבי טעם ב חרדל וכרוב, והשלילי שלהם (progoitrin) וחיוביות (glucoraphanin) השפעות על בריאות אדם 5, 13, 14.
בגלל העניין הרב glucosinolates כמו תרכובות ביולוגיות אקטיביות, שיטות חילוץ וזיהוי מבוססות על כרומטוגרפיה הנוזלית התהפכו פאזיים בלחץ גבוה (HPLC) מצויד אולטרה סגול (UV) או מערך photodiode (PDA) גלאים כבר נפוצים מאז 1980 15 . בהתבסס על שיטה זו, הקהילה האירופית פרסמה פרוטוקול סטנדרטי אשר נבדק ומאומת בכמה מעבדות לניתוח של glucosinolates ב בוטנים (Brassica napus, כרוב הנפוס, קנולה 16). אחרים הוסיפו שיטה זו (למשל, על ידי קביעת גורמי מענה נוספים עבור glucosinolates שאינם נוכחים אונס זרעים להפקת שמן) 17. למרות הזמינות הגוברת של ספקטרומטריית מסה כרומטוגרפיה נוזלית (LC-MS) פלטפורמות ופרוטוקולים תפוקה גבוהה לניתוח glucosinolate 18 , 19, שיטת HPLC-UV / PDA המקורי עדיין נעשה שימוש נרחב על ידי מדענים. הסיבות העיקריות הן כי שיטה זו היא פשוטה, חסכונית, יחסית נגיש למעבדות ללא תשתית הידע הכימי-אנליטי נרחב. כדי לשרת את הקהילה הזו, אנחנו כאן בפירוט את הפרוטוקול עבור החילוץ של glucosinolates מחומרים הצמח ועל ניתוח desulfo-צורותיהם עם HPLC-PDA.
Protocol
1. הכנת פתרונות דרושה עבור הפקת Glucosinolate
- הכן 500 מ"ל של 70% מתנול (MeOH) במים (ultrapure) בתוך בקבוק זכוכית. עבור 100 דגימות ו -5 תקנים, 420 מ"ל של 70% MeOH נדרשת.
- הכן נתרן אצטט 20 מ"מ (NaOAc) (pH = 5.5) על ידי הוספת 0.82 גרם של NaOAc או 1.36 גר 'NaOAc x 3 H 2 O ב 500 מ"ל מים; להתאים את ה- pH עם מימן כלורי (HCl). אחסן את NaOAc במקרר. עבור 100 דגימות ו -5 תקנים, 370 מ"ל של 20 מ"מ NaOAc (pH = 5.5) במים נדרשת.
- כדי להכין את חומר הטור, לערבב 10 גרם של ג'ל dextran הצולב (סוג G-25) עם 125 מיליליטר מי ultrapure. אחסן את התערובת וכתוצאה מכך (C ° 4) במקרר.
- הכנת תמיסת sulfatase
- ממיסים 10,000 יחידות של sulfatase aryl (מסוג H-1 מ pomatia Helix) ב 30 מ"ל מים ultrapure ולהוסיף 30 מ"ל של אתנול אבסולוטי (EtOH). מערבבים את הפתרון גם ולהעבירו CEN 250 מ"ל אחדצינור trifuge או צינורות קטנים מרובים, בהתאם לזמינות.
- צנטריפוגה את התערובת על 2,650 XG במשך 20 דקות בטמפרטורת החדר (RT). מעבירים את supernatant (ים) מבחנה; להוסיף 90 מ"ל של EtOH ומערבבים אותו. צנטריפוגה את תערובת צינורות צנטריפוגה אחת או יותר 1,030 XG במשך 15 דקות ב RT.
- מחק את supernatants. ממסים ולשלב את הכדורים ב סך של 25 מיליליטר של מי ultrapure. וורטקס היטב, לוותר צינורות 1 מ"ל, ולאחסן במקפיא ב -20 ° C; הם ישמרו במשך שנה אחת לפחות.
- הכנת תמיסת התייחסות sinigrin
- לשקול בסביבות 9 מ"ג מונוהידראט sinigrin עם דיוק 1-מיקרוגרם (למשל, 8.769 מ"ג). ולהעביר אותו לתוך בקבוק מדידה 10 מ"ל ו לפזר את מונוהידראט sinigrin ב 10.0 מ"ל של מים ultrapure.
- חשב את molarity של פתרון המניות ולהכין חמש אזכור sinigrin בין 50-750 מיקרומטר על ידי דילול של מניות פתרון. לקבלת דוגמה מפורטת, ראה S1 קובץ משלים .
- מחלק את אזכור sinigrin השונה צינורות תגובה 1.5 מיליליטר ולהקפיא אותם על 20 מעלות צלזיוס. כלול בסדרה של חמישה אזכור sinigrin בכל אצווה החילוץ. השתמש תמיד ערכי molarity הנכונים עבור המשמש כיום sinigrin אזכור בעת חישוב הריכוזים.
2. הכנת התקנת ההפקה
- כן מתל טור עבור עמודות פיפטה פסטר (לעריכת עמודות, ראה שלב 3.1). לייבל מתלה או עמודות כדי לעקוב אחר מהמספרים לדוגמה (ראה איור 1).
- הכן לחסום מחזיק אותו המספר מסומן 2-מיליליטר צינורות microcentrifuge (ראה שלב 3.3 ואיור 1)
5 / 55425fig1.jpg "/>
איור 1: Rack להפקת glucosinolate. מבט מלפנים (משמאל) מבט מלמעלה (מימין) של מתלה טור מתוצרת עצמית ולחסום למיצוי glucosinolate. גובה: 100 מ"מ, המרחק בין מוזז חורים (להחזיק את העמודות פיפטה פסטר): 30 מ"מ (ציר x) x 15 מ"מ (ציר y). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
3. הכנה של עמודות ואבובים Microcentrifuge
- הכין עמודה אחת לדגימה וחמש עמודות נוספות במשך החמש דגימות התייחסות sinigrin.
- בכל פיפטה זכוכית, במקום חתיכת צמר זכוכית כ 1 ס"מ x 1 ס"מ. השתמש במקל עץ או זכוכית לדחוף את צמר הכוס עד לנקודה שבה פיפטה מצמצם. זכוכית הצמר צריך למנוע את חומר הטור מ ואוזל, אבל לא להשתמש יותר מדי, כפי שהוא יהיה להאט את elution של העמודות. יש להשתמש בכפפות WHen לעבוד עם צמר זכוכית.
- מניח את העמודות על מדף העמודה (ראה איור 1). מניח את מתלת עמודת מגש מעבדה (מגש פסולת) כדי לתפוס את eluents המשמש כביסות הטור הרצופות.
- חותכים את 5 מ"מ הראשונה מחוץ לקצה של קצה פיפטה פלסטיק 1 מ"ל ו פיפטה 0.5 מ"ל של חומר טור מוכן (G-25 ג'ל במים, ראה שלב 1.3) לתוך כל עמודה. לנער את הבקבוק המכיל את החומר טור היטב לפני pipetting. מחק עמודות דולפות (חומר G-25 ואוזל דרך שכבת צמר זכוכית) ולהחליף בחדשים.
- לאחר pipetting החומר עמודה לתוך עמודות, להוסיף 1 מ"ל של מים ultrapure כדי לשטוף את החומר.
- הכן צינור תגובה אחת 2 מ"ל לדגימה וחמישה צינורות במשך חמש דגימות התייחסות sinigrin; לתייג אותם. השתמש איזמל המנתחים לעשות חורים הכמוסים לייבוש בהקפאה מאוחר ומקום הצינורות המוכנים לבלוק הצינור בדפוס בדיוק כמועמודות (שלב 2.2, ראה איור 1).
הפקת 4. של glucosinolates
- לשקול להקפיא יבשי חומר צמחי-טחון (בדרך כלל 50.0-100.0 מ"ג של משקל יבש; ריכוזי glucosinolate האחרונים לחלץ צריכים להיות בטווח של העקום) המתייחס 0.1 מ"ג הקרוב 2 מיליליטר, שכותרתו, עגול צינורות תגובה -bottom. הוספת שני כדורי מתכת קטנים (3 מ"מ קוטר) כמו רותחי מעכבים על צינור אחד.
הערה: הפרוטוקול יכול להיות מיושם גם טריים, חומרים-קפוא פלאש, אשר נטחנו תחת חנקן נוזלי נשמרים בהקפאה עד מיצוי. הגדל את כמות החומר שקל להפקת ואחוז MeOH בנוזל מיצוי 85% כדי לפצות על דילול ידי המים חומרים 19. - פיפטה 1 מ"ל של 70% MeOH לתוך צינור כל מערבולת בקצרה. סגור את הצינורות לאטום אותם עם כובעי בטיחות לפני הציב מהר ככל האפשר לתוך חמי wאמבטית אטר (90-92 מעלות צלזיוס) במשך כמה דקות (~ 5 דקות), עד 70% MeOH פשוט רותח. זהירות: תלבש משקפי בטיחות במהלך שלב זה!
- מניח את דוגמיות באמבטיה קולית במשך 15 דקות. בינתיים, לקחת את sulfatase והחמש דגימות התייחסות sinigrin מהמקפיא להפשיר אותם ב RT.
- לאחר-sonication אולטרה, בצנטריפוגה דוגמיות ב 2,700 XG בצנטריפוגה benchtop במשך 10 דקות ב RT; גלולה צריכה טופס בצינור אחד. מוסיפים את supernatants למדורי שכותרתו פיפטה חמש דגימות התייחסות על עמודות נפרדות.
- בעוד pipetting את supernatants, לשמור על הקצה מעל הגלולה להימנע משימוש בחומרי צמח pipetting. שים לב שכאשר דגימות היבשים משמשים, נפח supernatant יהיה פחות מ 1.0 מ"ל.
- הוסף 1 מיליליטר של 70% MeOH את הכדורים שנותרו דוגמיות מערבולת הצינורות לפני הצבתי באמבטיה קולית במשך 15 דקות. בצנטריפוגה צינורות שוב, כמו בשלב 4.4, ולהוסיף את supernatants למדורי בהתאמה; בשל תכונות חומר הטור, הקבוצה סולפט הטעונה השלילי של glucosinolates תישמר באופן ספציפי על הטור.
- שטוף את העמודות עם התמציות בשלושה שלבים רציפים.
- פיפטה 2 x 1 מ"ל של 70% MeOH על כל עמודה. חכו בעמודה לרוץ יבש לפני הוספת 1 מ"ל הבא; זו תסיר תרכובות אי-קוטביות יותר מן התמציות (למשל, כלורופיל).
- לשטוף את MeOH על ידי הוספת 1 מ"ל של מים ultrapure כל עמודה.
- פיפטה 2 x 1 מ"ל של 20 מ"מ NaOAc חיץ כל עמודה כדי ליצור את התנאים האופטימליים עבור התגובה sulfatase.
- קח את מתלה עם עמודות מתוך מגש פסולת לייבש את הרגליים של מתלה עם רקמה. מניח את המדף מעל הבלוק עם צלוחיות צינורות שכותרתו. ודא כי כל קצה טור נמצא המקביל, שכותרתו, 2 מיליליטר הצינור (ראה איור 1).
- הוסף 20 μL של sulfatase solutiעל העמודים. ודא כי sulfatase מגיע לפני השטח של חומר העמודה. פיפטה 50 μL של NaOAc חיץ על כל עמודה כדי לשטוף את sulfatase. מכסים את העמודות עם רדיד אלומיניום ולתת לעמוד במשך הלילה.
הערה: בשל הפעילות של sulfatase, קבוצת סולפט יוסרה, שחרור desulfoglucosinolates מהעמודה כדי שיוכלו elute עם המים. לתיאור מפורט, ראה Crocoll et al. 19. - למחרת, elute desulfoglucosinolates ידי pipetting 2 x 0.75 מ"ל מים ultrapure על כל עמודה. כאשר כל העמודות יש תרגיל יבשה, להרים את מתלת הטור ולהסירו מן צינורות התגובה.
- כיסוי או הצינורות (לוודא שיש חורים הכמוסים) ולהקפיא אותם בחנקן נוזלי או ב -80 ° C במקפיא למשך 30 דקות. Freeze-לייבש את הדגימות למשך 12-24 שעות (תלוי במספר דגימות ואת היכולת של ניקוז ההקפאה) כדי להסיר את כל המים.
- לאחר ייבוש בהקפאה, מחדש לפזר את שאריות נפח מדויק (בדרך כלל 1.0 מ"ל) של מים ultrapure. העברת הדגימות וחמישה האזכור sinigrin כדי בקבוקוני HPLC שכותרתו. שמור את דגימות במקרר (4 ° C) עד שבועיים או במקפיא (-20 ° C) לתקופה של עד שנה אחת לפני ניתוחם עם HPLC.
- תנו זכוכית עמודות להתייבש מתחת למכסה המנוע לילה ועושה אותם כאשר יבש. לשחזר את כדורי המתכת מן הצינורות המדגמים המשמשים בשלב 4.5 לשימוש חוזר ולשים צינורות לפח האשפה.
5. מדידות HPLC של דוגמאות שחולצו
- הפרד את glucosinolates על עמודת 18 התהפך-שלב ג (4.6 x 150 מ"מ, 3 מיקרומטר, 300 א) עם שיפוע אצטוניטריל-מים (ראה טבלה 1) ו זרימה של 0.75 mL / min ובטמפרטורת טור של 40 ° C . בצע איתור וכימות ב 229 ננומטר.
- מדוד את אזכור sinigrin באותו טור אבל עם שיפוע מותאםשיטה לצמצם שימוש ממס (ראה טבלה 2). התחל עם הזרקה בחמישה אזכור sinigrin, החל ההתייחסות עם הריכוז הנמוך ביותר. ואז מזריק את הדגימות, כולל הזרקת מתנול (ריק) לאחר כל מדגם עשירי לנקות בעמודה ולמנוע את השפעת הלוואי של פסגות.
| זמן [min] | תזרים [mL / min] | % מים | % ב ACN |
| 1 | 0.750 | 98 | 2 |
| 35 | 0.750 | 65 | 35 |
| 40 | 0.750 | 98 | 2 |
| טמפרטורת טור 40 ° C. | |||
טבלה 1: שיפוע אצטוניטריל-מים להפרדה glucosinolate ו לניתוחים על HPLC פאזיים התהפך.
| זמן [min] | תזרים [mL / min] | % מים | % ב ACN |
| 1 | 0.750 | 98 | 2 |
| 10 | 0.750 | 89.3 | 10.7 |
| 11 | 0.750 | 98 | 2 |
| טמפרטורת טור 40 ° C. | |||
טבלה 2: קיצור אצטוניטריל-מים שיפוע כימות מחמשת אזכור sinigrin המשמש כימות של glucosinolates.
6. זיהוי Glucosinolate וכימות
- זיהוי
- השווה את פעמי ספקטרום UV ושימור של הפסגות בדגימות עם הועיל מסחרימסוגל, אזכור glucosinolate טהור. ראה איור 2 דוגמאות של ספקטרום UV ממעמדות glucosinolate השונות.
- זהה glucosinolates הידוע עם סטנדרטי התייחסות או על LC-MS 18, 19, אם אפשר.
- זהה glucosinolates ידוע עם תהודה מגנטית גרעינית (NMR), במידת האפשר.
- השווה את פעמי ספקטרום UV ושימור של הפסגות עם אלה באיור 2 ולוח 3, מסדי נתונים, או אזכור בספרות.
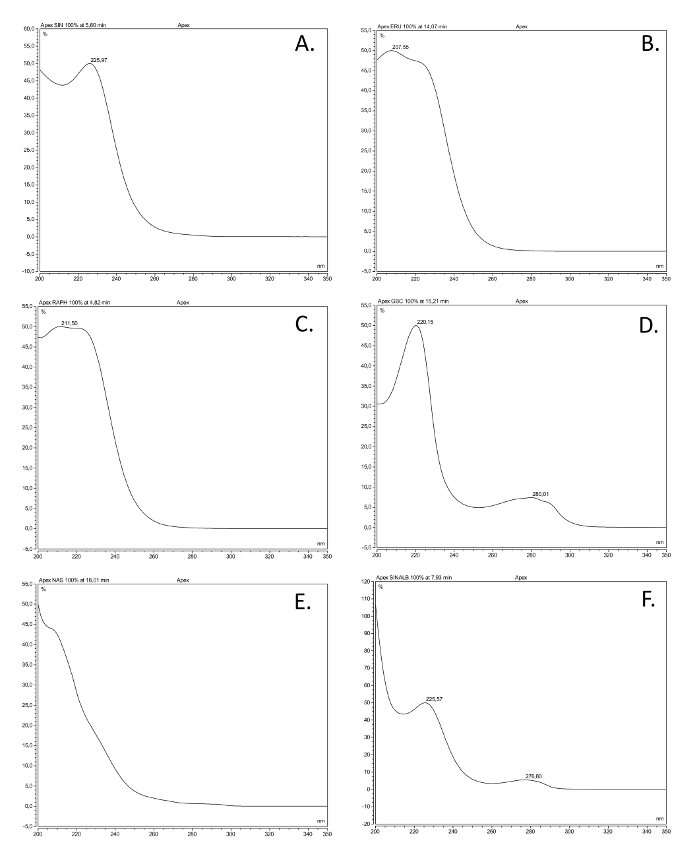
ספקטרום UV איור 2. של מעמדות glucosinolate הנפוצות ביותר. ספקטרום ספיג UV (200-350 ננומטר) של שישה desulfoglucosinolates (GSL), המבוסס על פתרונות עשויים תרכובות התייחסות זמינות מסחרי חילוץ כפי שמתואר כאן, המייצגים את המעמדות מבניות הנפוצות ביותר. השם הנפוץ, sשם tructural (בין סוגריים), ומעמד מבני מקבלים. (א) Sinigrin (2-propenyl GSL), alkenyl; (ב) glucoerucin (4-methylthiobutyl GSL), thioalkenyl; (C) glucoraphanin (4-methylsulfinlybutyl GSL), sulfinyl; (ד) glucobrassicin (indol-3-ylmethyl GSL), אינדול; (E) gluconasturtiin (2-phenylethyl GSL), ארומטי; (F) sinalbin (4-hydroxybenzyl GSL), ארומטי. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- קְבִיעַת כָּמוּת
- שלב את האזור תחת הפסגות של חמישה אזכור sinigrin לבין הדגימות.
- לחשב עקום כיול של חמישה האזכור sinigrin נמדד בהתבסס על אזור שילוב. השתמש המשוואה של קו הרגרסיה (ראה משוואה 1) לחשב את הסכום אינטרפולציה של glucosinolates (ראה משוואה 2).
- כדי לחשב את הריכוז של glucosinolates השונה, בסכום כפול מזה אינטרפולציה (x) במקדם התגובה (M) לגילוי ב 229 ננומטר מ EC (1990) 16, בוכנר (1987) 15, או בראון et al. (1993) 17; הגורמים בתגובת הקונצנזוס של desulphoglucosinolates המזוהה לרוב ניתנים בטבלה 3.
הערה: גורמי תגובה עשויה להשתנות בין מערכות-זה יכול להיות שזו הסיבה שישנם ערכים שונים שניתנו על ידי אזכור שונה (ראה הפניות 15-17). אף על פי כן, הערכים הם בעיקר די קרובים בסדר גודל דומה עם כיתות מבניות. בעקבות האמנה, להגדיר את גורם תגובת glucosinolates מזוהה עד 1, אם כי עבור glucosinolates אינדול ידוע עם ספקטרום UV דומה לזה של glucobrassicin ו glucosinolates אינדול אחרים (איור 2), יהיה זה רצוי להשתמש 0.25 כגורם בתגובה להשיגהערכה מציאותית של הריכוז (לוח 3). - כדי לחשב את הסכום הסופי של glucosinolates (x T) במדגם, לקחת את הגורם לדילול (D) ואת המסה של מדגם (w), המשמש לניתוח בחשבון (ראה משוואה 3).
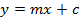 (1)
(1) 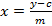 (2)
(2) 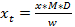 (3)
(3)
y = אזור השיא
מ = שיפוע עקום הרגרסיה של 5 נקודות התייחסות
c = ליירט של קו הרגרסיה עם ציר y
x = כמות glucosinolates בקטע
ריכוז x t = של glucosinolates במדגם צמח
D = גורם לדילול
M = גורם בתגובה לאיתור ב 229 ננומטר מן בוכנר (1987) או בראון et al. (1993)
w = מסה של מדגם המשמש להפקה
תוצאות
שיטה זו מאפשרת זיהוי והפרדה של desulfoglucosinolates נפוץ בכל הכיתות המבניות (איור 3). Progoitrin 2-hydroxyglucosinolate המזיק מגיע יחסית מוקדם הכרומתוגרמה מופרד בבירור מן glucoraphanin glucosinolate המועיל, את methylsulfinylglucosinolate רק מדגם זה. Sinigrin, gluconapin, ו glucobrassicanapin מהווים סדרה eluotropic של glucosinolates alkenyl עם הגדלת אורכי-שרשרת הצד (C3, C4, C5 ו, בהתאמה). סדרה הגיונית דומה גלויה לשני glucosinolates methylthioalkenyl, glucoiberverin (C3) ו glucoerucin (C4). הפסגות של שלושה glucosinolates אינדול, glucobrassicin ונגזרותיו 4-הידרוקסי ו 1-methoxyglucobrassicin (neoglucobrassicin), הם גם הפרדה ברורה. יצוין כי פסגות neoglucobrassicin ו glucoerucin, כמו גם gluconasturtiin, את גלוקו ארומטי רקsinolate במדגם זה, הם גבוהים במיוחד לחלץ Brassica זה נובע מהוספה של תמציות שורש לתערובת 9.
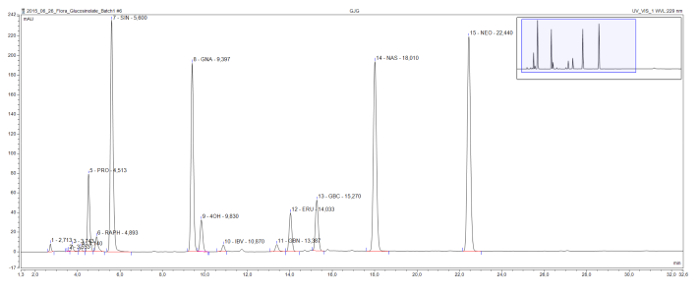
איור 3: הכרומתוגרמה של תמצית glucosinolate. פרט (1-32 דקות) של chromatogram HPLC הנובעים ניתוח של דגימות שורש לירות בשילוב מ nigra Brassica, ב Rapa, ו- B. oleracea. תוויות השיא לציין את זמן שמירה ואת הקיצורים עבור desulfoglucosinolates המזוהה (GSL). progoitrin PRO = (2-OH-3-butenyl GSL); ראף = glucoraphanin (4-methylsulfinlybutyl GSL); SIN = sinigrin (2-propenyl GSL), GNA = gluconapin (3-butenyl GSL); 4OH = 4-hydroxyglucobrassicin; IBV = glucoiberverin (3-methylthiopropyl GSL); GBN = glucobrassicanapin (4-pentenyl GSL); ERU = glucoerucin (4-methylthiobutyl GSL); GBC = glucobrassicin (indol-3-ylmethyl GSL); NAS = gluconasturtiin (2-phenylethyl GSL); NEO = neoglucobrassicin (1-MeOH-glucobrassicin). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Glucosinolates methylsulfinyl שרשרת ארוכים יותר, אשר מצויים לרוב צמח המודל ארבידופסיס, גם להראות סדרת eluotropic, כפי שניתן לראות תמצית שורש austriaca Rorippa. Glucohesperalin (C6), glucosiberin (C7), glucohirsutin (C8), ו glucoarabin (C9) להופיע במרווחי זמן קבועים על הכרומתוגרמה (איור 4). יחד עם ספקטרום UV של הפסגות, סדרה eluotropic הגיונית כאלה עשויות לשמש לסווג, ואת זמנים לזהות, glucosinolates הידוע.
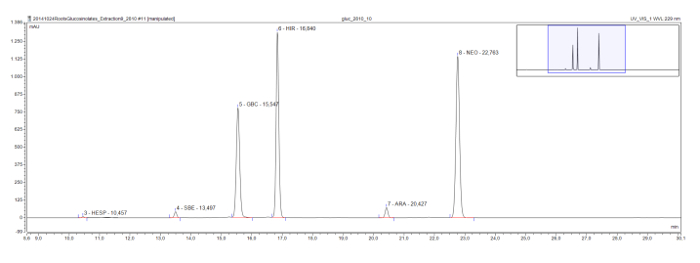
איור 4: chromatogram (מסגרת 9-30 דקות) של desulfoglucosinolates בתמצית austriaca שורש Rorippa. תוויות השיא לציין את זמן שמירה ואת הקיצורים עבור desulfoglucosinolates המזוהה (GSL). הס = glucohesperin (6-methylsulfinylhexyl GSL); SBE = glucosiberin (7-methylsulfinylheptyl GSL); GBC = glucobrassicin (indol-3-ylmethyl GSL); HIR = glucohirsutin (8-methylsulfinlyoctyl GSL); ARA = glucoarabin (9-methylsulfinylnonylglucosinolate); NEO = neoglucobrassicin (1-MeOH-glucobrassicin). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| שם נפוץ | מבנה שרשרת צד | RT (דקות) * | 229 ננומטר | התייחסות# |
| aliphatiglucosinolates ג | ||||
| Glucocapparin | מתיל | 3.5 | 1 | חום |
| Sinigrin | 2-propenyl | 5.5 | 1 | בראון, EC |
| Gluconapin | 3-butenyl | 9.5 | 1.11 | EC |
| Glucobrassicanapin | 4-pentenyl | 13.5 | 1.15 | EC |
| Glucoiberverin | 3-methylthiopropyl | 10.9 | 0.8 | חום |
| Glucoerucin | 4-methylthiobutyl | 14.0 | 0.9 | חום |
| Glucoiberin | 3-methylsulfinylpropyl | 3.7 | 1.2 | חום |
| Glucoraphanin | 4-methylsulfinylbutyl | 4.9 | 0.9 | חום |
| Glucoalyssin | 5-methylsulfinylpentyl | 7.6 | 0.9 | חום |
| Glucohesperin | 6-methylsulfinylhexyl | 10.5 | 1 | חום |
| Glucosiberin | 7-methylsulfinylheptyl | 13.5 | 1 | חום |
| Glucohirsutin | 8-methylsulfinyloctyl | 16.8 | 1.1 | חום |
| Glucoarabin | 9-methylsulfinylnonyl | 20.5 | 1 | |
| Glucocheirolin | 3-methylsulfonylpropyl | 4.2 | 0.9 | חום |
| Progoitrin | 2 (R) -OH-3-butenyl | 4.5 | 1.09 | בוכנר, EC |
| Gluconapoleiferin | 2-OH-5-pentenyl | 8.3 | 1 | EC |
| glucosinolates אינדול | ||||
| 4-hydroxyglucobrassicin | 4-hydroxyindol-3-ylmethyl | 11.2 | 0.28 | בוכנר, EC |
| Glucobrassicin | indol-3-ylmethyl | 15.3 | 0.29 | בוכנר, EC |
| 4-Methoxyglucobrassicin | 4-methoxyindol-3-ylmethyl | 18.2 | 0.25 | בוכנר, EC |
| Neoglucobrassicin | 1-methoxyindol-3-ylmethyl | 22.5 | 0.2 | בוכנר, EC |
| glucosinolates ארומטיים | ||||
| Sinalbin | 4-hydroxybenzyl | 8.1 | 0.5 | בוכנר |
| Glucosibarin | 2 (R) -OH-2-phenylethyl | 12.1 | לראות הבא | |
| Glucobarbarin | 2 (S) -OH-2-phenylethyl | 12.7 | 0.95 | בוכנר |
| Glucotropaeolin | בנזיל | 13.8 | 0.95 | בוכנר, EC |
| Gluconasturtiin | 2-phenylethyl | 18.0 | 0.95 | בוכנר, EC |
| לא ידוע - אליפטי / ארומטיים כמו UV ספקטרום | 1 | EC | ||
| לא ידוע - אינדול כמו ספקטרום | 0.25 | EC | ||
| * זמן השמירה המשוער (RT) מעוגל 0.1 דק 'הקרוב (± 0.3 דקות תלוי טור, איכות eluent). פעמי שמירה נקבעות על פלטפורמות האולטימטיביות HPLC ThermoFisher / Dionex מצוידות עמודת 18 C (150 x 4.6 מ"מ, 3 מיקרומטר גודל חלקיקים) בתוספת C 18 precolumn (10 x 4.6 מ"מ, 5 מיקרומטר גודל החלקיקים) עם תוכנית שיפוע כמו בטבלה 1. | ||||
| הפניות # לגורמי בתגובה: בוכנר, ר ב glucosinolates ב לפתית (ed JP Wathelet) 50-58 (מרטינוס Nijhoff Publishers, 1987); בראון, פ"ד, Tokuhisa, JG, Reichelt, M. & גרשנזון, J. וריאציה של הצטברות glucosinolate בין איברים שונים שלבי ההתפתחות של thaliana ארבידופסיס. Phytochemistry. 62 (3), 471-481, doi: 10.1016 / S0031-9422 (02) 00,549-6, (2003); EC. זרעי שמנים - קביעת glucosinolates בעל ביצועים גבוהים כרומטוגרפיה נוזלית. כתב העת הרשמי של הקהילה האירופית. 170/28 L. בנספח VIII 03.07.27-34 (1990). | ||||
טבלה 3: גורמי תגובה ביותר הנפוץ desulfo-glucosinolates ב תמציות צמחים פעמי השמירה המשוערות שלהם על C 18 עמודים. Eluents, gradient, טמפרטורת טור, ואת קצב זרימה כמו בטבלה 1.
Discussion
היתרונות הגדולים של שיטה נרחבת והקימה זה נעשה שימוש הם שזה חזק, די פשוט, בעלות נמוכה יחסית לדגימה. רוב הציוד הנדרש לצורך מיצוי הניתוח צריך להיות זמין במעבדה רגילה או יכול להיות עצמית בנוי, למעט ה- PDA-HPLC. יתרון נוסף הוא כי desulfoglucosinolates מומס במים מבחינה כימי יציב למדי כאשר שמרו על קור רוח ועל צלוחיות אוויר חזק (HPLC), כך התמציות יכולות להישלח בקלות לניתוח HPLC במקום אחרת. בניגוד פלטפורמות LC-MS, אשר דורשת ידע או מומחיות וניסיון מעשי נרחב לניהול תוכנה וניתוח נתונים, HPLC-UV / מחשבי כף יד ניתן להפעיל בקלות לאחר תקופת הכשרה קצרה. זה לא רק מפחית את עלויות ההליך, אלא גם עושה בשיטה זו לנגישה יותר מגוון רחב של מדענים, כולל סטודנטים.
בדרך כלל, כאשר ההליכים מתוארים מתוארים לעיל carefully, כמה בעיות צריכות להתרחש. באופן כללי, פסגות glucosinolate מופרדות היטב את הכרומתוגרמה. אם זה אינו המקרה, תכנית השיפוע יכולה להיות מותאמת על ידי הפחתת שיעור עליית אצטוניטריל ב eluent. לחלופין, אם יוצר-מראש של עמודות חדשות (200-500 זריקות) או עמודה (1,500 -2000 זריקות) עשוי לפתור את הבעיה. לפעמים, chromatograms של דגימות יחידות באצווה עשוי להיראות מאוד קטן או ללא פסגות. זה בדרך כלל בגלל שגיאות pipetting בעת הוספת sulfatase (למשל, טור כבר דילג או sulfatase לא נשטף כראוי למטה לתוך הטור). לחלופין, ריכוז glucosinolate בחומרים הניסיוניים אולי נמוך מצפוי וחומר מעט מדי נעשה שימוש לצורך המיצוי. אם זו הבעיה, את עוצמת הזריקה ניתן להעלות עד 100 μL, או aliquot מדויק (למשל, 800 μL) של תמצית יכול להיות מרוכז. זו האחרונה יכולה להיות מושגת על ידי ייבוש על ידי קורing התמצית, המסת שאריות נפח קטן יותר (למשל, 100 μL) של מים, reinjecting באמצעות עקומת הפניה אותו. בחישובים עבור הריכוז המקורי של תמצית, המספרים צריך להיות מוכפל במקדם דילול. אם זה לא פותר את הבעיה, החומרים יש לנצל שוב באמצעות חומר-מוצא יותר. אם זה יותר מ -100 מ"ג, היקף ממסי החילוץ ואת הגודל של הצינורות צריכים להיות מותאם באופן יחסי לשמור על יעילות המיצוי.
יתרון נוסף הוא כי שיטה זו כבר היטב תוקפת. זאת, משום שהיא תוארה שיטה סטנדרטית כימות של glucosinolates ב לפתית, עבורו הנהלים והדיוק אוששו מספר מעבדות 16. בנוסף, הרקע הגנטי, ביוסינתזה, והתפקידים ביולוגיים של glucosinolates כפופים מאמצי מחקר אינטנסיביים, ב modאל צמח מיני ארבידופסיס thaliana בין היתר 4, 6, 12. לכן, גורמים רבים בתגובת כימות המדויקת של desulfoglucosinolates ביחס sinigrin מוגדרים היטב לציבור רחב 15,17. למרות פרוטוקולים מבוססים LS-MS יותר תפוקה גבוהה, רגישים יותר, והם מסוגלים (בהיסוס) לזהות glucosinolates עבורו אין סטנדרטים זמינים 18, 19, 20, עדר גורמי תגובה אוניברסאלי-MS LC מגביל את כימות מדויק של ריכוזי glucosinolate 18. יתר על כן, שיטות אלה בדרך כלל אינן כוללות צעד ייבוש בהקפאה, ואת כמות מי החומר הצמחי הטרי הוא נעדר בחישובים, מה שהופך כימות מדויק קשה. לבסוף, בגלל שיטת החילוץ שלנו כרוכה טור מבוססטיהור צעד ריכוז, זה יכול לחול גם על דגימות "מלוכלכות" עם ריכוזים נמוכים של glucosinolates, כגון קרקעות 21.
בהשוואה לשיטות LC-מבוססות MS שבדרך כלל לחלץ חומרים קפוא טרי, השתמשו 96-גם צלחות להפקה, ואינו כוללים צעד sulfatase 18, 19, בשיטה שלנו היא יחסית זמן רב ועבודה אינטנסיבית. עם מתלי הטור המתואר במאמר זה, אדם אחד יכול לחלץ כ 100-150 דגימות ביום אחד. Elution (למחרת), להקפיא ייבוש (לילה), מחדש המסה יכולה להתקיים בתוך הימים הבאים. עם מזרק HPLC אוטומטי, זמן לרוץ איזון של 40-45 דקות לכל זריקה, ולא אירועים בלתי צפויים, זה ייקח 3-4 ימים כדי לרכוש את הנתונים עבור קבוצת מדגם זה. כשתוכנת HPLC מאפשרת כימות אוטומטית המבוססת על עקומת sinigrin, המחאה ידנית של chromatograms ו- PEהקצאות ak עבור 100 דגימות עשויות רק לקחת עוד h 1 או 2 לפני הנתונים ניתן להשתמש עבור ניתוחים סטטיסטיים.
למרות הזמינות הגוברת של סטנדרטים glucosinolate, רק חלק קטן של יותר מ -130 מועמדים יכולים כיום לקנות מסחרית. עם זאת, עם כמה הפניות לכל המעמדות biosynthetic; גישה למאגרי מידע בספרות המפרטת את תרכובות שנמצאו בעבר מיני צמחים (למשל, פאהי ואח 22.); ידע בסיסי של עקרונות chromatographic, כגון ההיגיון של סדרת eluotropic (למשל, עבור מספר גדל והולך של Cs על שרשרת הצד ב אליפטיות, איורים 3 ו -4); ואת האימות של דגימות יחידות על LC-MS 19 או glucosinolates מבודד על תמ"ג 23, אפשר בקלות להתגבר על מגבלה זו. רוב פרוטוקולי glucosinolate מנתח להשתמש עקומות התייחסות פנימיות(כלומר, ריכוז מסוים להפקת sinigrin או sinalbin החילוץ 16 ממס, 17, 19). בעיקר, עקומות התייחסות פנימיות במתכונת מותאמות יותר לתקן שגיאות עיבוד מדגם בודדות ולכן תיאורטית להניב דיוק גבוה. למרות יתרון זה, אנחנו מעדיפים להשתמש עקומת ייחוס חיצוני חמש נקודות, כמו שאנחנו בדרך כלל לנתח מינים ברים שונים, שחלקם מכילים רמות גבוהות של sinigrin (למשל, Brassica nigra 24) או sinalbin (למשל, חַרדָל alba 25), שתי התייחסויות glucosinolate עבורו גורמים בתגובה זמינות. יתר על כן, הוספת תקנים פנימיים מדגם זה מגדילה את עלות הניתוחים, כמו התייחסות לסטנדרטים glucosinolate בדרגה גבוהה הם בדרך כלל די יקרים.
לסיכום, למרות הצעדים זמן רב, פרוטוקול זהמספק שיטה פשוטה ונגישה לחלץ ולכמת glucosinolates בדגימות צמח. עם זאת, חשוב לקחת בחשבון כי רמות glucosinolate עצמם הן רק אינדיקציה לפעילות הביולוגית הפוטנציאל, כפי שניתן לראות את הצורך להגיב עם myrosinase, ו וריאציה את תוצרי התגובה יכולה לנבוע כתוצאת glucosinolate יחיד 11. מבחני אימות חייבות להתבצע על מנת לאשר את הרלוונטיות הביולוגיות.
Disclosures
The authors have nothing to disclose.
Acknowledgements
NMvD thanks Dr. Michael Reichelt (Max-Planck-Institute for chemical Ecology, Jena, Germany) for providing the first reference samples when she started using this method 16 years ago. Ciska Raaijmakers (NIOO-KNAW, Wageningen, the Netherlands), Sebastian Krosse (B-Ware, Nijmegen, the Netherlands), and Christian Ristok (iDiv, Leipzig) are acknowledged for improving the protocol over the course of the years. Mirka Macel and Martine Huberty (University Tübingen, Germany) are acknowledged for their permission to use the Rorippa chromatogram. The authors gratefully acknowledge the support of the German Centre for Integrative Biodiversity Research (iDiv) Halle-Jena-Leipzig, funded by the German Research Foundation (FZT 118).
Materials
| Name | Company | Catalog Number | Comments |
| Methanol HiPerSolv CHROMANORM® gradient grade for HPLC grade | VWR | 20,864,320 | |
| Sodium acetate (NaOAc) | Sigma-Aldrich | W302406-1KG-K | |
| HCL | VWR | 1,090,571,000 | |
| Sephadex | Sigma-Aldrich | A25120-10G | |
| (−)-Sinigrin hydrate from horseradish | Sigma-Aldrich | S1647-500MG | |
| Aryl Sulfatase | Sigma-Aldrich | S9626-10KU | |
| Ethanol | VWR | 20,816,298 | |
| Pasteur Pipette | Carl Roth | 4518.1 | |
| Glass Wool | Carl Roth | 7377.1 | |
| Glass /wooden stick | VWR | HERE1080766 | |
| 2 mL reaction tubes | VWR | 211-2606 | |
| Dissecting needle | Carl Roth | KX93.1 | |
| Rotilabo-lab dishes | Carl Roth | 0772.1 | Waste tray |
| Freeze Dryer Freezone 12 L | Labconco | 7960030 | |
| Acetonitril super gradient grade | VWR | 83,639,320 | |
| Water bath | VWR | 462-5112 | |
| Ultrasonic bath | Fisher Scientific | FB 15061 | |
| PH Electrode | Thermo Fisher Scientific | STARA2115 | |
| Centrifuge Heraeus Multifuge X1 | Thermo Fisher Scientific | 75004210 | |
| Pre-Column | Thermo Fisher Scientific | 69697 | C18 column (4.6 x 10 mm, 5 µm, 300 Å) |
| Column Acclaim 300 | Thermo Fisher Scientific | 60266 | C18 column (4.6 x 150 mm, 3 µm, 300 Å) |
| HPLC Ultimate 3000 | Thermo Fisher Scientific | with column oven and UV or PDA detector | |
| Flask 1000 mL | VWR | 215-1595 | |
| Glucosinolate reference compounds | Phytoplan | various | http://www.phytoplan.de/ |
References
- Hartmann, T. From waste products to ecochemicals: Fifty years research of plant secondary metabolism. Phytochemistry. 68 (22-24), 2831-2846 (2007).
- Will, H., Laubenheimer, A. Ueber das Glucosid des weissen Senfsamens. Justus Liebigs Annalen der Chemie. 199 (1), 150-164 (1879).
- Agerbirk, N., Olsen, C. E. Glucosinolate structures in evolution. Phytochemistry. 77, 16-45 (2012).
- Halkier, B. A., Gershenzon, J. Biology and biochemistry of glucosinolates. Ann Rev Plant Biol. 57, 303-333 (2006).
- Sønderby, I. E., Geu-Flores, F., Halkier, B. A. Biosynthesis of glucosinolates - gene discovery and beyond. TIPS. 15 (5), 283-290 (2010).
- Kliebenstein, D. J., et al. Genetic control of natural variation in Arabidopsis glucosinolate accumulation. Plant Physiol. 126 (2), 811-825 (2001).
- van Leur, H., Raaijmakers, C. E., van Dam, N. M. A heritable glucosinolate polymorphism within natural populations of Barbarea vulgaris. Phytochemistry. 67 (12), 1214-1223 (2006).
- Kelly, P. J., Bones, A., Rossiter, J. T. Sub-cellular immunolocalization of the glucosinolate sinigrin in seedlings of Brassica juncea. Planta. 206 (3), 370-377 (1998).
- van Dam, N. M., Tytgat, T. O. G., Kirkegaard, J. A. Root and shoot glucosinolates: a comparison of their diversity, function and interactions in natural and managed ecosystems. Phytochem Rev. 8 (1), 171-186 (2009).
- Ratzka, A., Vogel, H., Kliebenstein, D. J., Mitchell-Olds, T., Kroymann, J. Disarming the mustard oil bomb. Proc Natl Acad Sci U S A. 99 (17), 11223-11228 (2002).
- Wittstock, U., Kliebenstein, D. J., Lambrix, V., Reichelt, M., Gershenson, J., Romeo, J. T. . Integrative Phytochemistry: From ethnobotany to molecular ecology: Recent Advances in Phytochemistry. 37, (2003).
- Hopkins, R. J., van Dam, N. M., van Loon, J. J. A. Role of glucosinolates in insect-plant relationships and multitrophic interactions. Ann Rev Entomol. 54 (1), 57 (2009).
- Kliebenstein, D. J., Gershenzon, J., Mitchell-Olds, T. Comparative quantitative trait loci mapping of aliphatic, indolic and benzylic glucosinolate production in Arabidopsis thaliana leaves and seeds. Genetics. 159 (1), 359-370 (2001).
- Mithen, R., Bennett, R., Marquez, J. Glucosinolate biochemical diversity and innovation in the Brassicales. Phytochemistry. 71 (17-18), 2074-2086 (2010).
- Buchner, R., Wathelet, J. P. . Glucosinolates in rapeseed. , 50-58 (1987).
- . Oil seeds - determination of glucosinolates High Perfomance Liquid Chromatography. Official Journal of the European Communities. , 27-34 (1990).
- Brown, P. D., Tokuhisa, J. G., Reichelt, M., Gershenzon, J. Variation of glucosinolate accumulation among different organs and developmental stages of Arabidopsis thaliana. Phytochemistry. 62 (3), 471-481 (2003).
- Glauser, G., Schweizer, F., Turlings, T. C. J., Reymond, P. Rapid Profiling of Intact Glucosinolates in Arabidopsis Leaves by UHPLC-QTOFMS Using a Charged Surface Hybrid Column. Phytochem Analysis. 23 (5), 520-528 (2012).
- Crocoll, C., Halkier, B. A., Burow, M. . Current Protocols in Plant Biology. , (2016).
- Griffiths, D. W., Bain, H., Deighton, N., Botting, N. P., Robertson, A. A. B. Evaluation of liquid chromatography-atmospheric pressure chemical ionisation-mass spectrometry for the identification and quantification of desulphoglucosinolates. Phytochem Analysis. 11 (4), 216-225 (2000).
- Gimsing, A. L., Kirkegaard, J. A. Glucosinolates and biofumigation: fate of glucosinolates and their hydrolysis products in soil. Phytochem Rev. 8 (1), 299-310 (2009).
- Fahey, J. W., Zalcmann, A. T., Talalay, P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants. Phytochemistry. 56, 5-51 (2001).
- de Graaf, R. M., et al. Isolation and identification of 4-α-rhamnosyloxy benzyl glucosinolate in Noccaea caerulescens showing intraspecific variation. Phytochemistry. 110, 166-171 (2015).
- van Dam, N. M., Raaijmakers, C. E. Local and systemic induced responses to cabbage root fly larvae (Delia radicum) in Brassica nigra and B. oleracea. Chemoecology. 16 (1), 17-24 (2006).
- Gols, R., et al. Temporal changes affect plant chemistry and tritrophic interactions. Bas Appl Ecol. 8 (5), 421-433 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved