Method Article
Un metodo semplice per glucosinolati estrazione e l'analisi con alta pressione cromatografia liquida (HPLC)
In questo articolo
Riepilogo
Here, we describe in great detail an established and robust protocol for the extraction of glucosinolates from ground plant materials. After an on-column sulfatase treatment of the extracts, the desulfoglucosinolates are eluted and analyzed by high-pressure liquid chromatography.
Abstract
Glucosinolates are a well-studied and highly diverse class of natural plant compounds. They play important roles in plant resistance, rapeseed oil quality, food flavoring, and human health. The biological activity of glucosinolates is released upon tissue damage, when they are mixed with the enzyme myrosinase. This results in the formation of pungent and toxic breakdown products, such as isothiocyanates and nitriles. Currently, more than 130 structurally different glucosinolates have been identified. The chemical structure of the glucosinolate is an important determinant of the product that is formed, which in turn determines its biological activity. The latter may range from detrimental (e.g., progoitrin) to beneficial (e.g., glucoraphanin). Each glucosinolate-containing plant species has its own specific glucosinolate profile. For this reason, it is important to correctly identify and reliably quantify the different glucosinolates present in brassicaceous leaf, seed, and root crops or, for ecological studies, in their wild relatives. Here, we present a well-validated, targeted, and robust method to analyze glucosinolate profiles in a wide range of plant species and plant organs. Intact glucosinolates are extracted from ground plant materials with a methanol-water mixture at high temperatures to disable myrosinase activity. Thereafter, the resulting extract is brought onto an ion-exchange column for purification. After sulfatase treatment, the desulfoglucosinolates are eluted with water and the eluate is freeze-dried. The residue is taken up in an exact volume of water, which is analyzed by high-pressure liquid chromatography (HPLC) with a photodiode array (PDA) or ultraviolet (UV) detector. Detection and quantification are achieved by conducting comparisons of the retention times and UV spectra of commercial reference standards. The concentrations are calculated based on a sinigrin reference curve and well-established response factors. The advantages and disadvantages of this straightforward method, when compared to faster and more technologically advanced methods, are discussed here.
Introduzione
Si stima che le piante producono oltre 200.000 diversi tipi di composti chimici 1. Solo una minoranza di questi composti sembra giocare un ruolo nel metabolismo primario delle piante, che alimenta la crescita e la riproduzione; la maggioranza sono i cosiddetti metaboliti secondari. Nonostante il loro nome, metaboliti secondari sono spesso critici per la sopravvivenza delle piante e la riproduzione, in quanto servono per attirare gli impollinatori o per difendere la pianta contro gli agenti patogeni ed erbivori 1.
I glucosinolati sono una classe molto eterogeneo di metaboliti secondari che sono stati studiati per oltre 150 anni 2. Ad oggi, più di 130 strutturalmente differenti glucosinolati sono stati identificati 3. In linea di massima, glucosinolati possono essere suddivise in diverse classi basate sulla aminoacido da cui sono sintetizzati. glucosinolati indolo, per esempio, sono sintetizzati dal amminoacidotriptofano, che fenilalanina fornisce lo scheletro di base per la sintesi di glucosinolati aromatici 4. All'interno delle classi, vi è un elevato livello di diversità strutturale, che è causata da sequenziali passaggi catena allungamento nelle vie biosintetiche, come nella classe di glucosinolati alifatici, o da modifiche catena laterale (ad esempio, idrossilazione) 4, 5. Una specie di piante glucosinolati possono contenere fino a 37 diversi glucosinolati appartenenti a diverse classi strutturali 6. Anche se le specie vegetali hanno profili tipici glucosinolati, la variazione intraspecifica per i tipi di glucosinolati è frequente tra gli individui e le popolazioni 6, 7. Glucosinolati intatti vengono memorizzati nei vacuoli delle cellule vegetali e può essere trovato in qualsiasi organo o fuori terra ipogea 7, 8, 9. In caso di rottura delle cellule (ad esempio, da erbivori), glucosinolati vengono rilasciati e sono mescolati con la mirosinasi dell'enzima, scatenando un olio di senape bomba a 10. Grazie all'attività di mirosinasi, e in funzione della struttura del glucosinolato, le condizioni di reazione, e la presenza di enzimi modificanti, si formano composti pungenti, tossiche, nocive o diversi, quali nitrili e (iso) tiocianati 11. I prodotti di reazione hanno elevate attività biologiche; per esempio, servono come repellenti di insetti erbivori generalisti 12. L'ereditabilità e biosintetici percorsi di glucosinolati sono ben studiati, soprattutto a causa della loro importanza per erbivori e resistenza ai patogeni, il loro valore come componenti aromatici a mostarde e cavoli, e il loro negativo (progoitrina) e gli effetti positivi (glucorafanina) sulla salute umana 5, 13, 14.
A causa del grande interesse glucosinolati come composti, estrazione e metodi di rilevamento biologicamente attivi basati su fase inversa liquida ad alta pressione cromatografia (HPLC) equipaggiato con ultravioletti (UV) o di fotodiodi (PDA) rivelatori sono stati comunemente usati dal 1980 15 . In base a questo metodo, le Comunità Europea ha emanato un protocollo standard che è stato testato e convalidato in diversi laboratori per l'analisi dei glucosinolati nei semi oleosi (Brassica napus, colza, canola 16). Altri aggiunti a questo metodo (ad esempio, determinando fattori di risposta aggiuntive per glucosinolati che non sono presenti nella colza) 17. Nonostante la crescente disponibilità di cromatografia-spettrometria di massa piattaforme liquidi (LC-MS) e protocolli di high-throughput per l'analisi dei glucosinolati 18 , 19, il metodo HPLC-UV / PDA originale è ancora ampiamente utilizzato dagli scienziati. I motivi principali sono che questo metodo è semplice, conveniente e relativamente accessibile ai laboratori senza una vasta infrastruttura conoscenze chimico-analitica. Per servire questa comunità, noi qui dettaglio il protocollo per l'estrazione di glucosinolati da materiali vegetali e l'analisi delle loro desulfo forme con HPLC-PDA.
Protocollo
1. Preparazione di soluzioni necessarie per l'estrazione glucosinolati
- Preparare 500 ml di 70% di metanolo (MeOH) in acqua (ultrapure) in una bottiglia di vetro. Per 100 campioni e 5 standard, 420 ml di 70% MeOH è necessaria.
- Preparare 20 mM acetato di sodio (NaOAc) (pH = 5,5) aggiungendo 0,82 g di NaOAc o 1,36 g di NaOAc x 3 H 2 O in 500 mL di acqua; regolare il pH con acido cloridrico (HCl). Conservare il NaOAc in frigorifero. Per è necessario 100 campioni e 5 standard, 370 ml di 20 mm NaOAc (pH = 5,5) in acqua.
- Per preparare il materiale della colonna, mescolare 10 g di gel di destrano reticolato (tipo G-25) con 125 ml di acqua ultrapura. Conservare la miscela risultante in frigorifero (4 ° C).
- Preparazione della soluzione solfatasi
- Sciogliere 10.000 unità di aril solfatasi (tipo H-1 da Helix pomatia) in 30 ml di acqua ultrapura e aggiungere 30 ml di etanolo assoluto (EtOH). Mescolare bene la soluzione e trasferirlo ad una cen 250 mLtubo trifuge o più tubi più piccoli, a seconda della disponibilità.
- Centrifugare la miscela a 2.650 xg per 20 min a temperatura ambiente (RT). Trasferire il surnatante (s) in un becher; aggiungere 90 ml di EtOH e mescolare. Centrifugare la miscela in uno o più tubi centrifugare a 1.030 xg per 15 minuti a RT.
- Eliminare il surnatante. Sciogliere e combinare i pellets in un totale di 25 ml di acqua ultrapura. Vortex bene, dispensare in 1 ml tubi, e conservare in un congelatore a -20 ° C; si conserva per almeno un anno.
- Preparazione della soluzione di riferimento sinigrina
- Pesare in circa 9 mg di monoidrato sinigrina con 1-mcg precisione (ad esempio, 8,769 mg). Trasferire in un matraccio tarato da 10 ml e sciogliere il monoidrato sinigrina in 10,0 ml di acqua ultrapura.
- Calcolare la molarità della soluzione di riserva e preparare cinque riferimenti sinigrina tra 50-750 micron diluendo della soluzione di riserva. Per un esempio dettagliato, vedere Supplementare S1 file .
- Erogare i diversi riferimenti sinigrina in provette da 1,5 ml e congelarli a 20 ° C. Include una serie di cinque riferimenti sinigrina in ciascun lotto di estrazione. Utilizzare sempre i valori corretti per il molarità attualmente utilizzato sinigrina riferimenti per il calcolo delle concentrazioni.
2. Preparazione del programma di installazione di estrazione
- Preparare una cremagliera colonna per le colonne pipette Pasteur (per la preparazione di colonne, vedere il punto 3.1). Etichetta il rack o le colonne per tenere traccia dei numeri di esempio (vedi Figura 1).
- Preparare un blocco tenendo lo stesso numero di tubi microcentrifuga da 2 ml etichettati (vedi punto 3.3 e Figura 1)
5 / 55425fig1.jpg "/>
Figura 1: Rack per l'estrazione di glucosinolati. Vista frontale (a sinistra) e vista dall'alto (a destra) di un rack colonna di self-made e il blocco per l'estrazione di glucosinolati. Altezza: 100 mm, la distanza tra i fori spostato (per contenere le colonne pipetta Pasteur): 30 mm (asse x) x 15 mm (asse y). Clicca qui per vedere una versione più grande di questa figura.
3. Preparazione delle colonne e microprovette
- Preparare una colonna per campione e cinque colonne supplementari per i cinque campioni di riferimento sinigrina.
- In ogni pipetta di vetro, posto un pezzo di lana di vetro circa 1 cm x 1 cm. Utilizzare un bastone di legno o vetro per spingere la lana di vetro fino al punto in cui la pipetta si restringe. La lana di vetro dovrebbe evitare che il materiale colonna di esecuzione, ma non usare troppo, in quanto rallenta l'eluizione delle colonne. Indossare guanti when lavorare con la lana di vetro.
- Posizionare le colonne sulla cremagliera della colonna (vedi Figura 1). Inserire la griglia di colonna in un vassoio laboratorio (vassoio dei rifiuti) per prendere gli eluenti utilizzati per i lavaggi delle colonne consecutive.
- Tagliare i primi 5 mm al largo della punta di una plastica punta della pipetta da 1 ml e pipettare 0,5 mL del materiale della colonna preparata (G-25 gel in acqua, vedere il punto 1.3) in ogni colonna. Agitare il flacone contenente il materiale della colonna ben prima pipettaggio. Eliminare colonne perdite (materiale G-25 esaurendo attraverso lo strato di lana di vetro) e sostituirli con quelli nuovi.
- Dopo aver pipettato il materiale della colonna nelle colonne, aggiungere 1 ml di acqua ultrapura per irrigare giù il materiale.
- Preparare un tubo di reazione da 2 ml per campione e cinque tubi per i cinque campioni di riferimento sinigrina; etichettarli. Utilizzare un ago dissezione per fare buchi nei tappi per dopo liofilizzazione e posizionare i tubi preparate nel blocco tubo nella esattamente lo stesso modello come ilcolonne (passo 2.2, vedere la Figura 1).
4. Estrazione di glucosinolati
- Pesare liofilizzati e materiale vegetale finemente macinato (solitamente 50,0-100,0 mg di peso secco, le concentrazioni finali glucosinolati nell'estratto dovrebbe essere nel range della curva di riferimento) con l'approssimazione di 0,1 mg in 2 mL, etichettati, rotondo provette di reazione -bottom. Aggiungere due piccole sfere di metallo (3 mm di diametro) come ritardanti bollente ad ogni provetta.
NOTA: Il protocollo può essere applicato anche a materiali freschi flash congelato, che sono stati terreno sotto azoto liquido e mantenuti congelati fino estrazione. Aumentare la quantità di materiale pesato per l'estrazione e la percentuale di MeOH nel liquido di estrazione al 85% per compensare la diluizione con l'acqua nei materiali 19. - Pipettare 1 ml di 70% MeOH in ciascuna provetta e vortex brevemente. Chiudere i tubi e chiuderli con tappi di sicurezza prima di loro il più rapidamente possibile in un caldo wBagno Ater (90-92 ° C) per un paio di minuti (~ 5 min), fino a quando il 70% MeOH incomincia a bollire. Attenzione: Indossare occhiali di sicurezza durante questa fase!
- Mettere le provette dei campioni in un bagno ad ultrasuoni per 15 minuti. Nel frattempo, prendere la solfatasi e cinque campioni di riferimento sinigrina fuori dal freezer per scongelare loro a RT.
- Dopo ultra-sonicazione, centrifugare le provette dei campioni a 2.700 xg in una centrifuga da banco per 10 minuti a temperatura ambiente; un pellet dovrebbe formare in ogni provetta. Aggiungere il surnatante alle colonne etichettate e pipetta i campioni di riferimento cinque su colonne separate.
- Mentre pipettando il surnatante, mantenere la punta ben oltre il pellet per evitare materiali vegetali pipettaggio. Si noti che quando si utilizzano campioni essiccati, il volume surnatante sarà inferiore a 1,0 mL.
- Aggiungere 1 ml di 70% MeOH ai rimanenti palline nei tubi campione e vortice i tubi prima di metterli in un bagno ad ultrasuoni per 15 minuti. Centrifugare le provette di nuovo, come al punto 4.4, e aggiungere la Supernaabi- alle rispettive colonne; a causa delle proprietà del materiale della colonna, il gruppo solfato carica negativa dei glucosinolati sarà specificamente trattenuti sulla colonna.
- Lavare le colonne con gli estratti in tre fasi sequenziali.
- Pipettare 2 x 1 ml di 70% MeOH su ciascuna colonna. Attendere che la colonna di funzionare a secco prima di aggiungere i prossimi 1 ml; Questa operazione rimuoverà più composti apolari dagli estratti (ad esempio, clorofilla).
- Lavare il MeOH con l'aggiunta di 1 ml di acqua ultrapura per ogni colonna.
- Pipettare 2 x 1 ml di 20 mm NaOAc tampone per ogni colonna di creare le condizioni ottimali per la reazione di solfatasi.
- Prendere la cremagliera con le colonne dal vassoio di rifiuti e asciugare i piedi del rack con un fazzoletto di carta. Inserire la griglia sopra il blocco con fiale e tubi etichettati. Assicurarsi che ogni punta colonna è nella, l'etichetta, il tubo corrispondente a 2 ml (vedi Figura 1).
- Aggiungere 20 ml di solfatasi solutia colonne. Assicurarsi che il solfatasi raggiunge la superficie del materiale colonna. Pipettare 50 ml di NaOAc tampone su ogni colonna per irrigare giù per la solfatasi. Coprire le colonne con un foglio di alluminio e lasciate riposare per una notte.
NOTA: A causa delle attività della solfatasi, il gruppo solfato verrà rimosso, rilasciando le desulfoglucosinolates dalla colonna in modo che possano eluire con l'acqua. Per una descrizione dettagliata, vedere Crocoll et al. 19. - Il giorno successivo, eluire gli desulfoglucosinolates pipettando 2 x 0,75 ml di acqua ultrapura su ogni colonna. Quando tutte le colonne sono funzionare a secco, alzare la cremagliera della colonna e rimuoverlo dai tubi di reazione.
- Tappare le provette (assicurarsi che non vi siano fori nei tappi) e congelarli in azoto liquido o in un congelatore -80 ° C per 30 min. Liofilizzare i campioni per 12-24 h (a seconda del numero di campioni e la capacità del blocco-drier) per rimuovere tutta l'acqua.
- Dopo liofilizzazione, ri-sciogliere il residuo in un volume esatto (di solito 1.0 mL) di acqua ultrapura. Trasferire i campioni e le cinque riferimenti sinigrina di fiale HPLC etichettati. Conservare i campioni in frigorifero (4 ° C) per un massimo di due settimane o un congelatore (-20 ° C) fino ad un anno prima analisi con HPLC.
- Lasciate che il vetro colonne asciugare sotto il cofano durante la notte e li smaltire una volta asciutto. Recuperare le sfere di metallo dai tubi di esempio utilizzati nella fase 4.5 per il riutilizzo e mettere i tubi nel bidone dei rifiuti.
5. Le misurazioni HPLC di estratti campioni
- Separare glucosinolati su un C 18 colonna a fase inversa (4,6 x 150 mm, 3 micron, 300 Å) con un gradiente di acetonitrile-acqua (vedi Tabella 1) ed una portata di 0,75 mL / min e una temperatura della colonna di 40 ° C . Eseguire il rilevamento e la quantificazione a 229 nm.
- Misurare i riferimenti sinigrina sulla stessa colonna ma con un gradiente adattatometodo per ridurre l'uso di solventi (vedere Tabella 2). Inizia con l'iniezione di cinque riferimenti sinigrina, a cominciare con il riferimento con la concentrazione più bassa. Poi iniettare i campioni, compresa una iniezione di metanolo (blank) dopo ogni campione decimo per pulire la colonna e per evitare il riporto di picchi.
| Tempo [min] | Portata [mL / min] | % A Acqua | % B ACN |
| 1 | 0.750 | 98 | 2 |
| 35 | 0.750 | 65 | 35 |
| 40 | 0.750 | 98 | 2 |
| Colonna Temperatura 40 ° C. | |||
Tabella 1: gradiente Acetonitrile-acqua per la separazione dei glucosinolati e analisi des su HPLC in fase inversa.
| Tempo [min] | Portata [mL / min] | % A Acqua | % B ACN |
| 1 | 0.750 | 98 | 2 |
| 10 | 0.750 | 89.3 | 10.7 |
| 11 | 0.750 | 98 | 2 |
| Colonna Temperatura 40 ° C. | |||
Tabella 2: abbreviato gradiente di acetonitrile-acqua per la quantificazione dei cinque riferimenti sinigrina utilizzati per la quantificazione dei glucosinolati.
6. glucosinolati identificazione e quantificazione
- Identificazione
- Confrontare gli spettri UV e tempi di ritenzione dei picchi nei campioni con risultato in commerciocapaci, riferimenti glucosinolati puri. Vedere la Figura 2 per gli esempi di spettri UV delle varie classi di glucosinolati.
- Identificare i glucosinolati sconosciuti con gli standard di riferimento o LC-MS 18, 19, se possibile.
- Identificare i glucosinolati sconosciuti con la risonanza magnetica nucleare (NMR), se possibile.
- Confrontare gli spettri UV e tempi di ritenzione dei picchi con quelli nella Figura 2 e Tabella 3 riferimenti, basi di dati, o la letteratura.
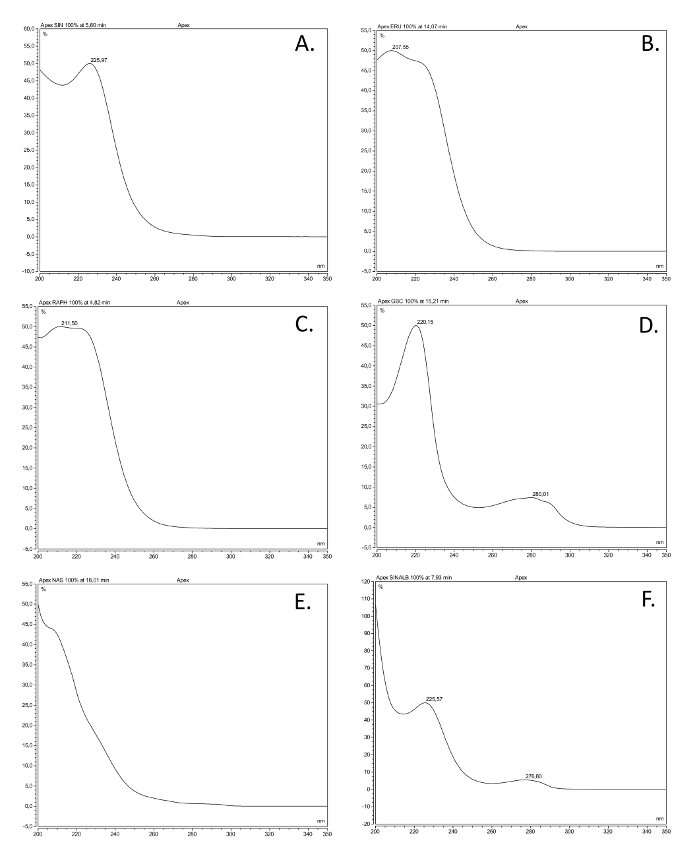
Figura 2. spettri UV delle classi glucosinolati più comuni. spettri di assorbimento UV (200-350 nm) di sei desulfoglucosinolates (GSL), basata su soluzioni fatte di composti di riferimento disponibili in commercio estratti come descritto qui, che rappresentano le classi strutturali più comuni. Il nome comune, sNome STRUTTURALI (tra parentesi), e la classe strutturale sono dati. (A) sinigrina (2-propenil GSL), alchenile; (B) glucoerucin (4-methylthiobutyl GSL), thioalkenyl; (C) glucorafanina (4-methylsulfinlybutyl GSL), sulfinilico; (D) glucobrassicin (indol-3-ilmetil GSL) indolo; (E) gluconasturtiina (2-phenylethyl GSL), aromatico; (F) sinalbina (4-idrossibenzile GSL), aromatico. Clicca qui per vedere una versione più grande di questa figura.
- quantificazione
- Integrare l'area sotto le cime delle cinque riferimenti sinigrina e dei campioni.
- Calcolare una curva di calibrazione dei cinque riferimenti sinigrina misurati in base alla zona integrata. Utilizzare l'equazione della retta di regressione (vedi Equazione 1) per calcolare la quantità interpolata di glucosinolati (vedi equazione 2).
- Per calcolare la concentrazione dei vari glucosinolati, moltiplicare la quantità interpolato (x) per il fattore di risposta (M) per il rilevamento a 229 nm da CE (1990) 16, Buchner (1987) 15, o Brown et al. (1993) 17; i fattori di risposta consenso dei desulphoglucosinolates più comunemente rilevati sono riportati nella tabella 3.
NOTA: I fattori di risposta possono variare tra i sistemi-questa può essere la ragione che ci sono valori diversi dati da diversi riferimenti (vedi Bibliografia 15-17). Tuttavia, i valori sono principalmente abbastanza vicino e in una gamma simile con classi strutturali. Dopo la convenzione, impostare il fattore di risposta di glucosinolati non identificati a 1, anche se per glucosinolati indolici sconosciuti con uno spettro UV simile a quella di glucobrassicin e altri glucosinolati indolici (figura 2), sarebbe consigliabile usare 0,25 come fattore di risposta per ottenereuna stima realistica della concentrazione (tabella 3). - Per calcolare la quantità finale di glucosinolati (x t) nel campione, prendere il fattore di diluizione (D) e la massa di campione (w) utilizzato per l'analisi in considerazione (vedi Equazione 3).
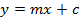 (1)
(1) 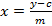 (2)
(2) 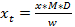 (3)
(3)
y = area del picco
m = pendenza della curva di regressione a 5 punti di riferimento
c = l'intercetta della retta di regressione con l'asse y
x = quantità di glucosinolati nell'estratto
x t = concentrazione di glucosinolati nel campione impianto
D = fattore di diluizione
M = fattore di risposta per la rivelazione a 229 nm da Buchner (1987) o Brown et al. (1993)
w = massa del campione utilizzato per l'estrazione
Risultati
Questo metodo consente la rilevazione e la separazione di desulfoglucosinolates trovano comunemente in tutte le classi strutturali (Figura 3). Il dannosa 2-hydroxyglucosinolate progoitrina arriva relativamente presto nel cromatogramma ed è chiaramente separato dal glucorafanina glucosinolati benefica, l'unica methylsulfinylglucosinolate in questo esempio. Sinigrina, gluconapin e glucobrassicanapin formano una serie eluotropica di glucosinolati alchenilici con lunghezza crescente catena laterale (C3, C4, C5 e, rispettivamente). Una serie logica simile è visibile per i due glucosinolati methylthioalkenyl, glucoiberverin (C3) e glucoerucin (C4). I picchi del tre glucosinolati indolici, glucobrassicin e suoi derivati 4-idrossi-1 e methoxyglucobrassicin (neoglucobrassicin), sono chiaramente separati. Va notato che i picchi di neoglucobrassicin e glucoerucin, nonché gluconasturtiina, l'unica gluco aromaticasinolate in questo esempio, sono particolarmente elevati in questo estratto Brassica dovuto all'aggiunta di estratti di radice alla miscela 9.
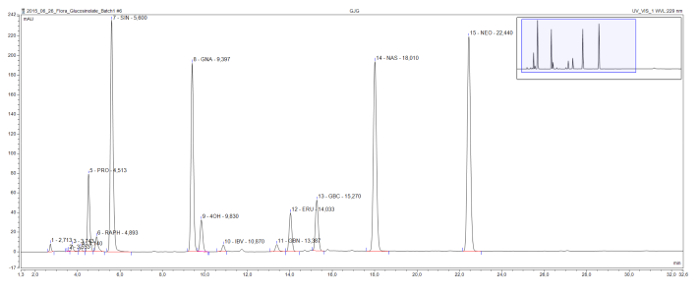
Figura 3: Cromatogramma di un estratto di glucosinolati. Dettaglio (1-32 min) di un cromatogramma HPLC risultante dall'analisi di campioni combinati radice e sparare da Brassica nigra, B. rapa, e B. oleracea. Le etichette di punta indicano il tempo di ritenzione e le abbreviazioni per desulfoglucosinolates identificati (GSL). PRO = progoitrina (2-OH-3-butenil GSL); Raph = glucorafanina (4-methylsulfinlybutyl GSL); SIN = sinigrina (2-propenil GSL), GNA = gluconapin (3-butenil GSL); 4OH = 4 hydroxyglucobrassicin; IBV = glucoiberverin (3-methylthiopropyl GSL); GBN = glucobrassicanapin (4-pentenil GSL); ERU = glucoerucin (4-methylthiobutyl GSL); GBC = glucobrassicin (indolo-3-ylmethyl GSL); NAS = gluconasturtiina (2-phenylethyl GSL); NEO = neoglucobrassicin (1-MeOH-glucobrassicin). Clicca qui per vedere una versione più grande di questa figura.
Più lunghe catene di glucosinolati metilsulfinil, che si trovano comunemente nella pianta modello Arabidopsis, mostrano anche una serie eluotropica, come si è visto in un estratto di radice di Rorippa austriaca. Glucohesperalin (C6), glucosiberin (C7), glucohirsutin (C8), e glucoarabin (C9) appaiono a intervalli regolari sul cromatogramma (Figura 4). Insieme con gli spettri UV dei picchi, tale serie logica eluotropica può essere utilizzato per classificare, e provvisoriamente identificare, glucosinolati sconosciuti.
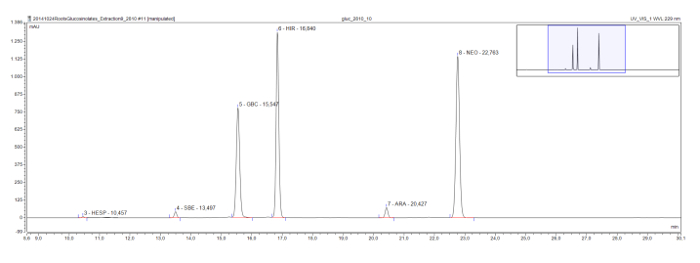
Figura 4: Cromatogramma (telaio 9-30 min) Dei desulfoglucosinolates in un estratto di radice austriaca Rorippa. Le etichette di punta indicano il tempo di ritenzione e le abbreviazioni per desulfoglucosinolates identificati (GSL). HES = glucohesperin (6-methylsulfinylhexyl GSL); SBE = glucosiberin (7-methylsulfinylheptyl GSL); GBC = glucobrassicin (indolo-3-ylmethyl GSL); HIR = glucohirsutin (8-methylsulfinlyoctyl GSL); ARA = glucoarabin (9-methylsulfinylnonylglucosinolate); NEO = neoglucobrassicin (1-MeOH-glucobrassicin). Clicca qui per vedere una versione più grande di questa figura.
| Nome comune | Struttura della catena laterale | Rt (min) * | 229 nm | riferimento# |
| aliphatic glucosinolati | ||||
| Glucocapparin | metile | 3.5 | 1 | Marrone |
| sinigrina | 2-propenile | 5.5 | 1 | Brown, CE |
| Gluconapin | 3-butenile | 9.5 | 1.11 | CE |
| Glucobrassicanapin | 4-pentenil | 13.5 | 1.15 | CE |
| Glucoiberverin | 3-methylthiopropyl | 10.9 | 0.8 | Marrone |
| Glucoerucin | 4-methylthiobutyl | 14.0 | 0.9 | Marrone |
| Glucoiberin | 3-methylsulfinylpropyl | 3.7 | 1.2 | Marrone |
| glucorafanina | 4-methylsulfinylbutyl | 4.9 | 0.9 | Marrone |
| Glucoalyssin | 5-methylsulfinylpentyl | 7.6 | 0.9 | Marrone |
| Glucohesperin | 6-methylsulfinylhexyl | 10.5 | 1 | Marrone |
| Glucosiberin | 7-methylsulfinylheptyl | 13.5 | 1 | Marrone |
| Glucohirsutin | 8-methylsulfinyloctyl | 16.8 | 1.1 | Marrone |
| Glucoarabin | 9-methylsulfinylnonyl | 20.5 | 1 | |
| Glucocheirolin | 3-methylsulfonylpropyl | 4.2 | 0.9 | Marrone |
| progoitrina | 2 (R) -OH-3-butenile | 4.5 | 1.09 | Buchner, CE |
| Gluconapoleiferin | 2-OH-5-pentenile | 8.3 | 1 | CE |
| glucosinolati indolo | ||||
| 4-hydroxyglucobrassicin | 4-hydroxyindol-3-ilmetil | 11.2 | 0,28 | Buchner, CE |
| glucobrassicin | indol-3-ilmetil | 15.3 | 0,29 | Buchner, CE |
| 4-Methoxyglucobrassicin | 4-methoxyindol-3-ilmetil | 18.2 | 0.25 | Buchner, CE |
| Neoglucobrassicin | 1-methoxyindol-3-ilmetil | 22.5 | 0.2 | Buchner, CE |
| glucosinolati aromatiche | ||||
| sinalbina | 4-idrossibenzil | 8.1 | 0.5 | Buchner |
| Glucosibarin | 2 (R) -OH-2-feniletil | 12.1 | 0,95 | vedi il prossimo |
| Glucobarbarin | 2 (S) -OH-2-feniletil | 12,7 | 0.95 | Buchner |
| Glucotropaeolin | benzilico | 13.8 | 0.95 | Buchner, CE |
| gluconasturtiina | 2-feniletile | 18,0 | 0.95 | Buchner, CE |
| sconosciuto - alifatici / aromatici come spettro UV | 1 | CE | ||
| sconosciuto - indolo come spettro | 0.25 | CE | ||
| * Tempo di ritenzione approssimativo (Rt) arrotondato a 0,1 min (± 0,3 min seconda colonna, eluente qualità). I tempi di ritenzione sono determinati su piattaforme ThermoFisher / Dionex ultimo HPLC equipaggiati con una colonna C 18 (150 x 4.6 mm 3 micrometro dimensioni delle particelle) più C 18 precolonna (10 x 4.6 mm 5 micrometri granulometria) con un programma gradiente come in Tabella 1. | ||||
| # Riferimenti per i fattori di risposta: Buchner, R. in glucosinolati a colza (a cura di JP Wathelet) 50-58 (Martinus Nijhoff Publishers, 1987); Brown, PD, Tokuhisa, JG, Reichelt, M. & Gershenzon, J. Variazione di accumulo di glucosinolati tra i diversi organi e fasi di sviluppo di Arabidopsis thaliana. Fitochimica. 62 (3), 471-481, doi: 10.1016 / S0031-9422 (02) 00.549-6, (2003); CE. Semi - Determinazione dei glucosinolati liquida ad alte prestazioni cromatografia. Gazzetta ufficiale delle Comunità europee. L 170/28. Allegato VIII 03.07.27-34 (1990). | ||||
Tabella 3: Fattori di risposta del più comunemente desulfo-glucosinolati in estratti di piante e dei loro tempi di ritenzione approssimativi sulla C 18 colonne. Eluenti, gradient, temperatura della colonna, e portata come in Tabella 1.
Discussione
I più grandi vantaggi di questo metodo consolidata e ampiamente utilizzato sono che è robusto, piuttosto semplice, e relativamente a basso costo per campione. La maggior parte delle attrezzature necessarie per l'estrazione e l'analisi dovrebbero essere disponibili in un laboratorio standard o può essere auto-costruito, con l'eccezione della HPLC-PDA. Un altro vantaggio è che desulfoglucosinolates disciolti in acqua sono chimicamente abbastanza stabili conservato fresco e in (HPLC) flaconi ermetici, quindi gli estratti possono essere facilmente spediti per l'analisi HPLC altrove. In contrasto con le piattaforme LC-MS, che richiedono una formazione specializzata e una vasta esperienza hands-on per la gestione del software e l'analisi dei dati, HPLC-UV / PDA può essere eseguito facilmente dopo un breve periodo di formazione. Questo non solo riduce i costi del procedimento, ma anche rende questo metodo più accessibile ad una vasta gamma di scienziati, compresi gli studenti.
In generale, quando le procedure sopra descritte sono seguite carefully, dovessero verificarsi alcuni problemi. In generale, i picchi glucosinolati sono molto ben separati nel cromatogramma. Se questo non è il caso, il programma gradiente potrebbe essere adattato diminuendo il tasso di aumento di acetonitrile in eluente. In alternativa, la costruzione di una nuova pre-colonna (200-500 iniezioni) o colonna (1.500 -2.000 iniezioni) potrebbe risolvere il problema. Di tanto in tanto, cromatogrammi di campioni singoli in un lotto possono mostrare molto piccolo o senza picchi. Questo è di solito a causa di errori di pipettamento quando si aggiunge il solfatasi (ad esempio, una colonna è stato ignorato o la solfatasi non è stato adeguatamente lavato giù nella colonna). In alternativa, la concentrazione glucosinolati nei materiali sperimentali può essere stata inferiore al previsto e troppo poco materiale è stato utilizzato per l'estrazione. In quest'ultimo caso, il volume di iniezione può essere aumentata a 100 microlitri, o potrebbe essere concentrata un'aliquota esatta (es, 800 microlitri) dell'estratto. Quest'ultimo potrebbe essere ottenuto liofilizzarezione l'estratto, sciogliendo il residuo in un volume più piccolo (ad esempio, 100 ml) di acqua, e reiniettando utilizzando la stessa curva di riferimento. Nei calcoli per la concentrazione originale dell'estratto, i numeri devono essere moltiplicati per il fattore di diluizione. Se questo non risolve il problema, i materiali devono essere estratti usando ancora più materiale di partenza. Se è superiore a 100 mg, il volume dei solventi di estrazione e le dimensioni dei tubi devono essere regolate in proporzione per mantenere l'efficienza di estrazione.
Un ulteriore vantaggio è che questo metodo è stato ben convalidato. Questo perché è stato descritto come un metodo standard per la quantificazione di glucosinolati in colza, per la quale sono state confermate le procedure e precisione in diversi laboratori 16. Inoltre, il background genetico, biosintesi e funzioni biologiche di glucosinolati sono soggetti a intensi sforzi di ricerca, in modEL thaliana specie di piante di Arabidopsis tra gli altri 4, 6, 12. Di conseguenza, molti fattori di risposta per l'esatta quantificazione dei desulfoglucosinolates in relazione alla sinigrina sono ben definiti e disponibili al pubblico 15,17. Anche se protocolli LS-MS-based sono più high-throughput, più sensibile, e sono in grado di (indicativamente) identificare glucosinolati per cui non sono disponibili standard 18, 19, 20, la mancanza di fattori di risposta universali per LC-MS limita la la quantificazione esatta delle concentrazioni di glucosinolati 18. Inoltre, questi metodi di solito non includono una fase di liofilizzazione, e la quantità di acqua nel materiale vegetale fresco è dispersi nei calcoli, rendendo esatta quantificazione difficile. Infine, perché il nostro metodo di estrazione comporta una base di colonnapurificazione e fase di concentrazione, può essere applicato anche a campioni "sporchi" con basse concentrazioni di glucosinolati, come terreni 21.
Rispetto ai metodi LC-MS-based che di solito estraggono appena materiali congelati, utilizzano piastre a 96 pozzetti per l'estrazione, e non includono un passo solfatasi 18, 19, il nostro metodo è relativamente lungo e intenso lavoro. Con i rack delle colonne descritte in questo documento, una sola persona può estrarre circa 100-150 campioni in un solo giorno. Eluizione (giorno successivo), liofilizzazione (durante la notte), e ri-dissoluzione può avvenire entro i due giorni successivi. Con un iniettore automatico HPLC, un tempo di esecuzione e di equilibrio di 40-45 min per iniezione, e non eventi imprevisti, ci sarebbero voluti 3-4 giorni di tempo per acquisire i dati per questo set di esempio. Quando il software HPLC consente la quantificazione automatica basata sulla curva sinigrina, un controllo manuale dei cromatogrammi e peassegnazioni ak per 100 campioni possono richiedere solo un altro 1 o 2 ore prima che i dati possono essere utilizzati per le analisi statistiche.
Nonostante la crescente disponibilità di standard di glucosinolati, solo una piccola frazione degli oltre 130 candidati attualmente può essere acquistato in commercio. Tuttavia, con alcuni riferimenti per ciascuna delle classi biosintetici; l'accesso alle banche dati di letteratura che specificano i composti precedentemente trovato nelle specie vegetali (ad esempio, Fahey et al 22.); conoscenza di base dei principi cromatografici, come la logica della serie eluotropica (ad esempio, per i numeri di Cs crescente sulla catena laterale di composti alifatici, le figure 3 e 4); e la convalida di singoli campioni in LC-MS 19 o glucosinolati isolato su NMR 23, si può facilmente superare questo limite. La maggior parte dei protocolli per glucosinolati analisi utilizzare curve di riferimento interni(Cioè, una certa concentrazione per l'estrazione di sinigrina o sinalbina del solvente di estrazione 16, 17, 19). Principalmente, le curve di riferimento interni sono più appropriate per correggere gli errori individuali di elaborazione del campione e quindi teoricamente produrre una maggiore precisione. Nonostante questo vantaggio, preferiamo usare una curva di riferimento esterno a cinque punti, come abbiamo spesso analizziamo diverse specie selvatiche, alcune delle quali contengono alti livelli di sinigrina (ad esempio, Brassica nigra 24) o sinalbina (ad esempio, Sinapis alba 25), il due riferimenti glucosinolati per i quali i fattori di risposta sono disponibili. Inoltre, aggiungendo standard interni per ogni campione aumenta il costo delle analisi, come standard di riferimento glucosinolati pregiati sono di solito abbastanza costosi.
In conclusione, nonostante i passi in termini di tempo, questo protocollofornisce un metodo semplice e accessibile per estrarre e quantificare glucosinolati in campioni vegetali. Tuttavia, è importante considerare che i livelli glucosinolate stessi sono solo un'indicazione del potenziale attività biologica, visto come la necessità di reagire con mirosinasi e variazione dei prodotti di reazione possono derivare da una singola glucosinolati 11. test di convalida devono essere effettuate per confermare la rilevanza biologica.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
NMvD thanks Dr. Michael Reichelt (Max-Planck-Institute for chemical Ecology, Jena, Germany) for providing the first reference samples when she started using this method 16 years ago. Ciska Raaijmakers (NIOO-KNAW, Wageningen, the Netherlands), Sebastian Krosse (B-Ware, Nijmegen, the Netherlands), and Christian Ristok (iDiv, Leipzig) are acknowledged for improving the protocol over the course of the years. Mirka Macel and Martine Huberty (University Tübingen, Germany) are acknowledged for their permission to use the Rorippa chromatogram. The authors gratefully acknowledge the support of the German Centre for Integrative Biodiversity Research (iDiv) Halle-Jena-Leipzig, funded by the German Research Foundation (FZT 118).
Materiali
| Name | Company | Catalog Number | Comments |
| Methanol HiPerSolv CHROMANORM® gradient grade for HPLC grade | VWR | 20,864,320 | |
| Sodium acetate (NaOAc) | Sigma-Aldrich | W302406-1KG-K | |
| HCL | VWR | 1,090,571,000 | |
| Sephadex | Sigma-Aldrich | A25120-10G | |
| (−)-Sinigrin hydrate from horseradish | Sigma-Aldrich | S1647-500MG | |
| Aryl Sulfatase | Sigma-Aldrich | S9626-10KU | |
| Ethanol | VWR | 20,816,298 | |
| Pasteur Pipette | Carl Roth | 4518.1 | |
| Glass Wool | Carl Roth | 7377.1 | |
| Glass /wooden stick | VWR | HERE1080766 | |
| 2 mL reaction tubes | VWR | 211-2606 | |
| Dissecting needle | Carl Roth | KX93.1 | |
| Rotilabo-lab dishes | Carl Roth | 0772.1 | Waste tray |
| Freeze Dryer Freezone 12 L | Labconco | 7960030 | |
| Acetonitril super gradient grade | VWR | 83,639,320 | |
| Water bath | VWR | 462-5112 | |
| Ultrasonic bath | Fisher Scientific | FB 15061 | |
| PH Electrode | Thermo Fisher Scientific | STARA2115 | |
| Centrifuge Heraeus Multifuge X1 | Thermo Fisher Scientific | 75004210 | |
| Pre-Column | Thermo Fisher Scientific | 69697 | C18 column (4.6 x 10 mm, 5 µm, 300 Å) |
| Column Acclaim 300 | Thermo Fisher Scientific | 60266 | C18 column (4.6 x 150 mm, 3 µm, 300 Å) |
| HPLC Ultimate 3000 | Thermo Fisher Scientific | with column oven and UV or PDA detector | |
| Flask 1000 mL | VWR | 215-1595 | |
| Glucosinolate reference compounds | Phytoplan | various | http://www.phytoplan.de/ |
Riferimenti
- Hartmann, T. From waste products to ecochemicals: Fifty years research of plant secondary metabolism. Phytochemistry. 68 (22-24), 2831-2846 (2007).
- Will, H., Laubenheimer, A. Ueber das Glucosid des weissen Senfsamens. Justus Liebigs Annalen der Chemie. 199 (1), 150-164 (1879).
- Agerbirk, N., Olsen, C. E. Glucosinolate structures in evolution. Phytochemistry. 77, 16-45 (2012).
- Halkier, B. A., Gershenzon, J. Biology and biochemistry of glucosinolates. Ann Rev Plant Biol. 57, 303-333 (2006).
- Sønderby, I. E., Geu-Flores, F., Halkier, B. A. Biosynthesis of glucosinolates - gene discovery and beyond. TIPS. 15 (5), 283-290 (2010).
- Kliebenstein, D. J., et al. Genetic control of natural variation in Arabidopsis glucosinolate accumulation. Plant Physiol. 126 (2), 811-825 (2001).
- van Leur, H., Raaijmakers, C. E., van Dam, N. M. A heritable glucosinolate polymorphism within natural populations of Barbarea vulgaris. Phytochemistry. 67 (12), 1214-1223 (2006).
- Kelly, P. J., Bones, A., Rossiter, J. T. Sub-cellular immunolocalization of the glucosinolate sinigrin in seedlings of Brassica juncea. Planta. 206 (3), 370-377 (1998).
- van Dam, N. M., Tytgat, T. O. G., Kirkegaard, J. A. Root and shoot glucosinolates: a comparison of their diversity, function and interactions in natural and managed ecosystems. Phytochem Rev. 8 (1), 171-186 (2009).
- Ratzka, A., Vogel, H., Kliebenstein, D. J., Mitchell-Olds, T., Kroymann, J. Disarming the mustard oil bomb. Proc Natl Acad Sci U S A. 99 (17), 11223-11228 (2002).
- Wittstock, U., Kliebenstein, D. J., Lambrix, V., Reichelt, M., Gershenson, J., Romeo, J. T. . Integrative Phytochemistry: From ethnobotany to molecular ecology: Recent Advances in Phytochemistry. 37, (2003).
- Hopkins, R. J., van Dam, N. M., van Loon, J. J. A. Role of glucosinolates in insect-plant relationships and multitrophic interactions. Ann Rev Entomol. 54 (1), 57 (2009).
- Kliebenstein, D. J., Gershenzon, J., Mitchell-Olds, T. Comparative quantitative trait loci mapping of aliphatic, indolic and benzylic glucosinolate production in Arabidopsis thaliana leaves and seeds. Genetics. 159 (1), 359-370 (2001).
- Mithen, R., Bennett, R., Marquez, J. Glucosinolate biochemical diversity and innovation in the Brassicales. Phytochemistry. 71 (17-18), 2074-2086 (2010).
- Buchner, R., Wathelet, J. P. . Glucosinolates in rapeseed. , 50-58 (1987).
- . Oil seeds - determination of glucosinolates High Perfomance Liquid Chromatography. Official Journal of the European Communities. , 27-34 (1990).
- Brown, P. D., Tokuhisa, J. G., Reichelt, M., Gershenzon, J. Variation of glucosinolate accumulation among different organs and developmental stages of Arabidopsis thaliana. Phytochemistry. 62 (3), 471-481 (2003).
- Glauser, G., Schweizer, F., Turlings, T. C. J., Reymond, P. Rapid Profiling of Intact Glucosinolates in Arabidopsis Leaves by UHPLC-QTOFMS Using a Charged Surface Hybrid Column. Phytochem Analysis. 23 (5), 520-528 (2012).
- Crocoll, C., Halkier, B. A., Burow, M. . Current Protocols in Plant Biology. , (2016).
- Griffiths, D. W., Bain, H., Deighton, N., Botting, N. P., Robertson, A. A. B. Evaluation of liquid chromatography-atmospheric pressure chemical ionisation-mass spectrometry for the identification and quantification of desulphoglucosinolates. Phytochem Analysis. 11 (4), 216-225 (2000).
- Gimsing, A. L., Kirkegaard, J. A. Glucosinolates and biofumigation: fate of glucosinolates and their hydrolysis products in soil. Phytochem Rev. 8 (1), 299-310 (2009).
- Fahey, J. W., Zalcmann, A. T., Talalay, P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants. Phytochemistry. 56, 5-51 (2001).
- de Graaf, R. M., et al. Isolation and identification of 4-α-rhamnosyloxy benzyl glucosinolate in Noccaea caerulescens showing intraspecific variation. Phytochemistry. 110, 166-171 (2015).
- van Dam, N. M., Raaijmakers, C. E. Local and systemic induced responses to cabbage root fly larvae (Delia radicum) in Brassica nigra and B. oleracea. Chemoecology. 16 (1), 17-24 (2006).
- Gols, R., et al. Temporal changes affect plant chemistry and tritrophic interactions. Bas Appl Ecol. 8 (5), 421-433 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon