Method Article
Yüksek basınçlı Sıvı Kromatografi ile Glukosinolat Ekstraksiyon ve Analiz A Basit Yöntemi (HPLC)
Bu Makalede
Özet
Here, we describe in great detail an established and robust protocol for the extraction of glucosinolates from ground plant materials. After an on-column sulfatase treatment of the extracts, the desulfoglucosinolates are eluted and analyzed by high-pressure liquid chromatography.
Özet
Glucosinolates are a well-studied and highly diverse class of natural plant compounds. They play important roles in plant resistance, rapeseed oil quality, food flavoring, and human health. The biological activity of glucosinolates is released upon tissue damage, when they are mixed with the enzyme myrosinase. This results in the formation of pungent and toxic breakdown products, such as isothiocyanates and nitriles. Currently, more than 130 structurally different glucosinolates have been identified. The chemical structure of the glucosinolate is an important determinant of the product that is formed, which in turn determines its biological activity. The latter may range from detrimental (e.g., progoitrin) to beneficial (e.g., glucoraphanin). Each glucosinolate-containing plant species has its own specific glucosinolate profile. For this reason, it is important to correctly identify and reliably quantify the different glucosinolates present in brassicaceous leaf, seed, and root crops or, for ecological studies, in their wild relatives. Here, we present a well-validated, targeted, and robust method to analyze glucosinolate profiles in a wide range of plant species and plant organs. Intact glucosinolates are extracted from ground plant materials with a methanol-water mixture at high temperatures to disable myrosinase activity. Thereafter, the resulting extract is brought onto an ion-exchange column for purification. After sulfatase treatment, the desulfoglucosinolates are eluted with water and the eluate is freeze-dried. The residue is taken up in an exact volume of water, which is analyzed by high-pressure liquid chromatography (HPLC) with a photodiode array (PDA) or ultraviolet (UV) detector. Detection and quantification are achieved by conducting comparisons of the retention times and UV spectra of commercial reference standards. The concentrations are calculated based on a sinigrin reference curve and well-established response factors. The advantages and disadvantages of this straightforward method, when compared to faster and more technologically advanced methods, are discussed here.
Giriş
Bitkiler kimyasal bileşiklerin 1 200.000 farklı türleri üretmek olduğu tahmin edilmektedir. Sadece bu bileşiğin azınlık bitkilerin primer metabolizma, yakıtlar büyüme ve üreme bir rol oynadığı görülmektedir; çoğunluğu ikincil metabolitler olarak adlandırılmaktadır. Onlar pollinatorsu çekmeyi veya patojenler ve otobur 1 karşı bitki savunmak için hizmet olarak kendi adına rağmen, sekonder metabolitler, genellikle bitki hayatta kalma ve üreme için kritik öneme sahiptir.
Glucosinolates 150 yıldır 2 çalışılmıştır ikincil metabolitlerin bir çok farklı sınıf bulunmaktadır. Bugüne kadar, en fazla 130 yapısal olarak farklı glukozinolatlar 3 tespit edilmiştir. Genel olarak, glukozinolatlar da sentezlenmiş olan bir amino asit göre farklı sınıflara bölünebilir. Indol glukozinolatların, örneğin amino asitten sentezlenirlertriptofan, oysa fenilalanin aromatik glukozinolatların 4 sentezi için baz iskeleti sağlar. Sınıfları içinde, alifatik glukozinolatların sınıf olarak biyosentetik yollardaki sıralı zincir uzatma adımlar getirdiği ya da yan zincir modifikasyon (örneğin, hidroksilasyon) 4, 5 ile yapısal çeşitlilik, yüksek düzeyde vardır. Bir glukosinolat bitki türleri farklı yapısal sınıflardan 6 mensup kadar 37 farklı glikozinolitleri içerebilir. Bitki türleri tipik glukozinolat profillerine sahip olsa da, glukozinolatların türleri için intraspecific varyasyon sık sık bireyler ve nüfus 6, 7 arasında bulunur. Bozulmamış glukozinolatlar, bitki hücrelerinin vakuolleri içinde saklanır ve bir yer altı veya toprak altında organı 7 bulunabilir 8, 9. Hücre parçalanması (örn herbivory olarak) üzerine, glukozinolatların serbest bırakılır ve hardal yağı bomba 10 yola, mirosinaz ile karıştırılır. Mirosinaz aktivitesi için ve glukozinolat, reaksiyon koşulları ve modifiye enzimlerin varlığı yapısına bağlı olarak, farklı, keskin, toksik veya zararlı bileşikler, nitriller ve (izo) 11 tiyosiyanatlar olarak oluşturulmaktadır. reaksiyon ürünleri yüksek biyolojik aktivitelere sahip; Örneğin, kültürlü haşere otçul 12 geri püskürtme ajanları olarak hizmet vermektedir. Glukozinolatların kalıtım ve biyosentez yolları iyi, esas olarak, çünkü otobur ve patojen direnci, mustards ve lahana lezzet bileşenleri olarak kendi değer ve negatif (progoitrin) ve insan sağlığına 5 pozitif (glukorafanine bağlıdır) etkileri önemleri, incelenmiştir 13, 14.
Çünkü ters fazlı yüksek basınçlı sıvı kromatografisi ultraviyole (UV) ya da fotodiyot dizi ile donatılmış (HPLC) göre biyolojik olarak etkin olan bileşikleri, ekstraksiyon ve saptama yöntemleri glukozinolatlar açısından büyük bir ilgi (PDA) detektörleri mutat olarak 1980'lerden 15 beri kullanılmaktadır . Bu yönteme dayalı, Avrupa Toplulukları Yağlı tohumlardan glukozinolatların analizi (Brassica napus, kolza, kanola 16) için çeşitli laboratuarlarda test edilmiş ve onaylanmış bir standart protokol yayınladı. Diğer 17 (kolza mevcut değildir glukozinolatların ek müdahale katlarının belirlenmesi ile, örneğin), bu yöntem için ilave edildi. Glukosinolat analizi 18 için sıvı kromatografisi-kütle spektrometresi (LC-MS) platformları ve yüksek verimlilik protokolleri artan bulunmasına karşın , 19, orijinal HPLC-UV / PDA yöntemi hala yaygın olarak bilim adamları tarafından kullanılır. başlıca nedenleri bu yöntem basit, düşük maliyetli ve kapsamlı bir kimyasal analitik bilgi altyapısının olmayan laboratuvarlarda nispeten erişilebilir olmasıdır. Bu topluma hizmet etmek, bitkisel maddelerden glukozinolatların çıkarılması ve HPLC-PDA ile desulfo-formlarının analizi için biz burada detay protokolü.
Protokol
Glukosinolat Ekstraksiyon için gerekli Çözümler 1. Hazırlık
- bir cam şişe içinde, su içinde% 70 metanol (MeOH) 500 mL (ultra saf) hazırlayın. 100 numune, 5 standart,% 70 420 ml MeOH gereklidir.
- NaOAc 0.82 g veya NaOAc X3, H 1.36 g eklenerek 20 mM sodyum asetat (NaOAc) (pH = 5.5) hazırlanması 2 O 500 mL su içinde; hidrojen klorür (HCl) ile pH ayarlanır. buzdolabında NaOAc saklayın. 100 numune ve 5 standartları, su içinde 20 mM NaOAc (pH = 5.5) 370 ml gereklidir.
- Sütun malzemesi elde ultra saf su 125 mL 'si ile çapraz bağlanmış dekstran jel (tip G-25) 10 g karıştırın. bir buzdolabı (4 ° C) 'de elde edilen karışımın saklayın.
- sülfataz çözeltisinin hazırlanması
- Ultra saf su 30 mL aril sülfatazın 10.000 adet (tip H-1 Helix pomatia gelen) çözündürün ve mutlak etanol 30 mL (EtOH) ekleyin. iyi çözüm karıştırın ve bir 250 ml cen transfertrifuge tüp veya doluluk durumuna bağlı olarak birden fazla küçük tüpler.
- Oda sıcaklığında 20 dakika boyunca (RT) 2.650 x g'de karışımı santrifüjleyin. Bir behere süpernatant (ler) aktarın; EtOH 90 ml ekleyin ve karıştırın. Oda sıcaklığında 15 dakika boyunca 1,030 x g'de bir veya daha fazla santrifüj tüplerine karışımı santrifüjleyin.
- süpernatantlar atın. Çözündürün ve ultra saf su 25 ml'lik toplam pelet birleştirir. Vorteks de, -20 ° C'de bir dondurucuda 1 ml'lik tüplerde dağıtılması ve depolamak; en az bir yıl süreyle devam edecektir.
- sinigrin referans çözeltisinin hazırlanması
- 1-ug doğruluk (örneğin, 8,769 mg) ile sinigrin monohidrat 9 mg civarında tartılır. 10 mL'lik volümetrik bir şişeye içine aktarılır ve ultra saf su 10,0 mL Sinigrin monohidrat çözülür.
- stok solüsyonu molaritesi nedir ve stok solüsyonu seyreltilmesi ile 50-750 uM arasında beş sinigrin başvuruları hazırlar. Ayrıntılı bir örnek için, bakınız Ek Dosya S1 .
- 1.5 ml'lik tepkime tüpleri farklı Sinigrin referanslar koyun ve 20 ° C'de dondurmak. Her çıkarma toplu beş sinigrin referansların bir dizi içerir. konsantrasyonları hesaplanırken her zaman şu anda başvurular sinigrin kullanılan doğru molarite değerlerini kullanın.
Ekstraksiyon Kur'un 2. Hazırlık
- Pasteur pipeti sütun için bir sütun raf hazırlama (sütun hazırlanması için, adım 3.1). Örnek numaraları takip etmek için raf veya sütun etiketi (Şekil 1 e bakınız).
- Etiketli 2 mL mikrosantrifüj tüpleri aynı sayıda tutan bir blok hazırlanması (adım 3.3 ve Şekil 1 e bakınız)
5 / 55425fig1.jpg "/>
Şekil 1: glukosinolat çıkarılması için Raf. Önden görünüm (solda) ve glukozinolat çıkarılması için bir self-made sütun raf ve bloğun üst görünümü (sağda). Yükseklik: 100 mm arasında bir mesafe (Pasteur pipeti sütun tutmak için) delik kayar: 30 mm (x-ekseni) 15 mm (y-ekseni) x. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Sütunlar ve Mikrosantrifüj Tüpler 3. hazırlanması
- Numune başına bir sütun ve beş sinigrin referans örnekleri için fazladan beş sütun hazırlayın.
- her bir cam pipet olarak, cam yünü, yaklaşık 1 cm x 1 cm'lik bir parçası eklenir. pipet daraltır noktaya cam yünü aşağı itmek için bir tahta veya cam çubuğu kullanın. cam yünü tükeniyor sütun malzeme önlemek gerekir, ancak sütunların elüsyon yavaş olacak gibi, çok fazla kullanmayın. eldiven wh Wearcam yünü ile çalışan tr.
- Sütun rafa sütunları yerleştirin (Şekil 1). ardışık sütun yıkama için kullanılan yürütücüler yakalamak için bir laboratuar tepsisi (atık tepside) sütun raf yerleştirin.
- plastik bir 1-ml pipet ucu ve pipet hazırlanan kolon malzemesi 0.5 ml ucunda ilk 5 mm ve kesik de her sütuna (su içinde G-25 jel, basamak 1.3). pipetleme önce iyice sütun malzeme içeren şişeyi çalkalayın. sızıntı sütunları (cam yünü katmanı üzerinden tükeniyor G-25 malzeme) atın ve yenileriyle değiştirin.
- sütunlar halinde kolon malzemesi pipetleme sonra, malzeme aşağı temizlemek için ultra saf su 1 ml ekleyin.
- numune başına bir 2 ml'lik reaksiyon tüpü ve beş sinigrin referans örnekleri için beş tüpleri hazırlayın; etiketlemek. Daha sonra dondurarak kurutma için kapaklar delik yapmak için bir diseksiyon iğnesi kullanın ve tam olarak aynı desende tüp bloğu içine hazırlanmış tüpler yerleştirinsütunlar (adım 2.2, bakınız Şekil 1).
Glukozinolatların 4. Ekstraksiyon
- (Ekstrakt son glukozinolat konsantrasyonları bir referans eğrisi aralığında olmalıdır kuru ağırlığın genellikle 50,0-100,0 mg), 2-mL, en yakın 0.1 mg, etiketlenmiş, yuvarlak liyofiliz ve ince öğütülmüş bitki maddesi, tartılır -Dip reaksiyon tüpleri. Her tüpe geciktiriciler kaynama iki küçük metal bilyeler (Çapı 3 mm) ekleyin.
Not: protokol, sıvı azot altında öğütüldü ve ekstre kadar donmuş tutulmuştur taze anında donduruldu malzemelere uygulanabilir. Malzeme 19 su ile seyreltme için telafi etmek için% 85 ekstraksiyon sıvısı içinde ekstraksiyon Tartılan malzeme miktarı ve MeOH yüzdesini arttırır. - Kısaca, her bir tüp ve girdap içine% 70 MeOH pipetle 1 ml. tüpleri kapatın ve w sıcak içine mümkün olduğunca çabuk koymadan önce emniyet kapakları ile mühürMeOH sadece kaynar% 70 kadar bir kaç dakika (~ 5 dakika) için bırakmayın banyo (90-92 ° C). Dikkat: Bu adımı sırasında koruyucu gözlük takın!
- 15 dakika boyunca ultrasonik bir banyoda numune tüpleri yerleştirin. Bu arada, sülfataz almak ve dondurucu dışına beş sinigrin referans örnekleri oda sıcaklığında onları Çözülme.
- ultrasonikasyonla sonra oda sıcaklığında 10 dakika boyunca bir tezgah üstü santrifüj içinde 2700 x g'de santrifüj numune tüpleri; Pelet, her bir tüp içinde oluşturmalıdır. etiketli sütunlara süpernatantlar ekleyin ve ayrı sütunlarda üzerine beş referans örnekleri pipetle.
- süpernatantlar pipetleme ederken, pipet bitki materyalleri önlemek için pelet üzerine de ucu tutun. Kurutulan örnekler kullanıldığında, üst faz hacmi en az 1,0 ml olacağına dikkat ediniz.
- Örnek tüpler geri kalan topaklar,% 70 MeOH 1 ml ilave edilir ve 15 dakika boyunca ultrasonik bir banyoda yerleştirmeden önce tüpleri girdap. Adım 4.4 olduğu gibi yine tüpleri santrifüj ve Superna ekleyinİlgili sütunlara tants; Sütun malzemesi özellikleri nedeniyle, glukozinolatların negatif yüklü sülfat grubu, özellikle kolon üzerinde muhafaza edilecektir.
- Üç sıralı adımda özleri ile sütun yıkayın.
- Her bir kolon üzerine 70% MeOH Pipet 2 x 1 mi. sonraki 1 mL eklemeden önce kuru çalıştırmak için sütun için bekleyin; Bu ekstrelerin (örneğin, klorofil) daha apolar bileşikler kaldıracaktır.
- Her sütun ultra saf su 1 ml ekleyerek MeOH dışarı floş.
- Pipet 2 x 1 ml 20 mM NaOAc sülfataz Reaksiyon için en uygun şartları oluşturmak için her bir kolon tamponu.
- Atık tepsinin dışına sütunları ile raf alın ve bir doku ile raf ayakları kuru. şişeleri ve etiketli tüpler blok üzerine rafa yerleştirin. Her sütun ucu karşılık, etiketli, 2-ml tüp içinde olduğundan emin olun (bakınız Şekil 1).
- sülfataz soluti 20 mcLsütun üzerine. sülfataz sütun malzemesinin yüzeyine ulaşır emin olun. NaOAc'den Pipet 50 ul sülfataz aşağı temizlemek için her kolona tampon. alüminyum folyo ile örtün sütunları ve gece boyunca bekletin.
Not: sülfatazın aktiviteleri nedeniyle, sülfat grubu su ile elüte böylece sütun desulfoglucosinolates serbest, kaldırılacaktır. Ayrıntılı bir açıklama için, Crocoll ve diğ. 19. - Sonraki gün, her bir kolon üzerinde ultra saf su, 2 x 0.75 mL pipetleme desulfoglucosinolates elüte. tüm sütunlar kuru çalıştırmak, sütun raf kaldırın ve reaksiyon tüpleri çıkarın.
- tüpleri (kapaklar delikleri vardır emin olun) Cap ve sıvı azot ya da bir bunları dondurmak -80 ° C derin dondurucuda 30 dakika boyunca. -Freeze kuru tüm suyu uzaklaştırmak için (numune sayısı ve dondurularak kurutucunun kapasitesine bağlı olarak) 12-24 saat için örnekler.
- , dondurularak kurutulduktan sonra, ultra saf su tam bir hacimde (çoğunlukla 1.0 mL) içinde bir tortu yeniden çözülür. etiketli HPLC şişelere örnekleri ve beş sinigrin referansları aktarın. iki hafta kadar bir buzdolabına (4 ° C) ya da HPLC ile analiz etmeden önce, bir dondurucu (-20 ° C) kadar bir yıl örnekleri tutun.
- Gecede başlık altında sütun kurumasını cam edelim ve kuru bunları elden çıkarın. yeniden kullanım için adım 4.5 kullanılan numune tüpleri metal topları kurtarmak ve atık bidonuna tüpleri koydu.
Ayıklanan Örneklerinin 5. HPLC Ölçümleri
- Bir asetonitril-su derecesi ile ters-fazlı C18 sütunu (4.6 x 150 mm, 3 um, 300 A) üzerinde glukozinolatların ayrılır ve 0.75 ml / dk'lık bir akış ve 40 ° C kolon sıcaklığı (Tablo 1 e bakınız) . 229 nm'de algılama ve ölçümü gerçekleştirin.
- aynı sütunda ama uyarlanmış gradyan ile sinigrin referanslar ölçünÇözücü kullanımını azaltmak için bir yöntem (bakınız Tablo 2). en düşük konsantrasyon ile referans ile başlayan, beş sinigrin referanslar enjekte başlayın. Sonra sütunu temizlemek için ve piklerin taşınmasını önlemek için her onuncu numuneden sonra metanol enjeksiyonu (boşluk) de dahil olmak üzere, örnekleri enjekte edilir.
| Zaman [dk] | Akış [mL / dak] | % Bir su | % B ACN |
| 1 | 0.750 | 98 | 2 |
| 35 | 0.750 | 65 | 35 |
| 40 | 0.750 | 98 | 2 |
| Kolon sıcaklığı 40 ° C. | |||
Tablo 1: glukozinolat ayırma ve analysi asetonitril-su gradyanıters fazlı HPLC ile ilgili.
| Zaman [dk] | Akış [mL / dak] | % Bir su | % B ACN |
| 1 | 0.750 | 98 | 2 |
| 10 | 0.750 | 89.3 | 10.7 |
| 11 | 0.750 | 98 | 2 |
| Kolon sıcaklığı 40 ° C. | |||
Tablo 2: glukozinolatların miktarının kullanılan beş Sinigrin referans ölçümü için kısaltılmış asetonitril-su gradyanı.
6. Glukosinolat Belirlenmesi ve Ölçümü
- Kimlik
- ticari boşuna ile numunelerde piklerin UV spektrumları ve saklama süreleri karşılaştırmakmümkün, saf glukozinolat referanslar. Çeşitli glukozinolat sınıflardan UV spektrumlarının örnekleri için Şekil 2'ye bakınız.
- Mümkünse, referans standartları ile veya LC-MS 18, 19 bilinmeyen glikozinolitleri tanımlayın.
- nükleer manyetik rezonans (NMR), mümkünse bilinmeyen glikozinolitleri tanımlayın.
- Şekil 2 ve Tablo 3, veri tabanları ya da literatür referanslarında karşılaştırılmasına UV spektrumlan ve tutma kere.
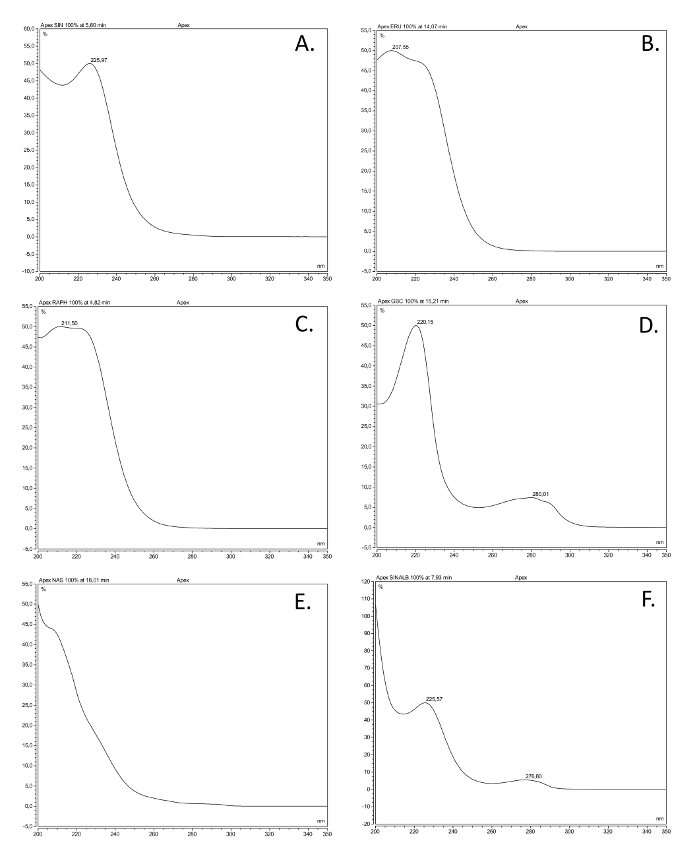
En yaygın glukosinolat sınıfların Şekil 2. UV spektrumları. Altı desulfoglucosinolates (GSL) UV absorpsiyon spektrumları (200-350 nm), en sık görülen yapısal sınıfları temsil eden, burada açıklandığı gibi ekstre piyasada mevcut referans bileşikleri yapılan çözümlerine dayalı. ortak ad, structural adı (parantez içinde), ve yapısal sınıf verilmiştir. (A) Sinigrin (2-propenil GSL) alkenil; (B) glukoerusin (4-metiltiyobutil GSL), thioalkenyl; (C) glukorafanine bağlıdır (4-methylsulfinlybutyl GSL) sülfinil; (D) glukobrassisin (indol-3-ilmetil GSL) indol; (E) gluconasturtiin (2-feniletil GSL), aromatik; (F) sinalbin aromatik (4-hidroksibenzil GSL). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Niceleme
- Beş sinigrin referanslar ve numunelerin tepelerin altındaki alanların entegre edin.
- Entegre alan üzerine kurulu beş ölçülen sinigrin referansların bir kalibrasyon eğrisi hesaplayın. regresyon çizgisinin denklemi kullanın glukozinolatların (Denklem 2 bakınız) interpole miktarını hesaplamak için (Denklem 1).
- Farklı glukozinolatların konsantrasyonunun hesaplanması için, AT 229 nm'de tespit için yanıt faktörü (M) ile interpolasyon miktar (X) çarpma (1990) 16, Buchner (1987) 15 ya da Brown ve ark. (1993) 17; En sık tespit edilen desulphoglucosinolates konsensüs tepki faktörleri Tablo 3'te verilmiştir.
NOT: arasında değişebilir Tepki faktörleri sistemleri-bu farklı referanslar verdiği farklı değerler vardır sebebi olabilir (Başvurular 15-17 bakınız). Bununla birlikte, değerler daha çok oldukça yakın ve yapısal sınıfları ile benzer bir aralık içindedir. Kongre sonra, glukobrassisin ve indol glukozinolatlarının (Şekil 2) benzer bir UV spektrumu bilinmeyen indol glukozinolatların için, elde edilmesi için bir tepki çarpanı 0.25 kullanmak tavsiye edilebilir, ancak, 1 tanımlanamayan glukozinolatların yanıt faktörünükonsantrasyon gerçekçi tahmini (Tablo 3). - Örnek glukozinolatların nihai bir miktar (x T) hesaplamak için, dikkate analizi için kullanılan seyreltme faktörü (D) ve numunenin kütlesi (g) alır (Denklem 3).
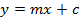 (1)
(1) 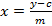 (2)
(2) 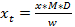 (3)
(3)
Y tepe alanını
Referans 5 puanlık gerileme eğrisinin m = eğim
C = Y-ekseni regresyon çizgisinin kesişme
özü glukozinolatların X = miktarı
Bitki örnek glukozinolatların x T = konsantrasyon
D = seyreltme faktörü
Ve arkadaşları Buchner (1987) ya da Brown 229 nm'de tespit için M = yanıt faktörü. (1993)
W = numune kütlesi çıkarılması için kullanılan
Sonuçlar
Bu yöntem algılama ve yapısal sınıfın yaygın olarak bulunan desulfoglucosinolates ayrılmasını (Şekil 3) sağlar. zararlı 2-hydroxyglucosinolate progoitrin nispeten erken kromatogramda gelir ve açık bir şekilde olumlu glukozinolat glukorafaninin bu örnekte sadece methylsulfinylglucosinolate ayrılır. Sinigrin, gluconapin ve glucobrassicanapin artan yan zincir uzunlukları (sırasıyla C3, C4 ve C5,) sahip alkenil glukozinolatların bir eluotropic dizi oluşturur. Benzer bir mantıksal dizi iki methylthioalkenyl glukozinolatların için, glucoiberverin (C3) ve glukoerusin (C4) görülebilir. 4-hidroksi, 1-methoxyglucobrassicin (neo- glukobrassisin) üç indol glukozinolatlar, glukobrassisin tepe ve türevleri, aynı zamanda açık bir şekilde birbirinden ayrılır. Bu dikkat edilmelidir ki, neo- glukobrassisin ve glukoerusin tepeleri gibi gluconasturtiin, sadece aromatik glukoBu örnekteki sinolate nedeniyle karışımı 9 kök özleri ilavesinden Bu Brassica özü özellikle yüksek olur.
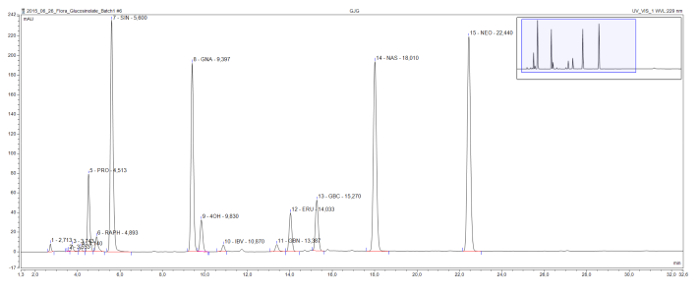
Şekil 3: Bir glukozinolat özü kromatogramı. Birleştirilen Brassica nigra kök ve filiz örnekleri, B. rapa, B. oleracea analizinden elde edilen bir HPLC kromatogramıdır detay (1-32 dakika). zirve etiketleri tutma süresine ve belirlenen desulfoglucosinolates için kısaltmalar (GSL) gösterir. PRO = progoitrin (2-OH-3-bütenil GSL); Ralph = glukorafanine bağlıdır (4-methylsulfinlybutyl GSL); SIN = Sinigrin (2-propenil GSL), GNA = gluconapin (3-bütenil GSL); 4OH = 4-hydroxyglucobrassicin; IBV = glucoiberverin (3-metiltiopropil GSL); GBN = glucobrassicanapin (4-pentenil GSL); ERU = glukoerusin (4-metiltiyobutil GSL); GBC = glukobrassisin (indol-3-ilmetil GSL); NAS gluconasturtiin (2-feniletil GSL); NEO = neo- glukobrassisin (1 MeOH glukobrassisin). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Rorippa Austriaca bir kökü özü görüldüğü gibi yaygın model bitkisi Arabidopsis'te bulunan uzun zincirli metilsülfinil glukozinolatlar, aynı zamanda, bir eluotropic serisi yer almaktadır. Glucohesperalin (C6), glucosiberin (C7), glucohirsutin (C8), ve glucoarabin (C9) kromatogram (Şekil 4) düzenli aralıklarla görünür. Birlikte tepe UV spektrumu ile, örneğin eluotropic mantık dizisi, bilinmiyor glukozinolatlar sınıflandırır, ve geçici olarak tespit etmek için kullanılabilir.
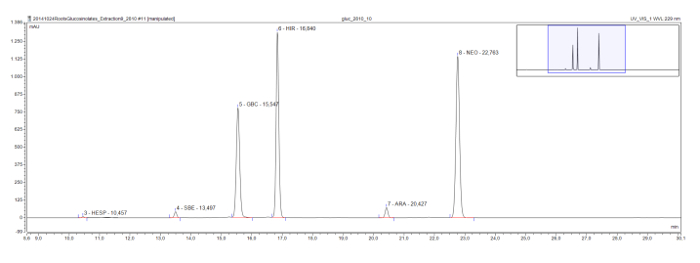
Şekil 4: kromatogramı (çerçeve 9-30 dk) Bir Rorippa Austriaca kök özü desulfoglucosinolates arasında. zirve etiketleri tutma süresine ve belirlenen desulfoglucosinolates için kısaltmalar (GSL) gösterir. HES = glucohesperin (6-methylsulfinylhexyl GSL); SBE = glucosiberin (7-methylsulfinylheptyl GSL); GBC = glukobrassisin (indol-3-ilmetil GSL); HIR glucohirsutin (8-methylsulfinlyoctyl GSL) =; ARA = glucoarabin (9-methylsulfinylnonylglucosinolate); NEO = neo- glukobrassisin (1 MeOH glukobrassisin). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| Yaygın isim | Yan zincir yapısı | R (dakika) * | 229 nm | referans# |
| aliphatic glukozinolatlar | ||||
| Glucocapparin | metil | 3.5 | 1 | Kahverengi |
| Sinigrin | 2-propenil | 5.5 | 1 | Brown, AK |
| Gluconapin | 3-bütenil | 9.5 | 1.11 | AK |
| Glucobrassicanapin | 4-pentenil | 13.5 | 1.15 | AK |
| Glucoiberverin | 3-metiltiopropil | 10.9 | 0.8 | Kahverengi |
| glukoerusin | 4-metiltiyobutil | 14.0 | 0.9 | Kahverengi |
| Glucoiberin | 3-methylsulfinylpropyl | 3.7 | 1.2 | Kahverengi |
| gLUKORAFANİN | 4-methylsulfinylbutyl | 4.9 | 0.9 | Kahverengi |
| Glucoalyssin | 5-methylsulfinylpentyl | 7.6 | 0.9 | Kahverengi |
| Glucohesperin | 6-methylsulfinylhexyl | 10.5 | 1 | Kahverengi |
| Glucosiberin | 7-methylsulfinylheptyl | 13.5 | 1 | Kahverengi |
| Glucohirsutin | 8-methylsulfinyloctyl | 16.8 | 1.1 | Kahverengi |
| Glucoarabin | 9-methylsulfinylnonyl | 20.5 | 1 | |
| Glucocheirolin | 3-metilsülfonilpropil | 4.2 | 0.9 | Kahverengi |
| Progoitrin | 2 (R) -OH-3-bütenil | 4,5 | 1.09 | Büchner, AK |
| Gluconapoleiferin | 2-OH-5-pentenil | 8.3 | 1 | AK |
| indol glukozinolatlar | ||||
| 4-hydroxyglucobrassicin | 4-hidroksiindol-3-ilmetil | 11.2 | 0.28 | Büchner, AK |
| glukobrassisin | indol-3-ilmetil | 15.3 | 0.29 | Büchner, AK |
| 4-Methoxyglucobrassicin | 4-metoksiindol-3-ilmetil | 18.2 | 0.25 | Büchner, AK |
| neo- glukobrassisin | 1-metoksiindol-3-ilmetil | 22.5 | 0.2 | Büchner, AK |
| aromatik glukozinolatlar | ||||
| Sinalbin | 4-hidroksibenzil | 8.1 | 0.5 | Buchner |
| Glucosibarin | 2 (R) -OH-2-feniletil | 12.1 | 0.95 | Bir sonraki bakın |
| Glucobarbarin | 2 (S) -OH-2-feniletil | 12.7 | 0.95 | Buchner |
| Glucotropaeolin | benzil | 13.8 | 0.95 | Büchner, AK |
| Gluconasturtiin | 2-feniletil | 18.0 | 0.95 | Büchner, AK |
| bilinmeyen - alifatik / UV spektrumu gibi aromatik | 1 | AK | ||
| bilinmeyen - Yelpazenin gibi indol | 0.25 | AK | ||
| * Yaklaşık tutma süresi (R,) (sütun, elüan kalitesi ile ilgili olarak 0,3 dakika ±) en yakın 0.1 dakika yuvarlanır. Alıkonma süreleri, bir C18 kolonu (150 x 4.6 mm, 3 mikrometre parçacık büyüklüğü) artı C18 ile donatılmış ThermoFisher / Dionex nihai HPLC platformlarında belirlenir Tablo 1 'deki gibi bir gradyan programı ile UB> Kolon öncesi (10 x 4.6 mm, 5 mikrometre parçacık büyüklüğü). | ||||
| tepki faktörleri arasında Referanslar: kolza glukozinolatların içinde Buchner, R. (ed JP WATHELET) 50-58 (Martinus NijhoffPublishers, 1987); Brown, PD, Tokuhisa, JG, Reichelt, M. & Gershenzon, farklı organ ve Arabidopsis thaliana gelişim evreleri arasında glukosinolat birikim J. değişimi. Bitki Kimyası. 62 (3), 471-481, DOI: 10,1016 / S0031-9422 (02) 00549-6 (2003); AK. Yağlı tohumlar - glukozinolatların Yüksek Performanslı Sıvı Kromatografi belirlenmesi. Avrupa Toplulukları Resmi Gazetesi. L 170/28. Ek VIII 03.07.27-34 (1990). | ||||
Tablo 3: Tepki faktörleri en yaygın bulundu desulfo-glukozinolatların C 18 sütun üzerinde bitki özleri ve bunların yaklaşık tutma süreleri. Elüsyon, gradyanTablo 1 'de T, kolon sıcaklığı ve akış hızı.
Tartışmalar
Bu kurulan ve yaygın olarak kullanılan yöntemin en büyük avantajı, sağlam, oldukça basit ve örnek başına nispeten düşük maliyetli olmasıdır. ekstraksiyon ve analiz için gerekli ekipman çoğu standart laboratuar mevcut olmalıdır ya da HPLC-PDA hariç olmak üzere, kendinden-inşa edilebilirler. Diğer bir avantajı, su içinde çözüldü desulfoglucosinolates serin ve hava geçirmez (HPLC) şişelerde muhafaza zaman, kimyasal olarak çok kararlıdır, yani ekstreler başka bir yerde kolaylıkla HPLC analizi için sevk olmasıdır. eğitim ve veri yazılımı yönetmek ve analiz etmek için kapsamlı uygulamalı deneyim uzman gerektiren LC-MS platformları, aksine, HPLC-UV / PDA kolayca kısa bir eğitim döneminden sonra çalıştırılabilir. Bu prosedürün maliyetlerini azaltır, aynı zamanda öğrencilerin de dahil olmak üzere bilim adamları geniş bir yelpazede, bu yöntem daha erişilebilir hale değil sadece.
Genel olarak, yukarıda tarif edilen prosedürler dikkatli bir şekild uyulduğundaLly, bazı problemler meydana gelmelidir. Genel olarak, glukozinolat pikleri çok iyi kromatogramda ayrılır. Bu durum söz konusu değilse, bir dereceleme programı akıtıcı asetonitril artış hızını azaltarak uyarlanabilir. Alternatif olarak, yeni ön-kolon (200-500 enjeksiyon) veya sütun (1.500 -2.000 enjeksiyon) bina sorunu çözebilir. Bazen, bir toplu tek numunelerin kromatogramları çok küçük veya hiç doruklarına gösterebilir. Bu sülfatazı eklerken nedeniyle pipetleme hataları genellikle (örneğin, bir sütun atlanır edilmiş veya sülfataz düzgün sütuna aşağı yıkadı değildi). beklenen ve çok az malzeme çıkarılması için kullanılan daha Seçenek olarak ise, deney malzemeleri glukozinolat konsantrasyonunun daha düşük olabilir. İkinci durumda ise, enjeksiyon hacmi 100 uL kadar yükseltilebilir, veya ekstre tam kısım (örneğin, 800 uL) konsantre edildi olabilir. ikinci dondurarak kurutma ile elde edilebilirsu daha küçük bir hacimde (örneğin, 100 uL) içinde eritilmesi, özü ing ve aynı referans eğrisi kullanılarak reinjecting. ekstresi orijinal konsantrasyonu için hesaplamalarda, sayılar seyreltme faktörü ile çarpılmalıdır. Bu sorunu çözmek değilse, malzeme başlangıç malzemesi kullanılarak daha ekstre edilmelidir. Bu fazla 100 mg ise, ekstraksiyon çözücü hacmi ve borular boyutu ekstraksiyon verimini korumak için orantılı olarak ayarlanmalıdır.
Diğer bir avantaj, bu yöntem iyi-valide edilmiş olmasıdır. Bu usul ve doğruluğu birçok labaratuvar 16 doğrulanmıştır olan kolza glukozinolatların miktarının, standart bir yöntem olarak tarif edilmiş olmasına olmasıdır. Buna ek olarak, genetik arka plan, biyosentez ve glukozinolatların biyolojik fonksiyonları mod, yoğun araştırma çabaları tabidirdiğerleri 4, 6, 12 arasında el bitki türleri Arabidopsis thaliana. Bu nedenle, Sinigrin ilişkin desulfoglucosinolates tam ölçümü için birçok tepki faktörleri iyi tanımlanmış ve 15,17 kamuya açık. LS-MS-tabanlı protokoller daha yüksek verimli, daha duyarlı ve mümkün olsa da (geçici) bir standart 18, 19, 20, LC-MS için evrensel tepki faktörlerinin eksikliği sınırlar mevcut olduğu glukozinotlar belirlemek glukosinolat konsantrasyonlarının 18 tam ölçümü. Ayrıca, bu yöntemler genellikle taze bitki malzemesinin bir kurutma adımı, ve su miktarını içermez tam miktar zorlaştırır hesaplamalarda kayıt dışı olan. Bizim ekstraksiyon yöntemi içerir çünkü Son olarak, bir sütun tabanlıarındırma ve yoğunlaştırma aşamaları, aynı zamanda bu tür topraklarda 21 olarak glukozinolatların düşük konsantrasyonları ile "kirli" örnekleri uygulanabilir.
Genellikle, taze dondurulmuş malzeme elde çıkarılması için, 96 gözlü levhalar kullanmak ve sülfataz adım 18, 19 kapsamamaktadır LC-MS-tabanlı yöntemler ile karşılaştırıldığında, yöntem, nispeten zaman alıcı ve emek yoğundur. Bu yazıda anlatılan sütun raflarla, tek bir kişi bir günde yaklaşık 100-150 örnekleri elde edebilirsiniz. Elüsyon (ertesi gün), (gece) dondurarak kurutulmuş ve yeniden çözülmesini takip eden iki gün içinde yer alabilir. otomatik HPLC enjektör, enjeksiyon başına 40-45 dakikalık bir çalışma ve dengeleme zamanında ve hiçbir beklenmedik olaylar, bu örnek seti için veri elde etmek 3-4 gün sürer. HPLC yazılımı otomatik ölçümü sinigrin eğri, kromatogramlar ve pe manuel kontrol dayalı sağlar zamanveri istatistiksel analizler için kullanılmadan önce 100 numune için ak atamalar yalnızca başka bir 1 veya 2 saat sürebilir.
glukosinolat standartlarının artması bulunmasına karşın, 130'dan fazla adayın sadece küçük bir kısmı şu anda ticari olarak satın alınabilir. Bununla birlikte, sentetik sınıfların her biri için bir kaç referanslarla; bileşikleri belirten literatür veri tabanlarına erişim, daha önce bitki türlerinde bulunan (örneğin, Fahey ve ark 22.); Böyle eluotropic dizi mantığı olarak kromatografik ilkeler, temel bilgi (örneğin, alifatik bileşikler yan zinciri üzerindeki Cs sayıları artan için, 3 Şekiller ve 4); ve NMR 23 LC-MS 19 ya da izole glukozinolatların tek numunelerin doğrulama, kolayca bu sınırlama üstesinden gelebilir. glukosinalatının En protokolleri iç referans eğrileri kullanmak analizleri(Örneğin, solvent çıkarımı 16, 17, 19 Sinigrin ekstre ya sinalbin belirli konsantrasyon). Prensip olarak, iç referans eğrileri daha yüksek bir hassasiyet elde böylece teorik olarak bireysel numune işleme hataları düzeltmek ve daha uygundur. Bu avantajına rağmen, biz sık sık (örneğin, Brassica nigra 24) ya da sinalbin (örn Sinapis alba 25), Sinigrin yüksek düzeyde içeren bazıları farklı yabani türler, analiz gibi bir beş noktalı harici referans eğrisi kullanmayı tercih iki glukosinolat referanslar hangi yanıt faktörleri mevcuttur. yüksek dereceli glukosinolat referans standartları genellikle oldukça pahalı Dahası, her bir örnek için iç standartlar ekleyerek, analizlerin maliyetini artırmaktadır.
Sonuç olarak, zaman alıcı adımlara rağmen, bu protokolayıklamak ve bitki örneklerinde glukozinotlar ölçmek için basit ve erişilebilir bir yöntem sağlar. Bununla birlikte, glukozinolat düzeyleri kendileri tek bir glukozinolat 11 kaynaklanabilecek reaksiyon ürünlerinde sadece mirosinaz ile tepkimeye gereklilik olarak görülen potansiyel biyolojik aktivitesinin göstergesi, ve varyasyonu olduğu dikkate alınması önemlidir. Doğrulama deneyleri biyolojik ilgisini onaylamak için gerçekleştirilmelidir.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
NMvD thanks Dr. Michael Reichelt (Max-Planck-Institute for chemical Ecology, Jena, Germany) for providing the first reference samples when she started using this method 16 years ago. Ciska Raaijmakers (NIOO-KNAW, Wageningen, the Netherlands), Sebastian Krosse (B-Ware, Nijmegen, the Netherlands), and Christian Ristok (iDiv, Leipzig) are acknowledged for improving the protocol over the course of the years. Mirka Macel and Martine Huberty (University Tübingen, Germany) are acknowledged for their permission to use the Rorippa chromatogram. The authors gratefully acknowledge the support of the German Centre for Integrative Biodiversity Research (iDiv) Halle-Jena-Leipzig, funded by the German Research Foundation (FZT 118).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Methanol HiPerSolv CHROMANORM® gradient grade for HPLC grade | VWR | 20,864,320 | |
| Sodium acetate (NaOAc) | Sigma-Aldrich | W302406-1KG-K | |
| HCL | VWR | 1,090,571,000 | |
| Sephadex | Sigma-Aldrich | A25120-10G | |
| (−)-Sinigrin hydrate from horseradish | Sigma-Aldrich | S1647-500MG | |
| Aryl Sulfatase | Sigma-Aldrich | S9626-10KU | |
| Ethanol | VWR | 20,816,298 | |
| Pasteur Pipette | Carl Roth | 4518.1 | |
| Glass Wool | Carl Roth | 7377.1 | |
| Glass /wooden stick | VWR | HERE1080766 | |
| 2 mL reaction tubes | VWR | 211-2606 | |
| Dissecting needle | Carl Roth | KX93.1 | |
| Rotilabo-lab dishes | Carl Roth | 0772.1 | Waste tray |
| Freeze Dryer Freezone 12 L | Labconco | 7960030 | |
| Acetonitril super gradient grade | VWR | 83,639,320 | |
| Water bath | VWR | 462-5112 | |
| Ultrasonic bath | Fisher Scientific | FB 15061 | |
| PH Electrode | Thermo Fisher Scientific | STARA2115 | |
| Centrifuge Heraeus Multifuge X1 | Thermo Fisher Scientific | 75004210 | |
| Pre-Column | Thermo Fisher Scientific | 69697 | C18 column (4.6 x 10 mm, 5 µm, 300 Å) |
| Column Acclaim 300 | Thermo Fisher Scientific | 60266 | C18 column (4.6 x 150 mm, 3 µm, 300 Å) |
| HPLC Ultimate 3000 | Thermo Fisher Scientific | with column oven and UV or PDA detector | |
| Flask 1000 mL | VWR | 215-1595 | |
| Glucosinolate reference compounds | Phytoplan | various | http://www.phytoplan.de/ |
Referanslar
- Hartmann, T. From waste products to ecochemicals: Fifty years research of plant secondary metabolism. Phytochemistry. 68 (22-24), 2831-2846 (2007).
- Will, H., Laubenheimer, A. Ueber das Glucosid des weissen Senfsamens. Justus Liebigs Annalen der Chemie. 199 (1), 150-164 (1879).
- Agerbirk, N., Olsen, C. E. Glucosinolate structures in evolution. Phytochemistry. 77, 16-45 (2012).
- Halkier, B. A., Gershenzon, J. Biology and biochemistry of glucosinolates. Ann Rev Plant Biol. 57, 303-333 (2006).
- Sønderby, I. E., Geu-Flores, F., Halkier, B. A. Biosynthesis of glucosinolates - gene discovery and beyond. TIPS. 15 (5), 283-290 (2010).
- Kliebenstein, D. J., et al. Genetic control of natural variation in Arabidopsis glucosinolate accumulation. Plant Physiol. 126 (2), 811-825 (2001).
- van Leur, H., Raaijmakers, C. E., van Dam, N. M. A heritable glucosinolate polymorphism within natural populations of Barbarea vulgaris. Phytochemistry. 67 (12), 1214-1223 (2006).
- Kelly, P. J., Bones, A., Rossiter, J. T. Sub-cellular immunolocalization of the glucosinolate sinigrin in seedlings of Brassica juncea. Planta. 206 (3), 370-377 (1998).
- van Dam, N. M., Tytgat, T. O. G., Kirkegaard, J. A. Root and shoot glucosinolates: a comparison of their diversity, function and interactions in natural and managed ecosystems. Phytochem Rev. 8 (1), 171-186 (2009).
- Ratzka, A., Vogel, H., Kliebenstein, D. J., Mitchell-Olds, T., Kroymann, J. Disarming the mustard oil bomb. Proc Natl Acad Sci U S A. 99 (17), 11223-11228 (2002).
- Wittstock, U., Kliebenstein, D. J., Lambrix, V., Reichelt, M., Gershenson, J., Romeo, J. T. . Integrative Phytochemistry: From ethnobotany to molecular ecology: Recent Advances in Phytochemistry. 37, (2003).
- Hopkins, R. J., van Dam, N. M., van Loon, J. J. A. Role of glucosinolates in insect-plant relationships and multitrophic interactions. Ann Rev Entomol. 54 (1), 57 (2009).
- Kliebenstein, D. J., Gershenzon, J., Mitchell-Olds, T. Comparative quantitative trait loci mapping of aliphatic, indolic and benzylic glucosinolate production in Arabidopsis thaliana leaves and seeds. Genetics. 159 (1), 359-370 (2001).
- Mithen, R., Bennett, R., Marquez, J. Glucosinolate biochemical diversity and innovation in the Brassicales. Phytochemistry. 71 (17-18), 2074-2086 (2010).
- Buchner, R., Wathelet, J. P. . Glucosinolates in rapeseed. , 50-58 (1987).
- . Oil seeds - determination of glucosinolates High Perfomance Liquid Chromatography. Official Journal of the European Communities. , 27-34 (1990).
- Brown, P. D., Tokuhisa, J. G., Reichelt, M., Gershenzon, J. Variation of glucosinolate accumulation among different organs and developmental stages of Arabidopsis thaliana. Phytochemistry. 62 (3), 471-481 (2003).
- Glauser, G., Schweizer, F., Turlings, T. C. J., Reymond, P. Rapid Profiling of Intact Glucosinolates in Arabidopsis Leaves by UHPLC-QTOFMS Using a Charged Surface Hybrid Column. Phytochem Analysis. 23 (5), 520-528 (2012).
- Crocoll, C., Halkier, B. A., Burow, M. . Current Protocols in Plant Biology. , (2016).
- Griffiths, D. W., Bain, H., Deighton, N., Botting, N. P., Robertson, A. A. B. Evaluation of liquid chromatography-atmospheric pressure chemical ionisation-mass spectrometry for the identification and quantification of desulphoglucosinolates. Phytochem Analysis. 11 (4), 216-225 (2000).
- Gimsing, A. L., Kirkegaard, J. A. Glucosinolates and biofumigation: fate of glucosinolates and their hydrolysis products in soil. Phytochem Rev. 8 (1), 299-310 (2009).
- Fahey, J. W., Zalcmann, A. T., Talalay, P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants. Phytochemistry. 56, 5-51 (2001).
- de Graaf, R. M., et al. Isolation and identification of 4-α-rhamnosyloxy benzyl glucosinolate in Noccaea caerulescens showing intraspecific variation. Phytochemistry. 110, 166-171 (2015).
- van Dam, N. M., Raaijmakers, C. E. Local and systemic induced responses to cabbage root fly larvae (Delia radicum) in Brassica nigra and B. oleracea. Chemoecology. 16 (1), 17-24 (2006).
- Gols, R., et al. Temporal changes affect plant chemistry and tritrophic interactions. Bas Appl Ecol. 8 (5), 421-433 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır