A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تعرض الجهاز العصبي المركزي الخنزير للتحليل النسيجي: دليل لقطع الرأس، الجمجمة افتتاح، والدماغ إزالة
In This Article
Summary
والهدف من هذه الورقة، والفيديو التعليمي هو شرح طريقة لكشف وإزالة الدماغ الخنازير والغدة النخامية وبعد الوفاة في حالة سليمة، ومناسبة لتحليل العيانية والنسيجي لاحقة.
Abstract
أصبحت الخنازير شعبية متزايدة في والحيوان كبير البحوث متعدية علم الأعصاب كبديل مجدية اقتصاديا وأخلاقيا لالرئيسيات غير البشرية. حجم دماغ كبير من الخنزير يسمح باستخدام التصوير الدماغ السريرية التقليدية والاستخدام المباشر واختبار الإجراءات والمعدات جراحة الأعصاب من العيادة الإنسان. مزيد من التحليل العيانية والنسيجي، ومع ذلك، يتطلب التعرض بعد الوفاة من النظام خنزير العصبي المركزي (CNS) وإزالة المخ لاحقة. هذه ليست مهمة سهلة، والخنزير يتم تغليف CNS من قبل سميكة، والجمجمة العظمية والعمود الفقري. والهدف من هذه الورقة، والفيديو التعليمي هو شرح طريقة لكشف وإزالة الدماغ الخنازير بعد الوفاة والغدة النخامية في حالة سليمة، ومناسبة لتحليل العيانية والنسيجي لاحقة.
Introduction
أصبحت دراسات علم الأعصاب متعدية الخنازير شعبية متزايدة خلال العقدين الماضيين. حجم كبير من الدماغ الخنازير يمكن استخدام التصوير الدماغ السريرية التقليدية والاستخدام المباشر واختبار إجراءات جراحة الأعصاب والمعدات من عيادة الإنسان 1، 2، 3، 4، 5، 6، 7، 8. في السنوات ال 20 الماضية، والخنازير، وخاصة minipigs (على سبيل المثال، غوتنغن minipig)، وقد استخدمت لدراسة طرق العلاج neuromodulatory، مثل زرع الخلايا الجذعية. الفيروسي ترنسفكأيشن النواقل؛ والتحفيز العميق للمخ الموجهة نحو مرض باركنسون، والسمنة، والاكتئاب، ومرض الزهايمر 2، 6،= "XREF"> 9، 10، 11، 12، 13، 14، 15، 16، 17. وقد تبع ذلك وضع نهج التجسيمي والجراحية لمعالجة minipig CNS 3 و 18 و 19 و 20 و 21. وقد تم تقييم التغييرات CNS وضعت في الحيوانات الحية باستخدام التصوير الدماغي (PET 10 و 13 و 22 و 24 و MR 23)، قياس المثانة 11، 12، 25، تحليل مشية17، وتقييم عصبي 9، 17، والفحص بعد الوفاة بناء على الأنسجة وتحليل stereological 14، 15، 17، 26، 27، 31. ومع ذلك، وتحليل بعد الوفاة يتطلب التعرض وإزالة الدماغ الخنازير، وهي ليست مهمة سهلة، وسميكة، والجمجمة العظمية والسحائي ليفية تغطي تحيط بالدماغ خنزير.
والهدف من هذه الورقة، والفيديو التعليمي هو شرح طريقة الدماغ الخنازير بعد الوفاة والغدة النخامية قد يتعرض وإزالتها في حالة سليمة في 15-20 دقيقة باستخدام أدوات جراحية غير الآلية. فيديو تعليمي والرسوم التوضيحية التصوير تظهر minipigs الذكور (العمر: 6 شهور، وزن الجسم: 20-25 كغ) تستخدم لدراسة تشريحية على الغدة النخامية minipig.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم إجراء تخدير الحيوان وeuthanesia وفقا ل "مبادئ مختبر رعاية الحيوان" (NIH المنشور رقم 86-23، منقحة 1985) والتي وافق عليها المجلس الدانمركي لأخلاقيات البحوث الحيوانية.
1. أدوات
- جمع الأدوات المعروضة في الفيديو والمدرجة في جدول المواد.
2. قطع الرأس
وكان المستحث التخدير عن طريق الحقن العضلي من 5 مل من ميدازولام (5 ملغ / مل) و 5 مل من الكيتامين (25 ملغ / مل): ملاحظة. في وقت لاحق 5-10 دقيقة، عندما كان مخدرا للحيوان بالغ، ومقنى الوريد الأذن وجرعة زائدة قاتلة (100 ملغم / كغم من وزن الجسم) من الصوديوم بنتوباربيتال أعطيت (200 ملغ / مل) عن طريق الوريد. للتأكد من أن هذا الحيوان كان الموت الرحيم تماما، تم اختبار رد الفعل الألم بين الأصابع كما يتضح من Ettrup وآخرون. (2011) 20. وقد ضمنت euthanization الكامل كما هو موضح فيبيان الأخلاق أعلاه ويليه نضح transcardial مع 5 L من المياه المالحة متساوي التوتر، كما يتبين من Ettrup وآخرون. (2011) 20. يتم تنفيذ كافة الإجراءات أثبت تشريح الجثة، والحيلولة دون الحاجة إلى الاحتياطات الرعاية اللازمة للتخدير طويلة الأجل والبقاء على قيد الحياة postprocedural.
- قطع رأس خنزير بواسطة شق عنق الرحم دائرية عالية، وذلك باستخدام مشرط جراحي، أقل بقليل من زاوية الفك السفلي (الشكل 1A).
- لا يزال مع مشرط جراحي، ومواصلة شق الأمامية من خلال الأنسجة الرخوة في الرقبة، بما في ذلك الحنجرة والمريء، حتى يتم التوصل إلى العمود الفقري عظمي، تقريبا على مستوى تقاطع craniocervical.
- تقدم قطع مع مشرط جراحي من الجانب الأمامي من مفترق الطرق craniocervical، فوق قوس الأمامي من الأطلس، وذلك من خلال الغشاء الفهقي الأمامي، وبالتالي تعريض القناة الشوكية والحبل الشوكي (الشكل 1B). نسأل نفس الوقت مساعدا لسحب الجسم الخنازير بعيدا عن رأس خنزير لتخفيف الوصول بين قاعدة الجمجمة وأول فقرة الرقبية.
- مواصلة شق جراحي من خلال الكيس الجافية والحبل الشوكي (الشكل 1B). عناية خاصة لضمان أن يتم التوصل إلى المقطع العرضي كاملة من الحبل الشوكي.
ملاحظة: الفشل في تنفيذ الخطوة السابقة قد يؤدي إلى جر غير المرغوب فيها على الحبل الشوكي والدماغ خلال الخطوات التالية لعملية قطع الرأس. - تمديد بقوة تقاطع cranocervical على مستوى القسم (الشكل 1C). في نفس الوقت، استخدم مشرط جراحي لقسم الأربطة الفهقي المتبقية للافراج عن التعبير بين لقمة القذالي وعملية التعبير العليا من الأطلس. فصل رأس خنزير من الجسم.

الشكل 1: Minipig قطع الرأس. (A) العنق شق (السهم، زاوية الفك السفلي). (B) شق طريق الأربطة الفهقي والنخاع الشوكي محاط الجافية (SC) عند تقاطع craniocervical (C1، القوس الأمامي من أطلس، OC، لقمة القذالي). يتم تحريرها (C) والجزء الخلفي من التعبير الفهقي بواسطة ملحق قوية (الأسهم) على مستوى القسم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
3. الجمجمة افتتاح
- وضع رأس خنزير على الطاولة.
- إجراء شق طولي الظهري مع مشرط جراحي عن طريق الجلد والأنسجة الرخوة الكامنة من الجزء الخلفي من الخطم، على قمة الرأس، وأسفل من خلال الجزء الخلفي منالمنطقة القفوية.
- كشف ظهري والخلفية جزء من الجمجمة عن طريق إزالة الأنسجة اللينة تقع الوحشي على شق الأولي مع مشرط جراحي.
- الافراج عن العضلات الزمنية ثنائيا من الجمجمة (الشكل 2A) مع مشرط جراحي. تأكد من أن عظم القذالي الخلفي يتم تنظيف الأنسجة اللينة.
- استخدام المدخل الخلفي للماغنوم الثقبة لإزالة عظم القذالي مع Kerrison العظام لكمة والعظام رينجرز وفضح المخيخ المغطاة الجافية (الشكل 2B).
- العودة إلى الجانب الأمامي المكشوفة من الجمجمة وتحديد نقطة الدخول في العظم الجبهي، عادل امام العينين. في هذه المرحلة، واستخدام إزميل العظام بمطرقة لاختراق الجمجمة وأدخل الجيب الأمامي (الشكل 2C).
- استخدام مدى الجيب الأمامي لمواصلة إزالة ظهراني خلفي من الصفيحة الجمجمة الخارجي مع مقراض العظم أو العظام لكمة وفضح الداخلية، رقيقةالعظمية الصفيحة الجمجمة التي تغطي المخ (الشكل 2D).
- فتح بلطف العظمية الداخلية الصفيحة الجمجمة الأمامية مع مطرقة وإزميل العظام لفضح المخ المغطاة الجافية (الشكل 2E).
- تواصل إزالة العظام أفقيا باستخدام إزميل العظام ومقراض العظم من خلال العظم الصدغي والجداري من أجل الإفراج عن الجزء ظهراني خلفي النهائي من الجمجمة، وتقع بين الأجزاء المكشوفة بالفعل للمخ المغطاة الجافية والمخيخ (الشكل 2F).
ملاحظة: من الممكن في كثير من الأحيان، خلال المرحلة الأخيرة من هذا الإجراء، لاستخدام الازميل لكسر فتح الخلفي الجمجمة العظام المتبقية من جانب واحد، تماما مثل واحد يفتح الباب.
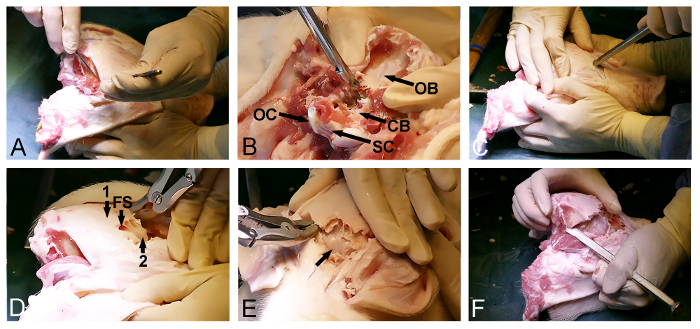
الشكل 2: Minipig فتح الجمجمة. (A) التعرض للdorsoposterioص سطح الجمجمة، بما في ذلك إزالة القذالي والعضلات الزمنية. (B) إزالة العظم القذالي (CB، المغطاة الجافية المخيخ، OB، عظم القذالي، OC، لقمة القذالي، وSC، والحبل الشوكي). وتستخدم (C) ومطرقة وإزميل العظم لاختراق الجمجمة الأمامية ولدخول الجيب الأمامي على مستوى العينين. (D) مدى الجيب الأمامي (FS) ويستخدم لإزالة الخارجي سميكة الجمجمة العظام (1)، وتعريض ورقيقة الداخلية الصفيحة العظام (2) التي تغطي المخ. (E) إزالة الصفيحة العظام رقيقة، وفضح المخ المغطاة الجافية (السهم). (F) وأخيرا، يتم استخدام مطرقة وإزميل العظام للاتصال أفقيا الأمامي والفتحات الخلفية الجمجمة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
4. الدماغ ازالتهاالله
- استخدام ملقط جراحي لرفع الجافية وإنشاء وثيقة شق لطيف على الجيب السهمي العلوي الوريدي باستخدام مشرط جراحي غرامة (الشكل 3A).
- استخدام مقص الجزئي أو الجافية سكين لمواصلة فتح الجافية التي تغطي السطح الظهري من المخ.
ملاحظة: يجب إيلاء عناية خاصة عند إزالة الجافية المقابلة لtentorium المخيخ (الشكل 3B)، والحفاظ على هذا أوراق الجافية سيمنع إزالة الدماغ لاحقة. - وضع رأس خنزير عموديا (الشكل 3C).
- استخدام إزميل العظم أو مشرح للافراج عن المخ ventroanterior عن طريق تشريح حادة من البصلة الشمية من الطابق المغطاة الجافية من تجويف الجمجمة (الشكل 3D).
- استخدام مشرط جراحي غرامة لقسم chiasm البصرية يتعرض (الشكل 3E). فضح وقسم ساق الغدة النخامية والأعصاب المحرك للعين.
- الافراج عن الدماغ البطني بواسطة باجتزاء اتحاد نقابات العمالور الأعصاب القحفية (الشكل 3F) مع مشرط جراحي على ما يرام. تأكد من أن tentorium المخيخ الجافية وقطعي تماما (الشكل 3B)، وهذه ورقة الجافية سيخفض ذلك من خلال الدماغ أثناء عملية الإصدار.
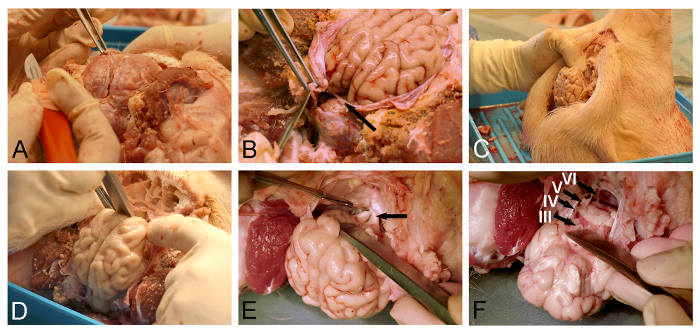
الشكل 3: إزالة الدماغ Minipig. (A) السحائي فتح مع ملقط الجراحة وسكين الجافية. يجب أن تؤخذ (B) العناية إلى شق تماما ورقة الجافية (السهم)، وتقع بين المخ والمخيخ. يتم وضع (C) ورأس خنزير عموديا لرؤية أفضل للهياكل قاعدة الجمجمة ومن أجل الجاذبية للمساعدة في تشريد المقصود من الدماغ. (D) ومشرح أو إزميل العظم يستخدم لتخفيف البصلة الشمية من قبل قسم حادة من الجافية-covereد قاعدة الجمجمة. واستمر (E) وتشريح في اتجاه الخلفي على طول قاعدة الجمجمة عن التعرض وباجتزاء من chiasm البصرية (السهم)، السويقة القمعية، والأعصاب المحرك للعين. اكتمال (F) الافراج الدماغ مع قسم الأعصاب القحفية أقل لأنها ابتعدت عن السطح البطني من الدماغ (III، العصب المحرك للعين، IV، العصب البكري، V، العصب مثلث التوائم، والسادس، عصب مبعد). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
5. إزالة الغدة النخامية
- التعرف على ساق الغدة النخامية ورقة محيطها الجافية (والسرج diapragma) في الطابق الجمجمة الشكل (4A).
- شق الوحشي ورقة الجافية إلى ساق الغدة النخامية باستخدام مشرط جراحي غرامة (الشكل 4B).
- استخدام مشرح للافراج عن حفرةuitary ورفعه للخروج من الحفرة النخامية (الشكل 4C).

الشكل 4: Minipig إزالة الغدة النخامية. تم تحديد (A) والحفرة النخامية (*) في الطابق الجمجمة (1، البصلة الشمية، 2، chiasm البصرية، وPF، الحفرة الخلفية في الجمجمة). (B) وتغطية الجافية (diagphragm سيلار، (السهم)) هو قطعي أفقيا. (C) يتم تحرير النخامية (السهم) مع مشرح ورفعت من الحفرة النخامية. شريط النطاق (AC) = 10 مم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
النتائج
لمنع المواد الأنسجة من الجفاف، فمن المستحسن لتخزين الدماغ إزالتها والغدة النخامية في جرة مملوءة تثبيتي أو المالحة متساوي التوتر على الفور بعد أن تم إجراء تحليل العيانية. قد يتم تخزين المواد الأنسجة في تثبيتي لسنوات، في حين أن تخزين في المياه المال?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يتم تنفيذ معظم الدراسات التجريبية علم الأعصاب في أنواع الحيوانات الصغيرة، مثل الفئران والجرذان، حيث يتم تسهيل الوصول إلى الجهاز العصبي المركزي التي كتبها رقيقة skull- والجافية سمك. ومع ذلك، في حيوانات التجارب الكبيرة مثل الخنازير 1 و 4
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
المؤلفون تعترف مع الامتنان المساعدة الماهرة السيدة ترين W. ميكلسن، السيدة ليز M. المناسب، والموظفين في Påskehøjgaard. المجلس الدانمركي للأبحاث الطبية، ومؤسسة وندبيك، ومؤسسة نوفو نورديسك الدعم المالي للدراسة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652(2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved