Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Воздействие на ЦНС Pig для гистологического анализа: Руководство для обезглавливания черепа Открытие и Brain Removal
В этой статье
Резюме
Цель данной статьи и обучающего видео, чтобы описать, как выявить и удалить посмертную свинью мозг и гипофиз в интактном состоянии, подходящем для последующего макроскопического и гистологического анализа.
Аннотация
Свиньи становятся все более популярными в крупных животных исследования трансляционной нейронауки в качестве экономически и этически возможной замены для приматов. Большой размер мозга свиньи позволяет использовать обычные томографы клинического мозга и прямое использование и тестирование нейрохирургических процедур и оборудования из человеческой клиники. Далее макроскопическое и гистологическое исследование, однако, требует посмертного воздействия на свиной центральную нервной системе (ЦНС) и последующего удаление головного мозга. Это не простая задача, как свиньи ЦНС инкапсулируется толстым, костистым черепом и позвоночником. Цель данной статьи и обучающего видео, чтобы описать, как выявить и удалить посмертный мозг свиньи и гипофиз в интактном состоянии, пригодный для последующего макроскопического и гистологического анализа.
Введение
Трансляционные исследования неврологии у свинех становятся все более популярными в течение последних двух десятилетий. Большой размер мозга свиньи позволяет использовать обычные томографы клинического мозга и прямого использование и тестирования нейрохирургических процедур и оборудования из человеческой клиники 1, 2, 3, 4, 5, 6, 7, 8. В течение последних 20 лет, свиней, особенно минисвиней (например, Гёттинген minipig), были использованы для изучения neuromodulatory методов лечения, таких как трансплантации стволовых клеток; вирусный вектор трансфекции; и глубокая стимуляция мозга направлены на болезнь Паркинсона, ожирение, депрессии и болезни Альцгеймера 2, 6,= "Xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Это было с последующим развитием стереотаксической и хирургических подходов для манипулирования minipig ЦНС 3, 18, 19, 20, 21. В возбужденные изменения ЦНС были оценены в живых животных с использованием визуализации мозга (ПЭТ 10, 13, 22, 24 и MR 23), цистометрию 11, 12, 25, анализ походки17, неврологическая оценка 9, 17 и вскрытие на основе гистологии и стереологического анализа 14, 15, 17, 26, 27, 31. Однако посмертный анализ требует экспозиции и удаления головного мозга свиньи, которая не является легкой задачей, в виде густым, костистый черепа и волокнистый дюраль, покрывающий окружают головной мозг свиньи.
Цель данной статьи и обучающего видео, чтобы описать, как посмертная свинью мозг и гипофиз, могут быть выявлены и удалены в интактном состоянии в 15-20 мин с использованием безмоторных хирургическими инструментов. Обучающее видео и фотографические иллюстрации показывают мужские минисвиней (возраст: 6 месяцев, вес тела: 20-25 кг), используемые для анатомического исследования на minipig гипофиза.
протокол
анестезии животных и euthanesia проводили в соответствии с «Принципами ухода за лабораторными животными» (NIH публикации № 86-23, пересмотренные 1985) и одобрен Советом Датских животных исследовательской этики.
1. инструменты
- Собирают инструменты , представленные в видео , и перечисленные в таблице материалов.
2. обезглавливание
Примечание: Анестезия индуцировали путем внутримышечной инъекции 5 мл мидазолам (5 мг / мл) и 5 мл кетамина (25 мг / мл). 5-10 мин позже, когда был глубоко седативные животное, ушную вену вводили канюлю и летальный передозировки (100 мг / кг веса тела) пентобарбитала натрия (200 мг / мл) вводили внутривенно. Для того, чтобы гарантировать , что животное было полностью умерщвлены, межпальцевых рефлекс боли тестировали , как показано Ettrup и соавт. (2011) 20. Полная euthanization была обеспечена, как описано вутверждение этики выше и последующая transcardial перфузией 5 л изотонического солевого раствора, как продемонстрировано Ettrup и соавт. (2011) 20. Все продемонстрированные процедуры выполняются вскрытие, исключающей необходимости мер предосторожности обеспечения, необходимой для долгосрочной анестезии и postprocedural выживания.
- Обезглавьте свиньи высокой круговой цервикального разреза, используя хирургический скальпель, чуть ниже угла нижней челюсти (рис 1А).
- Тем не менее с хирургическим скальпелем, продолжает надрез кпереди через мягкие ткани шеи, в том числе гортани и пищевода, пока костное позвоночника не будет достигнуто, примерно на уровне краниоцервикального перехода.
- Предварительный разрез с хирургическим скальпелем от передней стороны краниоцервикального перехода, выше передней дуги атласа, а через переднюю мембрану атлантозатылочной, тем самое подвергая спинномозговой канал и спинной мозг (Фигура 1В). Одновременно попросите помощник, чтобы вытащить тело свиньи от головы свиньи, чтобы облегчить доступ между основанием черепа и первым шейным позвонком.
- Продолжить хирургический разрез через дурального мешка и спинного мозга (Фиг.1В). Соблюдайте особую осторожность, чтобы обеспечить полное поперечное сечение спинного мозга достигается.
ПРИМЕЧАНИЕ: Невыполнение предыдущего шага может привести к нежелательному тяги на спинном и головном мозге в течение следующих этапов процесса обезглавливания. - Насильно продлить cranocervical соединение на уровне раздела (рис 1C). В то же время, использовать хирургический скальпель, чтобы остальные секции атлантозатылочных связки, чтобы освободить сочленение между затылочными мыщелками и верхним суставным процессом атласа. Отделить голову свиньи из организма.

Рисунок 1: Minipig обезглавливание. (А) шейный разрез (стрелка, угол нижней челюсти). (Б) Разрез через атлантозатылочный связок и спинной мозг Dura-окружение (SC) на стыке краниоцервикального (С1, передняя дуга атланта; OC, затылочный мыщелок). (С) Задней частью атлантозатылочного сочленения высвобождаются силовым расширение (стрелка) на уровне секции. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
3. Череп Открытие
- Поместите голову свиньи на столе.
- Сделать спинной продольный разрез с хирургическим скальпелем через кожу и подстилающую мягкую ткань из задней части морды, над вершиной головы и вниз по задней частизатылочная область.
- Выставляет спинную и заднюю часть черепа, удаляя мягкие ткани, расположенных сбоку от первоначального разреза с хирургическим скальпелем.
- Выпуск височной мышцы на двусторонней основе из черепа (рис 2A) с хирургическим скальпелем. Убедитесь, что задняя затылочная кость очищается от мягких тканей.
- Используйте вход заднего от затылочного отверстия для удаления затылочной кости с Kerrison костьми пуансонов и костными кусачками и подвергать твердый мозговой покрытый мозжечок (фигура 2В).
- Возврат к открытой передней стороне черепа и выберите точку входа в лобной кости, прямо перед глазами. На этом этапе использует кости долото с молотком , чтобы проникнуть через череп и ввести лобную пазуху (рис 2C).
- Используйте степень лобной пазухи для дальнейшего dorsoposterior удаления внешнего черепа пластинки с костью костных кусачек или костью пуансоном и подвергать внутренние, тонкиекостистые черепа пластинка покрывает головной мозг (рис 2D).
- Аккуратно откройте внутреннюю костистый череп пластинку кпереди с молотком и долотом кости , чтобы выставить Dura-покрытые головной мозг (рис 2E).
- Продолжить удаление кости в боковом направлении с использованием костного долота и костьми костных кусачек через временную и теменную кость , с тем , чтобы выпустить окончательную dorsoposterior части черепа, расположенной между уже открытыми частями твердым мозговым покрытым головным мозгом и мозжечка (рис 2F).
Примечание: Часто это возможно, во время последней стадии этой процедуры, использовать долото, чтобы взломать оставшуюся заднюю череп кости с одной стороны, так же, как один открывает дверь.
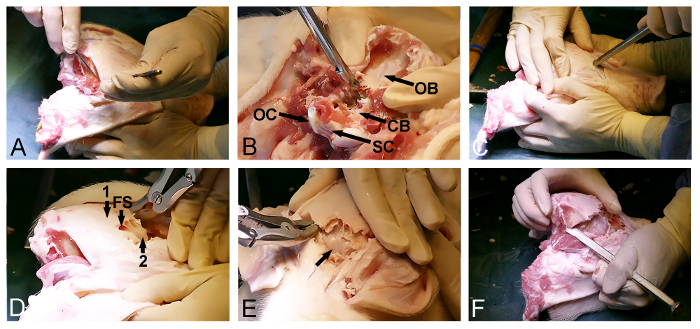
Рисунок 2: Minipig отверстие черепа. (А) Воздействие на dorsoposterioг поверхности черепа, в том числе удаление затылочной и височной мышцы. (Б) Удаление затылочной кости (СВ, Dura покрытого мозжечок; О.Б., затылочная кость; ОС, затылочный мыщелок, и СК, спинной мозг). (C) молоток и долото кости используются , чтобы проникнуть в череп кпереди и войти в лобных пазухах на уровне глаз. (D) Степень лобной пазухи (FS) используется , чтобы удалить наружную толстый череп кости (1), подвергая внутреннюю тонкая кость пластинка (2) , покрывающей головной мозг. (Е) Удаление тонкой костной пластинки, подвергая Dura-покрытые головной мозг (стрелка). (F) И, наконец, молоток и долото кости используются для боков подключения передней и задней отверстия черепа. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
4. Мозг убраль
- Используйте хирургические щипцы , чтобы поднять твердые мозговую оболочку и создать нежный надрез близко к венозному верхнему сагиттальному синусу с помощью тонкого хирургического скальпеля (рис 3А).
- Использование микро-ножницы или Dura-нож, чтобы еще больше открыть твердую мозговую оболочку, покрывающую спинной поверхности мозга.
ПРИМЕЧАНИЕ: Особое внимание должно быть принято при удалении твердой мозговой оболочки, соответствующий мозжечка мозжечка (рис 3B), как сохранение этого дюралевого листа предотвратит последующее удаление мозга. - Поместите свиньи голову вертикально (рис 3C).
- Используйте долото кости или прозектор , чтобы освободить ventroanterior головного мозга с тупым обонятельной луковицей от твердого мозгового покрытого пола черепной полости (рис 3D).
- Используйте тонкий хирургический скальпель раздел обнаженного зрительный перекрест (рис 3E). Expose и раздел гипофиз стебелек и глазодвигательных нервов.
- Отпустите вентральной стволомозговые секционирования ЛОWER черепные нервы (рис 3F) с тонким хирургическим скальпелем. Убедитесь , что дуральный мозжечковой Тенториум был полностью вырезан (фигура 3В), так как это дуральная лист будет иначе прорезать ствол мозга в процессе высвобождения.
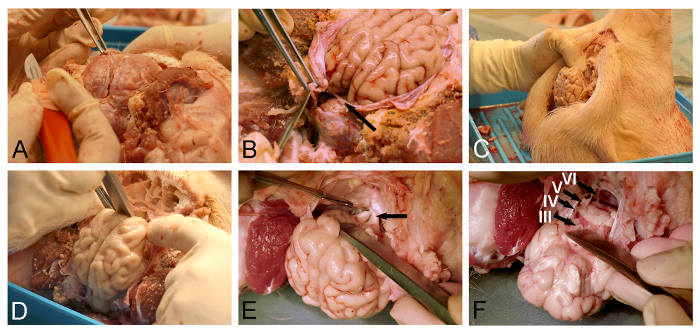
Рисунок 3: Minipig удаление мозга. (A) Dural отверстие с хирургическими щипцами и твёрдой ножом. (Б) Необходимо соблюдать осторожность , чтобы полностью надрезать дуральный лист (стрелка), расположенного между головным мозгом и мозжечком. (С) Головка свиньи расположена вертикально для лучшей визуализации черепа базовых структур , а для того , чтобы силы тяжести , чтобы помочь в предполагаемом смещении мозга. (D) прозектор или костное долото используется для облегчения обонятельной луковицы тупого участке от Dura-covereд основания черепа. (Е) Рассечение продолжается в направлении заднего вдоль основания черепа для экспозиции и секционирования зрительных нервов (стрелка), воронкообразного стебла и глазодвигательных нервов. (F) выпуск мозга завершается с секцией нижних черепных нервов , как они отходят от вентральной поверхности ствола мозга (III, глазодвигательного нерва; IV, блоковый нерв; V, тройничного нерва, и VI, отводящий нерв). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
5. гипофиз Удаление
- Определить гипофизарной стебель и его окружающий дурального лист (The diapragma sellae) в череп пола (фиг.4А).
- Надрезать дуральный листьев латеральнее гипофизарной ножку с помощью тонкого хирургического скальпеля (фиг.).
- Используйте прозектор, чтобы освободить ямуuitary и поднять его из гипофиза ямки (рис 4C).

Рисунок 4: Minipig удаление гипофиза. (A) гипофизарной ямки (*) идентифицируется в полу черепа (1, обонятельной луковицы; 2, зрительный перекрест, и PF, задней черепной ямки). (В) Дуральном покрытии (селлярная diagphragm, (стрелка)) разрежут в поперечном направлении . (С) Гипофизом (стрелка) высвобождаются с диссектором и поднял из гипофиза ямки. Шкала бар (АС) = 10 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Результаты
Чтобы предотвратить материал ткани от высыхания, рекомендуются хранить удаленный мозг и гипофиз в банке, наполненный фиксатором или изотоническим солевой раствор сразу после макроскопического анализ был выполнен. Материал, ткань может быть сохранен в фиксаторе в те...
Обсуждение
Большинство экспериментальных исследований неврологии проводятся в небольших видов животных, таких как мыши и крысы, где доступ к ЦНС облегчается с помощью тонкой skull- и дуральной толщины. Однако в более крупных экспериментальных животных , таких как свиньи 1,
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы с благодарностью искусной помощи миссис Трин W Миккелсен, г-ж Lise М. Место и сотрудники в Påskehøjgaard. Датский Совет по медицинским исследованиям, то Lundbeck фонд и Фонд Novo Nordisk при финансовой поддержке исследования.
Материалы
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
Ссылки
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs?. Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены