需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
猪中枢神经系统的组织学分析的曝光:一个手册斩首,颅骨打开,并去除脑
摘要
本文和视频教学的目的是描述如何揭露和删除死后猪脑和垂体处于完整状态,适合后续宏观和组织学分析。
摘要
猪有大型动物平移神经科学的研究越来越受欢迎作为一个经济上和道德上可行的替代品,以非人类的灵长类动物。猪的大脑神经尺寸允许使用常规临床脑成像器和直接使用和神经外科手术和设备测试从人的诊所。进一步宏观和组织学分析,但是,需要的猪中枢神经系统(CNS)和脑随后去除死后曝光。这不是一件容易的事,因为猪的中枢神经系统是由厚,骨头骨和脊柱封装。本文和视频教学的目的是描述如何揭露和删除死后猪脑和完整状态的脑垂体,适合后续的宏观和组织学分析。
引言
猪转化神经科学的研究在过去二十年中已经变得越来越流行。猪大脑的大尺寸使得能够使用常规临床脑成像器和直接使用和来自人诊所1,2,3,4,5,6,7,8神经外科手术和设备测试。在过去的20年里,猪,迷你猪特别是( 例如,哥廷根小型猪),已被用于检查神经调节的治疗方式,如造血干细胞移植;病毒载体转染;和深部脑刺激针对帕金森病,肥胖症,抑郁症,和阿尔茨海默病2,6,= "外部参照"> 9,10,11,12,13,14,15,16,17。这一直跟着的立体性和手术方法的发展,操纵小型猪CNS 3,18,19,20,21。的提起CNS变化在使用脑成像(PET 10,13,22,24和MR 23),膀胱测压11,12,25活体动物被评估,步态分析17,神经评价9,17,和基于组织学和体视分析14,15,17,26,27,31尸检。然而,事后分析需要曝光和去除猪脑,这不是一件容易的事,作为一个厚,骨颅骨和硬脑膜纤维覆盖包围猪脑子。
本文和视频教学的目的是描述如何在死后猪脑和垂体可在15-20分钟使用非机动手术工具进行曝光和去除的完整状态。教学视频和摄影插图显示雄性迷你猪(年龄:20-25公斤:6个月,体重),用于在小型猪脑垂体解剖研究。
研究方案
动物麻醉和euthanesia是按照(NIH出版号86-23,1985年修订版)和丹麦议会动物研究伦理认可的"实验动物管理的原则"进行。
1.仪器
- 收集的视频介绍和材料表中所列的仪器。
2.斩首
注:麻醉诱导通过5mL的咪达唑仑(5毫克/毫升)和5毫升氯胺酮(25毫克/毫升)的肌内注射。 5-10分钟后,当动物被深深地镇静剂,耳静脉插管,戊巴比妥钠致死过量(100毫克/千克体重)(200毫克/毫升)中的溶液经静脉内给予。为了确保将动物安乐死完全,叉指疼痛反射测试如图Ettrup 等。 (2011)20。如中所述确保完成安乐死伦理语句上述和后跟一个穿心灌注用5L等渗盐水,由Ettrup 等人所证明。 (2011)20。所有证明过程进行尸检,排除必要的长期麻醉和术后生存福利预防措施的需要。
- 通过高圆形颈部切口斩首猪,使用外科手术刀,只是下颌角( 图1A)的下方。
- 仍与外科手术刀,向前继续切口通过颈部,包括喉和食管的软组织,直到达到骨脊柱,大致在颅颈交界的水平。
- 从颅颈交界的前侧的外科手术刀推进切割,寰椎前弧的上方,并且通过前寰枕膜,由此暴露椎管和脊髓(图1B)。同时让助手从猪头拉猪身上移开,缓解颅底和第一颈椎之间的访问。
- 继续通过硬膜囊和脊髓( 图1B)的手术切口。应特别小心,以确保脊髓完全横截面实现。
注意:如果不执行上述步骤可导致在断头过程的以下步骤期间脊髓和大脑不需要的牵引力。 - 有力地延伸在所述区间电平( 图1C)的cranocervical结。与此同时,使用外科手术刀部的剩余寰枕韧带以释放枕骨髁和图谱的上铰接过程之间的关节运动。从身体分离的猪脑袋。

图1:小型猪断头。 (A)颈部切口(箭头,下颌角)。 (; OC,枕髁C1,寰椎前弧)通过寰枕韧带和在颅颈交界硬脑膜包围的脊髓(SC)(B)切口。 (C)的寰枕关节的后部分是通过在部分水平延伸有力(箭头)释放。 请点击此处查看该图的放大版本。
3.骷髅开幕
- 猪头上表中的位置。
- 使背侧纵向切口穿过皮肤和从炉鼻的后面,在头的顶点底层软组织的外科手术刀,上下贯通的后部分枕骨区域。
- 通过去除位于横向于初始切口用外科手术刀软组织暴露颅骨的背壳和后部分。
- 从头骨( 图2A)与外科手术刀双边释放颞肌。确保后枕骨清洁软组织。
- 使用枕骨大孔的后部入口为与Kerrison骨冲头和骨骨钳取下枕骨和暴露硬脑膜覆盖的小脑( 图2B)。
- 回到头骨的暴露前侧,然后在额骨一个切入点,就在眼前。在这点上,使用骨凿用锤穿透颅骨并进入额窦( 图2C)。
- 使用额窦的程度进一步与骨咬骨钳或骨冲头dorsoposterior除去外颅骨椎板和露出内,薄骨颅骨薄层覆盖大脑( 图2D)。
- 轻轻向前打开内骨颅骨薄层用锤子和凿子骨以暴露硬脑膜覆盖大脑( 图2E)。
- 继续骨去除以释放头骨的最终dorsoposterior部分,位于硬脑膜覆盖大脑和小脑( 图2F)的已曝光部分之间横向使用骨凿和骨咬骨钳通过时间和顶骨。
注意:它往往是可能的,在此过程中的最后一步,用凿子从一个侧面破开后剩余的颅骨,就像一个打开一扇门。
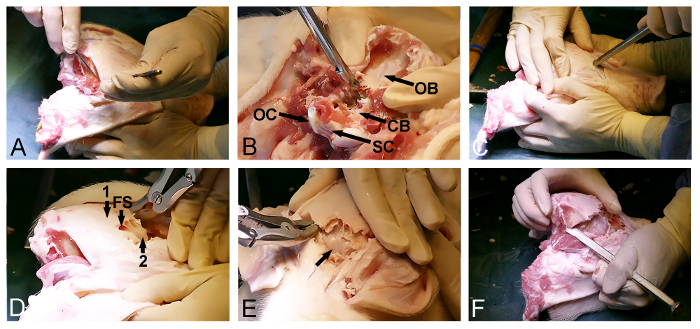
图2:微型猪颅骨开口。 (A)的dorsoposterio的曝光ř颅骨表面,包括去除枕骨和颞肌的。枕骨(B)去除(CB,硬脑膜覆盖小脑; OB,枕骨; OC,枕骨髁;和SC,脊髓)。 (C)一种锤子和凿子骨被用于向前穿透颅骨和在眼睛的水平进入额窦。 (D)额窦(FS)的程度被用于去除外部厚颅骨(1),露出的内薄骨薄层(2),其覆盖大脑。薄骨薄片(E)去除,露出硬脑膜覆盖大脑(箭头)。 (f)最后,锤子和凿子骨被用来横向连接的前部和后部颅骨开口。 请点击此处查看该图的放大版本。
4.脑祛瘀人
- 使用手术用钳子抬起硬脑膜,并使用精细的外科手术刀( 图3A)温柔的切口接近静脉上矢状窦。
- 使用微型剪刀或硬膜刀进一步打开覆盖在大脑的背表面硬膜。
注意:必须特别注意去除对应于小脑幕(图3B)硬膜时,应考虑,因为这硬脑膜叶的保存将防止随后的脑的去除。 - 猪头垂直( 图3C)的位置。
- 使用骨凿或解剖器通过从所述颅腔( 图3D)的硬脑膜覆盖的地板嗅球的钝器解剖以释放ventroanterior大脑。
- 使用精细外科手术刀部露出的视交叉( 图3E)。揭露和部分垂体柄和动眼神经。
- 通过切片的LO释放脑干腹侧WER颅神经( 图3F)用细外科手术刀。确保硬膜小脑幕完全切开( 图3B),因为这硬脑膜叶将通过脑干中的释放过程以其他方式切割。
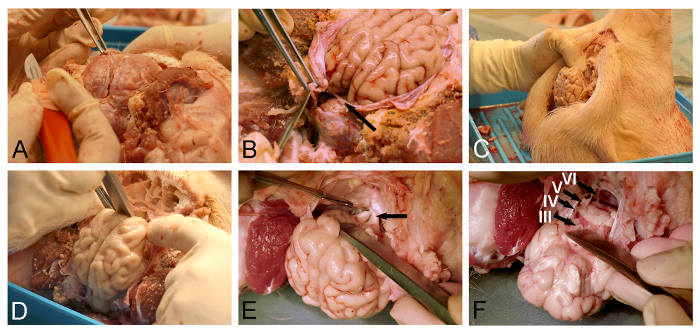
图3:小型猪的大脑取出。 (A)硬脑膜开口与手术镊子和硬脑膜刀。 (B)必须小心以完全切开硬脑膜叶(箭头),位于大脑和小脑之间。 (C)的猪头颅骨基部结构的更好的可视化,并且为了对重力协助在大脑的预期位移垂直定位。 (D)甲解剖器或骨凿被用于通过从硬脑膜-covere钝部,以减轻嗅球ð颅底。 (E)所述的夹层继续沿着颅底的视交叉(箭头),漏斗柄,和动眼神经的曝光和切片后方向。 (F)的大脑释放与下颅神经的部分完成的,因为它们从脑干的腹面出发(III,动眼神经; IV,滑车神经; V,三叉神经;和VI中,外展神经)。 请点击此处查看该图的放大版本。
5.垂体去除
- 识别垂体柄并在颅骨地板( 图4A)及其周边硬脑膜叶(在鞍diapragma)。
- 切开使用精细外科手术刀( 图4B)硬脊膜叶横向于垂体柄。
- 使用剥离释放坑uitary和将其取出垂体窝( 图4C)的。

图4:微型猪垂体切除。 (A)的垂体窝(*)在颅骨地板被识别(1,嗅球; 2,视交叉;和PF,后颅窝)。 (B)硬脑膜覆盖(鞍diagphragm,(箭头))被横向切开。 (C)的垂体(箭头)被释放与解剖器和提升出垂体窝。比例尺(AC)= 10毫米。 请点击此处查看该图的放大版本。
结果
为了防止干燥的组织材料,建议去除的脑和垂体存储在填充有固定剂或已经执行宏观分析之后立即等渗盐水罐。组织材料可以被存储在固定剂多年,而存储在等渗盐水,即使在冰箱中,会导致组织随时间衰减。
除去的垂体也可以通过浸入干冰冷却液体的2-甲基丁烷中直接冷冻,而完整猪脑为直接冷冻28过大。?...
讨论
大多数实验研究神经科学在小动物物种,如小鼠和大鼠,在那里访问CNS由薄skull-和硬脑膜厚度容易进行。然而,在较大的实验动物如猪1,4,8,羊32,以及非人类灵长类动物中,相当大的厚度这些结构需要使用坚固的仪器(材料表)和适当的入口点头骨骨去除( 图的2)。需要限制硬?...
披露声明
作者什么都没有透露。
致谢
作者感激地承认特林·W·米尔森太太的熟练援助,莉莎M.夫人配件,并在Påskehøjgaard员工。丹麦医学研究委员会,Lundbeck公司基金会和诺和诺德基金会提供资助的研究。
材料
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
参考文献
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs?. Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。