Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La exposición del cerdo del SNC para el análisis histológico: Un Manual para decapitación, Apertura cráneo, cerebro y Remoción
En este artículo
Resumen
El objetivo de este documento y vídeo de instrucción es describir cómo exponer y retirar el cerebro de cerdo y la glándula pituitaria postmortem en un estado intacto, adecuado para el análisis macroscópico e histológico posterior.
Resumen
Los cerdos se han vuelto cada vez más popular en la investigación traslacional animal grande neurociencia como un sustituto económicamente y éticamente factible primates no humanos. El tamaño del cerebro grande del cerdo permite el uso de generadores de imágenes cerebrales clínica convencionales y el uso directo y las pruebas de los procedimientos y equipos de neurocirugía de la clínica humana. Además análisis macroscópico e histológico, sin embargo, requiere la exposición postmortem del sistema de cerdo nervioso central (CNS) y la extracción del cerebro posterior. Esta no es una tarea fácil, ya que el cerdo CNS está encapsulada por una, estructura ósea del cráneo de espesor y la columna vertebral. El objetivo de este documento y vídeo de instrucción es describir cómo exponer y retirar el cerebro de cerdo postmortem y la glándula pituitaria en un estado intacto, adecuado para el análisis macroscópico e histológico posterior.
Introducción
Los estudios de neurociencia traslacional en cerdos se han vuelto cada vez más populares en las últimas dos décadas. El gran tamaño del cerebro de cerdo permite el uso de generadores de imágenes cerebrales clínica convencionales y el uso directo y las pruebas de los procedimientos neuroquirúrgicos y el equipo de la clínica humana 1, 2, 3, 4, 5, 6, 7, 8. En los últimos 20 años, cerdos, especialmente cerdos enanos (por ejemplo, Göttingen minipig), se han utilizado para examinar las modalidades de tratamiento neuromoduladores, como el trasplante de células madre; transfección vector viral; y la estimulación cerebral profunda dirigida hacia la enfermedad de Parkinson, la obesidad, la depresión y la enfermedad de Alzheimer 2, 6,= "xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Esto ha sido seguido por el desarrollo de enfoques estereotáxica y quirúrgicos para manipular el cerdo enano CNS 3, 18, 19, 20, 21. Los cambios del SNC instituidos se han evaluado en animales vivos usando imágenes del cerebro (PET 10, 13, 22, 24 y MR 23), cistometría 11, 12, 25, análisis de la marcha17, la evaluación neurológica 9, 17, y el examen postmortem base de la histología y análisis estereológico 14, 15, 17, 26, 27, 31. Sin embargo, el análisis post-mortem requiere la exposición y la eliminación del cerebro de cerdo, que no es una tarea fácil, como, cráneo óseo de espesor y un dural fibrosa que cubre rodean el cerebro de cerdo.
El objetivo de este documento y vídeo de instrucción es describir cómo el cerebro de cerdo postmortem y la pituitaria pueden estar expuestos y eliminados en un estado intacto en 15-20 min utilizando herramientas quirúrgicas no motorizados. El vídeo de instrucciones y las ilustraciones fotográficas muestran cerdos enanos varones (edad: 6 meses, el peso corporal: 20-25 kg) utilizados para un estudio anatómico de la glándula pituitaria cerdo enano.
Protocolo
anestesia Animal y euthanesia se realizó de acuerdo con "Principios de laboratorio cuidado de los animales" (NIH publicación No. 86-23, revisada 1985) y aprobada por el Consejo Danés de Ética de la Investigación Animal.
1. Instrumentos
- Recoge los instrumentos presentados en el video y que figuran en la Tabla de Materiales.
2. Decapitación
NOTA: La anestesia se indujo mediante una inyección intramuscular de 5 ml de midazolam (5 mg / ml) y 5 ml de ketamina (25 mg / ml). 5-10 min más tarde, cuando el animal estaba profundamente sedado, una vena de la oreja y se canuló una sobredosis letal (100 mg / kg de peso corporal) de pentobarbital sódico se administra por vía intravenosa (200 mg / ml). Para asegurar que el animal fue sacrificado por completo, el reflejo de dolor interdigital se ensayó como se muestra por Ettrup et al. (2011) 20. eutanasia completa se asegura como se describe enla declaración ética arriba y seguido por una perfusión transcardial con 5 L de solución salina isotónica, como se demuestra por Ettrup et al. (2011) 20. Todos los procedimientos se realizan demostrado postmortem, evitando la necesidad de las precauciones necesarias para la anestesia de bienestar a largo plazo y la supervivencia después del procedimiento.
- Decapitar al cerdo por un alto incisión cervical circular, usando un bisturí quirúrgico, justo debajo del ángulo mandibular (Figura 1A).
- Todavía con el bisturí quirúrgico, continuar la incisión anterior a través del tejido blando del cuello, incluyendo la laringe y el esófago, hasta que se alcanza la columna vertebral ósea, aproximadamente en el nivel de la unión craneocervical.
- Avanzar en el corte con un bisturí quirúrgico desde el lado anterior de la unión craneocervical, por encima del arco anterior del atlas, y a través de la membrana atlantooccipital anterior, exponiendo así el canal espinal y la médula espinal (Figura 1B). Al mismo tiempo pedir a un asistente para sacar el cuerpo del cerdo lejos de la cabeza de cerdo para facilitar el acceso entre la base del cráneo y la primera vértebra cervical.
- Continuar la incisión quirúrgica a través del saco dural y la médula espinal (Figura 1B). Tenga especial cuidado para asegurarse de que se logra una sección transversal completa de la médula espinal.
NOTA: Si no se realiza el paso anterior puede dar lugar a la tracción no deseado en la médula espinal y el cerebro durante los siguientes pasos del proceso de decapitación. - Con fuerza extender la unión cranocervical a nivel de sección (Figura 1C). Al mismo tiempo, utilizar el bisturí quirúrgico a la sección de los ligamentos atlantooccipitales restantes para liberar la articulación entre los cóndilos del occipital y el proceso articular superior de atlas. Separar la cabeza de cerdo del cuerpo.

Figura 1: Minipig decapitación. Incisión (A) del cuello (flecha, el ángulo mandibular). (B) incisión a través de los ligamentos atlantooccipitales y la médula espinal dura-rodeado (SC) en la unión craneocervical (C1, arco anterior del atlas; OC, cóndilo occipital). (C) La parte posterior de la articulación atlantooccipital es liberado por una extensión contundente (flechas) en el nivel de sección. Haga clic aquí para ver una versión más grande de esta figura.
3. Apertura cráneo
- Coloque la cabeza de cerdo sobre una mesa.
- Haga una incisión longitudinal dorsal con un bisturí quirúrgico a través de la piel y el tejido blando subyacente de la parte posterior de la boca, sobre el vértice de la cabeza, y hacia abajo a través de la parte posterior dela región occipital.
- Exponer la parte dorsal y posterior del cráneo mediante la eliminación de tejido blando situado en el lateral de la incisión inicial con un bisturí quirúrgico.
- Soltar el músculo temporal bilateralmente en el cráneo (Figura 2A) con un escalpelo quirúrgico. Asegúrese de que el hueso occipital posterior se limpian de tejido blando.
- Utilice la entrada posterior del foramen magnum para eliminar el hueso occipital con una Kerrison punzón y hueso rongeurs óseas y exponer el cerebelo dura-cubierta (Figura 2B).
- Volver a la cara anterior expuesta del cráneo y seleccione un punto de entrada en el hueso frontal, justo en frente de los ojos. En este punto, utilizar un cincel de hueso con un martillo para penetrar en el cráneo y entrar en el seno frontal (Figura 2C).
- Usar la medida del seno frontal para promover la eliminación dorsoposterior de la lámina cráneo exterior con un rongeur hueso o médula punzón y exponer el interior, delgadalámina cráneo óseo que cubre el cerebro (Figura 2D).
- Abrir suavemente el interior lámina cráneo óseo en sentido anterior con un martillo y un cincel de hueso para exponer el cerebro dura-cubierta (Figura 2E).
- Continuar la eliminación de hueso lateralmente usando un cincel de hueso y un rongeur hueso a través del hueso temporal y parietal a fin de liberar la parte dorsoposterior final del cráneo, situado entre las partes ya expuestas de la cerebro dura-cubierta y el cerebelo (Figura 2F).
NOTA: A menudo es posible, durante el paso final de este procedimiento, para usar el cincel para romper el hueso del cráneo posterior restante de un lado, al igual que uno abre una puerta.
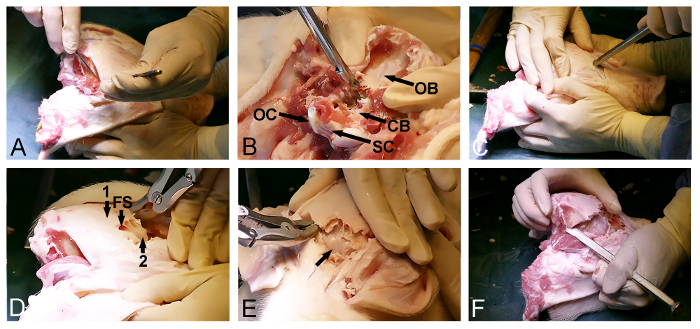
Figura 2: Minipig abertura cráneo. (A) La exposición de la dorsoposteriosuperficie del cráneo r, incluida la eliminación de la occipital y los músculos temporales. (B) La retirada del hueso occipital (CB, cerebelo dura-cubierto; OB, hueso occipital; OC, cóndilo occipital; y SC, médula espinal). (C) un martillo y un cincel de hueso se utilizan para penetrar en el cráneo anterior y para entrar en el seno frontal en el nivel de los ojos. (D) La medida del seno frontal (FS) se utiliza para eliminar el hueso del cráneo de espesor exterior (1), la exposición de una lámina fina de hueso interior (2) que cubre el cerebro. (E) La eliminación de la lámina delgada de hueso, dejando al descubierto el cerebro dura-cubierta (flecha). (F) Por último, un martillo y un cincel de hueso se utilizan para conectar lateralmente el de las aberturas del cráneo anterior y posterior. Haga clic aquí para ver una versión más grande de esta figura.
4. Cerebro RemovAlabama
- El uso de fórceps quirúrgicos para levantar la duramadre y crear una incisión cerca suave para el seno sagital superior venosa usando un bisturí quirúrgico fino (Figura 3A).
- Utilice micro-tijera o un cuchillo de duramadre a abrir más la duramadre que recubre la superficie dorsal del cerebro.
NOTA: El cuidado especial debe ser tomado cuando la eliminación de la duramadre que corresponde a la tentorium cerebelar (Figura 3B), como la preservación de esta hoja dural evitará la extracción del cerebro posterior. - Coloque la cabeza de cerdo verticalmente (Figura 3C).
- Utilice el cincel de hueso o un disector para liberar el cerebro ventroanterior mediante disección roma del bulbo olfatorio del suelo dura-cubierta de la cavidad craneal (Figura 3D).
- Utilice un bisturí quirúrgico bien a la sección del quiasma óptico expuesto (Figura 3E). Exponer y la sección del tallo hipofisario y los nervios oculomotores.
- Soltar el tronco cerebral ventral seccionando la LOnervios wer craneales (Figura 3F) con un bisturí quirúrgico fino. Asegúrese de que la tentorium cerebelosa dural se realizó una incisión por completo (Figura 3B), ya que esta hoja dural será lo contrario cortar a través del tronco cerebral durante el proceso de liberación.
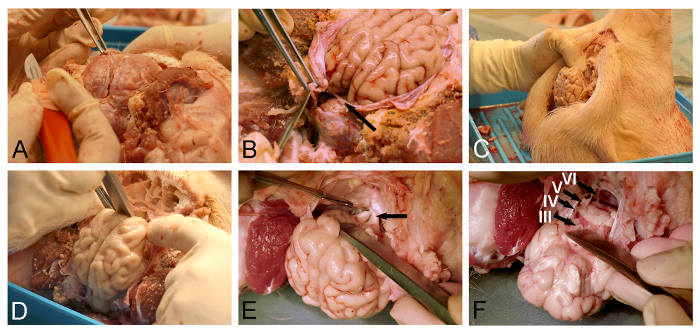
Figura 3: la extracción del cerebro Minipig. De apertura (A) Dural con fórceps quirúrgicos y un cuchillo duramadre. (B) Se debe tener cuidado para incidir completamente la hoja dural (flecha), situada entre el cerebro y el cerebelo. (C) La cabeza de cerdo se coloca verticalmente para una mejor visualización de las estructuras de la base del cráneo y para que la gravedad ayude en el desplazamiento previsto del cerebro. (D) un disector o un cincel de hueso se usa para aliviar el bulbo olfativo por la sección romo de la dura-covered base del cráneo. (E) La disección se continúa en una dirección posterior a lo largo de la base del cráneo para la exposición y el seccionamiento del quiasma óptico (flecha), tallo infundibular, y los nervios oculomotores. (F) La liberación cerebro se completa con la sección de los nervios craneales inferiores a medida que salen de la superficie ventral del tronco cerebral (III, el nervio oculomotor; IV, nervio troclear; V, nervio trigémino; y VI, ocular externo del nervio). Haga clic aquí para ver una versión más grande de esta figura.
5. Eliminación de la hipófisis
- Identificar el tallo hipofisario y su hoja dural circundante (la sellae diapragma) en el suelo cráneo (Figura 4A).
- Incisión en el lateral de la hoja dural al tallo hipofisario usando un bisturí quirúrgico fino (Figura 4B).
- Utilice un disector para liberar el pozouitary y la saca de la fosa pituitaria (Figura 4C).

Figura 4: eliminación pituitaria Minipig. (A) La fosa pituitaria (*) se identifica en el suelo cráneo (1, bulbo olfatorio; 2, quiasma óptico, y PF, posterior fosa craneal). (B) La cubierta dural (diagphragm selar, (flecha)) se realiza una incisión lateralmente. (C) La pituitaria (flecha) se libera con un disector y sacó de la fosa pituitaria. Barra de escala (AC) = 10 mm. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Para evitar que el material de tejido de la desecación, se recomienda para almacenar el cerebro eliminado y la hipófisis en una jarra llena de fijador o solución salina isotónica inmediatamente después que se ha realizado el análisis macroscópico. El material tejido puede ser almacenado en el fijador por año, mientras que el almacenamiento en solución salina isotónica, incluso en un refrigerador, dará lugar a la descomposición del tejido con el tiempo.
Discusión
La mayoría de los estudios de neurociencia experimentales se llevan a cabo en las especies de animales pequeños, tales como ratones y ratas, donde el acceso al SNC se ve facilitada por una fina calavera y dural-espesor. Sin embargo, en los animales de experimentación más grandes como cerdos 1, 4, 8, ovejas 32, y primates no humanos, el espesor considerable de estas estructuras requiere el uso de inst...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen con gratitud la ayuda experta de la señora Trine W. Mikkelsen, la señora Lise M. de montaje, y el personal de Påskehøjgaard. El Consejo Danés de Investigación Médica, la Fundación Lundbeck, y la Fundación Novo Nordisk con el apoyo financiero del estudio.
Materiales
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
Referencias
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs?. Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados