A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نظام الزراعة المائية المشتركة للتحليل المتزامن والمنهجي للتفاعلات الجزيئية النباتية / الميكروبية والتشوير
In This Article
Summary
ويدعم النظام كوكولتفاتيون المائية المائية النباتات سليمة مع شاشات شبكة معدنية وتزرع لهم البكتيريا. ويمكن بعد ذلك تحصين الأنسجة النباتية والبكتيريا والجزيئات التي تفرز بشكل منفصل لتحليل المصب، مما يسمح في وقت واحد للاستجابات الجزيئية من كل من المضيفين النبات والتفاعل الميكروبات أو الميكروبيوم ليتم التحقيق فيها.
Abstract
إن التصميم التجريبي الذي يحاكي التفاعلات الطبيعية بين النباتات والميكروب مهم جدا لتحديد عمليات التشوير المعقدة للنباتات الميكروبية. أرابيدوبسيس ثاليانا - أغروباكتريوم توميفاسيانز يوفر نظام نموذج ممتاز لدراسة المرضية البكتيرية وتفاعلات النبات. الدراسات السابقة من النباتات -التفاعلات العطرية تعتمد إلى حد كبير على الخلايا النباتية تعليق الثقافات، اصابة اصطناعية للنباتات، أو تحريض اصطناعي من عوامل الفوعة الميكروبية أو الدفاعات النباتية من قبل المواد الكيميائية الاصطناعية. ومع ذلك، فإن هذه الأساليب تختلف عن الإشارات الطبيعية في بلانتا ، حيث النباتات والميكروبات تعترف وتستجيب في الأخلاق المكانية والزمانية. يعرض هذا العمل نظام استنبات مشترك المائية حيث يتم دعم نباتات سليمة من خلال شاشات شبكة معدنية وcocultivated مع الأجرعية. في هذا النظام كوكولتيفاتيون، لا الاصطناعية فيتوهورمون أو الكيميائية التي تحفز ميكرأوفيال الفوعة أو دفاع النبات ويستكمل. نظام كوكولتفاتيون المائية يشبه عن كثب التفاعلات النباتية والمكروب الطبيعية والتوازن إشارة في بلانتا . ويمكن فصل جذور النباتات عن الوسيط المحتوي على أغروباكتريوم ، ويمكن التحقق من إشارات واستجابات كل من المضيفات النباتية والميكروبات المتفاعلة في وقت واحد ومنهجي. في أي وقت معين / فاصل زمني، يمكن حصاد الأنسجة النباتية أو البكتيريا بشكل منفصل لمختلف تحليلات "أوميكس"، مما يدل على قوة وفعالية هذا النظام. يمكن تكييف نظام الزراعة المائية بسهولة لدراسة: 1) الإشارات المتبادلة لنظم متنوعة من نباتات الميكروب، 2) تشوير بين مضيف النباتات والأنواع الميكروبية المتعددة ( أي اتحادات الميكروبات أو الميكروبيوم)، 3) كيفية تورط العناصر الغذائية والمواد الكيميائية في تشوير النباتات الميكروبية، و 4) كيفية تفاعل الميكروبات مع المضيفين النبات والمساهمة في تحمل النبات للحيوية or أبيوتيك ستريسس.
Introduction
وتؤدي الميكروبات المرتبطة بالمصانع أدوارا هامة في ركوب الدراجات الكيميائية الجيولوجية الحيوية، والمعالجة البيولوجية، والتخفيف من تغير المناخ، ونمو النباتات والصحة، وتسامح النبات للإجهادات الأحيائية وغير الحيوية. الكائنات الحية الدقيقة تتفاعل مع النباتات مباشرة من خلال الخلايا النباتية الجدار الاتصال وبشكل غير مباشر عن طريق إفراز الكيميائية والإشارات 1 ، 2 ، 3 . وبوصفها كائنات حية، وضعت النباتات آليات مباشرة وغير مباشرة لمقاومة العدوى بواسطة مسببات الأمراض. وتشمل الدفاعات المباشرة الدفاعات الهيكلية والتعبير عن بروتينات الدفاع، في حين أن الدفاعات غير المباشرة تشمل إنتاج المستقلب النبات الثانوي وجذب الكائنات الحية معادية للغزو مسببات الأمراض 4 ، 5 . الجذور المستمدة من الافرازات الجذر، إفرازات، ميوسيلاجيس، موسيجيل، و ليسيتس يغير الخصائص الفيزيائية والكيميائية لل ريزوسفير لجذب أو صدالميكروبات نحو المضيفين 6 . التركيب الكيميائي لإفراز الجذر هو نوع معين، وبالتالي بمثابة مرشح انتقائي يسمح بعض الكائنات الحية الدقيقة قادرة على الاعتراف هذه المركبات لتزدهر في الجريزوسفير 6 . وهكذا، يمكن تحفيز الأنواع الميكروبية المتوافقة لتنشيط وتعزيز جمعياتها، إما لصالح أو ضرر للمضيف النبات 1 .
ويعد فهم تفاعلات الميكروب النباتي في الغلاف الجوي أمرا أساسيا لتعزيز إنتاجية النبات وأداء النظام الإيكولوجي، حيث أن غالبية التعرض للميكروبات والكيماويات يحدث في البنية الجذرية والسطح البيني للتربة والهواء 2 و 6 و 7 و 8 . ومع ذلك، فإن فحص التفاعلات بين النباتات الميكروبية تحت الأرض والاستجابات المتبادلة كان تحديا بسبب ما يثير الفضول والطبيعة المعقدة والديناميكية وعدم وجود نماذج تجريبية مناسبة مع هيكل الجذر الطبيعي ومورفولوجيا النبات تحت ظروف نمو يمكن السيطرة عليها بإحكام. وباعتبارها واحدة من أكثر النباتات النباتية التي تمت دراستها بشكل كبير، فإن الجراثيم تصيب مجموعة واسعة من النباتات ذات الأهمية الزراعية والبستانية، بما في ذلك الكرز والتفاح والكمثرى والعنب والورود 9 . الجراثيم هو كائن نموذج مهم لفهم التفاعلات الممرضات النباتية وهو أداة قوية في تحويل النبات والهندسة النباتية 10 ، 11 ، 12 ، 13 ، 14 .
وقد تم دراسة التفاعلات الجراثيم دراسة جذور لعدة عقود، والفهم الحالي للأمراض الجراثيم المرضية واسعة النطاق 9 ،f "> 11 ، 15 ، 16. ويعزى المرضية الجرثومية إلى حد كبير إلى قدراتها المتطورة لإدراك الإشارات المستمدة من النباتات، مما أدى إلى التشكيل الدقيق لبرنامج الفوعة والاتصالات من خلية إلى خلية، ما يسمى استشعار النصاب 17 . وينظم برنامج الجرثومة الفوعة من قبل العديد من الإشارات المتاحة في ريزوسفير وينطوي على مجموعتين من أنظمة 2-مكون، ونظام تشفغ / I ونظام فيرا / G.الظروف الحمضية في ريزوسفير تفعيل النسخ من تشفغ / I ، فيرا / G ، والعديد من الجينات الأخرى المشاركة في الأجرعية المرضية، بما في ذلك virE0، virE1، virH1، virH2، والجينات من نوع VI نظام إفراز (T6SS) 18. المركبات الفينولية، بما في ذلك acetosyringone (4'-هيدروكسي-3، 5 مصنع مشتقة '-dimethoxyacetophenone)، وتفعيل Vإيرا / G 2-نظام مكون من خلال آليات الإشارات الفسفرة 19 . فيرا / G ثم ينشط ريجيونون الفيروس بأكمله، مما أدى إلى نقل والتكامل من ~ 20 كيلو بايت جزء الحمض النووي البكتيرية تسمى الحمض النووي نقل (T- دنا) من البلازميد (تي) التي تحفز الورم في نواة النبات 16 . T-دنا يحمل الجينات المسؤولة عن تخليق هرمونات النبات إندول -3 حمض الخليك (إيا) ( إام و إاه ) والسيتوكينين ( إيبت )، وعبر مرة واحدة في الخلايا النباتية، ويتم إنتاج كميات كبيرة من هذه الفيتوهورمونات. وهذا يؤدي إلى انتشار الأنسجة غير طبيعي وتطور الورم النباتي، والمعروفة باسم مرض غالون تاج، وهو مشكلة مزمنة وعاد للنباتات 9 ، 11 ، 20 . إيا أيضا يعمل بشكل جماعي مع حمض الصفصاف وحمض الأمينية غاما الأمينية لقمع الفوعة الجرثومية أو للحد من أغروباكتيريو (كور) الاستشعار عن بعد (قس) 17 ، 21 ، 22 . لمكافحة هذا القمع، T- الحمض النووي يحمل أيضا الجينات لالبصرية الحيوي، الذي ينشط أغروباكتريوم النصاب الاستشعار عن تعزيز إمبروكتريوم المرضية وأيضا بمثابة مصدر المغذيات للمسبب 22 ، 23 .
وعلى الرغم من فهم عميق العام للالأجرعية التفاعلات -plant والناتجة نقل T-DNA إلى المضيف النبات، والأحداث الإشارات المعقدة في المرحلة الأولى من التفاعل وفهم أقل أيضا. ويرجع ذلك جزئيا إلى القيود المفروضة على النهج التقليدية للتحقيق الجراثيم- زرع إشارة. وتستخدم الخلايا النباتية تعليق الثقافات والجروح اصطناعية محددة الموقع عادة لدراسة الجزيئية التفاعلات النباتية ميكروب 24 ،إف "> 26 ، 27. ومع ذلك، تعليق خلية تفتقر النموذجية مورفولوجيا النبات، على وجه الخصوص، وخلايا تعليق النبات ليس لديهم هياكل الجذور ونضح الافرازات، والتي هي مهمة جدا لتفعيل الكيميائي الميكروبي والفوعة 28 ، 29. الحفاظ على مورفولوجيا النبات وقد تم معالجة هيكل الجذر عن طريق اصابة النباتات اصطناعيا، مما يسهل العدوى موقع معين، مما أدى إلى الكشف عن الجينات ذات الصلة دفاع النبات التي يسببها في الأنسجة النباتية المصابة مباشرة 30 ، 31. ومع ذلك، الإصابات الاصطناعية يختلف اختلافا كبيرا عن العدوى الممرض في الطبيعة ، لا سيما أن الجرح يؤدي إلى تراكم حمض جاسمونيك (جا)، والذي يتداخل بشكل منهجي مع إشارات النباتات الطبيعية والدفاع 26. وبالإضافة إلى ذلك، وتستخدم المواد الكيميائية الاصطناعية عادة لتحفيز اصطناعية ردود المضيف النباتأو فيروسة الممرض. على الرغم من أن تكملة هذه المركبات الكيميائية تعكس تركيزات في بلانتا ممكن، فإن مثل هذه المكملات لا تمثل نشر الافرازات الجذر تدريجيا في ريزوسفير المحيطة، الذي يولد التدرج الكيميائي الاستشعار عن طريق الميكروبات 28 ، 32 . ونظرا للقيود المفروضة على النهج التقليدية لدراسة تفاعلات الميكروبات النباتية، قد تكون دقة وعمق البيانات التي تم الحصول عليها معوقة ومقيدة، والمعرفة الناتجة عن النهج التقليدية قد لا تترجم مباشرة في النباتات . العديد من جوانب النباتات الزراعية إشارة ليست مفهومة تماما، لا سيما في المرحلة المبكرة من التفاعلات، عندما لم تظهر أعراض المرض بعد.
ولتعديل القيود على النهج التقليدية، يعرض هذا العمل الزراعة المائية غير المكلفة والمتحكم فيها بشكل صارم والمرننظام أوكولتيفاتيون الذي يسمح للباحثين للحصول على رؤى أعمق في مسارات التشوير والاستجابة المعقدة في المرحلة الأولى من التفاعلات الجزيئية النباتية والميكروب. وقد استخدمت الزراعة المائية على نطاق واسع لدراسة المغذيات النباتية، الافرازات الجذر، وظروف النمو، وآثار السمية المعدنية على النباتات 33 ، 34 . وهناك العديد من المزايا للنماذج المائية، بما في ذلك المتطلبات المكانية الصغيرة، وإمكانية الوصول إلى الأنسجة النباتية المختلفة، والرقابة المشددة على العناصر الغذائية / البيئية، ومكافحة الآفات / الأمراض. كما أن أنظمة الزراعة المائية أقل تقييدا لنمو النباتات مقارنة بتقنيات طلاء أجار / فيتواغار التي تقيد النمو عادة بعد 2-3 أسابيع. الأهم من ذلك، والحفاظ على هياكل المصنع كله يسهل إفراز الجذر الطبيعي الضروري للالعلاج الكيميائي الميكروبي والفوعة الحث 8 ، 29 . وصف النظامالسرير هنا هو أبسط وأقل كثيفة العمالة من البدائل 33 ، 34 . ويستخدم أجزاء أقل ولا يتطلب أي أدوات أخرى من مقص القياسية. ويستخدم شبكة معدنية (على عكس النايلون 33 ) كدعم قوي لنمو النبات وطريقة بسيطة من التهوية تحت ظروف معقمة من خلال الهز لدعم النمو الميكروبي. وبالإضافة إلى ذلك، يمكن للنظام استخدام شبكة معدنية من مختلف الأحجام لدعم نمو النبات، الذي يستوعب أنواع النباتات المختلفة دون تقييد عرض جذورها.
في النظام كوكولتفاتيون المائية المعروضة هنا، تزرع النباتات في نظام الزراعة المائية العقيمة حيث جذور النباتات تفرز المركبات العضوية التي تدعم نمو البكتيريا الملقحة. في هذا النظام كوكولتيفاتيون، لا تكمل أي مواد كيميائية اصطناعية، مثل هرمونات النبات، داعية إليتور، أو المواد الكيميائية التي تسبب الفوعة، مما يعكس الخلية الطبيعيةوالتوازن -signaling خلال التفاعلات مصنع الميكروب. مع هذا النظام كوكولتفاتيون المائية، كان من الممكن تحديد في وقت واحد التعبير الجيني في أرابيدوبسيس ثاليانا كول -0 أنسجة الجذر على العدوى من قبل أغروباكتريوم ، فضلا عن تفعيل الجينات الجراثيم على كوكولتيفاتيون مع أرابيدوبسيس . وقد تجلى أيضا أن هذا النظام هو مناسبة لدراسة مرفق الأجرعية إلى جذور النباتات، وكذلك التعريف secretome جذور النبات، على استنبات مشترك (العدوى) مع الأجرعية (الشكل 1).
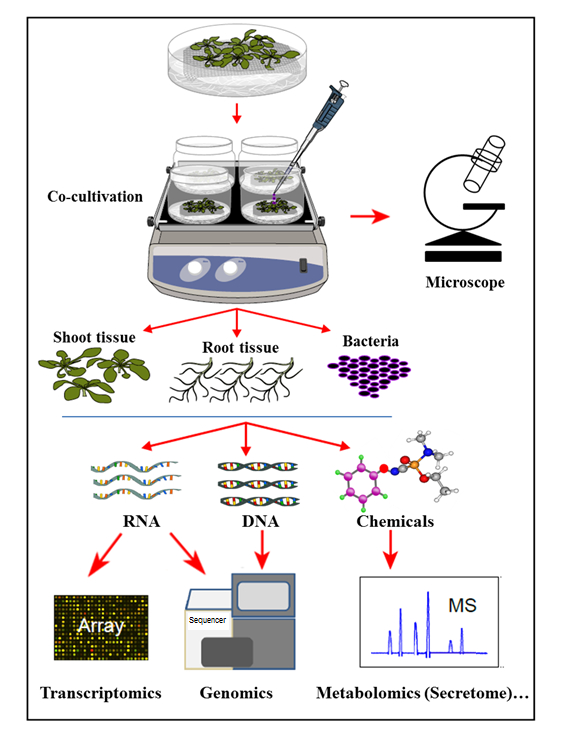
الشكل 1: نظرة عامة على نظام الزراعة المائية، مع تحليلات عينة. تزرع النباتات على رأس شبكة (يطلق النار فوق شبكة)، مع جذور مغمورة في المتوسطة المائية التي يتم بعد ذلك تلقيح مع البكتيريا وأو كوكولتشر. ثم يتم فصل الأنسجة النباتية والبكتيريا للاستخراج في وقت واحد والتحليلات. وقد عدل هذا الرقم من المرجع 35 .
Protocol
1. التخطيط التجريبي
- حدد الأهداف المحددة للتجربة.
- قراءة من خلال البروتوكول بأكمله أدناه. حدد الأقسام ذات الصلة بالأهداف المحددة وما إذا كان يلزم إجراء أي تعديلات. انظر أدناه للحصول على أمثلة.
- النظر في ما إذا كانت التجارب سوف تستخدم A. النباتات ثاليانا و A. البكتيريا المومياء ، على النحو التالي، أو مزيج آخر من النبات الميكروبي.
ملاحظة: في حين يمكن استخدام أنواع النباتات المختلفة، سمك جذور النبات قد تتطلب شبكة مختلفة الحجم (الخطوة 3.3)، ومعلمات النمو (الخطوات 3.10-3.11، و 4.4) وحجم خزان المائية وحجم المتوسطة (خطوة 4.2) قد تتطلب أيضا تعديل ( الشكل 2 ). يمكن بسهولة تلقيح الميكروبات كثقافات خالصة، أو أنواع مختلطة (كونسورتيومات)، أو من عينات بيئية (ميكروبيوم)، ولكن يمكن أن تؤثر أي تغييرات على البروتوكول، وخاصة الخطوة 4.5. - النظر فيأنواع التجارب التي سيتم استخدامها لتحليل العينات.
ملاحظة: المجهر مضان (الخطوة 5) يتطلب الكائنات التي وصفت مع بناء مراسل الفلورسنت.
- النظر في ما إذا كانت التجارب سوف تستخدم A. النباتات ثاليانا و A. البكتيريا المومياء ، على النحو التالي، أو مزيج آخر من النبات الميكروبي.
- تصميم الضوابط المناسبة. وتشمل خزانات المائية دون الشتلات التي يتم تلقيحها مع البكتيريا السيطرة والدبابات مع شتلات السيطرة التي لم يتم تلقيح مع البكتيريا.
- خطة التجارب مع العدد المناسب من البذور والدبابات المائية. النظر في الضوابط، مكررات البيولوجية (3 على الأقل)، وكميات من الأنسجة اللازمة لجميع التحليلات.
- تحديد طول مناسب من كوكولتفاتيون للأهداف التجريبية (الخطوة 4.8).
- راجع أي خطوات أدناه، حسب الاقتضاء.

الشكل 2. أمثلة على النباتات الأخرى التي يمكن زراعتها في نظام الزراعة المائية، بدعم من P منصة من شبكة معدنية. التوافق بين مجموعة من شبكات معدنية لمجموعة متنوعة من بذور النباتات وزراعة. ( A ) الفولاذ المقاوم للصدأ نوع 304 ويلدميش 3 × 3 شبكة × .047 "ديا سلك ل فيسيا فبا . ( ب ) الفولاذ المقاوم للصدأ نوع 304 ويلدميش 4 × 4 شبكة × .035" ديا الأسلاك ل زي مايس . (C) نوع الفولاذ المقاوم للصدأ 304 weldmesh 4 × 4 × شبكة 0.032 "سلك ديا لجليكاين ماكس (فول الصويا). (D) نوع الفولاذ المقاوم للصدأ 304 weldmesh 6 × 6 × شبكة 0.047" سلك ديا لRaphanus نبات الخيار (الشتاء الفجل). ( E ) الفولاذ المقاوم للصدأ نوع 304 ويلدميش 6 × 6 شبكة × .047 "ديا سلك ل تريتيكوم سب. ( F ) الفولاذ المقاوم للصدأ نوع 304 ويلدميش 6 × 6 شبكة × .035" ديا سلك ل كوكوميس ساتيفوس . وقد عدل هذا الرقم من المرجع 35 .955fig2large.jpg "تارجيت =" _ بلانك "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
2. النبات البذور سطح التعقيم
- دوامة (بسرعة عالية) ما يقرب من 200 بذور A. ثاليانا مع 500 ميكرولتر من الماء منزوع الأيونات في أنبوب ميكروسنتريفوج. بالنسبة لأنواع النباتات ذات البذور الكبيرة، استخدم أنبوب كبير لتسهيل التعقيم السطحي.
- أجهزة الطرد المركزي هذا في حوالي 9000 x ج لمدة 30 ثانية في ميكروسنتريفوج الجدول الأعلى. إزالة الماء (طاف) باستخدام ماصة.
- إضافة 300 ميكرولتر من 2٪ هيبوكلوريت الصوديوم إلى البذور والدوامة. ترك في درجة حرارة الغرفة لمدة 1 دقيقة. بالنسبة لأنواع النباتات ذات البذور الكبيرة، استخدم كميات أكبر لتغطية البذور.
- أجهزة الطرد المركزي في حوالي 9000 x ج لمدة 30 ثانية في ميكروسنتريفوج طاولة أعلى. إزالة محلول هيبوكلوريت الصوديوم باستخدام ماصة.
- إضافة 500 ميكرولتر من العقيمة، منزوع الأيونات الماء إلى البذور والدوامة. أجهزة الطرد المركزي في حوالي 9000 x ج ل30 ثانية وإزالة المياه باستخدام ماصة معقمة.
- كرر الخطوة 2.5 إضافية 4 مرات.
- إضافة 500 ميكرولتر من الايثانول 70٪ إلى البذور والدوامة. ترك في درجة حرارة الغرفة لمدة 1 دقيقة.
- أجهزة الطرد المركزي في حوالي 9000 x ج لمدة 30 ثانية في ميكروسنتريفوج طاولة أعلى. إزالة الايثانول 70٪ باستخدام ماصة.
- كرر الخطوة 2.5 إضافية 5 مرات.
- ريسوسبيند البذور معقمة في 500 ميكرولتر من العقيمة، الماء عالى النقاء.
3. إنبات البذور و شبه الصلبة زراعة النباتات
- إعداد شبه الصلبة موراشيج و سكوغ (مس) المتوسطة: 2.165 ز / ل مس الأملاح القاعدية. 10 غ / L سكروز؛ 0.25 جم / لتر ميس؛ و 59 مل / لتر B5 مزيج فيتامين، ودرجة الحموضة 5.75، مع 4 غ / L فيتواغار.
- الأوتوكلاف المتوسطة مس. صب 25 مل منه في كل طبق بتري عميق العقيمة (100 × 25 مم 2 ).
- لكل طبق بتري، وقطع 90 × 90 مم مربع من الفولاذ المقاوم للصدأ شبكة.
ملاحظة: شبكة الموصى بها ل A. ثاليانا < / إم> على درجة 304 (الدرجة القياسية)، وعدد الشبكة (عدد الثقوب لكل بوصة خطية) 40 × 40، وقطر السلك 0.01 "(0.0254 سم)، وهناك حاجة إلى مربع شبكة أكبر لصهاريج هدروبينيك أكبر أو منصات أعلى. - ثني زوايا كل شبكة مربعة فقط بما فيه الكفاية بحيث شبكة يناسب داخل لوحة بتري. ثني الزوايا في زاوية 90 درجة إلى الجزء الأكبر من شبكة للسماح شبكة لتكون مدعومة من قبل الزوايا، وترك مساحة كافية أدناه لتطوير الجذر ( الشكل 3A ).
- وضع الساحات شبكة قطع في كوب، تغطية مع رقائق الألومنيوم، وتعقيم بواسطة التعقيم باستخدام دورة 30 دقيقة الجافة.
- مرة واحدة وقد عززت المتوسطة في أطباق بتري وشبكة معقمة، ضع كل مربع شبكة معقمة على رأس المتوسطة شبه الصلبة، مع زوايا عازمة تواجه أسفل.
- دفع الشبكة بحيث زوايا تخترق المتوسطة والجزء الأكبر من شبكة تلامس السطح العلوي من المتوسطة (> الشكل 3 ب).
- استخدام ماصة نقل 200 ميكرولتر لرسم الفردية سطح تعقيم A. بذور ثاليانا (البذور ستبقى على طرف ماصة بسبب قوة فراغ) ونقل بلطف كل البذور على رأس شبكة. وضع البذور بحيث تكون متباعدة بشكل مناسب للاحتياجات التجريبية (على سبيل المثال، 4 6 بذور / لوحة).
- ختم لوحات بتري مع الأغطية، ووضع الشريط الجراحية يسهل اختراقها حول حواف.
- تصنف البذور بوضع طبق بتري بأكمله عند 4 درجات مئوية لمدة 2 د في الظلام (على سبيل المثال، التفاف في التينفول لمحاكاة الظلام.)
- زراعة البذور في طبق بتري في 22-24 درجة مئوية مع 16 ساعة فوتوبيريود لمدة 10-14 يوما ( الشكل 3C ).

الشكل 3: نظام زراعة النباتات الميكروبية المائية. اليسار اليسارنيل يمثل مخططا تدفق يحدد الخطوات الرئيسية الست في تجميع وتشغيل نظام الزراعة المشتركة للزراعة. اللوحة اليمنى يوضح المواد التجريبية الفعلية، والمعدات، والإجراءات التشغيلية لنظام الزراعة المائية كوكولتيفاتيون عند دراسة التفاعلات أرابيدوبسيس-أغروباكتريوم . وتظهر الآن خطوة التلقيح والخطوة النهائية لأخذ العينات النباتية أو البكتيرية. وقد عدل هذا الرقم من المرجع 35 . الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
4. نظام كوكولتيفاتيون المائية
- إعداد السائل موراشيج و سكوغ (مس) المتوسطة: 2.165 غم / لتر الأملاح القاعدية مس، 10 غ / L سوكروز، 0.25 غ / L ميس، و 59 مل / L B5 مزيج فيتامين، ودرجة الحموضة 5.75.
- الأوتوكلاف المتوسطة. صب 18 مل منه في كل زجاج أسطواني معقمة أو خزان من البلاستيك واضحة (أطباق بلورة، 100 × 80 مم2) مع الأغطية المعقمة.
ملاحظة: بريستريليز الدبابات والأغطية عن طريق لفها في رقائق الألومنيوم والتعقيم. - في غطاء تدفق معقمة، استخدام ملقط معقم لنقل بلطف كل مربع شبكة مع 10-14 شتلات عمرها اليوم من المتوسطة شبه الصلبة إلى خزان اسطواني المائية ( الشكل 3D ). ختم الأغطية على الدبابات باستخدام الشريط الجراحي المسامية.
- زراعة الشتلات على شبكة في الخزان لمدة 72 ساعة في 22-24 درجة مئوية، مع 16 ساعة فوتوبيريود والهز في 50 دورة في الدقيقة لتهوية ( الشكل 3E ).
ملاحظة: هذا يسمح للنباتات للتكيف مع البيئة المائية قبل التلقيح (كوكولتيفاتيون) مع الكائنات الحية الدقيقة. وستسمح فترة االنتظار أيضا بالتلوث الجرثومي العرضي قبل ظهور التلقيح.- تبدأ الخطوة التالية في اليوم السابق لنهاية فترة الحضانة.
- تنمو A. توميفاسيونس في أب المتوسطة(0.5٪ ث / الخامس الخميرة استخراج، 0.5٪ ث / ت تريبتون، 0.5٪ ث / س السكروز، 50 ملي مغسو 4 ، ودرجة الحموضة 7.0) عند 28 درجة مئوية مع اهتزاز بين عشية وضحاها حتى تصل الثقافة كثافة بصرية النهائية من 1.0 في 600 نانومتر (أود 600 )، كما تم قياسها باستخدام مقياس الطيف، مع المتوسطة أب أونينوكولاتد كما فارغة.
ملاحظة: أود 600 من 1.0 ما يعادل حوالي 10 9 خلايا / مل. - غسل A. توميفاسينس ثلاث مرات في حجم مساو من 0.85٪ كلوريد الصوديوم. ريسوسبيند في حجم متساو من الماء المقطر المزدوج المعقم.
- قبل التلقيح، فحص الدبابة مع الشتلات بعناية لضمان عدم وجود تلوث. يجب أن تكون الوسيلة في الخزانات غير الملوثة واضحة وشفافة.
- تجاهل أي خزان مع السائل الغائم (التلوث) وعدد بقية الدبابات. عينة كمية صغيرة (20 ميكرولتر) من المتوسطة المائية من كل دبابة مرقمة ووضعه على طبق بتري مليئة لوريا مرق (لب). احتضانطبق في 28 درجة مئوية.
- على الفور، إضافة 50 ميكرولتر من تعليق A. توميفاسيانز (حوالي 5 × 10 7 خلايا، ويقدر من أود 600 ) في كل خزان مائي مرقمة. كوكولتيفات الشتلات A. ثاليانا و A. المهدئات في 22-24 درجة مئوية مع فوتوبيريود 16 ساعة ويهز في 50 دورة في الدقيقة ( الشكل 3F ).
- فحص لوحة لب رصدت من الخطوة 4.7.1. بعد حضانة 12 و 28 ساعة للتحقق من عقم الدبابات. إذا كان هناك أي تلوث، لا تستخدم خزان مرقمة المقابلة (تلقيح مع البكتيريا) لمزيد من المقايسات المصب.
- إذا رغبت في ذلك، ومراقبة نمو A. توميفاسيانز على فترات منتظمة عن طريق إزالة عينة من المتوسطة من الخزان وقياس أود 600 باستخدام مطياف مع المتوسطة من السيطرة غير الملقحة كما فارغة ( الشكل 4 ).
لاتي: أعراض المرض النباتي يجب أن يكون واضحا بعد 7 د ( الشكل 5 ). - جذور A. ثاليانا منفصلة من تعليق البكتيرية عن طريق رفع لوحة شبكة. فإن توقيت هذه الخطوة يعتمد على عمليات المصب. راجع الخطوات من 5 إلى 8 للحصول على التفاصيل.
- إذا استخدمت جذور لتحليلات لاحقة، شطف بسرعة الجذور في الماء المقطر المزدوج. إذا كنت تستخدم ورقة أو غيرها من الأنسجة، وقطع الأنسجة. لتحليل الحمض النووي الريبي، انتقل فورا إلى الخطوة 7.1.
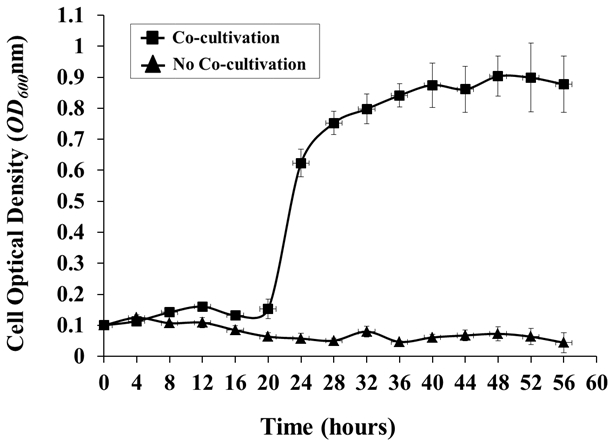
الشكل 4: نمو الجراثيم في نظام الزراعة المائية. تم رصد نمو الجراثيم في وجود أو غياب المضيف النبات ( أرابيدوبسيس ) كل 4 ساعات. تم زراعة الخلايا الجراثيم في أب المتوسطة O / N، وغسلها 3X مع كلوريد الصوديوم 0.85٪، وتلقيح في نظام الزراعة المائية، مع أو ثإيثوت أرابيدوبسيس شارك في زراعة، من أود الأولي 600 من حوالي 0.1. القيم أود 600 هي وسيلة من ثلاث مكررات بيولوجية، مع الانحرافات المعيارية ( أود 600 من 1.0 = 1 × 10 9 خلية / مل).

الشكل 5: النماذج النمطية النباتية ممثل والأعراض مرض ملحوظ أثناء كوكولتيفاتيون. في غضون 4 د بعد التلقيح، لا تظهر أعراض المرض ( A ) بالمقارنة مع النباتات نونينوكولاتد ( B ). بعد 7 د من كوكولتيفاتيون (العدوى)، لوحظت أعراض المرض في النباتات المصابة ( C )، في حين تبقى النباتات غير الملقحة صحية ( D ).
5. مضان المجهري
- استخدام A. توميفاسيانز تؤوي بناء مراسل لبروتين أوتوفلورسنت لالإعداد كوكولتيفاتيون في الخطوة 4.5 .
ملاحظة: يتم تعديل PJP2 البلازميد تعبير بهيري، مشتق من دسرد 36 ، هنا. - بعد زراعة مناسبة مناسبة (على سبيل المثال، 48 ساعة) في الخطوة 4.8، منفصلة الجذور الثانوية الفردية (فروع جانبية من الجذر الرئيسي) باستخدام مقص العقيمة.
- شطف الجذور في الماء المقطر المزدوج لإزالة المواد فضفاضة ملزمة. تغمر كل جذر في 30 ميكرولتر من الماء على شريحة المجهر وتغطي مع ساترة الزجاج.
- ختم حواف ساترة مع طلاء الأظافر لمنع الجفاف من الجذور.
- تصور مرفق A. المهدئات إلى A. جذور ثاليانا بواسطة المجهر مضان.
ملاحظة: هنا، يتم استخدام المجهر متحد البؤر مع الإثارة من الهيليوم النيون (هي-ن) 543/594 نانومتر ليزر لتصور بيشري الأحمر مضان في 590-630 نانومتر تحت مقلوب 63X هدف عدسة المياه مع فتحة عددية من 1.4 ( الشكل 6).

الشكل 6: أغروباكتريوم الجذر مرفق، يحددها المجهر متحد البؤر. وتصور لالأجرعية المسمى مضان pCherry الحمراء في 590-630 نانومتر، مع الإثارة من الهليوم نيون (وني) 543/594 نانومتر ليزر. تم إجراء التصور تحت مقلوب الهدف عدسة المياه 63X مع فتحة عددية من 1.4. مقياس الحانات = 11 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
6. البكتيرية تحليلات النص
- بعد زراعة مشتركة مناسبة (على سبيل المثال، 8 ح) في الخطوة 4.8، فصل الجذور من المتوسطة المائية كما هو الحال في الخطوة 4.9. نقل 1.5 مل من المتوسطة المائية إلى 1.5 مل الدقيقةأنبوب الطرد المركزي وأجهزة الطرد المركزي في 12000 x ج لمدة 2 دقيقة لتكوير الخلايا.
- إزالة طاف. نقل آخر 1.5 مل من الوسط المائية إلى نفس أنبوب ميكروسنتريفوج 1.5 مل وأجهزة الطرد المركزي في 12،000 غرام لمدة 2 دقيقة لتكوير الخلايا.
- إزالة طاف.
ملاحظة: يمكن أن يكون البروتوكول مؤقتا هنا عن طريق تجميد العينات في -80 درجة مئوية حتى الاستخدام. - استخراج الحمض النووي الريبي من الخلايا A. توميفاسيانز باستخدام أساليب قياسية 37 أو مناسبة رنا التجاري وعزل مجموعة تنقية مع العلاج الدناز لتجنب التلوث الحمض النووي.
ملاحظة: يمكن أن يكون البروتوكول مؤقتا هنا عن طريق تجميد أليكوتس من الحمض النووي الريبي في -80 درجة مئوية حتى الاستخدام. - استخدام الحمض النووي الريبي معزولة لمجموعة متنوعة من التحليلات باستخدام الطرق القياسية، بما في ذلك ما يلي.
- استخدام ميكروأري التجارية وفقا لبروتوكول الشركة المصنعة للكشف عن مجموعات الجينات التي تم التعبير عنها تفاضليا في كوكولتيفاتد مقابل السيطرةحضاره.
- استخدام الكمية في الوقت الحقيقي البلمرة سلسلة رد الفعل (كرت-ير) للكشف عن التعبير عن جينات محددة أو للتحقق من صحة البيانات ميكروأري 38 .
7. تحاليل نص النبات
- بعد زراعة مناسبة (على سبيل المثال، 8 ح) في الخطوة 4.8، فصل الجذور من وسط الزراعة المائية، كما هو الحال في الخطوة 4.9، أو منفصلة الأنسجة الأخرى حسب الحاجة. وضع على الفور ما يقرب من 150 ملغ من الجذور أو الأنسجة النباتية الأخرى في النيتروجين السائل.
ملاحظة: يمكن أن يكون البروتوكول مؤقتا هنا عن طريق تجميد العينات في -80 درجة مئوية حتى الاستخدام. - طحن العينات المجمدة إلى مسحوق في النيتروجين السائل باستخدام هاون ومدقة.
- استخراج الحمض النووي الريبي من مسحوق باستخدام الطرق القياسية 39 أو مناسبة رنا التجاري وعزل مجموعة تنقية مع العلاج الدناز لتجنب تلوث الحمض النووي.
ملاحظة: يمكن أن يكون البروتوكول مؤقتا هنا عن طريق تجميد أليكوتس من الحمض النووي الريبي في-80 درجة مئوية حتى الاستخدام. - استخدام الحمض النووي الريبي معزولة لمجموعة متنوعة من التحليلات باستخدام الطرق القياسية، بما في ذلك ما يلي.
- استخدام ميكروأري التجارية وفقا لبروتوكول الشركة المصنعة للكشف عن مجموعات الجينات التي تم التعبير عنها تفاضليا في النباتات المزروعة المشترك مقابل السيطرة.
- استخدام كرت-ير للكشف عن التعبير التفاضلي للجينات محددة أو للتحقق من صحة البيانات ميكروأري 38 .
8. التنميط السريوم
- بعد زراعة مشتركة مناسبة (على سبيل المثال، 72 ساعة) في الخطوة 4.8، فصل الجذور من المتوسطة المائية كما في الخطوة 4.9. تعقيم 18 مل من المتوسطة المائية عن طريق تمريرها من خلال مرشح ميكرون 0.2 ميكرون إلى 50 مل أنابيب مخروطية.
- تجميد العينات في -80 ° كو / N.
- تخفيف قبعات على 50 مل أنابيب مخروطية ووضعها في آلة التجفيف لمدة 36 ساعة. المضي قدما لتخزين أو معالجة العينات (كما ديسكريبد أدناه) لتحليل هبلك وكشف مركب.
ملاحظة: يمكن إيقاف البروتوكول هنا. - ريسوسبيند كل عينة في 5 مل من الماء المقطر المزدوج في أنبوب اختبار قابل للاشتعال.
- إضافة 5 مل من خلات الإيثيل وخلط عن طريق قلب الأنبوب عدة مرات.
- السماح للمراحل للفصل في درجة حرارة الغرفة لمدة 5 دقائق.
- نقل الجزء العلوي (المرحلة العضوية) إلى حاوية جديدة عن طريق بيبتينغ. إذا لزم الأمر، تجمع الكسور العضوية متعددة.
- الجاف تحت تيار لطيف من غاز النيتروجين (~ 45 دقيقة).
- إعادة تعليق العينة في حل مناسب ل هبلك (على سبيل المثال، 100٪ الميثانول).
- أداء هبلك وفقا للأساليب القياسية 40 .
- كشف المركبات بالوسائل المناسبة.
ملاحظة: إليكتروسبراي التأين الوقت من الطيران الطيف الكتلي (إيسي-توف-مس) 40 يستخدم هنا.
النتائج
النمو في الزراعة المشتركة شارك في زراعة النظام
أظهر منحنى النمو ل A. توميفاسيونس C58 مرحلة تأخر كبيرة في 16 ساعة الأولي من زراعة النباتات، تليها نمو مستقر جدا عندما تزرع مع A. ثاليانا كول
Discussion
وبالنظر إلى الطبيعة التدريجية لإفراز الجذور، فإن تركيز المواد الكيميائية المحرضة للفوعة المنتجة في النباتات وتأثيراتها على التفاعلات الديناميكية بين النبات والميكروب تحدث في التدرجات المكانية والزمانية. في هذا النظام المشترك للزراعة المائية، لا يستكمل...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
نود أن نشكر براين ويسيلوسكي والكسندر إيستمان لمساعدتهم ومناقشة مفيدة. ونود أيضا أن نشكر الدكتور. يوجين دبليو نستر، لينغروي تشانغ، هايتاو شين، يوهاي تسوى، وجريج ثورن على مساعدتهم، مناقشات مفيدة، والقراءة النقدية للمخطوطة. وقد تم تمويل هذا البحث من قبل الزراعة و أغري-فود كانادا و غروينغ فوروارد-أغريفلكس (ربي رقم 2555) و غروينغ فوروارد إي بروجيكت نومبر 1670، التي أجراها المؤلفون كجزء من واجباتهم. كما تم تمويل هذه الدراسة جزئيا من قبل مجلس العلوم الطبيعية والهندسة البحوث في كندا (نزيرك) منحة اكتشاف ربين-2015-06052 منحت ل زك يوان.
Materials
| Name | Company | Catalog Number | Comments |
| plant seeds (Arabidopsis thaliana Col-0) | Arabidopsis Biological Resource Centre | CS7000 | https://abrc.osu.edu/order-stocks |
| bacteria (Agrobacterium tumefaciens C58) | University of Washington | N/A | |
| labeled bacteria | in-house | optional, depends on downstream analyses | |
| vortex | (various) | ||
| microcentrifuge tubes | (various) | ||
| microcentrifuge | (various) | ||
| 5% sodium hypochlorite | (various) | ||
| double distilled water | (various) | ||
| autoclave | (various) | ||
| micropipette | (various) | ||
| 70% ethanol | (various) | ||
| Murashige and Skoog (MS) basal salts | Sigma-Aldrich | M5524 | |
| sucrose | (various) | ||
| MES | (various) | ||
| B5 vitamin mix | Sigma-Aldrich | G1019 | |
| phytoagar | (various) | ||
| Deep Petri dishes | (various) | ||
| stainless steel mesh | Ferrier Wire Goods Company Ltd | N/A | grade: 304; mesh count: 40 × 40; wire DIA: 0.01 |
| micropore tape, 1" | 3M | 1530-1 | |
| diurnal growth chamber | (various) | ||
| cylindrical glass tanks, 100 × 80 mm | Pyrex | 3250 | other sizes can be used, in which case liquid content may need adjustment |
| flow hood | (various) | ||
| forcepts | (various) | ||
| yeast extract | (various) | ||
| tryptone | (various) | ||
| MgSO4 | (various) | ||
| shaking incubator | (various) | ||
| spectrophotometer | (various) | ||
| NaCl | (various) | ||
| shaker | (various) | ||
| scissors | (various) | optional, depends on downstream analyses | |
| fluorescence microscope | (various) | optional, depends on downstream analyses | |
| microscope slides and cover slips | (various) | optional, depends on downstream analyses | |
| nail polish | (various) | optional, depends on downstream analyses | |
| Bacterial RNA extraction kit | (various) | optional, depends on downstream analyses | |
| plant RNA extraction kit (RNeasy Plant Mini Kit) | Qiagen | 74903 or 74904 | optional, depends on downstream analyses |
| material and equipment for qRT-PCR | (various) | optional, depends on downstream analyses | |
| material and equipment for microarray analysis | (various) | optional, depends on downstream analyses | |
| liquid nitrogen | (various) | optional, depends on downstream analyses | |
| mortar and pestle | (various) | optional, depends on downstream analyses | |
| 0.2 µm pore filter | (various) | optional, depends on downstream analyses | |
| 50 mL conical tubes | (various) | optional, depends on downstream analyses | |
| freeze dryer | (various) | optional, depends on downstream analyses | |
| sealable test tubes | (various) | optional, depends on downstream analyses | |
| ethyl acetate | (various) | optional, depends on downstream analyses | |
| nitrogen gas | (various) | optional, depends on downstream analyses | |
| material and equipment for HPLC | (various) | optional, depends on downstream analyses | |
| material and equipment for ESI-TOF-MS | (various) | optional, depends on downstream analyses |
References
- Lambers, H., Mougel, C., Jaillard, B., Hinsinger, P. Plant-microbe-soil interactions in the rhizosphere: An evolutionary perspective. Plant Soil. 321 (1), 83-115 (2009).
- Philippot, L., Raaijmakers, J. M., Lemanceau, P., vander Putten, W. H. Going back to the roots: The microbial ecology of the rhizosphere. Nat. Rev. Microbiol. 11 (11), 789-799 (2013).
- Somers, E., Vanderleyden, J., Srinivasan, M. Rhizosphere bacterial signalling: A Love Parade beneath our feet. Crit. Rev. Microbiol. 30 (4), 205-240 (2004).
- Barah, P., Winge, P., Kusnierczyk, A., Tran, D. H., Bones, A. M. Molecular signatures in Arabidopsis thaliana in response to insect attack and bacterial infection. PLoS ONE. 8 (3), (2013).
- Zhang, J., Zhou, J. -. M. Plant immunity triggered by microbial molecular signatures. Mol. Plant. 3 (5), 783-793 (2010).
- Paterson, E., Gebbing, T., Abel, C., Sim, A., Telfer, G. Rhizodeposition shapes rhizosphere microbial community structure in organic soil. New Phytol. 173 (3), 600-610 (2006).
- Hartmann, A., Schmid, M., van Tuinen, D., Berg, G. Plant-driven selection of microbes. Plant Soil. 321 (1-2), 235-257 (2008).
- Micallef, S. A., Shiaris, M. P., Colon-Carmona, A. Influence of Arabidopsis thaliana accessions on rhizobacterial communities and natural variation in root exudates. J. Exp. Bot. 60 (6), 1729-1742 (2009).
- Burr, T., Otten, L. Crown gall of grape: Biology and disease management. Annu. Rev. Phytopathol. 37, 53-80 (2001).
- Clough, S. J., Bent, A. F. Floral dip: A simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16 (6), 735-743 (1998).
- Binns, A. N., Costantino, P., Spaink, H. P., Kondorosi, A., Hooykaas, P. J. J. The Agrobacterium oncogenes. The Rhizobiaceae. , (1998).
- Gheysen, G., Angenon, G., Van Montagu, M., Lindsey, K. Agrobacterium-mediated plant transformation: a scientifically intriguing story with significant applications. Transgenic Plant Research. , (1998).
- Valvekens, D., Von Montagu, M. V., Van Lijsebettens, M. Agrobacterium tumefaciens-mediated transformation of Arabidopsis thaliana root explants by using kanamycin selection. Proc. Natl. Acad. Sci. USA. 85 (15), 5536-5540 (1988).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283 (1999).
- Chilton, M. D., et al. Stable incorporation of plasmid DNA into higher plant cells: The molecular basis of crown gall tumorigenesis. Cell. 11 (2), 263-271 (1977).
- Gelvin, S. B. Agrobacterium in the genomics age. Plant Physiol. 150 (4), 1665-1676 (2009).
- Subramoni, S., Nathoo, N., Klimov, E., Yuan, Z. -. C. Agrobacterium tumefaciens responses to plant-derived signaling molecules. Front. Plant Sci. 5, 322 (2014).
- Yuan, Z., Liu, P., Saenkham, P., Kerr, K., Nester, E. W. Transcriptome profiling and functional analysis of Agrobacterium tumefaciens reveals a general conserved response to acidic conditions (pH 5.5) and a complex acid-mediated signaling involved in Agrobacterium-plant interactions. J. Bacteriol. 190 (2), 494-507 (2008).
- Stachel, S. E., Messens, E., Van Montagu, M., Zambryski, P. Identification of the signal molecules produced by wounded plant cells that activate T-DNA transfer in Agrobacterium tumefaciens. Nature. 318 (6047), 624-629 (1985).
- Memelink, J., de Pater, B. S., Hoge, J. H. C., Schilperoort, R. A. T-DNA hormone biosynthetic genes: Phytohormones and gene expression in plants. Dev. Genet. 8 (5-6), 321-337 (1987).
- Yuan, Z. -. C., et al. The plant signal salicylic acid shuts down expression of the vir regulon and activates quormone-quenching genes in Agrobacterium. Proc. Natl. Acad. Sci. USA. 104 (28), 11790-11795 (2007).
- Yuan, Z. -. C., Haudecoeur, E., Faure, D., Kerr, K. F., Nester, E. W. Comparative transcriptome analysis of Agrobacterium tumefaciens in response to plant signal salicylic acid, indole-3-acetic acid and γ-amino butyric acid reveals signalling cross-talk and Agrobacterium-plant co-evolution. Cell. Microbiol. 10 (11), 2339-2354 (2008).
- Li, P. L., Farrand, S. K. The replicator of the nopaline-type Ti plasmid pTiC58 is a member of the repABC family and is influenced by the TraR-dependent quorum-sensing regulatory system. J. Bacteriol. 182 (1), 179-188 (2000).
- Atkinson, M. M., Huang, J., Knopp, J. A. Hypersensitivity of suspension-cultured tobacco cells to pathogenic bacteria. Phytopathology. 75 (11), 1270-1274 (1985).
- Veena, ., Jiang, H., Doerge, R. W., Gelvin, S. B. Transfer of T-DNA and Vir proteins to plant cells by Agrobacterium tumefaciens induces expression of host genes involved in mediating transformation and suppresses host defense gene expression. Plant J. 35 (2), 219-236 (2003).
- León, J., Rojo, E., Sanchez-Serrano, J. J. Wound signalling in plants. J. Exp. Bot. 52 (354), 1-9 (2001).
- Ditt, R. F., Kerr, K. F., de Figueiredo, P., Delrow, J., Comai, L., Nester, E. W. The Arabidopsis thaliana transcriptome in response to Agrobacterium tumefaciens. Mol. Plant Microbe In. 19 (6), 665-681 (2006).
- Mandimba, G., Heulin, T., Bally, R., Guckert, A., Balandreau, J. Chemotaxis of free-living nitrogen-fixing bacteria towards maize mucilage. Plant Soil. 90 (1-3), 129-139 (1986).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiol. 148 (3), 1547-1556 (2008).
- Lee, C. W., et al. Agrobacterium tumefaciens promotes tumor induction by modulating pathogen defense in Arabidopsis thaliana. Plant Cell. 21 (9), 2948-2962 (2009).
- Reymond, P., Weber, H., Damond, M., Farmer, E. E. Differential gene expression in response to mechanical wounding and insect feeding in Arabidopsis. Plant Cell. 12 (5), 707-720 (2000).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front. Plant Sci. 5, 252 (2014).
- Alatorre-Cobos, F., et al. An improved, low-cost, hydroponic system for growing Arabidopsis and other plant species under aseptic conditions. BMC Plant Biol. 14 (1), 69 (2014).
- Conn, S. J., et al. Protocol: Optimising hydroponic growth systems for nutritional and physiological analysis of Arabidopsis thaliana and other plants. Plant Methods. 9 (1), 4 (2013).
- Nathoo, N. . Identification of putative plant defense genes using a novel hydroponic co-cultivation technique for studying plant-pathogen interaction. , (2015).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat. Biotechnol. 22 (12), 1567-1572 (2004).
- Wise, A. A., Liu, H., Binns, A. N. Nucleic acid extraction from Agrobacterium strains. Methods Mol. Bio. 343, 67-76 (2006).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat. Protoc. 1 (3), 1559-1582 (2006).
- Salter, M. G., Conlon, H. E. Extraction of plant RNA. Methods Mol. Bio. 362, 309-314 (2007).
- Bao, Y., Wang, S., Yang, X., Li, T., Xia, Y., Meng, X. Metabolomic study of the intervention effects of Shuihonghuazi Formula, a Traditional Chinese Medicinal formulae, on hepatocellular carcinoma (HCC) rats using performance HPLC/ESI-TOF-MS. J. Ethnopharmacol. 198, 468-478 (2017).
- Korves, T. M., Bergelson, J. A developmental response to pathogen infection in Arabidopsis. Plant Physiol. 133 (1), 339-347 (2003).
- Lyons, R., Rusu, A., Stiller, J., Powell, J., Manners, J. M., Kazan, K. Investigating the association between flowering time and defense in the Arabidopsis thaliana-Fusarium oxysporum interaction. PLoS ONE. 10 (6), e0127699 (2015).
- Badri, D. V., Weir, T. L., vander Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: Plant-microbe interactions. Curr. Opin. Biotechnol. 20 (6), 642-650 (2009).
- Baerson, S. R., et al. Detoxification and transcriptome response in Arabidopsis seedlings exposed to the allelochemical benzoxazolin-2(3H)-one. J. Biol. Chem. 280 (23), 21867-21881 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved