A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
طريقة موحدة لقياس المساحة الداخلية الرئة السطحية عن طريق استئصال رئوي الماوس وزرع الاصطناعية
In This Article
Summary
منطقة سطح الرئة الداخلية (عيسى) هو معيار حاسم لتقييم مورفولوجيا الرئة وعلم وظائف الأعضاء في أمراض الرئة والتجدد السنخي الناجم عن الاصابة. نحن تصف هنا طريقة موحدة التي يمكن أن تقلل من التحيز قياس عيسى في كل من استئصال رئوي الرئوي ونماذج الفئران زرع الاصطناعية.
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
الوظيفة الأساسية للرئة هي تبادل الأكسجين وثاني أكسيد الكربون بين الأوعية الدموية والغلاف الجوي. أمراض الرئة مثل خلل التنسج القصبي الرئوي (بد)، مرض الانسداد الرئوي المزمن (كوبد)، والتهابات الجهاز التنفسي الحادة، ويؤدي إلى انخفاض عيسى 2 . وقد طور الباحثون الذين يدرسون أمراض الرئة العديد من الطرق الكمية لتقييم التغيرات المورفولوجية في الرئتين، بما في ذلك ملي، إلف، وعدد من وحدات تبادل الغاز، عيسى، والالتزام أنسجة الرئة 2 ، 3 . دراسات رائدة من قبل ويبل وآخرون. 4 و دوغويد إت آل. 5 معا أن المعیار الدولي للتدقیق یمکن استخدامھ کمقیاس مباشر لقدرة تبادل الغاز الرئوي في الرئتین البشریة ویمکن استخدامھ کمعیار لتحدید شدة انتفاخ الرئة. وقد استخدم عدد من الدراسات التي نشرت في السنوات الخمس الماضية المعلمات المورفولوجية الرئة (على سبيل المثال، عيسى و ملي) لتقييم التغيرات المورفولوجية والوظيفية في الرئتين من الفئران خلال التنمية 6 وخلال الانتعاش من إصابة ينكس 1 ، 7 . ويحسب عيسى باستخدام المعادلة 1 8 و 9 :
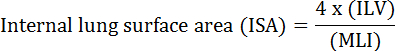
، حيث إلف هو حجم الرئة الداخلية و ملي هو وسيط المعلمة التي تمثل المجال الجوي الطرفية الرئوية حجم 10 .
ينكس، إزالة جراحية واحدة أو أكثر من فصوص الرئة، تم الإبلاغ على نطاق واسع للحث على تجديد السنخية في العديد من الأنواع، بما في ذلك البشر 11 ، الفئران 1 ، الكلاب 12 ، الفئران 13 ، والأرانب 14 ، 15 . مسمارذ من الرئتين الفئران في أربعة عشر يوما بعد بنكس أظهرت أن كلا من التوسع في الحويصلات الهوائية الموجودة مسبقا وتشكيل دي نوفو من الحويصلات الهوائية تسهم في استعادة عيسى، إلف، وعدد من الحويصلات الهوائية في أنسجة الرئة المتبقية 1 . لقد أظهرنا نحن وآخرون أن إدخال مواد مثل الإسفنج أو الشمع أو بدلة على شكل مخصص في التجويف الصدري الفارغ بعد بنكس ( أي زرع الأطراف الاصطناعية) يضعف تجديد السنخية. ومن الثابت الآن أن القوة الميكانيكية تعمل باعتبارها واحدة من أهم العوامل لبدء تجديد السنخية 1 ، 16 ، 17 . وقد سلطت هذه الدراسات الضوء على فعالية استخدام قيم عيسى من بنكس المعالجة والرئة الاصطناعية مزروع كمعيار لتقييم كميا تجديد السنخية.
ومن المعروف أن التحيز المراقب تؤثر تأثيرا كبيرا فازهري لمعلمات المورفولوجية الرئة (على سبيل المثال، MIL وILV). ويمكن استخدام بروتوكولات موحدة لتفادي هذا التحيز في تحديد كل من إلف و ملي، وهما البارامترات المستخدمة في حساب عيسى. هنا، ونحن نقدم بروتوكولات مفصلة للغاية، موحدة لقياس هذه المعلمات الرئة. الأهم من ذلك، القدرة على تحديد بدقة عيسى وعد بتحسين موثوقية واستنساخ الدراسات من وظائف الرئة في نماذج تجديد السنخية الناجم عن إصابة وينبغي أن تسهل الاكتشافات الميكانيكية في أمراض رئوية متعددة.
Access restricted. Please log in or start a trial to view this content.
Protocol
جميع الإجراءات المستخدمة في هذا البروتوكول نفذت وفقا للتوصيات الواردة في المبادئ التوجيهية لرعاية واستخدام الحيوانات المختبرية للمعهد الوطني للعلوم البيولوجية، بكين. تم إيواء الفئران الذكور من نوع سد-1 البالغ عمرها 8 أسابيع في منشأة خالية من مسببات الأمراض (سف) حتى أجريت التجارب. أجريت العمليات الجراحية باستخدام الفئران تخدير تماما ( أي دون أي ردود قرصة أخمص القدمين). بعد الجراحة، تم الاحتفاظ بالفئران في غرفة دافئة رطبة مع ما يكفي من الغذاء والمياه العذبة. تم التضحية الفئران باستخدام جرعة زائدة من مخدر تسليمها عن طريق الحقن داخل الصفاق.
1. ماوس ينكس جراحة
- تخدير كامل الفئران مع فينوباربيتال الصوديوم (120 ملغ / كغ من وزن الجسم) والبوبرينورفين (0.1 ملغ / كغ من وزن الجسم) عن طريق الحقن داخل الصفاق (إب). إجراء الجراحة عندما الفئران لم تعد تتفاعل مع معصم القدمين معسر.
- إزالة الشعر على الصدر الأيسر من الفئران مع ديب الكيميائيةإلاتوري العلاج (~ 3 × 3 سم 2 منطقة).
- تأمين كل الماوس على منصة التنبيب مع الجانب البطني التي تواجه المشغل ( الشكل 1A ).
- سحب اللسان الماوس وإلقاء الضوء على الحبال الصوتية مع منظار الحنجرة الحيوانية الصغيرة التي تحتوي على درجة لتوجيه القسطرة 18 ( الشكل 1A ).
- التمييز بين الحبال الصوتية من خلال مراقبة تحركات الحبال الصوتية أثناء التنفس. إدراج بلطف 20 G قنية التنبيب عن طريق الوريد في القصبة الهوائية في زاوية الأمامية 19 .
- وضع الفئران في موقف راقد الجانبي الأيمن وربط قنية إلى التنفس الصناعي الميكانيكية (على سبيل المثال، والضغط تسيطر عليها، انظر جدول المواد ). تحقق من إدراج قنية في القصبة الهوائية من خلال مراقبة حركات التنفس من الصدر الماوس ( الشكل 1B ).
- تعيين الضغط الشهيق of التنفس الصناعي إلى 12 سم H 2 O وتعيين معدل التنفس إلى 120 الأنفاس في الدقيقة ( الشكل 1B ).
- تطهير الجلد في منطقة العمليات الجراحية مع بيتادين و 70٪ من الإيثانول.
- جعل 2 - شق بضع الصدر 3 سم الخلفي الوحشي في الفضاء في الفضاء وربي ال 5، وقطع طريق الجلد والعضلات مع نويس الربيع مقص (قطع حافة: 14 مم؛ قطر الحافة: 0.275 مم) (الشكل 2B، C). يتم تعقيم الأدوات الجراحية المستخدمة لإجراء بضع الصدر قبل الاستخدام.
- جعل شق 1.5 سم في الفضاء وربي الموافق 5 لفضح الرئة اليسرى (الشكل 2D، E). أثناء العملية، استخدام ارتفاع درجة الحرارة كويريزر لوقف النزيف.
- رفع ثلث الفص الرئة اليسرى من الصدر مع ملقط طرف حادة ( الشكل 2F )، ومن ثم استخدام مسحة القطن لسحب اليسار بأكملهالرئة ( الشكل 2G ).
- تحديد الشريان الرئوي والشعب الهوائية من الفص الرئة الأيسر ( الشكل 2G ).
- ليغات بإحكام الشعب الهوائية والسفن في هيلوم مع خياطة الجراحية الحرير وقطع الفص الرئة اليسرى في 3-4 ملم من ربط ( الشكل 2H ، I ).
ملاحظة: يجب الحرص على عدم قطع عقدة خياطة على نقي اليسرى، والتي يمكن أن تسبب استرواح الصدر ( أي الهواء أو الغاز في تجويف الصدر) . - إغلاق جدار الصدر مع 1 خياطة، ومن ثم غرزة طبقة العضلات وطبقة الجلد بالتتابع، وذلك باستخدام 5 - 6 توقف الغرز. ترك فجوة 3 - 4 ملم بين كل خياطة ( الشكل 2M ، 2N ).
ملاحظة: الحفاظ على إبرة خياطة الجراحية بعيدا عن القلب. فإن ثقب القلب غير مقصود يؤدي إلى الموت الفوري. - تطهير المنطقة الجراحية مع البوفيدون اليود.
- بعد عملية الشراءr العملية الجراحية، ضع الماوس على لوحة الحرارية 38 درجة مئوية وربط الماوس إلى التنفس الصناعي حتى حركات التنفس العفوية تبدأ ( الشكل 2O ).
2. زرع الاصطناعية
- تنفيذ الخطوات 1.1 - 1.13 من الإجراء بنكس (وهذا هو، حتى النقطة التي يتم فيها إزالة الفص الرئة اليسرى من الماوس).
- المشبك مركز الاصطناعي سيليكون (العملاء المقدمة، 12 مم في الطول، 3 مم في سمك، 7 ملم في العرض، 0.2 غرام، شكل بيضاوي الشكل) باستخدام ملقط حادة ( الشكل 2J ). تعقيم بدلة سيليكون قبل الإدراج.
- عقد الضلع مع ملقط بيد واحدة لفضح تجويف الصدري، ومن ثم إدراج بدلة في تجويف الصدر فارغة الأيسر مع يد أخرى.
ملاحظة: زاوية الإدراج حوالي 45 درجة بين الطائرة الأمامية من الأطراف الصناعية والسطحية الصدرية ( الشكل 2K ،L). يكون لطيف جدا عند إدخال الأطراف الاصطناعية. سوف تؤدي القوة المفرطة إلى تمزق الجنبي. - ضبط اتجاه الأطراف الاصطناعية مع ملقط حادة للتأكد من أن بدلة تحتل اليسار تجويف الصدر فارغة.
- تنفيذ الخطوات 1.14 - 1.16 من إجراء الماوس الماوس.
3. قياس إلف
- إعداد جهاز مخصص ("أنبوب التضخم") الذي يتكون من المكبس إزالة من ماصة المصلية المتاح (10 مل)، أنبوب مرن 40 سم طويلة مع محول الإبرة، صمام التحكم معدل التدفق، وإبرة 18 G. بعد التجمع، وتأمين ماصة على متن مع الشريط ( الشكل 3A ). المسافة بين الجزء العلوي من ماصة والمقعد التجريبية يجب أن يكون على الأقل 30 سم.
- إعداد الطازجة 4٪ بارافورمالدهيد (بفا) حل التثبيت عن طريق إذابة 20 غرام بفا في 500 مل قبل تسخينها 1X الفوسفات مخزنة المالحة (بس) في حمام مائي 55 درجة مئوية، والهز يدويا علىسي كل 10 دقيقة حتى الحل واضح. بعد التبريد لدرجة حرارة الغرفة، وتصفية الحل مع مرشح 0.45 ميكرون.
تنبيه: ارتداء معدات الوقاية الشخصية المناسبة (ب) عند التعامل مع بفا. - التضحية الفئران مع حقن جرعة زائدة من مخدر (0.8٪ الفينوباربيتال الصوديوم، 1000 U / مل الهيبارين).
- تأمين كل الماوس على لوحة تشريح البوليسترين ورذاذ مع الكحول 70٪.
- فتح بعناية الماوس الماوس وقطع من القص باستخدام مقص لتعريض بدقة فصوص الرئة.
- إزالة الأنسجة المفرطة باستخدام مقص لفضح القصبة الهوائية. تأكد من فصل القصبة الهوائية من المريء.
- قطع الشريان الأورطي البطني وإدراج إبرة 25 قياس في البطين الأيمن من القلب. ربط الإبرة إلى حقنة 20 مل قبل هذا الإدراج. دفع ببطء 1X برنامج تلفزيوني في القلب لإزالة خلايا الدم حتى الرئتين تتحول إلى اللون الأبيض. عادة، مطلوب 5 - 10 مل بس لمسح الأوعية الدموية الرئوية.
- ملء ثه أنبوب التضخم التي شيدت خصيصا مع بفا 4٪ الطازجة وإزالة جميع الفقاعات من أنبوب التضخم.
- إدراج إبرة 18 قياس أنبوب التضخم في القصبة الهوائية وقصبة القصبة الهوائية مع مقاطع السفينة لتجنب تسرب السوائل.
- تضخيم الرئتين مع بفا 4٪ في الضغط المستمر عبر الرئوي من 25 سم / H 2 O 2 ، 20 . احتضان الرئتين في درجة حرارة الغرفة لمدة 2 ساعة لتحقيق الرئتين الموسعة بالكامل. هذه الخطوة "ما قبل الإصلاح" أمر بالغ الأهمية للحفاظ على مورفولوجيا الرئة.
- من خلال مراقبة أنبوب التضخم، تسجيل قيمة الأولي 4٪ بفا حجم وتسجيل الحجم النهائي. حجم الرئة الداخلية يساوي حجم بفا الأولي 4٪ ناقص حجم بفا النهائي 4٪.
- ليغات القصبة الهوائية واستخدام مقص، تشريح بلطف من الرئتين (الحفاظ على الرئتين سليمة) من الأنسجة الضامة المحيطة بها. يكون لطيف جدا لتجنب إتلاف الرئتين.
- Incuباتي الرئتين في أنبوب مخروطي 50 مل مليئة 4٪ بفا لمدة 12 ساعة في 4 درجات مئوية مع هز لطيف على شاكر (50 دورة في الدقيقة). انتقل إلى معالجة الأنسجة وتلطيخ (انظر القسم 4).
4. الأنسجة التضمين، سيكتيونينغ، و هيماتوكسيلين و يوسين (H & E) تلطيخ
- بعد التثبيت، استخدم مقص نويس الربيع لتقليم القلب والأنسجة الضامة المفرطة قبالة الرئتين. فصل بلطف فصوص الرئة الفردية عن طريق قطع القصبات التي تربط فصوص الرئة إلى القصبة الهوائية.
- غسل على نطاق واسع فصوص الرئة 3-4 مرات في 50 مل 1X بس (30 دقيقة / غسل) على شاكر المداري (50 دورة في الدقيقة).
- بعد غسل النهائي، كريوبروتيكت فصوص الرئة عن طريق غمر لهم في محلول السكروز 30٪ (في برنامج تلفزيوني 1X) في 4 درجات مئوية حتى يغسل الأنسجة إلى الجزء السفلي من أنابيب مخروطية 50 مل (حوالي 12 ساعة).
- قبل تضمين و كريوسكتيونينغ الأنسجة، وإزالة عينات الفص الرئة من الأنابيب مع ملقط، والاحتفاظ أسيسالفصوص السوري للتحليل النسيجي، داب محلول السكروز المتبقية من سطح عينات الفص التبعي، ومن ثم تزج بدقة العينة في طبق بتري تحتوي على درجة حرارة القطع الأمثل (أكتوبر) مجمع لمدة 30 دقيقة تقريبا.
- تجميد أوكت جزءا لا يتجزأ من عينات الفص ملحق في النيتروجين السائل باستخدام كريومولدز. وضع أكبر مساحة سطح الفص موازية إلى الجزء السفلي من القالب.
- إعداد ما مجموعه ثلاثة أقسام 10 ميكرون سميكة لكل عينة خلال كريوسكتيونينغ للتحليل النسيجي. تجاهل أول 1 ملم من الأنسجة، وجمع واحد 10 ميكرون سميكة القسم، وتجاهل 0.5 ملم من الأنسجة، وجمع قسم آخر، وتجاهل 0.5 ملم من الأنسجة، وجمع القسم الثالث (النهائي).
- الهواء الجاف أقسام لمدة 1 ساعة قبل أداء H & E تلطيخ.
- أداء H & E تلطيخ
- غسل المقاطع في 3-4 التغييرات من مياه الصنبور ثم وصمة عار أقسام في الهيماتوكسيلين جديدة لمدة 2 دقيقة. شطف القسم تحت تشغيل مياه الصنبور. تزج القسم مرتين في محلول الإيثانول هكل-70٪ 1٪ لإزالة الهيماتوكسيلين الزائدة.
- وصمة عار القسم في يوزين طازج لمدة 3 دقائق. يذوى المقاطع مع اثنين متتالية 30 ثانية يغسل في الايثانول 95٪ واثنين من 30 ثانية يغسل مع الايثانول بنسبة 100٪. مسح المقاطع في زيلين لمدة 30 ثانية، كرر خطوة المقاصة مرة واحدة في الزيلين الطازج. جبل الشرائح مع تصاعد المتوسطة باستخدام كوفرسليبس الزجاج.
5 - التحديد الكمي للمعهد المتعدد الأطراف
- الحصول على الصور الرقمية من H & E أقسام الفص ملحق الملون (20X التكبير) باستخدام المجهر مشرق الميدان.
- لتحديد الكمية المتعددة، حدد ما مجموعه 15 وجهات النظر غير متداخلة (1000 ميكرون × 1000 ميكرون) عشوائيا من المناطق المناسبة (دون الشرايين والأوردة، الشعب الهوائية الرئيسية، والقنوات السنخية) من 3 أقسام.
- وضع شبكة مع 10 خطوط رأسية موزعة بالتساوي و 10 خطوط أفقية موزعة بالتساوي من لين محددةغث (1،000 ميكرون) على المناطق المختارة للعرض باستخدام أداة حاكم؛ وبالتالي تباعد كل سطر 100 ميكرون وبصرف النظر ( الشكل 4B ).
- تحديد قيمة اعتراض واحد كما طول الخطية بين اثنين من الظهارة السنخية المجاورة. قياس قيم جميع الاعتراضات على طول كل 1000 ميكرون طول الخط.
- ولكل شبكة، تحدد قيم جميع الاعتراضات بين خطوط الطول الأفقي البالغ طولها 1000 ميكرون وخطوط الطول العمودي البالغ طولها 1000 ميكرون.
ملاحظة: ملي هو متوسط قيمة أطوال اعتراض من ما مجموعه 15 شبكة تحليلها من بين الأقسام الثلاثة المعدة لكل من الفصوص التبعي.
6. حساب عيسى
- احسب المعیار الدولي للتدقیق باستخدام المعادلة 1 (انظر المقدمة ). يرجى الرجوع إلى القسم 3 لقياس إلف والرجوع إلى القسم 5 من أجل التحديد الكمي لمؤشر الضعف المتعدد.
Access restricted. Please log in or start a trial to view this content.
النتائج
أجرينا هنا تجربة مع مجموعة معالجة ينكس ومجموعة زرع الاصطناعية (الاصطناعية). هذه المجموعات هي نفس المجموعات المستخدمة في دراسة نشرت سابقا من مجموعتنا البحثية 14 .
يظهر الماوس وين...
Access restricted. Please log in or start a trial to view this content.
Discussion
في هذا البروتوكول، ونحن نقدم أوصاف مفصلة عن قياس المعلمات الرئوية بعد الماوس اليسار الرئة ينكس وزرع الاصطناعية. ويعتبر عيسى الآن مقياسا رئيسيا لتقييم وظيفة الجهاز التنفسي في العديد من الأمراض الرئوية وفي تجديد السنخية الناجم عن الإصابة. ومع ذلك، على الرغم من أن مجت?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
ويود المؤلفون أن يعترفوا بالمعهد الوطني للعلوم البيولوجية، بيجين، على المساعدة. وأيد هذا العمل من قبل مؤسسة العلوم الطبيعية لبلدية بكين (رقم Z17110200040000).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
References
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. Morphometry of the Human Lung. , Springer-Verlag. Berlin Heidelberg. (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved