A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטה מתוקננת למדידת שטח הפנים של הריאות הפנימיות באמצעות דלקת ריאות של עכבר והשתלת תותב
In This Article
Summary
אזור פני השטח הפנימי של הריאות (ISA) הוא קריטריון קריטי להערכת מורפולוגיה ריאות ופיזיולוגיה במחלות ריאה ו-התחדשות שנגרם על ידי פציעה. אנו מתארים כאן שיטה סטנדרטית שיכולה למזער את הטיה המדידה עבור השב"כ הן ריאות pneumonectomy ריאות מודלים השתלת עכבר פרוטה.
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
הפונקציה הבסיסית של הריאה היא החלפת חמצן דו תחמוצת הפחמן בין כלי הדם לבין האווירה. מחלות ריאות כגון bronchopulmonary dysplasia (BPD), מחלת ריאות חסימתית כרונית (COPD) ודלקות בדרכי הנשימה חריפות, גורמות לירידת ערך 2 . חוקרים שחקרו מחלת ריאה פיתחו מספר שיטות כמותיות להערכת שינויים מורפולוגיים בריאות, כולל MLI, ILV, מספר יחידות חילופי גז, השב"כ, תאימות רקמות ריאה 2 , 3 . מחקרים חלוציים על ידי Weibel et al. 4 ו Duguid et al. 5 יחד נקבע כי ISA יכול לשמש כמדד ישיר של קיבולת גז ריאות החליפין בריאות האדם יכול לשמש כקריטריון כדי לקבוע חומרת נפחת. מספר מחקרים שפורסמו בחמש השנים האחרונות השתמשו בפרמטרים מורפולוגיים בריאה ( למשל, ISA ו MLI) כדי להעריך שינויים מורפולוגיים ופונקציונליים הריאות של עכברים במהלך הפיתוח 6 במהלך ההתאוששות מן הפציעה PNX 1 , 7 . ISA מחושב באמצעות משוואה 1 8 , 9 :
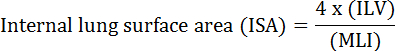
, כאשר ILV הוא נפח הריאות הפנימי ו- MLI הוא פרמטר ביניים המייצג את מרחב המרחב האווירי הריאתי 10 .
PNX, הסרה כירורגית של אונות ריאה אחת או יותר, דווחה באופן נרחב על חידוש התחדשות של מינים רבים, כולל בני אדם 11 , עכברים 1 , כלבים 12 , חולדות 13 , וארנבות 14 , 15 . חתיךY של עכברים הריאות ב ארבעה עשר ימים לאחר PNX הראו כי הן התרחבות של הקיים מראש alveoli ואת היווצרות דה נובו של alveoli לתרום לשיקום של השב"כ, ILV, ומספר alveoli ברקמות הריאה הנותרים 1 . אנחנו ואחרים הראו כי החדרת חומרים כגון ספוג, שעווה, או בצורת תותבת מותאמת אישית לתוך חלל החזה ריק הבא PNX ( כלומר , השתלת תותבת) פוגעת התחדשות אבולרית. עכשיו הוא הקים היטב כי כוח מכני פונקציות כאחד הגורמים החשובים ביותר ליזום התחדשות בשן 1 , 16 , 17 . מחקרים אלה הדגישו את האפקטיביות של השימוש בערכים של ISA מ ריאות שטופלו ב- PNX ו-מושתלים-ריאות כקריטריון להערכה כמותית של התחדשות אלואולרית.
הטיה משקיף ידוע להשפיע באופן משמעותי vaLues עבור פרמטרים מורפולוגיים ריאה ( למשל , MIL ו ILV). פרוטוקולים סטנדרטיים יכולים לשמש כדי למנוע הטיה זו בקביעת ILV ו- MLI, שהם שני הפרמטרים המשמשים בחישוב השב"כ. כאן, אנו מספקים פרוטוקולים מאוד מפורט, סטנדרטי למדידת פרמטרים אלה הריאה. חשוב לציין, היכולת לכמת במדויק את השב"כ מבטיח לשפר את האמינות ואת שחזור של מחקרים על תפקוד הריאות במודלים התחדשות פציעה שנגרמו על ידי פציעה צריך להקל על גילויי מכני במחלות ריאה מרובים.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הנהלים המשמשים בפרוטוקול זה בוצעו בהתאם להמלצות הקווים המנחים לטיפול ושימוש בחיות מעבדה של המכון הלאומי למדעי הביולוגיה בבייג'ינג. 8 שבועות בן CD-1 עכברים זכר שוכנו מתקן פתוגן ללא תשלום (SPF) חינם עד הניסויים נערכו. ניתוחים בוצעו באמצעות עכברים מורדמים לחלוטין ( כלומר , ללא תגובות קמצוץ הבוהן). לאחר הניתוח, עכברים נשמרו בחדר חם ולח, עם מספיק מזון ומים מתוקים. עכברים הוקרב באמצעות מנת יתר של הרדמה נמסר על ידי הזרקה intraperitoneal.
1. עכבר PNX כירורגיה
- להרדים לחלוטין את העכברים עם נתרן phenobarbital (120 מ"ג / ק"ג משקל גוף) ו buprenorphine (0.1 מ"ג / ק"ג משקל גוף) באמצעות הזרקת intraperitoneal (IP). בצע ניתוח כאשר עכברים לא מגיבים עוד צביטה הבוהן.
- הסר את השיער על החזה השמאלי של העכברים עם dep כימי(3 × 3 ס"מ שטח 2 ).
- מאובטח כל עכבר על פלטפורמת אינטובציה עם הצד הגחון שלה מול המפעיל ( איור 1 א ).
- לשלוף את הלשון העכבר להאיר את מיתרי הקול עם laryngoscope חיה קטנה המכילה חריץ להנחיית קטטרים 18 ( איור 1 א ).
- להבדיל את מיתרי הקול על ידי התבוננות תנועות של מיתרי הקול במהלך הנשימה. הכנס בעדינות 20 אינפוזיה צינורית תוך וריידית לתוך קנה הנשימה בזווית הקדמית 19 .
- מקום עכברים בתנוחה ישרה לרוחב ימין לחבר את הצינורית למכונת הנשמה מכני ( למשל, לחץ מבוקרת, לראות את לוח החומרים ). בדוק את הכניסה של הצינור לתוך קנה הנשימה על ידי התבוננות בתנועות נשימה של החזה העכבר ( איור 1 ב ).
- הגדר את הלחץ ההשראה oF המאוורר עד 12 ס"מ H 2 O ולהגדיר את קצב הנשימה עד 120 נשימות לדקה ( איור 1 ב ).
- לטהר את העור באזור כירורגי עם betadine ו 70% אתנול.
- הפוך 2 - חתך בית החזה 3 ס"מ posterolateral במרחב בחלל 5 th צלעי, לחתוך דרך העור והשרירים עם נויס האביב מספריים (חיתוך קצה: 14 מ"מ; קצה בקוטר: 0.275 מ"מ) (איור 2B, C). כירורגי מכשירים המשמשים הליך thoracotomy הם מעוקרים לפני השימוש.
- ביצוע חתך 1.5 ס"מ על שטח צלעי 5 th לחשוף את הריאה השמאלית (איור 2 ד, ה). במהלך הניתוח, יש להשתמש בקוטריזר בטמפרטורה גבוהה כדי להפסיק את הדימום.
- הרם שליש מהאונה הריאה השמאלית מהחזה עם מלקחיים קצה קהה ( איור 2F ), ולאחר מכן להשתמש במקלון צמר גפן כדי למשוך את כל שמאלריאות ( איור 2G ).
- לזהות את העורק הריאתי ואת ברונכי של האונה הריאות השמאלית ( איור 2G ).
- חזק לקשור את הסמפונות ואת כלי בשעה הילום עם תפר משי כירורגי לחתוך את האונה הריאות השמאלית ב 3-4 מ"מ מן קשירת ( איור 2H , I ).
הערה: היזהר לא לנתק את הקשרים תפר על הילום השמאלי, אשר יכול לגרום pneumothorax ( כלומר , אוויר או גז בחלל של בית החזה) . - סגור את קיר החזה עם תפר 1, ולאחר מכן לתפור את שכבת השרירים ואת שכבת העור ברצף, באמצעות 5 - 6 התפרים קטע. השאירו 3 - 4 מ"מ הפער בין כל תפר ( איור 2M , 2N ).
הערה: לשמור על מחט תפר כירורגי הרחק מהלב; ניקוב לב לא מכוון עלול לגרום למוות מיידי. - לחטא את האזור כירורגית עם יוד פובידון.
- לאחר מכןR המבצע כירורגי, מניחים את העכבר על כרית תרמית 38 ° C ולחבר את העכבר למכונת ההנשמה עד תנועות נשימה ספונטניות להתחיל ( איור 2O ).
2. השתלת תותב
- בצע את השלבים 1.1 - 1.13 של הליך PNX (כלומר, עד לנקודה שבה האונה הריאה השמאלית של העכבר מוסר).
- מהדק את מרכז סיליקון פרוטזה (הלקוח עשה, 12 מ"מ אורך, עובי 3 מ"מ, 7 מ"מ רוחב, 0.2 גרם, אליפסואידים צורה) באמצעות מלקחיים קהה ( איור 2J ). לעקר פרוטזה סיליקון לפני הכניסה.
- החזק את הצלע עם מלקחיים ביד אחת לחשוף את חלל החזה, ולאחר מכן להכניס את הפרתזה לתוך חלל בית החזה ריק עם יד אחרת.
הערה: זווית ההכנסה הוא כ 45 מעלות בין המטוס הקדמי של תותבת לבין משטח החזה ( איור 2K ,L). להיות עדין מאוד בעת הכנסת תותבת. כוח מופרז יגרום לקרע pleural. - התאם את הכיוון של תותבת עם מלקחיים קהה על מנת להבטיח כי תותבת תופסת את חלל בית החזה ריק.
- בצע את שלבים 1.14 - 1.16 של הליך PNX העכבר.
3. מדידת ILV
- הכן התקן מותאם אישית ("צינור אינפלציה") המורכב מבוכנה שהוסרה מ פיפטה סרולוגית חד פעמית (10 מ"ל), צינור 40 ס"מ גמיש ארוך עם מתאם מחט, שסתום בקרת קצב הזרימה, 18 מחט G. לאחר הרכבה, לאבטח את פיפטה על לוח עם קלטת ( איור 3 א ). המרחק בין החלק העליון של פיפטה הספסל הניסוי חייב להיות לפחות 30 ס"מ.
- הכן טריים 4% paraformaldehyde (PFA) פתרון קיבוע על ידי המסת 20 גרם PFA ב 500 מ"ל מראש מחומם 1x פוספט שנאגרו מלוחים (PBS) ב 55 מעלות צלזיוס אמבטיה, רועדת ידנית עלCe כל 10 דקות עד הפתרון ברור. לאחר הקירור לטמפרטורת החדר, לסנן את הפתרון עם מסנן 0.45 מיקרומטר.
זהירות: ללבוש ציוד מגן אישי מתאים (PPE) בעת טיפול ב- PFA. - להקריב עכברים עם הזרקה מנת יתר של הרדמה (0.8% phenobarbital נתרן, 1,000 U / mL הפרין).
- מאובטח כל עכבר על צלחת לנתיחה פוליסטירן לרסס אותו עם אלכוהול 70%.
- בזהירות לפתוח את החזה העכבר לחתוך את עצם החזה באמצעות מספריים כדי לחשוף ביסודיות את אונות הריאות.
- הסר רקמות מוגזמות באמצעות מספריים לחשוף את קנה הנשימה. הקפד להפריד את קנה הנשימה מן הוושט.
- חותכים את אבי העורקים הבטן ומוסיפים מחט 25-מד לתוך החדר הימני של הלב; לחבר את המחט מזרק 20 מ"ל לפני הכניסה זו. לאט לאט לדחוף 1x PBS לתוך הלב כדי להסיר את תאי הדם עד הריאות להפוך לבן. בדרך כלל, 5-10 מ"ל PBS נדרש לנקות את כלי הדם הריאתיים.
- מלא את הדואר מותאם אישית צינור אינפלציה עם 4% טריים PFA ולהסיר את כל הבועות מן צינור האינפלציה.
- הכנס את המחט 18-מד של צינור האינפלציה לתוך קנה הנשימה ואת קליפ קנה הנשימה עם קליפים כלי כדי למנוע דליפת נוזל.
- לנפח ריאות עם PFA 4% בלחץ transpulmonary קבוע של 25 ס"מ / H 2 O 2 , 20 . דגירה את הריאות בטמפרטורת החדר למשך 2 שעות כדי להשיג ריאות מורחבת באופן מלא. זה "מראש לתקן" צעד קריטי לשימור מורפולוגיה ריאות.
- על ידי ניטור צינור האינפלציה, לרשום את הערך של נפח PFA 4% הראשונית ולהקליט את נפח הסופי. נפח הריאות הפנימי שווה נפח PFA 4% הראשונית פחות נפח PFA הסופי 4%.
- לקשור את קנה הנשימה באמצעות מספריים, בעדינות לנתח את הריאות (שמירה על הריאות שלם) מן הרקמות החיבור הסובבים. להיות עדין מאוד כדי למנוע נזק לריאות.
- אינקולהכות את הריאות בצינור חרוטי 50 מ"ל מלא PFA 4% עבור 12 שעות ב 4 ° C עם רעד עדין על שייקר (50 סל"ד). המשך לעיבוד רקמות וכתמים (ראה סעיף 4).
4. רקמה Embedding, חתך, ו Hematoxylin & Eosin (H & E) מכתים
- לאחר קיבוע, השתמש Noyes האביב מספריים כדי לקצץ את הלב ואת רקמת החיבור מוגזם מן הריאות. בעדינות להפריד את אונות הריאה הפרט על ידי ניתוק הסמפונות שמחבר את אונות הריאות אל קנה הנשימה.
- לשטוף את אונות הריאה באופן נרחב 3 - 4 פעמים 50 מ"ל 1x PBS (30 דקות / לשטוף) על שייקר מסלולית (50 סל"ד).
- לאחר לשטוף הסופי, cryoprotect את אונות הריאה על ידי טבילה אותם פתרון סוכרוז 30% (ב 1x PBS) ב 4 ° C עד הכיור רקמות לתחתית צינורות 50 מ"ל חרוטי (כ 12 שעות).
- לפני הטבעה cryosectioning הרקמות, להסיר את דגימות אונה הריאות מן הצינורות עם מלקחיים, לשמור על accesסורי אונות לניתוח היסטולוגית, dab הפתרון הנותר סוכרוז מפני השטח של דגימות האונה אביזר, ולאחר מכן לטבול ביסודיות את המדגם לתוך צלחת פטרי המכיל אופטימלית טמפרטורת חיתוך (OCT) המתחם במשך כ 30 דקות.
- להקפיא את OCT- מוטבע אביזר דגימות האונה חנקן נוזלי באמצעות cryomolds. מקם את פני השטח הגדול ביותר של האונה במקביל לתחתית של התבנית.
- הכן סך של שלושה 10 מיקרומטר עבה חלקים עבור כל מדגם במהלך cryosectioning לניתוח היסטולוגית. מחק הראשון 1 מ"מ של רקמות, לאסוף סעיף 10 מיקרומטר עבה, למחוק 0.5 מ"מ של רקמות, לאסוף קטע אחר, להשליך 0.5 מ"מ של רקמות, ולאסוף את החלק השלישי (הסופי).
- האוויר יבש את הסעיפים עבור 1 שעות לפני ביצוע מכתים H & E.
- ביצוע מכתים H & E
- לשטוף את הסעיפים 3-4 שינויים של מי ברז ולאחר מכן הכתם את הסעיפים hematoxylin טריים במשך 2 דקות; שוטפים את החלק מתחת למים זורמים; לטבול את הקטע שתי פעמים ב 1% HCl-70% פתרון אתנול להסיר hematoxylin עודף.
- הכתם בסעיף eosin טריים במשך 3 דקות; לייבש את הסעיפים עם שני רצופים 30 s שוטף באתנול 95% ושני 30 s שוטף עם 100% אתנול; לנקות את החלקים ב xylene עבור 30 s, לחזור על שלב ניקוי פעם קסילן טרי; הר שקופיות עם המדיום גובר באמצעות coverslips זכוכית.
5. כימות של MLI
- לרכוש תמונות דיגיטליות של H & E כתמים אביזר קטעים (הגדלה 20X) באמצעות מיקרוסקופ שדה בהיר.
- כדי לכמת את MLI, בחר סך של 15 תצוגות לא חופפות (1,000 מיקרומטר x 1000 מיקרומטר) באופן אקראי מן האזורים המתאימים (ללא עורקים וורידים, דרכי הנשימה הגדולות, צינוריות alveolar) של 3 חלקים.
- מניחים רשת עם 10 שורות אנכיות מבוזרות באופן שווה ו -10 קווי אופקי מופצים באופן שווה של len מוגדרGth (1000 מיקרומטר) על האזורים הנבחרים של תצוגה באמצעות כלי סרגל; כל שורה הוא ובכך רווח 100 מיקרומטר בנפרד ( איור 4 ב ).
- הגדר את הערך של אחד ליירט כמו אורך ליניארי בין שני epithelia alvolar סמוך. למדוד את הערכים של כל מיירט לאורך כל קו אורך 1000 מיקרומטר.
- עבור כל רשת, לכמת את הערכים של כל intercepts בין 10 אופקית 1000 שורות אורך מיקרומטר 10 אנכי 1000 מיקרומטר שורות אורך.
הערה: ה- MLI הוא הערך הממוצע של אורכי היורט מתוך סך של 15 רשתות המנותחות מתוך שלושת החלקים שהוכנו עבור כל אחת מאונות האביזרים.
6. חישוב הרשות
- חישוב השב"כ באמצעות משוואה 1 (ראה מבוא ). ראו סעיף 3 למדידת ILV, והתייחסו לסעיף 5 לכימות של מכון מנדל למנהיגות.
Access restricted. Please log in or start a trial to view this content.
תוצאות
ביצענו כאן ניסוי עם PNX שטופלו הקבוצה השתלת תותבת (Prosthesis-implanted) קבוצה. קבוצות אלה זהות לקבוצות ששימשו במחקר שפורסם בעבר מקבוצת המחקר 14 שלנו.
PENX העכבר ואת פרוצדזה ההשתלה נהלים מוצג...
Access restricted. Please log in or start a trial to view this content.
Discussion
בפרוטוקול זה, אנו מספקים תיאורים מפורטים על המדידה של פרמטרים ריאתיים לאחר העכבר השמאלי PNX ריאות השתלת תותבת. השב"כ נחשב כיום כמדד מרכזי להערכת תפקוד הנשימה במחלות ריאות רבות ובשיקום התחדשות השחלות המושרה. עם זאת, אף על פי שקהילת המחקר הריאתי מסכימה על תועלתה של הר?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מבקשים להודות המכון הלאומי למדעי הביולוגיה, בייג 'ין על הסיוע. עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של בייג'ינג (מס 'Z17110200040000).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
References
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. Morphometry of the Human Lung. , Springer-Verlag. Berlin Heidelberg. (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved