Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Стандартизованный метод измерения внутренней площади поверхности легких с помощью мышечной пневмоэнцетомии и имплантации протезов
В этой статье
Резюме
Внутренняя площадь поверхности легких (ISA) является критическим критерием для оценки морфологии и физиологии легких при заболеваниях легких и вызванной травмой альвеолярной регенерации. Мы описываем здесь стандартизованный метод, который может минимизировать смещение измерения для ISA в моделях мышиной пневмоэктомии и имплантации протезов.
Аннотация
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Введение
Фундаментальной функцией легкого является обмен кислорода и углекислого газа между кровеносными сосудами и атмосферой. Болезни легких, такие как бронхолегочная дисплазия (БЛД), хроническая обструктивная болезнь легких (ХОБЛ) и острые респираторные инфекции, приводят к снижению ИСА 2 . Исследователи, изучающие болезнь легких, разработали несколько количественных методов для оценки морфологических изменений в легких, включая MLI, ILV, количество единиц газообмена, ISA и соответствие ткани легких 2 , 3 . Пионерские исследования Weibel et al. 4 и Duguid et al. 5 вместе установили, что ISA может использоваться как прямая мера способности газообмена легких в легких человека и может использоваться в качестве критерия для определения тяжести эмфиземы. В ряде исследований, опубликованных за последние пять лет, были использованы морфологические параметры легких ( например, ISA и MLI) для оценки морфологических и функциональных изменений в легких мышей во время развития 6 и во время восстановления после травмы PNX 1 , 7 . ISA рассчитывается с использованием уравнения 1 8 , 9 :
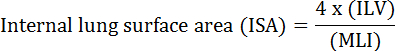
, Где ILV представляет собой внутренний объем легких, а MLI является промежуточным параметром, который представляет собой размер 10 периферического воздушного пространства легких.
Известно, что PNX, хирургическое удаление одной или нескольких легочных долей, индуцирует альвеолярную регенерацию у многих видов, включая людей 11 , мышей 1 , собак 12 , крыс 13 и кроликов 14 , 15 . Шпилькау мышей легких в течение четырнадцати дней после PNX показали , что как расширение уже существующих альвеол и формирование De Novo альвеол способствуют восстановлению ISA, РКН, а число альвеол в остальных тканях легкого 1. Мы и другие показали, что введение таких материалов, как губка, воск или протез произвольной формы в пустую грудную полость после PNX ( т. Е. Имплантацию протеза) ухудшает альвеолярную регенерацию. В настоящее время твердо установлено, что механическая сила функционирует как один из наиболее важных факторов для инициирования альвеолярной регенерации 1 , 16 , 17 . В таких исследованиях была подчеркнута эффективность использования значений ИСА из обработанных PNX и имплантированных протезами легких в качестве критерия количественной оценки альвеолярной регенерации.
Известно, что смещение наблюдателя оказывает значительное влияние на измеренные значения vaСифилиса для морфологических параметров легких ( например , MIL и ILV). Стандартизированные протоколы могут использоваться для устранения этого смещения при определении как ILV, так и MLI, которые являются двумя параметрами, используемыми при расчете ISA. Здесь мы предоставляем очень подробные, стандартизированные протоколы для измерения этих параметров легких. Важно отметить, что способность точно оценивать ISA обещает повысить надежность и воспроизводимость исследований функции легких в моделях альвеолярной регенерации, вызванных травмами, и должна способствовать механистическим открытиям при множественных легочных заболеваниях.
Access restricted. Please log in or start a trial to view this content.
протокол
Все процедуры, используемые в этом протоколе, проводились в соответствии с рекомендациями Руководства по уходу и использованию лабораторных животных Национального института биологических наук в Пекине. 8-недельные мыши-самки CD-1 помещались в специальную патогенную среду (SPF) до проведения экспериментов. Хирургии проводили с использованием полностью обезболивающих мышей ( т. Е. Без каких-либо пинч-ответов). После операции мышей содержали в теплой, влажной комнате с достаточным количеством пищи и пресной воды. Мышей умерщвляли с использованием передозировки анестетика, получаемого внутрибрюшинной инъекцией.
1. Мышиная хирургия PNX
- Полностью обезболивают мышей с фенобарбиталом натрия (120 мг / кг массы тела) и бупренорфином (0,1 мг / кг массы тела) с помощью внутрибрюшинной (IP) инъекции. Выполните операцию, когда мыши больше не реагируют на защемление пальцев.
- Удалите волосы на левой грудной клетке мышей химическим оттиском(Площадь 3 х 3 см 2 ).
- Закрепите каждую мышь на интубационной платформе с ее вентральной стороной, обращенной к оператору ( рис. 1A ).
- Вытяните язычок мыши и осветите голосовые связки небольшим животным ларингоскопом, содержащим выемку для направляющих катетеров 18 ( рис. 1А ).
- Различают голосовые связки, наблюдая движения голосовых связок во время дыхания. Аккуратно вставьте внутривенную интубационную канюлю 20 G в трахею с передним углом 19 .
- Поместите мышей в правое боковое лежачее положение и соедините канюлю с механическим вентилятором ( например, с контролем давления, см. Таблицу материалов ). Проверьте вставку канюли в трахею, наблюдая за дыхательными движениями сундука для мыши ( рис. 1B ).
- Установите давление вдоха oF вентилятор до 12 см H 2 O и установите скорость дыхания до 120 вдохов в минуту ( рис. 1B ).
- Дезактивируйте кожу в хирургической области бетадином и 70% этанолом.
- Сделайте 2-3-сантиметровый разрез грудной торакотомии в пространстве на 5- м межреберном пространстве, прорезь через кожу и мышцы с помощью Ножницы Весенние ножницы (режущая кромка: 14 мм, диаметр наконечника: 0,275 мм) ( рисунок 2В , С ). Хирургические инструменты, используемые для процедуры торакотомии, стерилизуются перед использованием.
- Сделайте разрез 1,5 см на 5- м межреберье, чтобы выставить левое легкое ( рис. 2D , E ). Во время работы используйте высокотемпературный прижигатель, чтобы остановить кровотечение.
- Поднимите одну треть левой легочной доли от сундука с помощью тупых щипцов ( рис. 2F ), а затем используйте ватный тампон, чтобы вытащить весь левыйЛегких ( фиг. 2G ).
- Определите легочную артерию и бронхи левой легочной доли ( рис. 2G ).
- Плотно лигируйте бронхи и сосуды в hilum с помощью шелкового хирургического шва и вырежьте левый левый лепесток на 3 - 4 мм от лигирования ( рис. 2H , I ).
ПРИМЕЧАНИЕ. Будьте осторожны, чтобы не обрезать узлы швов на левом холме, что может вызвать пневмоторакс ( т. Е. Воздух или газ в полости грудной клетки) . - Закройте грудную стенку 1 швом, а затем последовательно выровняйте мышечный слой и слой кожи, используя 5-6 прерывистых швов. Оставьте промежуток 3 - 4 мм между каждым швом ( рисунок 2M , 2N ).
ПРИМЕЧАНИЕ. Держите хирургическую иглу шва от сердца; Непреднамеренная сердечная пункция приведет к немедленной смерти. - Дезинфицируйте хирургическую зону повидон-йодом.
- AfteВ хирургической операции поместите мышь на термопластическую панель на 38 ° C и подключите мышь к вентилятору, пока не начнутся самопроизвольные дыхательные движения ( рисунок 2O ).
2. Имплантация протеза
- Выполните шаги 1.1-1.13 процедуры PNX (то есть до момента, когда левая левая доля мыши удалена).
- Закрепите центр силиконового протеза (заказчика, 12 мм в длину, 3 мм в толщину, 7 мм в ширину, 0,2 г, эллипсоидальной формы) с использованием тупых щипцов ( рис. 2J ). Перед вставкой стерилизовать силиконовый протез.
- Держите ребро с помощью щипцов одной рукой, чтобы выставить грудную полость, а затем вставьте протез в левую пустую грудную полость другой рукой.
ПРИМЕЧАНИЕ. Угол введения составляет приблизительно 45 градусов между фронтальной плоскостью протеза и грудной поверхностью ( рисунок 2K ,L). Будьте очень осторожны при вставке протеза. Чрезмерная сила приведет к разрыву плевры. - Отрегулируйте ориентацию протеза тупыми щипцами, чтобы протез занимал левую пустую грудную полость.
- Выполните шаги 1.14 - 1.16 процедуры PNX мыши.
3. Измерение ILV
- Подготовьте специальное устройство («инфляционную трубку»), состоящее из плунжера, удаляемого из одноразовой серологической пипетки (10 мл), гибкой трубки длиной 40 см с адаптером для иглы, регулирующего клапана расхода и иглы 18 G. После сборки закрепите пипетку на доске лентой ( рис. 3A ). Расстояние между вершиной пипетки и экспериментальной скамье должно составлять не менее 30 см.
- Подготовьте свежий раствор для фиксации 4% параформальдегида (PFA) путем растворения 20 г PFA в 500 мл предварительно нагретого 1x забуференного фосфатом физиологическом растворе (PBS) на водяной бане с температурой 55 ° C, встряхивая вручнуюКаждые 10 мин, пока раствор не станет прозрачным. После охлаждения до комнатной температуры фильтруйте раствор с помощью фильтра 0,45 мкм.
ПРЕДОСТЕРЕЖЕНИЕ: При обращении с PFA используйте соответствующие средства индивидуальной защиты (СИЗ). - Жертвенные мыши с передозировкой инъекции анестетика (0,8% фенобарбитала натрия, 1000 ед. / Мл гепарина).
- Закрепите каждую мышь на пластине для вскрытия полистирола и распылите ее на 70% спирта.
- Осторожно откройте мышь и вырежьте грудную клетку, используя ножницы, чтобы полностью обнажить легочные дольки.
- Удалите чрезмерную ткань, используя ножницы, чтобы выставить трахею. Обязательно отделите трахею от пищевода.
- Обрежьте брюшную аорту и вставьте иглу 25 калибра в правый желудочек сердца; Перед иглой присоедините иглу к 20 мл шприцу. Медленно подталкивайте 1x PBS в сердце, чтобы удалить клетки крови, пока легкие не станут белыми. Обычно для очистки легочных кровеносных сосудов требуется 5-10 мл PBS.
- ЗаполнитеИзготовленную по индивидуальному заказу инфузионную трубку с 4% свежего PFA и удалить все пузырьки из трубки для накачивания.
- Вставьте иглу 18-миллиметровой инфузионной трубки в трахею и закрепите трахею с помощью зажимов для сосудов, чтобы избежать утечки жидкости.
- Вздуйте легкие с 4% PFA при постоянном транспульмональном давлении 25 см / H 2 O 2 , 20 . Инкубируйте легкие при комнатной температуре в течение 2 ч для достижения полностью расширенных легких. Этот шаг «предварительной фиксации» имеет решающее значение для сохранения морфологии легких.
- Контролируя тюбик инфляции, запишите значение начального 4% объема PFA и запишите окончательный объем. Внутренний объем легких равен начальному объему PFA 4% минус окончательный объем PFA 4%.
- Лигируйте трахею и используя ножницы, аккуратно рассекайте легкие (сохраняя легкие в неповрежденном состоянии) из окружающих соединительных тканей. Будьте очень осторожны, чтобы не повредить легкие.
- INCUBate легкие в 50-миллилитровой конической трубке, заполненной 4% PFA в течение 12 ч при 4 ° C, с осторожным встряхиванием на шейкере (50 об / мин). Продолжайте обрабатывать и окрашивать ткани (см. Раздел 4).
4. Вложение тканей, секционирование и окрашивание гематоксилином и эозином (H & E)
- После фиксации используйте ножницы Noyes Spring Scissors для обрезания сердца и чрезмерных соединительных тканей с легких. Аккуратно отделите отдельные легочные лепестки, отрезав бронх, который соединяет легочные доли с трахеей.
- Экстенсивно мыть легочные доли 3 - 4 раза в 50 мл 1x PBS (30 мин / промывка) на орбитальном шейкере (50 об / мин).
- После окончательной промывки криопротектор легочных долей, погружая их в 30% -ный раствор сахарозы (в 1х PBS) при 4 ° C, пока ткань не опустится до нижней части 50-миллилитровых конических пробирок (приблизительно 12 часов).
- Перед встраиванием и криоселекцией тканей удалите образцы легких из труб с помощью щипцов, сохраните ихДолей для гистологического анализа, удалите оставшийся раствор сахарозы с поверхности образцов вспомогательных лепестков, а затем тщательно погрузите образец в чашку Петри, содержащую оптимальное значение температуры резания (OCT) в течение примерно 30 мин.
- Заморозьте образцы вспомогательных лепестков OCT в жидком азоте, используя криомодели. Расположите наибольшую площадь поверхности лопасти параллельно дну формы.
- Подготовьте в общей сложности три участка толщиной 10 мкм для каждого образца во время криосекции для гистологического анализа. Отбросьте первые 1 мм ткани, соберите один участок толщиной 10 мкм, выбросьте 0,5 мм ткани, соберите еще одну секцию, выбросьте 0,5 мм ткани и соберите третью (конечную) секцию.
- Воздух высушите секции в течение 1 часа перед нанесением окрашивания H & E.
- Выполнение окрашивания H & E
- Промойте секции в 3 - 4 изменениях водопроводной воды, а затем окрасьте участки в свежий гематоксилин в течение 2 мин; Промыть участок под проточной водопроводной водой; Погрузите секцию два раза в 1% раствор HCl-70% этанола для удаления избытка гематоксилина.
- Окрасить участок свежим эозином в течение 3 мин; Обезвоживают секции с помощью двух последовательных 30-секундных промывок в 95% этаноле и двух 30-секундных промывках со 100% этанолом; Очистить секции в ксилоле в течение 30 с, повторить этап очистки один раз в свежем ксилоле; Монтируйте слайды с монтажной средой, используя покровные стекла.
5. Количественная оценка MLI
- Приобретайте цифровые изображения разделенных на H & E секций вспомогательных лепестков (увеличение 20X) с помощью микроскопа с ярким полем.
- Чтобы количественно определить MLI, выберите в общей сложности 15 неперекрывающихся представлений (1000 мкм х 1000 мкм) из подходящих областей (без артерий и вен, основных дыхательных путей и альвеолярных каналов) из трех секций.
- Поместите сетку с 10 равномерно распределенными вертикальными линиями и 10 равномерно распределенными горизонтальными линиями определенной длиныGth (1000 мкм) на выбранных областях с помощью инструмента линейки; Каждая линия, таким образом, расположена на расстоянии 100 мкм ( рис. 4B ).
- Определите значение одного перехвата как линейную длину между двумя соседними альвеолярными эпителиями. Измерьте значения всех перехватов вдоль каждой линии длины 1000 мкм.
- Для каждой сетки количественно оценивайте значения всех перехватов между 10 горизонтальными линиями длины 1000 мкм и 10 вертикальными линиями длины 1000 мкм.
ПРИМЕЧАНИЕ. MLI представляет собой среднее значение длины перехвата из 15 сеток, проанализированных из трех разделов, подготовленных для каждой из вспомогательных долей.
6. Расчет ISA
- Вычислить ISA, используя уравнение 1 (см. Введение ). См. Раздел 3 для измерения ILV и обратитесь к разделу 5 для количественной оценки MLI.
Access restricted. Please log in or start a trial to view this content.
Результаты
Мы провели здесь эксперимент с группой, обработанной PNX, и имплантацией протеза (имплантированной протезом). Эти группировки такие же, как и группы, использованные в ранее опубликованном исследовании нашей исследовательской группы 14 .
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этом протоколе мы приводим подробные описания измерения легочных параметров после введения легкого PNX и имплантации протеза. МСА теперь считается ключевым показателем для оценки функции дыхания при многих заболеваниях легких и вызванной травмой альвеолярной регенерации. Однако, х?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Национальный институт биологических наук, Пекин за помощь. Эта работа была поддержана Муниципальным научным фондом Пекина (№ Z17110200040000).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Ссылки
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. Morphometry of the Human Lung. , Springer-Verlag. Berlin Heidelberg. (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены