Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine standardisierte Methode zur Messung der inneren Lungenoberfläche über Maus Pneumonektomie und Prothesenimplantation
In diesem Artikel
Zusammenfassung
Die interne Lungenoberfläche (ISA) ist ein kritisches Kriterium für die Beurteilung der Lungenmorphologie und der Physiologie bei Lungenkrankheiten und der verletzungsinduzierten alveolären Regeneration. Wir beschreiben hier eine standardisierte Methode, die die Messvorspannung für ISA sowohl in der Lungenpneumonektomie als auch in den Prothesenimplantationsmausmodellen minimieren kann.
Zusammenfassung
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Einleitung
Die Grundfunktion der Lunge ist der Austausch von Sauerstoff und Kohlendioxid zwischen Blutgefäßen und der Atmosphäre. Lungenerkrankungen wie bronchopulmonale Dysplasie (BPD), chronisch obstruktive Lungenkrankheit (COPD) und akute Atemwegsinfektionen führen zu einer verminderten ISA 2 . Forscher, die Lungenkrankheit studieren, haben mehrere quantitative Methoden entwickelt, um morphologische Veränderungen in den Lungen, einschließlich MLI, ILV, Anzahl der Gasaustauscheinheiten, ISA und Lungengewebe Compliance 2 , 3 zu bewerten. Pionierstudien von Weibel et al. 4 und Duguid et al. 5 zusammen festgestellt, dass ISA als direkte Maßnahme der Lungengasaustauschkapazität in menschlichen Lungen verwendet werden kann und als Kriterium für die Bestimmung des Emphysemschweregrads verwendet werden kann. Eine Reihe von Studien, die in den letzten fünf Jahren veröffentlicht wurden, verwendeten Lungen-morphologische Parameter ( z. ISA und MLI) zur Beurteilung morphologischer und funktioneller Veränderungen in der Lunge von Mäusen während der Entwicklung 6 und während der Erholung von Verletzungen PNX 1 , 7 . ISA wird nach Gleichung 1 8 , 9 berechnet:
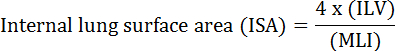
, Wobei ILV das interne Lungenvolumen ist und MLI ein Zwischenparameter ist, der die pulmonale periphere Luftraumgröße 10 darstellt .
PNX, die chirurgische Entfernung von einem oder mehreren Lungenlappen, wurde weithin berichtet, um eine alveoläre Regeneration bei vielen Spezies, einschließlich der Menschen 11 , Mäuse 1 , Hunde 12 , Ratten 13 und Kaninchen 14 , 15 zu induzieren. Ein BolzenY von Mäusen Lungen an vierzehn Tagen nach PNX zeigte, dass sowohl die Erweiterung der bereits bestehenden Alveolen und die de novo Bildung von Alveolen zur Wiederherstellung von ISA, ILV und die Anzahl der Alveolen in den verbleibenden Lungengewebe 1 beitragen. Wir und andere haben gezeigt, dass die Einfügung von Materialien wie Schwamm, Wachs oder einer kundenspezifischen Prothese in die leere Thoraxhöhle nach PNX ( dh Prothesenimplantation) die Alveolenregeneration beeinträchtigt. Es ist nun fest etabliert, dass die mechanische Kraft als einer der wichtigsten Faktoren für die Initiierung der Alveolenregeneration 1 , 16 , 17 fungiert . Solche Studien haben die Wirksamkeit der Verwendung von ISA-Werten aus PNX-behandelten und Prothesen-implantierten Lungen als Kriterium zur quantitativen Bewertung der Alveolenregeneration hervorgehoben.
Observer Bias ist bekannt, um signifikante Einfluss gemessen vaFür lungenmorphologische Parameter ( zB MIL und ILV). Standardisierte Protokolle können verwendet werden, um diese Vorspannung bei der Bestimmung sowohl ILV und MLI, die die beiden Parameter bei der Berechnung von ISA verwendet werden, zu vermeiden. Hier stellen wir hoch detaillierte, standardisierte Protokolle zur Messung dieser Lungenparameter zur Verfügung. Wichtig ist, dass die Fähigkeit, ISA genau zu quantifizieren, die Zuverlässigkeit und Reproduzierbarkeit von Studien der Lungenfunktion in verletzungsinduzierten alveolären Regenerationsmodellen zu verbessern und mechanistische Entdeckungen bei multiplen Lungenerkrankungen zu erleichtern.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle in diesem Protokoll verwendeten Verfahren wurden gemäß den Empfehlungen in den Richtlinien für die Pflege und Verwendung von Labortieren des Nationalen Instituts für Biowissenschaften, Peking, durchgeführt. 8 Wochen alte CD-1 männliche Mäuse wurden in einer bestimmten pathogenfreien (SPF) -Funktion untergebracht, bis die Experimente durchgeführt wurden. Operationen wurden unter Verwendung von vollständig anästhesierten Mäusen durchgeführt ( dh ohne Zehen-Quetschantworten). Nach der Operation wurden die Mäuse in einem warmen, feuchten Raum mit ausreichend Nahrung und Süßwasser gehalten. Die Mäuse wurden unter Verwendung einer Überdosierung der Anästhesie, die durch intraperitoneale Injektion geliefert wurde, geopfert.
1. Maus PNX Chirurgie
- Vollständige Betäubung der Mäuse mit Natrium-Phenobarbital (120 mg / kg Körpergewicht) und Buprenorphin (0,1 mg / kg Körpergewicht) über intraperitoneale (IP) Injektion. Chirurgie durchführen, wenn Mäuse nicht mehr auf Zehenkneifen reagieren.
- Haare auf dem linken Thorax der Mäuse mit Chemikalien dep entfernenIlatale Behandlung (~ 3 x 3 cm 2 Fläche).
- Sichern Sie jede Maus auf einer Intubationsplattform mit ihrer ventralen Seite, die dem Bediener zugewandt ist ( Abbildung 1A ).
- Ziehen Sie die Zunge heraus und beleuchten Sie die Stimmbänder mit einem kleinen Tierlaryngoskop, das eine Kerbe zur Führung der Katheter 18 enthält ( Abbildung 1A ).
- Unterscheiden Sie die Stimmbänder, indem Sie die Bewegungen der Stimmbänder beim Atmen beobachten. Legen Sie vorsichtig eine 20 G intravenöse Intubationskanüle in die Trachea an einem vorderen Winkel 19 ein .
- Legen Sie Mäuse in eine rechte seitliche Liegeposition und verbinden Sie die Kanüle mit einem mechanischen Beatmungsgerät ( z. B. druckgesteuert, siehe Tabelle der Materialien ). Überprüfen Sie das Einsetzen der Kanüle in die Trachea, indem Sie die Atembewegungen der Mauskiste beobachten ( Abbildung 1B ).
- Setzen Sie den Inspirationsdruck oF das Ventilator auf 12 cm H 2 O stellen und die Atemfrequenz auf 120 Atemzüge pro Minute einstellen ( Abbildung 1B ).
- Dekontaminieren Sie die Haut im chirurgischen Bereich mit Betadin und 70% Ethanol.
- Führe ein 2 - 3 cm posterolateralen Thorakotomie Inzision in dem Raum am 5. Interkostalraum, geschnitten durch die Haut und Muskeln mit Noyes Feder Schere (Schneidkante: 14 mm; Spitzendurchmesser: 0,275 mm) (2B, C). Chirurgische Instrumente, die für das Thorakotomieverfahren verwendet werden, werden vor der Verwendung sterilisiert.
- Machen Sie einen 1,5 cm langen Schnitt im 5. Intercostalraum die linke Lunge (2D, E) zu belichten. Während des Betriebes einen Hochtemperatur-Kauterisierer verwenden, um das Ausbluten zu stoppen.
- Heben Sie ein Drittel des linken Lungenlappens aus der Brust mit stumpfen Spitzenzangen ( Abbildung 2F ) und verwenden Sie dann einen Wattestäbchen, um die gesamte linke herauszuziehenLunge ( Abbildung 2G ).
- Identifizieren Sie die Pulmonalarterie und Bronchien des linken Lungenlappens ( Abbildung 2G ).
- Ziehen Sie die Bronchien und Gefäße am Hilum mit einer Seidenchirurgie an und ziehen Sie den linken Lungenlappen bei 3 - 4 mm von der Ligation aus ( Abbildung 2H , I ).
HINWEIS: Achten Sie darauf, dass Sie die Nahtknoten am linken Hilum nicht abschneiden, was Pneumothorax ( dh Luft oder Gas in der Kavität des Thorax) verursachen kann . - Schließen Sie die Brustwand mit 1 Naht, und dann sticken Sie die Muskelschicht und die Hautschicht nacheinander, mit 5 - 6 unterbrochenen Nähten. Lassen Sie einen Abstand von 3 - 4 mm zwischen jeder Naht ( Abbildung 2M , 2N ).
HINWEIS: Halten Sie die chirurgische Nahtnadel vom Herzen weg; Unbeabsichtigte Herzpunktion führt zum sofortigen Tod. - Desinfizieren Sie den chirurgischen Bereich mit Povidon-Iod.
- AfteR die chirurgische Operation, platziere die Maus auf eine 38 ° C thermische Pad und verbinden die Maus mit dem Ventilator, bis spontane Atembewegungen beginnen ( Abbildung 2O ).
2. Prothesenimplantation
- Führen Sie die Schritte 1.1 - 1.13 des PNX-Verfahrens durch (dh bis zu dem Punkt, an dem der linke Lungenlappen der Maus entfernt wird).
- Klemmen Sie die Mitte der Silikonprothese (kundenspezifisch, 12 mm in der Länge, 3 mm in der Dicke, 7 mm in der Breite, 0,2 g, Ellipsoid-Form) mit stumpfen Zangen ( Abbildung 2J ). Sterilisieren Sie die Silikonprothese vor dem Einsetzen.
- Halten Sie die Rippe mit einer Pinzette mit einer Hand, um die Thoraxhöhle freizulegen, und legen Sie dann die Prothese in die linke leere Thoraxhöhle mit einer anderen Hand ein.
HINWEIS: Der Einführungswinkel beträgt etwa 45 Grad zwischen der Frontalebene der Prothese und der Thoraxoberfläche ( Abbildung 2K ,L). Sei sehr schonend beim Einsetzen der Prothese. Übermäßige Kraft führt zu Pleuraruptur. - Passen Sie die Ausrichtung der Prothese mit stumpfen Pinzetten an, um sicherzustellen, dass die Prothese die linke leere Thoraxhöhle einnimmt.
- Führen Sie Schritte 1.14 - 1.16 der Maus PNX-Prozedur.
3. Messung von ILV
- Vorbereiten eines kundenspezifischen Gerätes ("Inflationsröhrchen"), das aus einem aus einer Einweg-Seropipette (10 ml) entfernten Stößel besteht, einem 40 cm langen Schlauch mit Nadeladapter, einem Durchflussregelventil und einer 18 G-Nadel. Nach der Montage die Pipette auf einem Brett mit Klebeband befestigen ( Abbildung 3A ). Der Abstand zwischen der Oberseite der Pipette und der Versuchsbank muss mindestens 30 cm betragen.
- Bereiten Sie frische 4% Paraformaldehyd (PFA) Fixierlösung vor, indem Sie 20 g PFA in 500 ml vorgewärmter 1x phosphatgepufferter Kochsalzlösung (PBS) in einem 55 ° C Wasserbad auflösen und manuell schüttelnCe alle 10 min, bis die Lösung klar ist. Nach dem Abkühlen auf Raumtemperatur filtriere die Lösung mit einem 0,45 μm Filter.
ACHTUNG: Bei der Handhabung von PFA geeignete persönliche Schutzausrüstung (PSA) tragen. - Opfer Mäuse mit einer Überdosis Injektion von Anästhetikum (0,8% Phenobarbital Natrium, 1.000 U / ml Heparin).
- Sichern Sie jede Maus auf eine Polystyrol-Dissektion Platte und sprühen Sie sie mit 70% Alkohol.
- Vorsichtig öffnen Sie die Maus Brust und schneiden Sie das Brustbein mit Schere, um die Lungenlappen gründlich auszusetzen.
- Entfernen Sie überschüssiges Gewebe mit einer Schere, um die Trachea freizulegen. Achten Sie darauf, die Trachea aus der Speiseröhre zu trennen.
- Schneide die Bauch-Aorta und stecke eine 25-Gauge-Nadel in den rechten Herzschritt des Herzens ein. Verbinden Sie die Nadel mit einer 20 mL Spritze vor dieser Insertion. Langsam schieben Sie 1x PBS in das Herz, um Blutzellen zu entfernen, bis Lungen weiß werden. Typischerweise sind 5 - 10 ml PBS erforderlich, um die pulmonalen Blutgefäße zu löschen.
- Füllen thE maßgeschneiderte Inflationsröhre mit 4% frischem PFA und entfernen Sie alle Blasen aus dem Aufblasrohr.
- Setzen Sie die 18-Gauge-Nadel des Aufblasrohres in die Trachea ein und klemmen Sie die Trachea mit Gefäßklammern, um Flüssigkeitsverluste zu vermeiden.
- Lungen mit 4% PFA bei konstantem Transpulmonaldruck von 25 cm / H 2 O 2 , 20 auflösen. Inkubieren Sie die Lungen bei Raumtemperatur für 2 h, um vollständig ausgedehnte Lungen zu erreichen. Dieser "Pre-fix" -Schritt ist entscheidend für die Erhaltung der Lungenmorphologie.
- Durch die Überwachung des Aufblasrohres den Wert des ursprünglichen 4% PFA-Volumens aufzeichnen und das Endvolumen aufzeichnen. Das interne Lungenvolumen entspricht dem ursprünglichen 4% PFA-Volumen abzüglich des endgültigen 4% PFA-Volumens.
- Ligate die Trachea und mit Schere, sanft sezieren die Lungen (halten die Lunge intakt) aus umliegenden Bindegewebe. Sei sehr sanft, um die Lunge nicht zu beschädigen.
- IncuDie Lungen in einem 50-ml-konischen Röhrchen, gefüllt mit 4% PFA, für 12 h bei 4 ° C unter leichtem Schütteln auf einem Shaker (50 U / min). Gehen Sie zur Gewebeverarbeitung und -färbung vor (siehe Abschnitt 4).
4. Gewebeeinbettung, Sektionierung und Hämatoxylin & Eosin (H & E) Färbung
- Nach der Fixierung, verwenden Sie Noyes Spring Scissors, um das Herz und übermäßige Bindegewebe aus der Lunge zu trimmen. Die einzelnen Lungenlappen vorsichtig trennen, indem man den Bronchus abschneidet, der die Lungenlappen mit der Trachea verbindet.
- Die Lungenlappen 3 - 4 mal in 50 mL 1x PBS (30 min / waschen) auf einem Orbitalschüttler (50 U / min) abwaschen.
- Nach der abschließenden Wäsche kryoprotect die Lungenlappen durch Eintauchen in eine 30% ige Saccharose-Lösung (in 1x PBS) bei 4 ° C, bis das Gewebe auf den Boden der 50-mL-Kegelrohre sinkt (ca. 12 h).
- Vor dem Einbetten und Kochen der Gewebe, entfernen Sie die Lungenkeulen Proben aus den Rohren mit Pinzette, behalten Sie den ZugangFür die histologische Analyse, die verbleibende Saccharose-Lösung von der Oberfläche der Zubehör-Lappenproben abtupfen und dann die Probe in eine Petrischale, die eine optimale Schneidetemperatur (OCT) -Verbindung enthält, für etwa 30 min eintauchen.
- Gefrieren Sie die OCT-eingebetteten Zubehörlappenproben in flüssigem Stickstoff mit Kryomaten. Positionieren Sie die größte Fläche des Lappens parallel zum Boden der Form.
- Vorbereitung von insgesamt drei 10 μm dicken Abschnitten für jede Probe während der Kryoschaltung für die histologische Analyse. Verwerfen Sie das erste 1 mm Gewebe, sammeln Sie einen 10 μm dicken Abschnitt, entsorgen Sie 0,5 mm Gewebe, sammeln Sie einen anderen Abschnitt, verwerfen Sie 0,5 mm Gewebe und sammeln Sie den dritten (endgültigen) Abschnitt.
- Luft trocknen die Abschnitte für 1 Stunde vor der Durchführung von H & E-Färbung.
- H & E-Färbung durchführen
- Waschen Sie die Abschnitte in 3 - 4 Änderungen des Leitungswassers und färben Sie dann die Abschnitte in frischem Hämatoxylin für 2 min; Spülen Sie den Abschnitt unter laufendem Leitungswasser aus; Tauchen Sie den Abschnitt zweimal in eine 1% ige HCl-70% ige Ethanollösung ein, um überschüssiges Hämatoxylin zu entfernen.
- Färben Sie den Abschnitt in frischem Eosin für 3 min; Dehydrieren die Abschnitte mit zwei aufeinanderfolgenden 30 s-Waschungen in 95% Ethanol und zwei 30-s-Waschungen mit 100% Ethanol; Die Abschnitte in Xylol für 30 s klar, wiederholen Sie den Clearing-Schritt einmal in frischem Xylol; Montieren Sie die Objektträger mit Montagemedium mit Glasdeckel.
5. Quantifizierung von MLI
- Erfassen Sie digitale Bilder der H & E-gefärbten Zubehörlappenabschnitte (20fache Vergrößerung) mit einem hellen Feldmikroskop.
- Um das MLI zu quantifizieren, wählen Sie aus den passenden Bereichen (ohne Arterien und Venen, Hauptluftwege und Alveolarkanäle) aus insgesamt 15 nicht überlappenden Sichten (1.000 μm x 1.000 μm) zufällig.
- Legen Sie ein Gitter mit 10 gleichmäßig verteilten senkrechten Linien und 10 gleich verteilten horizontalen Linien von definierten lenGth (1.000 μm) auf den gewählten Sichtfeldern mit einem Linealwerkzeug; Jede Linie ist somit um 100 μm voneinander beabstandet ( Fig. 4B ).
- Definieren Sie den Wert eines Intercept als lineare Länge zwischen zwei benachbarten Alveolarepithelien. Messen Sie die Werte aller Abschnitte entlang jeder Länge von 1.000 μm.
- Für jedes Gitter quantifizieren Sie die Werte aller Abschnitte zwischen den 10 horizontalen 1.000 μm Längenlinien und den 10 vertikalen 1.000 μm Längenlinien.
ANMERKUNG: MLI ist der Mittelwert der Abschnittslängen von insgesamt 15 Gittern, die aus den 3 Abschnitten analysiert wurden, die für jeden der zusätzlichen Lappen vorbereitet wurden.
6. Berechnung der ISA
- Berechnen Sie die ISA mit Gleichung 1 (siehe Einleitung ). Siehe Abschnitt 3 für die Messung von ILV und siehe Abschnitt 5 zur Quantifizierung von MLI.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Wir haben hier ein Experiment mit einer PNX-behandelten Gruppe und einer Prothesenimplantation (Prothesen-implantierte) Gruppe durchgeführt. Diese Gruppierungen sind die gleichen wie die Gruppierungen, die in einer zuvor veröffentlichten Studie aus unserer Arbeitsgruppe verwendet wurden 14 .
Die Maus-PNX- und Prothesenimplantationsverfahren sind in Abbildung 2 dargestellt
Access restricted. Please log in or start a trial to view this content.
Diskussion
In diesem Protokoll liefern wir detaillierte Beschreibungen über die Messung der pulmonalen Parameter nach der Maus links Lunge PNX und Prothese Implantation. ISA gilt heute als Schlüsselmetrik für die Beurteilung der Atemfunktion bei vielen Lungenerkrankungen und bei der Verletzungsinduzierten alveolären Regeneration. Obwohl die Lungenforschungsgemeinschaft sich über die Nützlichkeit von ISA als nützliche Metrik einverstanden ist, gab es bislang nur wenig die Standardisierung der Messung von ILV und MLI, die bei...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren möchten das National Institute of Biological Sciences, Peking für die Unterstützung anerkennen. Diese Arbeit wurde von Beijing Municipal Natural Science Foundation (Nr. Z17110200040000) unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Referenzen
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. Morphometry of the Human Lung. , Springer-Verlag. Berlin Heidelberg. (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten