Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fare Pnömonektomi ve Protez İmplantasyonu ile İç Akciğer Yüzey Alanının Ölçümü için Standart Bir Yöntem
Bu Makalede
Özet
Akciğer hastalıklarında ve yaralanmaya bağlı alveol rejenerasyonunda akciğer morfolojisi ve fizyolojisini değerlendirmek için iç akciğer yüzey alanı (ISA) kritik bir kriterdir. Burada hem akciğer pnömonektomisinde hem de protez implantasyon fare modellerinde ISA için önyargı önlemeyi en aza indirecek standart bir yöntem açıklanmaktadır.
Özet
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Giriş
Akciğerin temel işlevi, kan damarları ile atmosfer arasındaki oksijen ve karbon dioksit değişimidir. Bronkopulmoner displazi (BPD), kronik obstrüktif akciğer hastalığı (COPD) ve akut solunum yolu enfeksiyonları gibi akciğer hastalıkları, ISA 2 azalmasına neden olur. Akciğer hastalığını araştıran araştırmacılar, MLI, ILV, gaz değişim birimi sayısı, ISA ve akciğer dokusu uyumluluğu 2 , 3 dahil olmak üzere akciğerlerdeki morfolojik değişiklikleri değerlendirmek için çeşitli niceliksel yöntemler geliştirmiştir. Weibel ve ark.nın öncü çalışmaları 4 ve Duguid ve ark. 5 , ISA'nın insan akciğerlerindeki akciğer gaz değişim kapasitesinin doğrudan bir ölçümü olarak kullanılabileceğini ve amfizemin ciddiyetini belirlemek için bir kriter olarak kullanılabileceğini birlikte ortaya koymuştur. Son beş yılda yayınlanan bir dizi çalışma, akciğer morfolojik parametrelerini ( örn. ISA ve MLI) 6 gelişme sırasında ve yaralanma PNX 1 , 7 kurtarma sırasında farelerin akciğerlerinde morfolojik ve fonksiyonel değişiklikleri değerlendirmek için. ISA, Denklem 8 , 9 kullanılarak hesaplanır:
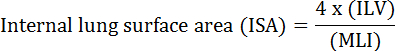
, Burada ILV, iç akciğer hacmi ve MLI, pulmoner periferik hava sahası büyüklüğünü 10 gösteren aracı bir parametredir.
PNX, bir veya daha fazla akciğer lobunun cerrahi olarak çıkarılması, insanlar 11 , fareler 1 , köpekler 12 , sıçanlar 13 ve tavşanlar 14 , 15 dahil olmak üzere birçok türe ait alveol rejenerasyonunu uyardığı yaygın olarak bildirilmiştir. SaplamaOn dört gün sonra fareler, akciğer y sonrası PNX önceden var olan alveoller genişlemesi ve alveollere de novo oluşumu hem ISA, ilv restorasyonu ve kalan akciğer dokularında 1 alveol sayısını katkı göstermiştir. Biz ve diğerleri, PNX'yi takiben boş göğüs boşluğuna sünger, balmumu veya özel şekil verilmiş bir protez gibi materyallerin sokulduğunu ( örn. , Protez implantasyonu) alveol rejenerasyonunu engellediğini gösterdik. Artık mekanik kuvvetin alveol rejenerasyonunu başlatmak için en önemli faktörlerden biri olarak işlev gördüğü tam olarak bilinmektedir 1 , 16 , 17 . Bu tür çalışmalar, alveol rejenerasyonunu kantitatif olarak değerlendirmek için bir kriter olarak PNX ile tedavi edilen ve Protez implante edilen akciğerlerden alınan ISA değerlerinin etkinliğini vurgulamıştır.
Gözlemci önyargılarının ölçülen vayı önemli derecede etkilediği bilinmektedirAkciğer morfolojik parametreleri ( örn. , MIL ve ILV). ISA hesaplamasında kullanılan iki parametre olan hem ILV hem de MLI'yi belirlemede bu önyargıdan kurtulmak için standart protokoller kullanılabilir. Burada, bu akciğer parametrelerini ölçmek için oldukça ayrıntılı ve standartlaştırılmış protokoller sunuyoruz. Daha da önemlisi, ISA'yı doğru bir şekilde ölçebilme özelliği, yaralanmaya bağlı alveolar rejenerasyon modellerinde akciğer fonksiyonlarının güvenilirliğini ve tekrarlanabilirliğini artırmayı ve çoklu pulmoner hastalıklarda mekanik keşifleri kolaylaştırmayı taahhüt eder.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu protokolde kullanılan tüm prosedürler, Pekin Ulusal Biyolojik Bilimler Enstitüsünün Laboratuar Hayvanlarının Bakımı ve Kullanımı için Yönergelerdeki önerilere uygun olarak gerçekleştirildi. 8 haftalık CD-1 erkek fareler, deneyler gerçekleştirilene kadar spesifik bir patojen içermeyen (SPF) tesiste barındırıldı. Ameliyatlar tamamen anestezi uygulanmış fareler kullanılarak gerçekleştirildi (diğer bir deyişle çimdikleme tepkileri olmadan). Ameliyattan sonra fareler yeterli miktarda yiyecek ve tatlı su ile sıcak, nemli bir odada tutuldu. Fareler, intraperitoneal enjeksiyon yoluyla verilen bir anestetik doz aşımı kullanılarak öldürüldü.
1. Fare PNX Cerrahisi
- İntraperitoneal (IP) enjeksiyon yoluyla farelere sodyum fenobarbital (120 mg / kg vücut ağırlığı) ve buprenorfin (0.1 mg / kg vücut ağırlığı) ile tamamen uyartın. Fareler artık parmak ucu ile tepki göstermediğinde ameliyat yapın.
- Farelerin sol toraksındaki saçları kimyasal madde ile çıkarınilatory tedavisi (~ 3 x 3 cm 2 alan).
- Her fareyi, ventral tarafı operatöre bakacak şekilde entübasyon platformuna sabitleyin ( Şekil 1A ).
- Farenin dilini çekin ve ses tellerini, kateterleri 18 ( Şekil 1A ) yönlendirmek için bir çentik içeren küçük bir hayvan laringoskopu ile aydınlatın.
- Solunum sırasında ses tellerinin hareketlerini gözleyerek ses tellerini ayırt edin. Anterior açı 19 ile trakea 20 G intravenöz entübasyon kanülünü yavaşça yerleştirin.
- Fareleri sağ yanal yatık konuma getirin ve kanülü mekanik bir ventilatöre bağlayın ( örn., Basınç kontrollü , Malzeme Tablosuna bakın). Fare göğsünün solunum hareketlerini gözleyerek kanülün trakeaya sokulduğunu kontrol edin ( Şekil 1B ).
- İnspirasyon basıncını ayarlayınVentilatörü 12 cm H 2 O'ye ayarlayın ve solunum hızını dakikada 120 nefes alma değerine ayarlayın ( Şekil 1B ).
- Cerrahi bölgedeki cildi betadin ve% 70 etanol ile arındırın.
- 5. interkostal boşluktaki boşluğa Noyes Bahar Makas (kesici kenar: 14 mm, uç çapı: 0.275 mm) ile cilt ve kasları keserek 2-3 cm posterolateral torakotomi insizyonu yapın ( Şekil 2B , C ). Torakotomi prosedürü için kullanılan cerrahi aletler kullanımdan önce sterilize edilir.
- Sol akciğerin ortaya çıkması için 5. interkostal boşluğa 1.5 cm'lik bir kesi yapın ( Şekil 2D , E ). Ameliyat sırasında kanamayı durdurmak için yüksek sıcaklıkta bir koterizer kullanın.
- Sol akciğer lobunun üçte birini künt uçlu forseps ile göğüsten kaldırın ( Şekil 2F ) ve daha sonra solun tamamını dışarı çekmek için bir pamuk çubuğu kullanınAkciğer ( Şekil 2G ).
- Sol akciğer lobunun pulmoner arter ve bronşunu belirleyin ( Şekil 2G ).
- Bronşu ve damarları ipek cerrahi dikişle hilumda sıkıca bağlayın ve ligasyondan 3-4 mm uzakta sol akciğer lobunu kesin ( Şekil 2H , I ).
NOT: (toraks boşluğunda yani hava veya gaz) pnömotoraks neden olabilir sol hilusta, üzerinde dikiş knot kesmeye özen gösterin. - 1 dikiş ile göğüs duvarını kapatın ve kas tabakasını ve cilt tabakasını sırayla 5-6 kesilmiş sütürleri kullanarak dikin. Her dikiş arasında 3-4 mm boşluk bırakın ( Şekil 2M , 2N ).
NOT: Cerrahi dikiş iğnesini kalpten uzak tutun; İstenmeyen kardiyak ponksiyon ölümle sonuçlanır. - Cerrahi alanı povidon iyotla dezenfekte edin.
- AfteCerrahi işlem, fareyi 38 ° C'lik bir termal yastığa yerleştirin ve spontan solunum hareketleri başlayana kadar fareyi vantilatörün içine bağlayın ( Şekil 2O ).
2. Protez İmplantasyonu
- PNX prosedürünün adımları 1.1 - 1.13'ü gerçekleştirin (farenin sol akciğer lobu çıkarıldığı noktaya kadar).
- Künt forseps kullanarak silikon protezin (müşterinin yaptığı, 12 mm uzunluğunda, 3 mm kalınlığında, 7 mm genişliğinde, 0.2 g, elipsoid şeklinde) kelepçeleyin ( Şekil 2J ). Silikon protezi yerleştirmeden önce sterilize edin.
- Göğüs boşluğunu ortaya çıkarmak için kaburgayı bir elinizle forsepsle tutun ve daha sonra başka bir elle boş protezi sol boş torak boşluğuna yerleştirin.
NOT: Ekleme açısı protezin ön yüzü ile göğüs arası yüzeyi arasında yaklaşık 45 derecedir ( Şekil 2K ,L). Protezi yerleştirirken çok nazik olun. Aşırı kuvvet plevral rüptüre neden olur. - Protezin sol boş torak boşluğunu kapladığından emin olmak için künt forsepsle protezin yönünü ayarlayın.
- Fare PNX prosedürünün 1.14 - 1.16 adımlarını uygulayın.
3. ILV ölçümü
- Tek kullanımlık bir serolojik pipetten (10 mL), bir iğne adaptörü olan 40 cm uzunluğunda bir esnek borudan, bir akış hızı kontrol valfinden ve 18 G'lik bir iğneden çıkarılmış bir pistondan oluşan özel bir cihaz hazırlayın ("şişme tüpü"). Montajdan sonra, pipeti bantla bir tahtaya sabitleyin ( Şekil 3A ). Pipet üstü ile deney tezgahı arasındaki mesafe en az 30 cm olmalıdır.
- Elle çalkalanarak, 55 ° C'lik bir su banyosunda 500 gr önceden ısıtılan 1x fosfat tamponlu salin (PBS) içinde 20 g PFA'nın eritilmesi ile taze% 4 paraformaldehit (PFA) fiksasyon çözeltisi hazırlayınSolüsyon berrak olana kadar her 10 dakikada bir temizleyin. Oda sıcaklığına soğuttuktan sonra, solüsyonu 0.45 um'lik bir filtreyle süzün.
DİKKAT: PFA kullanırken uygun kişisel koruyucu ekipmanı (PPE) giyin. - Anestezik doz aşımı dozunda (% 0.8 fenobarbital sodyum, 1000 U / mL heparin) fareleri kurban edin.
- Her fare bir polistiren diseksiyon plakası üzerinde sabitleyin ve% 70 alkol ile püskürtün.
- Farenin göğsünü dikkatli bir şekilde açın ve akciğer loblarını iyice ortaya çıkarmak için göğüs uçlarını makas kullanarak kesin.
- Trakea maruz bırakmak için aşırı makroyu makas kullanarak çıkarın. Trakeayı özofagustan ayırdığınızdan emin olun.
- Karın aortunu kesin ve sağ kalp sağ ventrikülüne 25-gauge iğne yerleştirin; Bu yerleştirmeden önce iğneyi 20 mL şırınga ile birleştirin. Akciğerler beyaza dönüşene kadar kan hücrelerini çıkarmak için yavaşça kalbe 1x PBS itin. Tipik olarak, pulmoner kan damarlarını temizlemek için 5 - 10 mL PBS gereklidir.
- Doldurun thE% 4'lük yeni PFA ile özel olarak yapılmış enflasyon tüpünü ve enflasyon tüpündeki tüm kabarcıkları çıkartın.
- Enflasyon borusunun 18-mertebeli iğnesini trakea sokun ve sıvı sızıntısını önlemek için trakeaya gemi klipsleri ile bağlayın.
- 25 sm bir sabit, transpülmoner basınç / H2O 2, 20% 4 PFA ile akciğerlerini şişirmek. Akciğerleri oda sıcaklığında 2 saat inkübe ederek tamamen akciğer genişletmesini sağlayın. Bu "ön-düzeltme" adımı, akciğer morfolojisini korumak için kritik önem taşır.
- Enflasyon borusunu izleyerek ilk% 4 PFA hacminin değerini kaydedin ve nihai hacmi kaydedin. İç akciğer hacmi, ilk% 4 PFA hacminden eksi son 4% PFA hacmine eşittir.
- Trakea bağlayın ve makas kullanarak, çevredeki bağ dokularından akciğerleri hafifçe parçalayın (akciğerleri sağlam tutun). Akciğerlere zarar vermemek için çok nazik olun.
- incuAkciğerleri, 4 ° C'de 12 saat boyunca çalkalayıcıda hafifçe çalkalayarak (50 dev / dak)% 4'lük PFA ile dolu 50 ml'lik bir konik tüpe koyun. Doku işleme ve boyama işlemlerine devam edin (bkz. Bölüm 4).
4. Doku Gömme, Kesitleme ve Hematoksilen ve Eozin (H & E) Boyama
- Düzeltmeden sonra, akciğerlerden kalbi ve aşırı bağ dokularını düzeltmek için Noyes Bahar Makas kullanın. Akciğer loblarını trakeaya bağlayan bronşu keserek bireysel akciğer loblarını nazikçe ayırın.
- Bir yörünge çubuğu çalkalayıcıda (50 dev / dak) akciğer loblarını 50 mL 1x PBS'de (30 dakika / yıkama) 3-4 kez yoğun yıkayın.
- Son yıkamayı takiben, doku 50 mL'lik konik tüplerin dibine (yaklaşık 12 saat) batıncaya kadar akciğer loblarını 4 ° C'de% 30 sükroz çözeltisine (1x PBS) daldırmak suretiyle kriyoproteksiyona uğratın.
- Gömülmeden ve cryosectioning dokularından önce, forseps ile tüplerden akciğer lob örnekleri çıkarın, acces korumakHistolojik analiz için sory lobları, aksesuar lop numunelerinin yüzeyinden kalan sukroz çözeltisini ilave edin ve sonra yaklaşık 30 dakika boyunca optimum kesme ısısı (OCT) bileşiğini içeren bir Petri kabına iyice daldırın.
- Cryomolds kullanarak sıvı azot içerisindeki OCT gömülü aksesuar lob örneklerini dondurun. Lobun en geniş yüzey alanını kalıbın tabanına paralel konuma getirin.
- Histolojik analiz için cryosectioning sırasında her numune için toplam üç 10-μm kalınlığında bölümleri hazırlayın. İlk 1 mm'lik dokuyu atın, 10 mm kalınlığında bir bölüm toplamayın, 0.5 mm doku atın, başka bir bölüm toplamayın, 0.5 mm doku atın ve üçüncü (son) bölümü toplayın.
- H & E boyamayı yapmadan önce bölümleri 1 saat boyunca havayla kurutun.
- H & E boyama yapın
- Musluk suyundaki 3-4 değişikliklerdeki bölümleri yıkayın ve daha sonra bölümleri taze hematoksilen içinde 2 dakika boyayın; Musluk suyunun altında yıkayın; Fazla hematoksileni çıkarmak için bölümü% 1 HC1-% 70 etanol solüsyonuna iki kez batırın.
- Parçayı taze eozin içinde 3 dakika boyunca boyayın; % 95 etanol içinde iki ardışık 30 s yıkama ve% 100 etanol ile iki 30 s yıkama ile bölümleri kurutun; Ksilen bölümlerini 30 s temizleyin, temizleme adımını bir kez taze ksilen içinde tekrarlayın; Slaytları, cam lamelleri kullanarak montaj ortalığına monte edin.
5. MLI ölçümü
- Parlak alan mikroskopu kullanarak H & E lekeli aksesuar lob bölümlerinin dijital görüntülerini (20X büyütme) elde edin.
- MLI'yi ölçmek için, 3 bölümden oluşan uygun alanlardan (arterler, damarlar, ana hava yolları ve alveolar kanallar olmaksızın) rastgele toplam 15 bindirmeyen görüntü (1000 μm x 1000 μm) seçin.
- 10 adet eşit dağıtılmış dikey çizgi ve 10 adet eşit olarak dağıtılan yatay çizgi ile bir ızgarayı yerleştirin.Cetvel aracını kullanarak seçilen alanlarda gth (1000 μm); Her hat 100 μm aralıklarla ayrılır ( Şekil 4B ).
- Bir kesişmenin değerini iki bitişik alveolar epitelyum arasındaki doğrusal uzunluk olarak tanımlayın. Her bir 1000 μm uzunluk çizgisi boyunca tüm kesişme değerlerini ölçün.
- Her bir ızgara için, 10 yatay 1000 μm uzunluk çizgisi ve 10 dikey 1.000 um uzunluk çizgisi arasındaki tüm kesme noktalarının değerlerini ölçün.
NOT: MLI, her aksesuar lob için hazırlanan 3 bölümden analiz edilen toplam 15 ızgaradan kesme uzunluklarının ortalama değeridür.
6. ISA'nın hesaplanması
- Denklem 1'i kullanarak ISA'yı hesaplayın ( Giriş'e bakın). ILV'nin ölçümü için bölüm 3'e bakınız ve MLI'nin nicelendirilmesi için bölüm 5'e bakınız.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Burada, PNX ile işleme tabi tutulan bir grup ve bir protez implantasyonu (Protez yerleştirilmiş) grubu ile bir deney gerçekleştirdik. Bu gruplamalar, araştırma grubumuzdan daha önce yayınlanmış bir çalışmada kullanılan gruplamalarla aynıdır 14 .
Fare PNX ve protez yerleştirme prosedürleri Şekil 2'de gösterilmektedir. Ameliyatlar ve kantifikasy...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokolde, fare sol akciğer PNX ve protez yerleştirildikten sonra pulmoner parametrelerin ölçümü hakkında ayrıntılı açıklamalar sağlarız. ISA, şimdi birçok pulmoner hastalıkta solunum fonksiyonlarının değerlendirilmesi ve yaralanmanın yol açtığı alveol rejenerasyonunda önemli bir metrik olarak düşünülmektedir. Bununla birlikte, pulmoner araştırma topluluğu ISA'nın yararlı bir metriği olarak yararlı olduğu konusunda anlaşmaya rağmen, günümüze kadar ISA hesaplamak için k...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, yardım için Pekin Ulusal Biyolojik Bilimler Enstitüsü'nü kabul etmek istiyorlar. Bu çalışma Pekin Belediye Tabiat Bilimleri Vakfı (No. Z17110200040000) tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Referanslar
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. Morphometry of the Human Lung. , Springer-Verlag. Berlin Heidelberg. (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır