このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス肺切除術および義歯移植による内臓肺表面積の標準化法
要約
内臓の肺表面積(ISA)は、肺疾患および傷害誘発性肺胞再生における肺の形態学および生理学を評価するための決定的な基準である。ここでは、肺の肺切除術とプロテーゼ移植マウスモデルの両方でISAの測定バイアスを最小限に抑える標準化された方法について説明します。
要約
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
概要
肺の基本的機能は、血管と大気との間の酸素と二酸化炭素の交換である。気管支肺胞形成異常(BPD)、慢性閉塞性肺疾患(COPD)、急性呼吸器感染症などの肺疾患は、ISA 2の減少をもたらす。肺疾患を研究研究者はMLI、ILV、ガス交換ユニットの数、ISA、および肺組織のコンプライアンス2、3などの肺の形態学的変化を評価するためにいくつかの定量的な方法を開発しました。 Weibel らによる先駆的研究4およびDuguid ら 5一緒にISAは、ヒト肺における肺のガス交換能力の直接の尺度として使用することができ、肺気腫の重症度を決定するための基準として使用することができることを確立しました。過去5年間に発表された多くの研究では、肺の形態学的パラメーター( 例えば、 6中や傷害PNX 1、7から回復中のマウスの肺の形態学的および機能的変化を評価するために、M> ISAとMLI)。 ISAは、 式(1)8,9用いて計算されます。
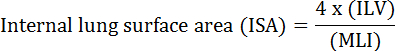
ここで、ILVは、内部肺容積であり、MLIは、肺周辺空隙サイズ10を表す中間パラメータである。
PNX、一つ以上の肺葉の外科的切除は、広く人間11、マウス1、犬12、ラット13、およびウサギ14、15を含め、多くの種で、肺胞の再生を誘導することが報告されています。スタッドPNX後14日目にマウスの肺のyは、既存の肺胞の拡大と肺胞の新形成の両方が、残りの肺組織におけるISA、ILV、および肺胞の数の回復に寄与することを示した1 。我々と他の人は、スポンジ、ワックス、カスタム形状のプロテーゼなどの材料を空の胸腔にPNX( すなわち人工器官の植え込み)後に挿入すると、肺胞の再生が損なわれることを示しています。今ではしっかりと肺胞の再生1、16、17を開始するための最も重要な要因の一つとして、その機械的な力の機能を確立しています。そのような研究は、肺胞再生を定量的に評価する基準として、PNX処置および人工器官埋め込み肺からのISA値を使用する有効性を強調している。
観察者バイアスは、測定されたvaに有意に影響を及ぼすことが知られている肺の形態学的パラメーター( 例えば 、MILおよびILV)についてのルーツ。 ISAの計算に使用される2つのパラメータであるILVとMLIの両方を決定する際に、標準化されたプロトコルを使用してこのバイアスを回避することができます。ここでは、これらの肺パラメータを測定するための非常に詳細な、標準化されたプロトコルを提供します。重要なことに、ISAを正確に定量する能力は、損傷誘発性の肺胞再生モデルにおける肺機能の研究の信頼性および再現性を改善することを約束し、複数の肺疾患における機械的発見を促進するはずである。
Access restricted. Please log in or start a trial to view this content.
プロトコル
このプロトコールで使用される全ての手順は、北京生物科学研究所の実験動物のケアおよび使用のためのガイドラインの推奨に従って行われた。実験が実施されるまで、8週齢のCD-1雄マウスを特定病原体不使用(SPF)施設に収容した。手術は、完全に麻酔したマウスを使用して行った( すなわち 、つま先のつまみの反応なし)。手術後、マウスは、十分な食物および淡水を有する温かく湿った室内に置かれた。マウスを、腹腔内注射により送達された過剰の麻酔薬を用いて犠牲にした。
1.マウスPNX手術
- 腹腔内(IP)注射によりナトリウムフェノバルビタール(120mg / kg体重)およびブプレノルフィン(0.1mg / kg体重)でマウスを完全に麻酔する。マウスがつま先へのピンチに反応しなくなったときに手術を行います。
- ケミカルデポを用いてマウスの左胸部の毛を除去する(約3×3cm 2面積)の治療を必要とする。
- 各マウスを腹側を操作者に向けて挿管台に固定する( 図1A )。
- マウスの舌を引き出し、カテーテル18 ( 図1A )を案内するノッチを含む小さな動物の喉頭鏡で声帯を照らす。
- 呼吸中に声帯の動きを観察して声帯を区別します。静かに20Gの静脈内挿管カニューレを前角19で気管に挿入する。
- マウスを右横臥位に置き、カニューレを機械的人工呼吸器( 例えば、圧力制御; 表の表を参照)に接続する。マウスの胸部の呼吸運動を観察して、カニューレの気管への挿入を確認します( 図1B )。
- 吸息圧力を設定する換気装置を12 cmH 2 Oに設定し、呼吸速度を毎分120回の呼吸に設定します ( 図1B )。
- ベタジンと70%エタノールで外科領域の皮膚を汚染除去する。
- Noyes Spring Scissors(刃先14 mm、先端直径0.275 mm)( 図2B 、C )を用いて、皮膚と筋肉を切断して、5 番目の肋間腔の空間に2〜3 cmの後外側開胸切開を行う。開胸手術に使用される手術器具は、使用前に滅菌される。
- 第 5肋間腔で1.5cmの切開を行い、左肺を露出させる( 図2D 、E )。操作中は、出血を止めるために高温焼灼器を使用してください。
- 左肺葉の3分の1を鈍い先端鉗子で胸から持ち上げ( 図2F )、次に綿棒を使用して左全体を引き出す肺( 図2G )。
- 左肺葉の肺動脈および気管支を特定する( 図2G )。
- hilumの気管支と血管を絹の外科用縫合糸でしっかりと結紮し、結紮から3〜4mmで左肺葉を切り取る( 図2H 、I )。
注:気胸( すなわち 、胸部の空洞内の空気またはガス)を引き起こす可能性のある左丘の縫合結び目を切断しないように注意してください。 - 1つの縫合糸で胸壁を閉め、筋層と皮膚層を5〜6本の中断縫合糸を用いて縫い合わせる。各縫合糸の間に3〜4 mmの隙間を残す( 図2M 、2N )。
注:外科用縫合針を心臓から離してください。不慮の心臓穿刺は即座に死に至る。 - ポビドンヨードで手術部位を消毒する。
- アフト外科手術で38℃のサーマルパッドにマウスを置き、自発呼吸の動きが始まるまでマウスを人工呼吸器に接続します( 図2O )。
2.プロテーゼインプラント
- PNX処置のステップ1.1〜1.13を実行します(つまり、マウスの左肺葉を取り除いた時点まで)。
- 鈍い鉗子( 図2J )を使用して、シリコンプロテーゼの中心(顧客が作成した、長さ12mm、厚さ3mm、幅7mm、0.2g、楕円形)を締め付けます。シリコーンプロテーゼを挿入する前に滅菌する。
- 胸腔を露出させるために片手で鉗子でリブを保持し、もう一方の手で左の空の胸腔にプロテーゼを挿入します。
注:挿入角度は、プロテーゼの前面と胸郭面との間で約45度です( 図2K 、L)。プロテーゼを挿入するときは非常に優しい。過度の力は胸膜破裂をもたらす。 - 鈍い鉗子でプロテーゼの向きを調整して、プロテーゼが左の空の胸腔を占めるようにします。
- マウスPNX手順のステップ1.14-1.16を実行します。
3.ILVの測定
- 使い捨ての血清学的ピペット(10 mL)から取り出したプランジャー、針アダプター、流量制御バルブ、および18 G針を備えた長さ40 cmのフレキシブルチューブからなるカスタムデバイス(「膨張チューブ」)を準備します。組み立て後、テープでボードにピペットを固定します ( 図3A )。ピペットの上部と実験台との間の距離は、少なくとも30cmでなければならない。
- 55℃の水浴中で予め加熱した1×リン酸緩衝生理食塩水(PBS)500mLにPFA 20gを溶解し、手動で振とうして新鮮な4%パラホルムアルデヒド(PFA)固定液を調製する溶液が透明になるまで10分おきに静置する。室温に冷却した後、溶液を0.45μmフィルターで濾過する。
注意:PFAを取り扱うときは、適切な個人用保護具(PPE)を着用してください。 - マウスを麻酔薬の過剰投与(0.8%のフェノバルビタールナトリウム、1,000U / mLヘパリン)で犠牲にする。
- ポリスチレン解剖プレートに各マウスを固定し、70%アルコールを噴霧する。
- 注意深くマウスの胸を開き、はさみを使用して胸骨を切り開いて肺葉を完全に露出させます。
- はさみを使用して過剰な組織を除去し、気管を露出させる。食道から気管を離してください。
- 腹部大動脈を切断し、心臓の右心室に25ゲージの針を挿入する。この挿入の前に針を20 mLシリンジに接続してください。肺が白くなるまで、ゆっくりと1x PBSを心臓に押し込み、血球を除去します。典型的には、5~10mLのPBSが肺血管を浄化するために必要とされる。
- あなたを埋める4%の新鮮なPFAを含むカスタムビルドのインフレーションチューブを取り出し、インフレーションチューブからすべての泡を除去します。
- インフレーションチューブの18ゲージの針を気管に挿入し、液体漏れを防ぐために気管クリップで気管をクリップする。
- 25cmで一定経肺圧力/ H 2 O 2、20℃で4%PFAで肺を膨らませます。完全に拡張した肺を達成するために、肺を室温で2時間インキュベートする。この「予備固定」工程は、肺の形態を維持するために重要である。
- 膨張チューブを監視することにより、最初の4%PFA量の値を記録し、最終量を記録する。内部肺容積は、初期4%PFA容積から最終4%PFA容積を差し引いた容積に等しい。
- 気管をLigateし、はさみを使用して、周囲の結合組織から肺を静かに(肺をそのままに)解剖する。肺の損傷を避けるために、非常に穏やかにしてください。
- インコ4%PFAを満たした50 mLコニカルチューブで、4℃で12時間、シェーカー(50 rpm)で穏やかに振とうしながら肺を栓をする。組織の処理と染色に進む(セクション4を参照)。
組織埋め込み、切片化、およびヘマトキシリン&エオシン(H&E)染色
- 固定後、Noyes Spring Scissorsを使用して、肺から心臓や過剰な結合組織を整えます。肺葉を気管に接続する気管支を切断することによって、個々の肺葉を静かに分離する。
- オービタルシェーカー(50 rpm)で50 mL 1x PBS(30分/洗浄)で3〜4回肺葉を広範囲に洗浄します。
- 最後の洗浄後、組織が50mLコニカルチューブ(約12時間)の底に沈むまで4℃で30%ショ糖溶液(1×PBS)に浸すことによって肺葉を凍結保護する。
- 組織を包埋して凍結切除する前に、鉗子で肺葉試料を管から取り出し、アクセスを保持する約30分間、最適切断温度(OCT)化合物を含有するペトリ皿に試料を完全に浸漬する。
- クライオホルムを使用して液体窒素中でOCTに埋め込まれたアクセサリーローブサンプルを凍結させる。ローブの最大表面積をモールドの底面に平行にします。
- 組織学的分析のために凍結切片作製中に、各試料について合計3つの厚さ10μmの切片を調製する。最初の1mmの組織を捨て、10μmの厚さの部分を1枚集め、0.5mmの組織を捨て、別の部分を集め、0.5mmの組織を捨て、第3の(最終)部分を集める。
- H&E染色を行う前に、セクションを1時間風乾します。
- H&E染色を行う
- 水道水の3〜4回の切替えで切片を洗浄し、新鮮なヘマトキシリン中の切片を2分間染色する。;実行中の水道水の下でセクションをすすぎます。切片を1%HCl-70%エタノール溶液に2回浸して過剰のヘマトキシリンを除去する。
- 新鮮なエオシンの切片を3分間染色する。 95%エタノール中で2回連続して30秒洗浄し、100%エタノールで2回30秒洗浄することにより切片を脱水する;キシレン中の切片を30秒間透明にし、清澄化工程を新鮮なキシレン中で1回繰り返す;カバーガラスを使用してスライドをマウント媒体でマウントします。
MLIの定量化
- 明視野顕微鏡を用いて、H&Eで染色されたアクセサリーローブ切片(20倍の倍率)のデジタル画像を取得する。
- MLIを定量化するには、3つのセクションからなる適切な領域(動脈および静脈、大気道および肺胞管なし)から無作為に合計15個の非重複ビュー(1,000μmx1,000μm)を選択します。
- 10個の均等に配分された垂直線と定義されたlenの均等に分布した水平線10個でグリッドを配置する選択された領域にルーラーツールを使用してgth(1,000μm)を表示します。したがって、各ラインは100μm離れて配置されている( 図4B )。
- 1つの切片の値を、2つの隣接する肺胞上皮の間の線形長さとして定義する。各1,000μmの長さのラインに沿ったすべての切片の値を測定する。
- 各グリッドについて、10本の水平な1,000μmの長さのラインと10本の垂直な1,000μmの長さのラインの間のすべての切片の値を定量化する。
注:MLIは、アクセサリーローブのそれぞれについて用意された3つのセクションの中から分析された合計15個のグリッドからの切片長の平均値である。
ISAの計算
- 式1を使ってISAを計算します( はじめにを参照)。 ILVの測定についてはセクション3を参照し、MLIの定量化についてはセクション5を参照してください。
Access restricted. Please log in or start a trial to view this content.
結果
ここでは、PNX治療群と人工器官埋め込み(義肢植込み)群の実験を行った。これらのグループ分けは、研究グループ14の以前に発表された研究で使用されたグループ分けと同じです。
マウスPNXおよびプロテーゼ移植手順を図2に示す。 8週齢のCD-1雄マウスを手術および定量のた?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
このプロトコールでは、マウス左肺PNXおよび人工器官移植後の肺パラメータの測定についての詳細な説明を提供する。 ISAは現在、多くの肺疾患および傷害誘発性肺胞再生における呼吸機能の評価のための重要なメトリックであると考えられている。しかし、肺研究の共同体はISAの有用性について有用な指標として合意されているが、ISAを計算するために使用されるILVとMLIの測定の標準化につ...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は何も開示することはない。
謝辞
著者は北京生物科学研究所に支援を求めています。この研究は、北京市自然科学財団(No Z17110200040000)の支援を受けました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
参考文献
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. Morphometry of the Human Lung. , Springer-Verlag. Berlin Heidelberg. (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved