Method Article
الببتيدات اختراق الخلية بيوتينيلاتيد لدراسة تفاعلات البروتين البروتين داخل الخلايا
In This Article
Summary
هذا بروتوكول لدراسة تفاعلات البروتين البروتين داخل الخلايا استناداً إلى نظام المنسدلة avidin البيوتين مع الجدة للجمع بين تسلسلات اختراق الخلية. والميزة الرئيسية هو أن التسلسل المستهدفة هي المحتضنة مع الخلايا الحية بدلاً من الخلية ليساتيس وذلك سوف تحدث التفاعلات في سياق الخلوية.
Abstract
نقدم هنا بروتوكولا لدراسة تفاعلات البروتين البروتين داخل الخلايا استناداً إلى نظام المنسدلة avidin البيوتين المستخدمة على نطاق واسع. ويشمل التعديل قدم المزيج من هذا الأسلوب مع تسلسل اختراق الخلية. نقترح لتصميم الطعم اختراق الخلية التي يمكن المحتضنة مع الخلايا الحية بدلاً من ليساتيس الخلية وذلك سيعكس التفاعلات العثور على تلك التي تحدث في سياق داخل الخلايا. Connexin43 (Cx43)، بروتين الذي يشكل فجوة تقاطع القنوات وهيميتشانيلس أسفل-ينظم gliomas عالية الجودة. منطقة Cx43 تتألف من الأحماض الأمينية 266-283 المسؤولة عن تثبيط النشاط النمطان من ج-Src في الخلايا الدبقي. هنا نستخدم تأت كتسلسل اختراق الخلية، البيوتين كعلامة سحب لأسفل، ومنطقة Cx43 التي تضم بين الأحماض الأمينية 266-283 كهدف للبحث عن التفاعلات داخل الخلية في الخلايا الجذعية الثابت ترانسفيكت الدبقي البشرية. أحد أوجه قصور الطريقة المقترحة أن الجزيء كالطعم يمكن أن يفشل في إضعاف بشكل صحيح، ونتيجة لذلك، التفاعلات وجدت يمكن أن لا تكون مرتبطة بالأثر. ومع ذلك، هذا الأسلوب يمكن أن تكون مثيرة للاهتمام لا سيما للتفاعلات المشتركة في ممرات توصيل الإشارات نظراً لأنها تنفذ عادة بمناطق اضطرابه جوهريا، وذلك، أنها لا تتطلب طي أمر. وبالإضافة إلى ذلك، واحدة من مزايا الأسلوب المقترح أنه يمكن دراسة أهمية كل بقايا على التفاعل بسهولة. هذا نظام معياري؛ ولذلك، يمكن استخدام تسلسلات أخرى اختراق الخلية، والعلامات الأخرى، وغيرها من الأهداف داخل الخلايا. وأخيراً، نطاق هذا البروتوكول أبعد من التفاعل البروتين-بروتين لأنه يمكن تطبيق هذا النظام على الشحنات الأخرى النشطة بيولوجيا مثل تسلسل الحمض النووي الريبي أو جسيمات نانوية، فيروسات أو أي جزيء يمكن ترانسدوسيد مع تسلسل اختراق الخلية و تنصهر فيها العلامات المنسدلة لدراسة إليه العمل داخل الخلايا.
Introduction
تفاعلات البروتين البروتين ضرورية لمجموعة كبيرة ومتنوعة من العمليات الخلوية. لنفهم تماما هذه العمليات، أساليب لتحديد تفاعلات البروتين داخل البيئة داخل الخلايا معقدة مطلوبة. إحدى الطرق الأكثر استخداماً تحديد الشركاء التفاعل البروتين استخدام هذا البروتين أو من ببتيد ميميتيك جزء من هذا البروتين حيث الطعم في تجارب المنسدلة تقارب متبوعاً بكشف البروتينات ملزمة. وكثيراً ما يستخدم نظام عبدين-البيوتين نظراً لتقارب عالية وخصوصية ومستقرة التفاعل بين عبدين والبيوتين1،2. البيوتين مرتبط تساهميا للطعم (بروتين أو ببتيد) عادة، وبعد فترة الحضانة مع ليساتيس الخلية السماح بإقامة التفاعلات، يتم سحبها الطعم بيوتينيلاتيد منضمة إلى شركائها داخل الخلايا إلى أسفل مع عبدين أو عبدين المشتقات مترافق مع الخرز الدعم. ثم، يتم الكشف عن تفاعلات البروتين الطعم بعد الغسيل وشطف والتحليل قبل يشوه التفريد تليها لطخة غربية. واحدة من المشاكل من هذا الأسلوب أن التفاعلات بين بروتين الفائدة وشركائها داخل الخلايا وتجري خارج سياق الخلوية. وهذا أهمية خاصة بالنسبة للتفاعلات المشتركة في ممرات توصيل الإشارات لأنها تجري في أماكن محددة داخل الخلايا، أنها عابرة والتي تنفذ عادة بالبروتينات ليست وفيرة. ولذلك، داخل ليساتيس الخلية قد يكون مقنعا هذه التفاعلات الأخرى أكثر وفرة البروتينات أو البروتينات التي عادة ما تكون ليست بالقرب.
اختراق الخلية الببتيدات (الهادئ) هي قصيرة الببتيدات (الأحماض الأمينية دي فور زيرو)، ويتألف معظمها من الأحماض الأمينية الموجبة التي قادرة على نقل مجموعة واسعة من الجزيئات في الخلية تقريبا أي3. وقد تم مترافق شحنات مثل البروتينات والحمض النووي بلازميد، siRNA، فيروسات، وكلاء التصوير، وجسيمات نانوية مختلفة الهادئ و كفاءة المدخلة4،5. بسبب هذه القدرة على نقل هم المعروف أيضا مجالات توصيل البروتين (بتدس) والغشاء ترانسلوكاتينج تسلسل (رخصة) الببتيدات حصان طروادة. بين الهادئ، درس الببتيد تأت من البروتين ترانساكتيفاتور فيروس نقص المناعة البشرية تأت6 كانت واحدة من الأكثر انتشارا 7،،من89. تأت هو نونابيبتيدي التي تحتوي على ارجينين 6 و 2 يسين المخلفات ونتيجة لذلك هو الغاية الموجبة. قد أثبتت الدراسات البديلة أن تهمة إيجابية صافية تأت ضروري للتفاعلات الالكتروستاتيكي مع الأغشية البلازمية للخلايا حقيقية النواة، واستيعاب اللاحقة10. وبالمثل لغيرها الهادئ، تأت مشحونة بشكل إيجابي بشدة بربط الكهربية الاستاتية مختلف مشحونة سلبا على الأنواع الحالية على سطح الخلية أغشية الخلايا، بما في ذلك المجموعات دهن الرأس و glycoproteins وبروتيوجليكانس3 , 10-النشطة بيولوجيا الشحنات المنقولة التي تأت تصبح حرة مباشرة في سيتوسول للوصول إلى شركائها داخل الخلايا.
نقدم هنا أسلوب يجمع بين حزب الشعب الكمبودي تأت مع البيوتين لدراسة التفاعلات داخل الخلية. ويهدف إلى تصميم الطعم اختراق الخلية بالصمامات بيوموليكولي المستهدفة لتأت البيوتين. والميزة الرئيسية لهذا الاقتراح أن التفاعلات بين الطعم وشركائها ستجري ضمن سياقها الخلوية. لإظهار مدى فعالية هذا الأسلوب نحن كبيت سلسلة صغيرة من البروتين Cx43 تم الإبلاغ عنها للتفاعل إينتراسيلولارلي مع بروتوونكوجيني ج-Src11،،من1213. Cx43 هو بروتين غشائي لا يتجزأ من هو المعرب عنها على نطاق واسع في أستروسيتيس14، وهو ينظم لأسفل في جليوماس عالية الجودة، الورم الخبيث الأكثر شيوعاً الجهاز العصبي المركزي15،16،17 ،18. لقد كان سابقا، تبين أن منطقة Cx43 التي تتفاعل مع ج-Src (الأحماض الأمينية 266-283 في Cx43 البشرية؛ Pubmed: P17302) تنصهر إلى تأت (Cx43 تأت266-283) يحول دون نشاط النمطان ج-سرسين الدبقي الخلايا والخلايا الجذعية الدبقي (جسكس)19،،من2021. تصميم الطعم داخل الخلايا، وقد تم تنصهر Cx43266-283 تأت في ن-المحطة (Cx43 تأت266-283) والبيوتين في ج-المحطة (Cx43 تأت266-283-ب). قد استخدمت هذه الاستراتيجية بنجاح في الفئران الدبقي خط الخلية C6 لتحديد ج-Src، ج-محطة Src كيناز (كورونا) والفوسفاتيز وتينسين homolog (فتن) كشركاء داخل الخلايا في هذه المنطقة من Cx4320. وهنا يصف لنا هذا الأسلوب اختبار كفاءته في جسكس البشرية، وهامة جداً للعلاج الدبقي ولكن أصعب بكثير ترانسفيكت من الخلايا الجذعية غير الدبقي.
Protocol
وأجريت جميع الإجراءات التجريبية في جامعة سالامانكا.
1-الخلايا
- يومين قبل البدء في هذا الإجراء، لوحة الخلايا في الكثافة المطلوبة لتكون المتلاقية في اليوم من هذه التجربة. لوحة الخلايا في قوارير أو لوحات. ومع ذلك، سيكون من الأسهل من لوحات استخراج البروتين. أنها ملائمة إعداد لوحات على الأقل 4 من 78 سم2 أو 2 قوارير بمعدل 150 سم2 في حالة كل تجربة، ومن المؤكد أن تكون النتائج متسقة.
- في هذه الدراسة، لوحة جسكس G166 البشرية في قوارير 4 من 150 سم2، مثقف في الخلية الجذعية آر-أ المتوسطة وتستكمل مع 2% B27، 1% N2، 20 نانوغرام/مليلتر مماثلة وب-صندوق الأجيال القادمة، كما وصفها بولارد et al.22. عملية عندما تم التوصل إلى التقاء. على سبيل المثال، عندما كانت مطلي الخلايا 5 × 106 G166 في قارورة2 150 سم، أنها جهزت 2 أيام بعد الطلاء.
2-بيوتينيلاتيد الهادئ
- تدور قارورة تحتوي على بيوتينيلاتيد المجففة بالتبريد الهادئ (بكبس) في س 8200 ز لمدة 30 ثانية، لتجنب بعض من مسحوق المتبقية على الغطاء. إدراج عنصر تحكم BCPP للتأكد من أن التفاعلات وجدت محددة في التسلسل المستهدفة. في هذه الدراسة، كان عنصر التحكم BCPP تأت-البيوتين (تأت-ب) وكانت معاملة BCPP Cx43 تأت266-283-باء. يمكن استخدام عناصر تحكم أخرى، مثل السندات الشظايا التي تنصهر فيها إلى المجمعة أو تحور تأت إلى البيوتين.
- حل بكبس في المتوسط الثقافة المقابلة في حل الأسهم المؤشرة بالشركة المصنعة؛ على سبيل المثال، إضافة BCPP لعلاج جسكس للحصول على حل أسهم 2 مغ/مل 0.5 مل من غسك الثقافة المتوسطة لقنينة واحدة تحتوي على 1 ملغ BCPP. دوامة وتأكد من الببتيد هو حل جيد.
3-أنابيب
ملاحظة: إعداد على الأقل اثنا عشر أنابيب 1.5 مل كل الشرط المطلوب في الفرع 7.
- وضع علامة على أنابيب 3 أولاً كل حالة. أنهم سوف يكون الحجم الإجمالي للهاتف الخلوي ليساتيس التي تم الحصول عليها في الخطوة 6، 4.
- علامة A في 3 أنابيب كل حالة. وسيكون هذه الأنابيب supernatants الأولى التي تم الحصول عليها بعد ليسينج والغزل ليساتيس الخلوية، خطوة 7.2.
- مارك أ ب في 3 أنابيب كل حالة. وسيكون هذه الأنابيب قاسمة صغيرة من سوبيرناتانتس الأولى. هذه ليساتيس سيكون بمثابة عينات لطخة غربية في الخطوة 7، 3.
- مارك ج في 3 أنابيب كل حالة. وسيكون هذه الأنابيب سوبيرناتانتس التي تم الحصول عليها بعد السحب لأسفل مع نيوترافيدين، الخطوة 7.7.
ملاحظة: هذا المهم في حال أظهرت لطخة غربية لا توجد إشارة للبروتينات، مما يعني أن البروتينات لا تهدمه أو ضاعت في خطوة بعض الإجراءات. إذا كانت هذه هي الحالة، كرر هذه العملية لهدم البروتينات.
4-الخلوية العلاج مع بكبس
- نضح المتوسطة الثقافة.
- استبدال حجم الطازجة المتوسطة المطلوبة لاحتضان بكبس في أصغر حجم ممكن المتوسطة وفقا لأوقات الاحتضان المقابلة. من المهم جداً أن على أية حال، المتوسط يغطي تماما كامل سطح اللوحة/قارورة حيث أن الخلايا لم تجف، على سبيل المثال، 6 مل الواحد 150 سم2 لتفريخ 30 دقيقة.
- إضافة حجم الأسهم حل BCPP للثقافات الخلية للوصول إلى تركيز أنه قد ثبت أن تكون فعالة. قد ثبت في هذه الدراسة 50 ميكرون Cx43 تأت266-283-ب للحد من انتشار GSC.
- إضافة لذلك، ميليلتر 92.8 2 مغ/مل Cx43 تأت266-283-ب (MW = 3723.34 g/mol) الواحد مل من الثقافة المتوسطة للحصول على تركيز نهائي من 50 ميكرومتر Cx43 تأت266-283-باء. إذا كانت وحدة التخزين المراد إضافتها مختلفة لمراقبة الببتيدات، كاملة مع ثقافة متوسطة تصل إلى نفس الحجم النهائي. 49.1 ميليلتر على سبيل المثال، تأت ب (ميغاواط = 1914.31 g/mol) بالإضافة إلى 43.7 المتوسطة غسك ميليلتر وأضيفت كل مل من الثقافة المتوسطة للحصول على تركيز نهائي من 50 ميكرومتر تأت-باء.
- وضع الخلايا في الحضانة عند 37 درجة مئوية و 5% CO2 لمدة 30 دقيقة للتأكد من أن تتم التفاعلات بين BCPP وشركائها داخل الخلايا. إذا كان التفاعل وقتاً أطول، احتضانها لأوقات أطول أو ضبط الأوقات في حالة التجربة تتألف من دورة الوقت. وبالإضافة إلى ذلك، يمكن تشجيع التفاعل بين المصالح أو منعت من حفز مختلف مسارات الإشارات داخل الخلايا.
5-المخازن المؤقتة والحلول.
- إعداد برنامج تلفزيوني الأس الهيدروجيني 7.4: 136 مم كلوريد الصوديوم؛ 2.7 مم بوكل؛ مم 7.8 غ2هبو4·2H2س؛ 1.7 مم خ2ص4.
- إعداد المخزن المؤقت لتحلل البروتين: 20 مم تريس-HCl (pH 8.0)، 137 مم كلوريد الصوديوم، 1% إيجيبال والمسبقة لاستخدام، يضاف ما يلي: 1/100 (v/v) "مبطلات كوكتيل المانع"، 1 مم فلوريد الصوديوم، 1 مم فينيلميثانيسولفونيل الفلوريد (بمسف) وأورثوفاناداتي الصوديوم 0.1 ملم.
- إعداد المخزن المؤقت لايملي: (س 4: 0.18 م تريس-HCl الأس الهيدروجيني 6.8؛ والغليسيرول م 5؛ والحزب الديمقراطي الصربي 3.7 في المائة (p/v)؛ 0.6 م β-mercaptoethanol أو 9 مم DTT؛ bromophenol 0.04% (v/v) الأزرق (بب)).
6. استخراج البروتين
ملاحظة: تم إجراء استخراج البروتين كما هو موضح سابقا20،23. القيام بهذا القسم كاملة من الإجراءات عند 4 درجة مئوية.
- نضح المتوسطة الثقافة تماما.
- أغسل 3 × 10 مل من الفوسفات المثلج مخزنة المالحة (PBS) الواحدة 150 سم2 بعناية فائقة لتجنب انفصال الخلية.
- للحصول على الخلية ليستي، أضف 3 مل من المخزن المؤقت لتحلل كل 150 سم2 ودقة كشط السطح باستخدام مكشطة خلية. إمالة اللوحة/قارورة إلى حوالي 45 درجة سيجعل من الأسهل لجمع ليساتيس الخلية إلى هذه الأنابيب المقابلة.
- صب 1 مل الخلوي كل أنبوب في ثلاثة أنابيب 1.5 مل. سيتم وضع علامة هذه الأنابيب مع الشرط وتكرار كما هو مبين في الخطوة 3، 1.
7-سحب لأسفل
- الطرد المركزي أنابيب 1.5 مل في 11,000 ز س لمدة 10 دقائق في 4 درجات مئوية.
- نقل سوبيرناتانتس بأنابيب جديدة (A).
- تأخذ قاسمة لهذه المادة طافية كل شرط لأنابيب مختلفة (ب)، أي 50 ميليلتر كل أنبوب. إضافة 4 من المخزن المؤقت x Laemmli (16.6 ميليلتر ل 50 ميليلتر من ليستي) وتجميد في-20 درجة مئوية. وستستخدم هذه ليساتيس عينات لطخة غربية كالمعتاد.
- مجانسة جيدا [اغروس] نيوترافيدين بالهز لطيف. قص نصائح نصائح ماصة لزيادة طول القطر وتحسين بيبيتينج الخرز.
ملاحظة: سوبيرناتانتس (أنابيب د) الآن جاهزة يتم تحميلها في لطخة غربية أو تجميد في-20 درجة مئوية.
8-الغربية وصمة عار
ملاحظة: النشاف الغربية كان إجراء كما هو موضح سابقا24.
- تحميل يعادل حجم كل عينة الواحدة وحارة على ميديجيلس مكررا-تريس (4-12 في المائة) في "نظام التفريد" ميدي-الخلية.
- ترانسبلوت البروتينات باستخدام نظام blotting جافة إلى كدسة النيتروسليلوز عادية.
- وصمة عار الغشاء مع 10% بونسياو لمدة 10 دقائق.
- غسل الأغشية دقيقة 3 × 5 مع 5 مل من تتبس.
- كتلة الأغشية مع لبن 7% في تتبس من أجل ح 1 مع الهز لطيف في أنابيب أو مربعات صغيرة. تأكد من أن وحدة التخزين التي تستخدم بما فيه الكفاية لتغطية الأغشية وأن أن لا تجف، أي 40 مل في غشاء ميدي كاملة.
- أغسل 3 x 5 دقيقة مع 5 مل من تتبس.
- تبني بين عشية وضحاها في 4 درجات مئوية مع جسم الأولية ضد البروتين الفائدة مع الهز لطيف.
- أغسل 3 x 5 دقيقة مع 5 مل من تتبس.
- احتضان الغشاء في درجة حرارة الغرفة مع المراسل مترافق البيروكسيديز الثانوية جسم في تتبس ح 1.
- أغسل 3 x 5 دقيقة مع 5 مل من تتبس.
- وضع مع الركازة تشيميلومينيسسينت في نظام تشيميلومينيسسينسي.
9-حل المشكلات
- إذا بعد وضع لطخة الغربية أي من العينات التي أظهرت أي إشارة على الإطلاق للبروتينات، تحقق بونسو.
ملاحظة: يجب أن تظهر الغشاء في بونسو غير معرف وتحميل عصابات عديدة على طول الممرات. إذا كانت العصابات غير ملحوظ جداً، الكمية البروتينات تحميل قد لا تكون كافية أو قد مرت انتقال بشكل غير صحيح. النظر في تكرار لطخة غربية. - إذا لم يكن هناك لا وصمة عار على الإطلاق في غشاء بونسو في أي لين، كرر الإجراء بأكمله من الخطوة 7.4 في الأنابيب (ج).
- إذا كانت إشارة بروتين بعد وضع وصمة عار الغربية ضعيف جداً ولكن أظهرت Ponceau البروتينات، احتضان الغشاء مع الأجسام المضادة الأساسي مرة أخرى لوقت أطول. إذا كان لا يزال الإشارة ضعيفة إلى حد، احتضان مرة أخرى عند درجة حرارة الغرفة.
10-أخرى تستخدم التقنيات في هذه المقالة.
- إيمونوسيتوتشيميستري بكبس
- إصلاح الخلايا في بارافورمالدهيد 4% (0.2 مل كل سم2) لمدة 20 دقيقة.
- أغسل 3 x 5 دقيقة مع برنامج تلفزيوني (0.2 مل كل سم2).
- تطبيق جسم المقابلة (على الأقل 0.15 مل كل سم2) المخفف في جسم حل بتركيز الشركة المصنعة المشار إليها ضد البروتين الخاص الاهتمام بين عشية وضحاها في 4 درجات مئوية.
- احتضان مع مترافق fluorophore ثانوية جسم (0.15 مل كل سم2) على ح 2 في درجة حرارة الغرفة.
- كرر الخطوات 10.1.2-10.1.4 مع سائر الأجسام المضادة ضد الخاص بك البروتينات ذات الاهتمام. احرص على عدم استخدام نفس الأنواع للأجسام المضادة الأولية مختلفة أو نفس الطول الموجي فلوروفوريس للأجسام المضادة الثانوية.
- جبل الخلايا باستخدام الكاشف أنتيفادي (0.005 مل كل سم2).
- تحليل مجهر fluorescence متصل بكاميرا رقمية.
- فحص MTT
- ثقافة الخلايا عند 37 درجة مئوية في لوحات 24-جيدا.
- احتضان الخلايا في الظلام لمدة 75 دقيقة مع 0.15 مل من المتوسطة الثقافة الواحدة سم2 التي تحتوي على 0.5 ملغ/مل MTT.
- نضح المتوسطة واحتضان الخلايا لمدة 10 دقائق في الظلام مع ثنائي ميثيل سلفوكسيد (0.25 مل كل سم2) مع الهز الخفيف.
- قياس امتصاص في موجه 570 نانومتر باستخدام قارئ ميكروسكوبية.
النتائج
قبل استخدام بكبس لدراسة التفاعل داخل الخلايا، من المهم لمقارنة آثار BCPP مقابل حزب الشعب الكمبودي للتحقق من صحة النتائج التي تم الحصول عليها مع BCPP. ونتيجة لذلك، لدراسة ما إذا كان إدراج البيوتين يعدل نشاط تسلسل الهدف، علينا أولاً تحليل أثر Cx43 تأت266-283-ب مقارنة مع Cx43 تأت266-283 في مورفولوجيا جسكس G166. للقيام بذلك، علينا إجراء بعض التحليلات الفلورة من بروتينات cytoskeletal اثنين، واكتين و α-tubulin بعد 24 ساعة علاج. ويبين الشكل 1 أن جسكس G166 بحضور 50 ميكرون Cx43 تأت266-283 أو Cx43 تأت266-283-ب اكتساب شكل مستدير الزوايا أكثر مقارنة بالتمديدات الخلوية ممدود والموسع هو موضح في عناصر التحكم (تأت أو تأت-ب). وفي الواقع، يبين الشكل 1b أن خيوط الأكتين معظمها يتم تجميعها كشبكات أكتين عندما كانت تعامل الخلايا مع Cx43 تأت266-283 أو Cx43 تأت266-283-ب في حين أنها تشكل حزم أكتين أكثر في الخلايا التحكم (تعامل مع تأت أو تاتب)25. وفي المقابل، لا يختلف التوزيع α-tubulin بين الأوضاع المختلفة. وأظهرت هذه النتائج أن وجود البيوتين لم لا تعديل أثر تسلسل المستهدفة على مورفولوجية جسكس G166. في الدراسات السابقة20،21، أظهرنا أن تأت Cx43266-283 خفض انتشار جسكس G166. في هذه الدراسة، ونحن التحقيق في ما إذا كان Cx43 تأت266-283ب-تمارس نفس الآثار في النمو ك Cx43 تأت266-283. للقيام بذلك، قمنا بتحليل انتشار جسكس G166 بفحص MTT بعد 72 ساعة علاج. فحص MTT مقايسة اللونية لتقييم النشاط الأيضي في الخلية. يتم استقلاب MTT بالأنزيمات أوكسيدوريدوكتاز ح NAD (P) في الميتوكوندريا مما يعكس عدد خلايا قابلة للتطبيق الحالي. ويبين الشكل 2 أن التخفيض في بقاء الخلية جسكس G166 لا تختلف اختلافاً كبيرا عندما تعامل الخلايا مع 50 ميكرون Cx43 تأت266-283 أو 50 ميكرون Cx43 تأت266-283-باء. في الواقع، على حد سواء تضاءل إلى حد كبير انتشار جسكس G166 بالمقارنة مع عنصر التحكم، تأت أو تأت-باء
بمجرد أننا أكدت أن تأثير لدينا تسلسل المستهدفة في G166 جسكس (Cx43 تأت266-283) تعديل لا بإدراج البيوتين في ج-المحطة (Cx43 تأت266-283-ب)، نحن التحقيق الشركاء داخل الخلايا في هذا التسلسل يتبع البروتوكول الوارد وصفها في هذه الدراسة (الشكل 3). لأن كابول تشارك في إليه ل استيعاب تأت26، قمنا بتحليل وجود كافيولين 1 (Cav-1) في السحب-هبوطاً. وأظهر تحليل لطخة غربية (الشكل 4) أن تأت-ب وتأت Cx43266-283-ب تتفاعل مع الخيالة-1. ومع ذلك، قدرة Cx43 تأت266-283-ب لتوظيف ج-Src، فتن وكورونا أقوى من التي وجدت مع تأت-باء. التصاق التنسيق كيناز (فاك) هو ركيزة من ج-Src التي لم يثبت للتفاعل مع Cx43. وفي الواقع، لم تظهر فاك أي تفاعل كبير مع تأت-ب أو Cx43 تأت266-283-باء.
لتأكيد التفاعل بين Cx43 تأت266-283-ب وج-Src، جسكس G166 كانت المحتضنة مع 50 ميكرون Cx43 تأت266-283-ب 30 دقيقة وعلى التعريب تبع مع streptavidin نيون [كنفوكل] مجهرية (الرقم 5 ). أظهرت النتائج التي توصلنا إليها أن التوزيع داخل الخلايا من Cx43 تأت266-283-ب بالقرب من غشاء البلازما (يظهر تلطيخ فوسفاتيديلسيريني) وتطابق مع ذلك ج-Src. وفي الواقع، كشفت تحليلات التعريب المشارك بعض النقاط للتعريب المشارك (أبيض) بين Cx43 تأت266-283-ب وج-Src في دمج الصورة. ونتيجة لذلك، تؤكد الدراسات مجهرية [كنفوكل] النتائج المتحصل عليها مع البروتوكول المنسدلة BCPP، المذكورة في هذه الدراسة.
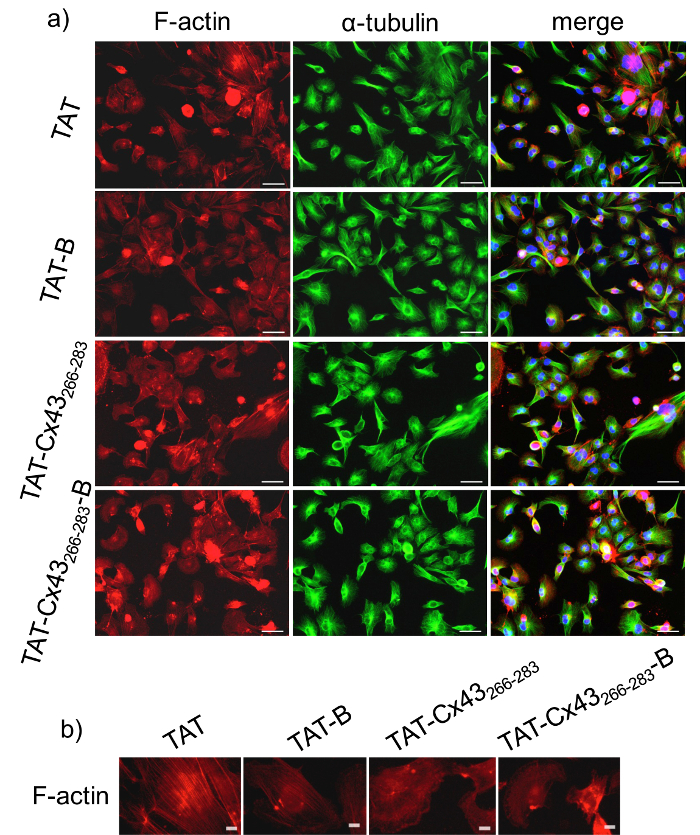
الشكل 1: أثر BCPP وحزب الشعب الكمبودي على مورفولوجيا GSC.
كانت مطلية جسكس G166 في كثافة منخفضة (2 × 104 خلايا/سم2) وبعد 24 ساعة أنهم كانوا المحتضنة مع 50 ميكرومتر سيطرة "حزب الشعب الكمبودي" (تأت)، التحكم في BCPP (تأت-ب)، والمعالجة بحزب الشعب الكمبودي (Cx43 تأت266-283) أو المعالجة BCPP (Cx43 تأت266-283-ب) . أ) واكتين (أحمر), α-tubulin (الأخضر) ومدمجة + immunostaining DAPI من نفس الحقل عرض مورفولوجيا جسكس G166. أشرطة = 50 ميكرومتر. ب) immunostaining واكتين تبين توزيع مختلف واكتين في جسكس G166 بعد حضانة ح 24 مع 50 ميكرومتر التحكم في "حزب الشعب الكمبودي" (تأت) أو التحكم في BCPP (تأت-ب) بالمقارنة مع 50 ميكرومتر معاملة حزب الشعب الكمبودي (Cx43 تأت266-283) أو BCPP (تأت-Cx43 266-283-ب). أشرطة = 10 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2: أثر BCPP وحزب الشعب الكمبودي على سلامة GSC.
مطلي في 5500 خلايا/سم2 في لوحات 24-مولتيويل جسكس G166 والمحتضنة مع 50 ميكرومتر التحكم الببتيدات، "حزب الشعب الكمبودي" (تأت) أو BCPP (تأت-ب)، أو 50 ميكرومتر العلاج الببتيدات، حزب الشعب الكمبودي (Cx43 تأت266-283) أو BCPP (Cx43 تأت266-283-ب). وقد تم تحليل بقاء الخلية باستخدام مقايسة MTT بعد 72 ساعة. النتائج التي يتم التعبير عنها ك MTT absorbances وهي s.e.m. ± يعني على الأقل 3 تجارب (+ + p˂0.01 مقابل السيطرة. * * p˂0.01، * * * مقابل p˂0.001 تأت أو ب تأت؛ أحادي الاتجاه ANOVA ويثتوكيي ما بعد الاختبار). لاحظ أنه لا توجد اختلافات كبيرة بين آثار مقابل الهادئ بكبس. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
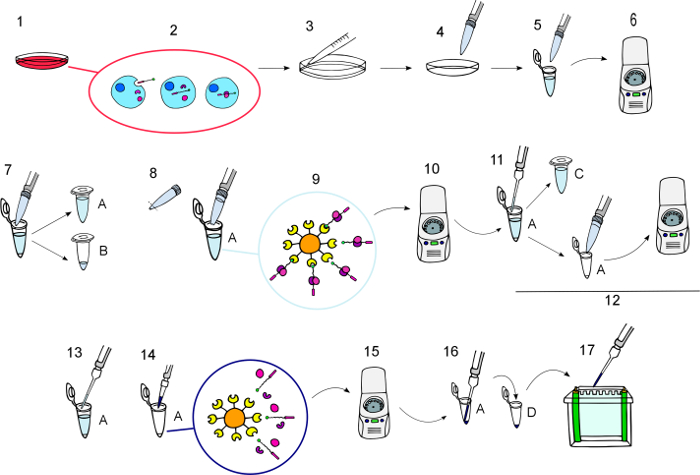
الشكل 3: رسم تخطيطي للبروتوكول.
تصوير رسومية خطوة بخطوة للإجراء كما هو موضح في قسم "بروتوكول"، من الاحتضان بكبس حتى بكبس التيد والبروتينات المتفاعلة بهم كانوا obtained.1) احتضان خلايا الثقافة مع بكبس في التركيز المطلوب الوقت المطلوب. 2) أثناء الحضانة، يتم استيعابها في بكبس وتفاعلها مع شركائها داخل الخلايا. 3) غسل الخلايا ثلاث مرات على الجليد مع برنامج تلفزيوني المثلج. 4) الخلايا لاستخراج البروتينات. 5) نقل الخلية ليساتيس للأنابيب.6) تدور في 11000 x ز لمدة 10 دقائق في 4 درجات مئوية. 7) نقل سوبيرناتانتس إلى أنابيب جديدة (A) والاحتفاظ قاسمة صغيرة من ليساتيس عملية كالغربية العادية لطخة عينات في الأنبوبة (ب). 8) ريسوسبيند نيوترافيدين [اغروس] الخرز وإضافة 50 ميليلتر لكل أنبوبة باستخدام تلميح قطع ماصة. 9) احتضان مع تهتز برفق ح 12 في 4 درجات مئوية للسماح بالخرز [اغروس] نيوترافيدين للتفاعل مع بكبس وشركائها. 10) تدور لمدة 1 دقيقة على 3000 x ز لبيليه الخرز مع بيوتينيلاتيد الطعم السام وعلى البروتينات المتفاعلة ملزمة لهم. 11) نقل سوبيرناتانتس إلى أنابيب جديدة (ج) والاحتفاظ بها استخدامها في حالة السحب إلى أسفل بحاجة إلى تكرارها. 12) يغسل بيليه خمس مرات مع المخزن المؤقت لتحلل الطازجة، ريسوسبيند بانعكاس، تدور لمدة 1 دقيقة على 3000 x ز وتجاهل المادة طافية. 13) إزالة جميع المادة طافية بعناية. 14) إضافة حجم 4 × لايملي المخزن المؤقت المطلوب والوت البروتينات عند 100 درجة مئوية للحد الأدنى 5 15) تدور في 8200 x ز لمدة 30 ثانية بيليه الخرز. 16) نقل البروتينات التيد وجدت في المادة طافية مع نصائح الشعرية بأنابيب جديدة (د). 17) تحميل على المواد الهلامية لتحليل لطخة غربية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
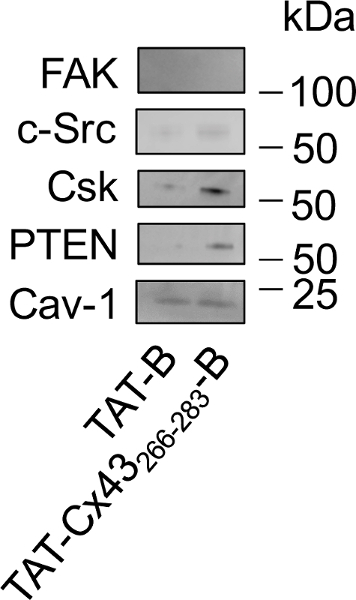
الشكل 4: دراسة التفاعلات داخل الخلايا من Cx43 تأت266-283-ب في جسكس G166 بسحب لأسفل تليها لطخة غربية.
جسكس G166 كانت المحتضنة مع 50 ب تأت أو Cx43 تأت ميكرومتر266-283-باء. وبعد 30 دقيقة تم تفكيك الخلايا وب تأت أو Cx43 تأت266-283هدمت-ب يعلق على شركائها داخل الخلايا مع الخرز نيوترافيدين. تحميل البروتينات التيد وتحليلها بواسطة لطخة غربية لدراسة مستويات فاك، ج-Src، كورونا، فتن والخيالة-1. علما بأن الخيالة-1 يتفاعل مع كلا ب تأت وتأت Cx43266-283-ب، ج-Src، فتن وكورونا التفاعل تفضيلي مع Cx43 تأت266-283-ب وذاتيا ولم تظهر أي تفاعل مع تأت-ب أو Cx43 تأت266-283-باء من فضلك انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
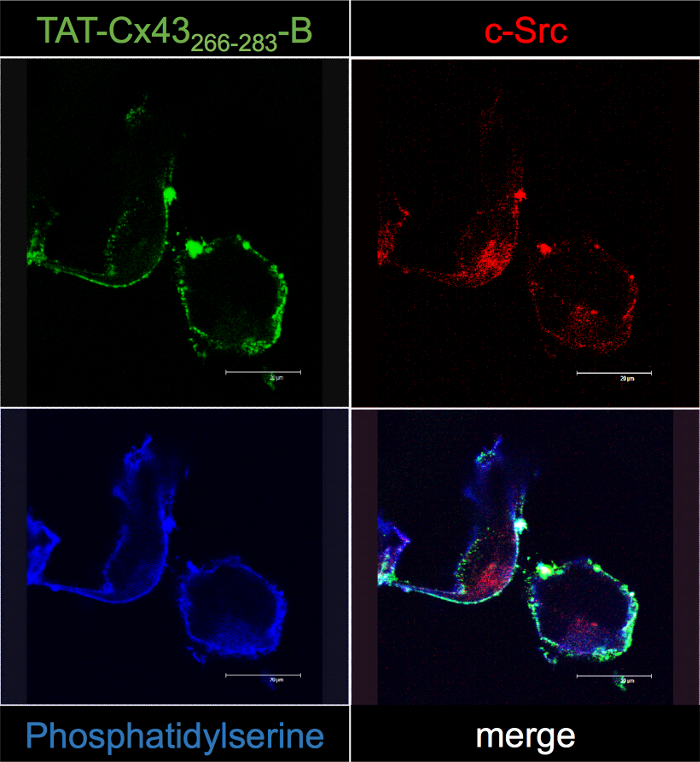
الشكل 5: تأكيد Cx43 تأت266-283-ب التفاعلات داخل الخلية في جسكس G166 بالفحص المجهري [كنفوكل].
جسكس G166 كانت المحتضنة مع 50 ميكرون Cx43 تأت266-283-باء. بعد 30 دقيقة، الخلايا كانت ثابتة وتجهيزها لتعريب Cx43 تأت266-283-ب Cy2-ستريبتافيدين (الأخضر)، ج-Src الفلورة (أحمر) وفوسفاتيديلسيريني مع أنيكسين الخامس (أزرق). ملاحظة بعض النقاط للتعريب المشارك (أبيض) بين Cx43 تأت266-283-ب وج-Src قريبة من غشاء البلازما في دمج الصور. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
هناك العديد من الطرق لدراسة تفاعلات البروتين البروتين. الطريقة التي عرضت في هذه الدراسة يستند على النظام المنسدلة عبدين البيوتين المستخدمة على نطاق واسع التي هي المحتضنة طعم بيوتينيلاتيد مع ليساتيس الخلية السماح بإقامة التفاعلات. ويشمل التعديل المقدمة في هذه الدراسة المزيج من هذا الأسلوب مع تسلسل اختراق الخلية. نقترح لتصميم الطعم اختراق الخلية التي يمكن المحتضنة مع الخلايا الحية بدلاً من ليساتيس الخلية وذلك سيعكس التفاعلات العثور على تلك التي حدثت في سياق الخلوية.
هنا نستخدم تأت كتسلسل اختراق الخلية، البيوتين كعلامة سحب لأسفل، ومنطقة Cx43 التي تضم بين الأحماض الأمينية 266-283 كهدف للبحث عن التفاعلات داخل الخلية في جسكس البشرية. الأساس الهيكلي للتفاعل بين Cx43 وج-Src هو معروف11،12. هذا تفاعل هام نظراً لأنه يحول دون نشاط النمطان ج-Src في الدبقي الخلايا24،13. وفي الواقع، تقليد الهادئ الذي يحتوي على هذه المنطقة (Cx43 تأت266-283) خصائص Cx43 أنتيونكوجينيك في الدبقي الخلايا19،،من2021. في الفئران الخلايا C6 الدبقي، وتشمل هذه الآلية الذي يمنع Cx43 تأت266-283 ج-Src تجنيد ج-Src مع مثبطات الذاتية كورونا وفتن20. تجدر الإشارة إلى أن جسكس مثيرة جداً للاهتمام كهدف في الدبقي العلاج، لأنها تشكل يتدنى مقاومة للعلاجات التقليدية والمسؤولة عن ذلك تكرار هذه أورام الدماغ الخبيثة27. وعلاوة على ذلك، فهي الخلايا الثابت ترانسفيكت وذلك دراسة التفاعلات داخل الخلايا يصبح أكثر صعوبة. الهادئ استيعاب سرعة وكفاءة في جسكس19 تفضل استخدامها لدراسة التفاعلات داخل الخلية. في هذه الدراسة، استخدام الهادئ تنصهر فيها البيوتين نؤكد تفاعل التسلسل266-283 Cx43 مع ج-Src مشفوعة مثبطات الذاتية كورونا وفتن في جسكس البشرية.
هذا الأسلوب قوية جداً لدراسة الآلية داخل الخلايا من المركبات النشطة بيولوجيا. ومع ذلك، المهم جداً تأكيد أن الأثر البيولوجي للطعم اختراق الخلية بيوتينيلاتيد لا تختلف عن تلك التي تم الحصول عليها بغير بيوتينيلاتيد واحدة. هذه الخطوة المطلوبة لربط التفاعلات وجدت مع تأثير المجمع النشطة بيولوجيا. وباﻹضافة إلى ذلك، استقرار المجمع، عن تدهور ممكن من البروتياز، فضلا عن سميته المحتملة، وينبغي بعناية اختبارها وتؤخذ في الاعتبار قبل التخطيط للتجربة. في المثال قدمت، قد أثر مكافحة التكاثري Cx43 تأت266-283 على جسكس البشرية G166 الموثقة سابقا20. في هذه الدراسة، ونؤكد أن تأثير مكافحة التكاثري Cx43 تأت266-283-ب ومن Cx43 تأت266-283 مشابهة جداً. وباﻹضافة إلى ذلك، كشف تحليل مورفولوجيا الخلوية أن α-tubulin وتوزيع F-أكتين مشابهة جداً في جسكس G166 التعامل مع Cx43 تأت266-283-ب أو مع Cx43 تأت266-283. وإجمالا، تشير هذه النتائج إلى أن إدراج البيوتين في ج-المحطة من Cx43 تأت266-283 لم لا تعديل آثار هذا المركب على جسكس البشرية. ومع ذلك، إذا كان يعدل البيوتين آثار جزيء النشطة بيولوجيا، العلامات الأخرى لتنقية البروتين يمكن اختبارها، مثل علم أوكتابيبتيدي (ديكدددك)28، العلامة هيماغلوتينين-مشتقة من الإنفلونزا البشرية هكتار (يبيدفبديا) أو الجلوتاثيون S-ترانسفيراز (GST)29. وبالمثل، إذا تأت لا تستهدف السكان خلية من الفائدة، الخلية الأخرى تسلسلات اختراق، مثل بينيتراتين، ميلا في الغالون (لإجراء استعراض، انظر30) أو خلية تسلسل معين يمكن أن تستخدم31.
ومن الناحية المثالية، بالإضافة إلى دراسة البروتينات التي تتفاعل على وجه التحديد مع تسلسل الهدف، ينبغي وجود البروتينات التي تتفاعل مع عنصر التحكم وتسلسل المستهدفة والبروتينات التي لا يتفاعل معها، كعناصر إيجابية وسلبية، موجهة. وبهذا المعني، وجدنا الخيالة-1 في عنصر التحكم والتعامل مع الوضع، مما يوحي بأنه تشارك في كابول في إليه للاستيعاب، كما أنه قد ثبت سابقا26. وعلاوة على ذلك، فاك، الذي يتفاعل مع ج-Src ولكن من المفترض أن لا تتفاعل مع جيم Cx43--المحطة الطرفية، كان غائبا في مراقبة ومعالجة الوضع. وتعزز هذه النتائج خصوصية التفاعل بين Cx43 تأت266-283-ب، ج-Src، كورونا وفتن. لتأكيد النتائج التي تم الحصول عليها مع هذا البروتوكول، يمكن استخدام الفحص المجهري [كنفوكل] لتصور توزيع البروتينات المتفاعلة ودراسة عن التعريب المشارك. وهكذا، نجد أن تأت Cx43266-283-ب وج-Src المعرض توزيع مماثل داخل الخلايا مع بعض النقاط للتعريب المشترك يؤكد النتائج التي تم الحصول عليها مع التجارب المنسدلة. وفي الواقع، Cx43 تأت266-283-ب يتم توزيع ما يقرب من غشاء البلازما مما يوحي بأن الشحنة، في هذه الدراسة Cx43266-283، يوجه الجزيء لشركائها داخل الخلايا.
أحد أوجه قصور الأسلوب المقترح أن لا يتم إيجاد الجزيء كالطعم يمكن أن يفشل في إضعاف بشكل صحيح، والآثار المتوقعة. في هذه الحالة، تعذر إقران للتأثير التفاعلات وجدت. ومع ذلك، هذا الأسلوب يمكن مثيرة للاهتمام لا سيما للتفاعلات المشتركة في ممرات توصيل الإشارات لأن التي تنفذ عادة بالمناطق جوهريا اضطرابه32 وذلك أنها لا تتطلب طي أمر. وبالإضافة إلى ذلك، واحدة من مزايا الأسلوب المقترح أنه يمكن اتباع الدورة الزمنية للتفاعل، الذي يكتسي أهمية خاصة لتفاعلات عابرة. وعلاوة على ذلك، يمكن بسهولة دراسة جدوى كل بقايا على التفاعل. وفي الواقع، فمن الممكن لدراسة مدى ملاءمة التعديلات بوستترانسلاشونال على التفاعل البروتين البروتين، على سبيل المثال، باستبدال فوسفوميميتيك من غلوتامات سيرين أو ثريونين. وبالمثل، يسمح استبدال سيرين أو ثريونين للأنين أو تيروزين فينيلألانين لاختبار تأثير سيرين غير فوسفوريلاتابل، ثريونين أو تيروزين.لتقليد تيروزين والرمات، هو الطريقة الأكثر دقة الاستعاضة عنها بصور لطير ف33.
وأخيراً، نطاق هذا البروتوكول أبعد من التفاعل البروتين-بروتين لأنه يمكن تطبيق هذا النظام على الشحنات الأخرى النشطة بيولوجيا مثل تسلسل الحمض النووي الريبي أو جسيمات نانوية، الفيروسات أو الجزيئات الأخرى التي يمكن أن تنصهر فيها البيوتين وترانسدوسيد مع حزب الشعب الكمبودي لدراسة إليه العمل داخل الخلايا.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونشكر م. موراليس وياء برافو لمساعدتهم مع التصميم الهادئ واريفالو كيركراده لمساعدته مع البروتوكول المنسدلة. ونحن ممتنون للمساعدة التقنية من "ت." ديل ري. أيد هذا العمل y وزارة الاقتصاد دي كومبيتيتيفيداد، إسبانيا؛ FEDER BFU2015-70040-R, y الطغمة دي كاستيلا ليون، إسبانيا؛ FEDER SA026U16 ومؤسسة رامون أريسيس. م. خارايز-رودريغيز وألف غونزاليس-سانشيز من المتلقين على زمالة من ذ "المجلس العسكري" دي كاستيلا ليون و "الصندوق الاجتماعي الأوروبي".
Materials
| Name | Company | Catalog Number | Comments |
| G166 GSC line | BioRep | ||
| RHB-A stem cell medium | Takara | Y40001 | |
| Laminin Mouse Protein | Invitrogen, Life Technologies, ThermoFisher Scientific | 23017-015 | 10 µg/ml |
| B-27 Serum free Supplement (50X) | Invitrogen, Life Technologies, ThermoFisher Scientific | 17504-044 | 2% |
| N-2 Supplement (100x) | Invitrogen, Life Technologies, ThermoFisher Scientific | 17502-048 | 1% |
| Recombinant Human EGF | Peprotech | AF-100-15 | 20 ng/ml |
| Recombinant Human b-FGF | Peprotech | AF-100-18B | 20 ng/ml |
| PBS pH 7.4: In deionized water, 136 mM NaCl ; 2.7 mM KCl; 7.8 mM Na2HPO4·2H2O ; 1.7 mM KH2PO4 | |||
| Accutase | Sigma | A6964 | |
| Cryostor CS10 cryopreservation medium | StemCell Technologies | 7930 | |
| TAT | GenScript | - | Custom made |
| TAT-B | GenScript | - | Custom made |
| TAT-Cx43266-283 | GenScript | - | Custom made |
| TAT-Cx43266-283-B | GenScript | - | Custom made |
| Alexa Fluor 594 Phalloidin | Molecular Probes, Life Technologies, ThermoFisher Scientific | A1275737 | 1/20 |
| Monoclonal α-tubulin mouse antibody | Sigma-Aldrich | T9026 | 1/500 |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes, Life Technologies, ThermoFisher Scientific | 1.25 mg/ml | |
| Pierce™ NeutrAvidin™ Agarose | ThermoFisher Scientific | 29200 | |
| Protein lysis buffer: 5 mM Tris-HCl (pH 6.8), 2% (w/v) SDS, 2 mM EDTA , 2 mM EGTA | |||
| Protease Inhibitor Cocktail Set III. EDTA-Free | Calbiochem, Bionova | 539134 | 1/100 (v/v) |
| Sodium Fluoride | PanReac AppliChem | 141675 | 1 mM |
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma-Aldrich | P7626 | 1 mM |
| Sodium orthovanadate | Sigma-Aldrich | S6508 | 0.1 mM |
| Laemmli buffer: (4x: 0.18 M Tris-HCl pH 6.8; 5 M glycerol; 3.7 % (w/v) SDS; 0.6 M β-mercaptoethanol or 9 mM DTT ; 0.04% (v/v) bromophenol blue (BB) . | 1X | ||
| Xcell 4 SureLock Midi-Cell Electrophoresis System | Life Technologies, ThermoFisher Scientific | WR0100 | |
| NuPAGE Novex Bis-Tris Midi-Gels 4-12% | Life Technologies, ThermoFisher Scientific | WG1402box | |
| NuPAGE MOPS SDS Running Buffer (20X) | Life Technologies, ThermoFisher Scientific | NP0001 | 1X |
| NuPAGE Transfer Buffer 20x | Life Technologies, ThermoFisher Scientific | NP0006 | 1X |
| Precision Plus Protein Dual Color Standard | Bio-Rad | 161-0374 | |
| iBlot 2 NC Regular Stacks (nitrocellulose membranes) | Life Technologies, ThermoFisher Scientific | IB23001 | |
| iBlot 2 Dry Blotting System - Gel transfer device | Life Technologies, ThermoFisher Scientific | IB21001 | |
| 10% Ponceau S Solution (0.1% Ponceau (w/v) in 5% acetic acid (v/v)) in water | Sigma | P7170 | |
| FAK polyclonal rabbit antibody | Life Technologies, ThermoFisher Scientific | AHO0502 | 1/500 |
| Src polyclonal rabbit antibody | Cell Signalling (WERFEN) | 2108S | 1/500 |
| Csk polyclonal rabbit antibody | Cell Signalling (WERFEN) | 4980 | 1/500 |
| PTEN polyclonal mouse antibody | Cell Signalling (WERFEN) | 9552 | 1/500 |
| Caveolin-1 polyclonal rabbit antibody | Abcam | ab2910 | 1/1000 |
| Goat anti-mouse IgG-HRP antibody | Quimigen, Santa Cruz Biotechnology | Sc-2005 | 1/5000 |
| Goat anti-rabbit IgG-HRP antibody | Quimigen, Santa Cruz Biotechnology | SC-2030 | 1/5000 |
| Western Blotting Luminol Reagent | Santa Cruz Biotechnology | SC-2048 | |
| Src polyclonal rabbit antibody | Cell Signalling (WERFEN) | 2108S | 1/500 |
| Antibody solution: PBS, 10% FBS, 0.1 M lysine, 0.02% sodium azide | |||
| Alexa Fluor 488 goat anti-mouse IgG | Invitrogen, Life Technologies, ThermoFisher Scientific | A11029 | 1/1000 |
| Cy2-conjugated streptavidin | Jackson ImmunoResearch | 016-220-089 | 1/500 |
| MicroChemi Luminescence system | DNA Bio-Imaging Systems | ||
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor® 488 & Propidium Iodide (PI) | Molecular Probes, Life Technologies, ThermoFisher Scientific | V13241 | 1/500 |
| SlowFade Gold antifade reagent | Life Technologies, ThermoFisher Scientific | S36936 | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | |
| Dimethyl sulfoxide for UV-spectroscopy, >=99.8% (GC) | Honeywell | 41641-1L | |
| Appliskan 2001 | Thermo Electron Corporation, Thermo Scientific |
References
- Green, N. M. Avidin. 3. The nature of the biotin-binding site. Biochem J. 89, 599-609 (1963).
- Wilchek, M., Bayer, E. A. Applications of avidin-biotin technology: literature survey. Methods Enzymol. 184, 14-45 (1990).
- Herce, H. D., Garcia, A. E., Cardoso, M. C. Fundamental molecular mechanism for the cellular uptake of guanidinium-rich molecules. J Am Chem Soc. 136 (50), 17459-17467 (2014).
- Ramsey, J. D., Flynn, N. H. Cell-penetrating peptides transport therapeutics into cells. Pharmacol Ther. 154, 78-86 (2015).
- Fominaya, J., Bravo, J., Rebollo, A. Strategies to stabilize cell penetrating peptides for in vivo applications. Ther Deliv. 6 (10), 1171-1194 (2015).
- Vives, E., Brodin, P., Lebleu, B. A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus. J Biol Chem. 272 (25), 16010-16017 (1997).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol Med. 13 (10), 443-448 (2007).
- Brooks, H., Lebleu, B., Vives, E. Tat peptide-mediated cellular delivery: back to basics. Adv Drug Deliv Rev. 57 (4), 559-577 (2005).
- Cuesto, G., et al. Phosphoinositide-3-kinase activation controls synaptogenesis and spinogenesis in hippocampal neurons. J Neurosci. 31 (8), 2721-2733 (2011).
- Schmidt, N., Mishra, A., Lai, G. H., Wong, G. C. Arginine-rich cell-penetrating peptides. FEBS Lett. 584 (9), 1806-1813 (2010).
- Sorgen, P. L., et al. Structural changes in the carboxyl terminus of the gap junction protein connexin43 indicates signaling between binding domains for c-Src and zonula occludens-1. J Biol Chem. 279 (52), 54695-54701 (2004).
- Giepmans, B. N., Hengeveld, T., Postma, F. R., Moolenaar, W. H. Interaction of c-Src with gap junction protein connexin-43. Role in the regulation of cell-cell communication. J Biol Chem. 276 (11), 8544-8549 (2001).
- Tabernero, A., Gangoso, E., Jaraíz-Rodríguez, M., Medina, J. M. The role of connexin43-Src interaction in astrocytomas: A molecular puzzle. Neuroscience. 323, 183-194 (2016).
- Giaume, C., Koulakoff, A., Roux, L., Holcman, D., Rouach, N. Astroglial networks: a step further in neuroglial and gliovascular interactions. Nat Rev Neurosci. 11 (2), 87-99 (2010).
- Shinoura, N., et al. Protein and messenger RNA expression of connexin43 in astrocytomas: implications in brain tumor gene therapy. J Neurosurg. 84, 839-845 (1996).
- Soroceanu, L., Manning, T., Sontheimer, H. Reduced expression of connexin-43 and functional gap junction coupling in human gliomas. Glia. 33, 107-117 (2001).
- Pu, P., Xia, Z., Yu, S., Huang, Q. Altered expression of Cx43 in astrocytic tumors. Clin Neurol Neurosurg. 107 (1), 49-54 (2004).
- Crespin, S., et al. Expression of a gap junction protein, connexin43, in a large panel of human gliomas: new insights. Cancer Med. 5 (8), 1742-1752 (2016).
- Gangoso, E., Thirant, C., Chneiweiss, H., Medina, J. M., Tabernero, A. A cell-penetrating peptide based on the interaction between c-Src and connexin43 reverses glioma stem cell phenotype. Cell Death & Disease. 5, (2014).
- Gonzalez-Sanchez, A., et al. Connexin43 recruits PTEN and Csk to inhibit c-Src activity in glioma cells and astrocytes. Oncotarget. 7 (31), 49819-49833 (2016).
- Jaraíz-Rodríguez, M., et al. A short region of connexin43 reduces human glioma stem cell migration, invasion and survival through Src, PTEN and FAK. Stem Cell Reports. , (2017).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem Cell. 4 (6), 568-580 (2009).
- Yu, T., et al. In vivo regulation of NGF-mediated functions by Nedd4-2 ubiquitination of TrkA. J Neurosci. 34 (17), 6098-6106 (2014).
- Herrero-Gonzalez, S., et al. Connexin43 inhibits the oncogenic activity of c-Src in C6 glioma cells. Oncogene. 29 (42), 5712-5723 (2010).
- Cooper, G. M. . The Cell: A Molecular Approach. , (2000).
- Fittipaldi, A., et al. Cell membrane lipid rafts mediate caveolar endocytosis of HIV-1 Tat fusion proteins. J Biol Chem. 278 (36), 34141-34149 (2003).
- Dirks, P. B. Brain tumor stem cells: the cancer stem cell hypothesis writ large. Mol Oncol. 4 (5), 420-430 (2010).
- Hopp, T. P., et al. A Short Polypeptide Marker Sequence Useful for Recombinant Protein Identification and Purification. Nat Biotech. 6 (10), 1204-1210 (1988).
- Benard, V., Bokoch, G. M. Assay of Cdc42, Rac, and Rho GTPase activation by affinity methods. Methods Enzymol. 345, 349-359 (2002).
- Guidotti, G., Brambilla, L., Rossi, D. Cell-Penetrating Peptides: From Basic Research to Clinics. Trends Pharmacol Sci. 38 (4), 406-424 (2017).
- Hu, Q., et al. Glioma therapy using tumor homing and penetrating peptide-functionalized PEG-PLA nanoparticles loaded with paclitaxel. Biomaterials. 34 (22), 5640-5650 (2013).
- Babu, M. M., van der Lee, R., de Groot, N. S., Gsponer, J. Intrinsically disordered proteins: regulation and disease. Curr Opin Struct Biol. 21 (3), 432-440 (2011).
- Anthis, N. J., et al. Beta integrin tyrosine phosphorylation is a conserved mechanism for regulating talin-induced integrin activation. J Biol Chem. 284 (52), 36700-36710 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved