Method Article
Biotinylated 세포 관통 펩 티 드 세포내 단백질-단백질 상호 작용을 공부 하
요약
이것은 세포내 단백질 단백질 상호 작용 세포 관통 시퀀스 결합의 참신과 함께 biotin avidin 풀 다운 시스템에 기초를 공부 하는 프로토콜 이다. 주요 장점은 세포 lysates 대신 살아있는 세포와 대상 시퀀스를 incubated 하 고 따라서 상호 작용 세포 컨텍스트 내에서 발생 합니다.
초록
여기 우리는 널리 biotin avidin 풀 다운 시스템을 기반으로 하는 세포내 단백질-단백질 상호 작용 연구 프로토콜을 제시. 제시 하는 수정이이 기술은 세포 관통 시퀀스의 조합을 포함 합니다. 우리는 세포 lysates 대신 살아있는 세포와 알을 품 수 세포 관통 미끼 디자인을 제안 하 고 따라서 상호 작용 발견 됩니다 반영 세포내 컨텍스트 내에서 발생 하는. Connexin43 (Cx43), 갭 정션 채널 및 hemichannels를 형성 하는 단백질은 고급 gliomas에서 아래로 통제. 구성 아미노산 266-283 Cx43 지역 c-Src glioma 세포에서의 종양 활동의 억제에 대 한 책임 이다. 여기 우리 풀 다운 태그와 아미노산 266-283 transfect 하드 인간의 glioma 줄기 세포에서 세포 상호 작용을 찾을 대상으로 사이 구성 하는 Cx43의 지역으로 세포 관통 시퀀스, biotin 문신 사용 합니다. 제안된 된 방법의 한계 중 하나는 분자 사용 미끼는 제대로 하 고, 결과적으로 접어 하는 데 실패할 수 있습니다, 발견 하는 상호 작용 수 없습니다 효과와 관련입니다. 그러나 그들은 일반적으로 본질적으로 무질서 지역에 의해 실시 하 고, 따라서, 그들은 정렬 된 접는 필요 하지 않습니다 때문에,이 방법은 특히 신호 전달 경로에 관련 된 상호 작용에 대 한 흥미로운 수 있습니다. 또한, 제안된 된 방법의 장점 중 하나입니다 상호 작용에 각 잔류물의 관련성 쉽게 공부 될 수 있다. 이것은 모듈식 시스템; 따라서, 다른 세포 관통 시퀀스, 다른 태그와 다른 세포내 표적을 사용할 수 있습니다. 마지막으로,이 프로토콜의 범위는 단백질 단백질 상호 작용 보다 훨씬 RNA 시퀀스, 나노 입자, 바이러스 또는 세포 관통 시퀀스 불리고 수 있는 어떤 분자 같은 다른 생리 활성 화물에이 시스템을 적용할 수 있습니다 때문에 고 활동의 그들의 세포내 기계 장치를 공부 하기 풀 다운 태그에 융합.
서문
단백질 단백질 상호 작용 다양 한 세포질 과정을 위해 필수적입니다. 완벽 하 게 이해 하려면 이러한 프로세스, 환경 내에서 복잡 한 세포내 단백질 상호 작용을 식별 하기 위한 방법이 제시해 주셔야 합니다. 단백질의 상호 작용 협동자를 식별 하기 위해 가장 많이 사용 된 방법 중 하나는 단백질 또는 그 단백질으로 선호도 풀 다운 실험 뒤에 바인딩 단백질의 검출에에서 미끼의 일부의 모방 펩 티 드를 사용 하는. Avidin 비타민 b 복합체 시스템은 높은 선호도, 특이성 및 avidin 비타민 b 복합체1,2간의 안정적인 상호 작용 때문에 자주 사용 됩니다. 일반적으로, 비오 틴 (단백질 또는 펩 티 드) 미끼에 바인딩되어 covalently 및 상호 작용의 설립을 허용 하는 세포 lysates 가진 외피의 기간 후 세포내 파트너에 바인딩된 biotinylated 미끼 avidin 또는 avidin 내려 오게 됩니다. 파생 상품 활용 지원 구슬. 다음, 미끼-단백질 상호 작용은 서쪽 오 점 순이 전기 이동 법을 변성 시키기 의해 세척, 차입, 및 분석 후 검색 됩니다. 이 기술은의 문제 중 하나는 관심사의 단백질 및 세포내 파트너 간의 상호 작용 세포 컨텍스트 외부 자리 하고있다입니다. 이 때문에 그들은 특정 세포내 위치에서 그들은 과도 하 고 그들은 일반적으로 풍부 하지 단백질에 의해 실행 신호 변환 통로에 관련 된 상호 작용에 대 한 특히 중요 하다. 따라서, 세포 lysates 내에서 이러한 상호 작용 수 수 마스크 다른 더 풍부한 단백질 또는 단백질 일반적으로 가까이 하지 않습니다.
세포 관통 펩 티 드 (CPPs) 짧은 펩 티 드 (≤40 아미노산), 거의 모든 셀3에 다양 한 분자를 수송 할 수 있다 양이온 아미노산에 의해 주로 구성 되어 있습니다. 단백질, 플라스 미드 DNA, siRNA, 바이러스, 이미징 에이전트, 다양 한 나노 입자 같은 화물 CPPs을 효율적으로 내 면된4,5활용 되어 있다. 이 수송 능력 때문에 그들은 또한로 알려져 있습니다 단백질 변환 도메인 (PTDs), 막 translocating 시퀀스 (MTSs), 그리고 트로이 펩 티 드. CPPs, 중 문신6 중 하나 되었습니다 가장 널리 HIV transactivator 단백질에서 문신 펩타이드 7,,89공부. 문신은 6 아르기닌과 2 리 진 잔류물을 포함 하 고 결과적으로 높은 양이온은 nonapeptide 이다.입니다. 대체 연구 문신의 순수한 양 전은 진 핵 세포와 그 이후의 국제화10의 플라즈마 멤브레인과 정전기 상호 작용에 필요한 증명 하고있다. 마찬가지로 다른 CPPs에 긍정적으로 위탁 문신 강하게 결속 정전 다양 한 부정 청구 종 세포 외 표면에 세포 막 지질 머리 그룹, proteoglycans3 , glycoproteins 등의 , 10. 생리 화물 문신에 의해 수송 될 그들의 세포내 파트너에 도달 cytosol에서 즉시 무료.
여기 선물이 biotin 세포내 상호 작용을 공부 하는 문신 CPP를 결합 하는 방법. 목표 대상 biomolecule 문신 biotin을 융합 하 여 세포 관통 미끼를 디자인 하는. 이 제안서의 주요 장점은 미끼와 파트너 간의 상호 작용 세포의 컨텍스트 내에서 자리를 차지할 것 이다입니다. 이 방법의 효능 표시 하려면 우리가 사용 미끼 proto-oncogene c-Src11,,1213침 작용할 것으로 보고 되었습니다 Cx43 단백질의 작은 순서. Cx43는 완전 한 막 단백질 이다 이다14널리 표현 하 고 고급 gliomas 아래로 통제 되는 중앙 신 경계15,16,17의 가장 일반적인 악성 종양 ,18. 그것은 되었습니다 이전 c-Src (266-283에에서 아미노산 인간 Cx43;와 상호 작용 하는 Cx43 지역 표시 Pubmed: P17302) 문신 (문신-Cx43266-283)을 융합 c Srcin glioma 세포의 종양 활동을 억제 및 glioma 줄기 세포 (GSCs)19,,2021. 세포내 미끼 디자인, Cx43266-283 는 되었습니다 융합 C-말단에 biotin을 N-말단 (문신-Cx43266-283)에서 문신 (문신-Cx43266-283-B). 이 전략은 성공적으로 사용 되었습니다 쥐 glioma C6 셀 라인에에서 c-Src, c 터미널 Src 키 (CSK)와 인산 가수분해 효소 및 Cx4320의이 지역의 세포내 파트너로 체 (PTEN) tensin 식별 하. 여기, 우리는 매우 관련 된 glioma 치료 하지만 훨씬 더 비 줄기 glioma 셀 보다 transfect에 인간 GSCs에 그 효능을 테스트 하는이 메서드를 설명 합니다.
프로토콜
모든 실험 절차 살라 망 카 대학에서 실행 되었다.
1입니다. 셀
- 절차를 시작 하기 전에 2 일 실험의 하루 confluent 되도록 필요한 밀도에 세포 격판덮개. 플라스 크 또는 접시에 셀 접시 그러나, 단백질 추출 접시에서 쉬울 것입니다. 그것은 준비 하 78 c m2 의 4 접시 또는 2 플라스 크 실험, 당 조건 당 150 c m2 의 확실 하 게 일관 된 결과 편리 합니다.
- 이 연구에서는 150 cm2, 2 %1 %N2, B27 20 ng/mL EGF와 b-FGF 폴라 드 외.22에 설명 된 대로 보충 RHB A 줄기 세포 매체에 경작의 4 플라스 크에 인간의 G166 GSCs 플레이트. 프로세스 합류에 도달 했다입니다. 예를 들어, 5 x 106 G166 셀 150 c m2 플라스 크에 도금 했다 때 그들은 도금 후에 2 일을 처리 했다.
2. Biotinylated CPPs
- 8200 x g 30에 동결 건조 된 biotinylated CPPs (BCPPs)를 포함 하는 튜브를 회전을 뚜껑에 남은 가루 중 일부를 피하기 위해 s. 컨트롤 BCPP 상호 작용 발견 대상 시퀀스의 특정 확인을 포함 합니다. 이 연구에서는 컨트롤 BCPP 문신-비오 틴 (문신-B) 이었고 치료 BCPP 문신 Cx43266-283. 다른 컨트롤 biotin 문신 스크램블 또는 돌연변이 융합된 조각 본드 같은 사용 될 수 있습니다.
- 재고 솔루션 제조 업체;로 표시에 해당 문화 매체에서 BCPPs를 분해 예를 들어, 2 mg/mL의 재고 솔루션을 얻기 위해 BCPP GSCs를 치료 하는 BCPP의 1mg을 포함 한 유리병에 GSC 문화 매체의 0.5 mL을 추가 합니다. 소용돌이 펩 티 드 잘 녹는 다는 것을 확인 하 고.
3입니다. 튜브
참고: 섹션 7에 필요 조건 당 적어도 12 1.5 mL 튜브 준비.
- 조건 당 처음 3 튜브를 표시 합니다. 그들은 단계 6.4에서에서 얻은 세포 lysates의 총 볼륨을 있을 것 이다.
- 조건 당 3 관에서 A를 표시 합니다. 이러한 튜브 lysing 및 세포 lysates 회전 단계 7.2 후 얻은 첫 번째 supernatants 있을 것 이다.
- 조건 당 3 튜브에 B를 표시 합니다. 이러한 튜브는 첫 번째 supernatants의 작은 약 수가 있을 것 이다. 이러한 lysates 단계 7.3에서에서 서쪽 오 점 샘플 될 것입니다.
- 표시 조건 당 3 관에서 C. 이러한 튜브는 NeutrAvidin, 단계 7.7와 풀 다운 후 얻은 supernatants 있을 것 이다.
참고: 이것이 중요 한 경우에 서쪽 오 점 보였다 단백질, 단백질 내려 오게 하지 했다 또는 절차의 어떤 단계에서 분실 된 의미에 대 한 신호. 만약이 상황이 라면, 풀 단백질 다운 프로세스를 반복 합니다.
4. 세포 치료는 BCPPs
- 문화 매체 발음
- 신선한 매체 품 어 부 화 시간에 따라 매체의 가장 작은 가능한 볼륨에 BCPPs 하는 데 필요한의 해당 볼륨을 교체 합니다. 그것은 매우 중요 한 그 어떤 경우에, 매체 커버 완전히 접시/플라스 크의 표면 전체를 셀 밖으로, 예를 들어, 6 mL 30 분 부 화에 대 한 150 c m2 당 건조 하지 마십시오.
- 효과가 입증 된 농도 도달 하는 세포 배양에 BCPP의 재고 솔루션의 볼륨을 추가 합니다. 이 연구 50 µ M 문신-Cx43266-283-B는 GSC 확산을 줄이기 위해 입증 되었다.
- 따라서, 문신-Cx43266-2832 mg/mL의 92.8 µ L를 추가-B (MW = 3723.34 g/mol) 50 µ M 문신-Cx43266-283의 최종 농도를 문화 매체의 mL 당. 추가 볼륨 컨트롤 펩 티 드에 대 한 다른 경우 동일한 최종 볼륨까지 배양 완료. 예를 들어, 49.1 µ L 문신 B (MW = 1914.31 g/mol) 43.7 µ L GSC 매체 플러스 50 µ M의 최종 농도를 문화 매체의 mL 당 추가 된 문신.
- BCPP와 세포내 파트너 간의 상호 작용 일어난다 되도록 30 분 동안 37 ° C, 5% CO2 배양 기에서 세포를 놓습니다. 상호 작용 오래 걸리면, 더 긴 시간 품 어 하거나 실험 한 시간 코스의 구성 하는 경우에 시간을 조정 합니다. 또한, 관심의 상호 작용 승진 수 있다 또는 자극 다른 세포내 신호 통로 의해 방해.
5. 버퍼 및 솔루션.
- PBS pH 7.4: 136 m m NaCl; 준비 2.7 m m KCl; 7.8 m m 나2HPO4·2H2O; 1.7 mM KH2포4.
- 단백질 세포의 용 해 버퍼 준비: 20 mM Tris HCl (pH 8.0), 137 mM NaCl, 1% 사용, IGEPAL, 사전에 다음 추가: 1/100 (v/v) 프로 테아 제 억제 물 칵테일, 1mm 나트륨 불 소, 1 m m Phenylmethanesulfonyl 불 소 (PMSF) 및 0.1 m m 나트륨 orthovanadate.
- Laemmli 버퍼 준비: (4 배: 0.18 M Tris HCl pH 6.8; 글리세롤 5 M; 3.7 %SDS (p/v), 0.6 M β-mercaptoethanol 또는 9 mM DTT; 0.04% (v/v) bromophenol 블루 (BB)).
6. 단백질 추출
참고: 앞에서 설명한20,23으로 단백질 추출 수행 되었다. 이 모든 섹션 4 ° c.에 절차의 수행
- 문화 매체를 완전히 발음.
- 워시 3 x 10 mL의 얼음 처럼 차가운 인산 염으로 세포 분리를 피하기 위해 매우 신중 하 게 염 분 (PBS) 150 c m2 당을 버퍼링 합니다.
- 세포 lysate를, 세포의 용 해 버퍼 150 c m2 당 3 mL를 추가 하 고 철저 하 게 셀 스 크레이 퍼를 사용 하 여 표면을 긁어. 약 45도 접시/플라스 크를 기울이기 쉽게 자신의 해당 튜브에 세포 lysates 수집 하.
- 3 1.5 mL 튜브에 세포 lysate 관 당 1 mL를 붓는 다. 이러한 튜브 상태와 복제 단계 3.1에에서 표시 된 대로 표시 됩니다.
7. 풀-다운
- 1.5 mL 튜브 4 ° c.에서 10 분 11000 x g 에서 원심
- 새로운 튜브 (A)는 supernatants 전송.
- 다른 튜브 (B), 즉 50 µ L 튜브 당 조건 당이 상쾌한의 약 수 가져가 라. 4 x Laemmli 버퍼 (lysate의 50 µ L에 대 한 16.6 µ L)를 추가 하 고-20 ° c.에 동결 이러한 lysates 평소 서쪽 오 점 샘플을 될 것입니다.
- 부드러운 진동에 의해 잘 NeutrAvidin Agarose 균질. 그들의 직경을 증가 하 고 구슬의 pipetting 향상 피 펫 팁의 끝을 잘라.
참고: supernatants (D 관) 준비가 지금 서쪽 오 점에 로드할 수 또는-20 ° c.에 동결
8. 서쪽 오 점
참고: 앞에서 설명한24로 수행 되었다 서 부 럽.
- Midi-셀 전기 시스템에서 두번째-트리 스 (4-12%) midigels에 차선 당 각 샘플의 동일한 볼륨을 로드 합니다.
- Transblot 단백질 니트로 일반 스택으로 건조 더 럽 히 시스템을 사용 하 여.
- 10% 막 얼룩 Ponceau 10 분.
- TTBS의 5 mL와 함께 3 x 5 분 막 씻으십시오.
- 부드러운 튜브 또는 작은 상자에 떨고와 1 시간에 대 한 TTBS에서 7% 우유와 함께 막 차단 합니다. 사용 하는 볼륨 멤브레인을 커버 하기에 충분 하 고는 그들은 건조 하지 마십시오, 즉 전체 midi 막 당 40 mL 다는 것을 확인 하십시오.
- TTBS의 5 mL와 함께 3 x 5 분을 씻어.
- 부드러운 진동으로 관심사의 단백질에 대 한 1 차적인 항 체와 4 ° C에서 밤새 품 어.
- TTBS의 5 mL와 함께 3 x 5 분을 씻어.
- 특 파 원 과산화 효소 활용 된 이차 항 체 TTBS에 1 시간에 대 한 실내 온도에서 막 품 어.
- TTBS의 5 mL와 함께 3 x 5 분을 씻어.
- 화학 시스템 chemiluminescent 기판으로 개발.
9. 문제 해결
- 개발 후 서쪽 모든 단백질을 위한 신호를 보여준 샘플의 오 점는 Ponceau 확인.
레인을 따라 수많은 밴드 로드 및 참고: Ponceau에 막 정의 되지 않은 표시 한다. 밴드 매우 눈에 띄는 경우, 로드 하는 단백질의 양이 충분 하지 않을 수 있습니다 또는 올바르게 사라 하는 전이 할 수 있습니다. 서쪽 오 점 반복 되는 것이 좋습니다. - 모든 레인에 Ponceau 막에 전혀 아무 얼룩 경우, (C) 튜브에서 7.4 단계에서 전체 절차를 반복 합니다.
- 서쪽 오 점 개발 후 단백질 신호는 매우 약한 경우는 Ponceau 보였다 단백질, 긴 시간에 대 한 1 차 항 체로 막을 다시 품 어. 신호가 여전히 다소 약한 경우에, 다시 실 온에서 품 어.
10. 기타 기술 사용 하는이 기사에서
- BCPPs의 Immunocytochemistry
- 20 분 동안 4 %paraformaldehyde (0.2 mL c m2당)에 있는 셀을 수정 합니다.
- PBS (0.2 mL c m2당)를 가진 3 x 5 분을 씻어.
- 하룻밤 4 ° c.에 대 한 관심의 단백질에 대 한 제조 업체의 지정 된 농도에서 항 체 용액에 희석 해당 항 체 (c m2당 0.15 mL 이상) 적용
- fluorophore 활용 된 이차 항 체 (c m2당 0.15 mL) 실 온에서 2 h와 함께 품 어.
- 관심사의 단백질에 대하여 다른 항 체와 단계 10.1.2-10.1.4를 반복 합니다. 다른 기본 항 체 또는 이차 항 체에 대 한 동일한 파장 fluorophores 같은 종족을 사용 하지 않기 위하여 주의 해야 합니다.
- Antifade 시 약 (c m2당 0.005 mL)을 사용 하 여 셀을 탑재 합니다.
- 디지털 카메라에 연결 된 형광 현미경에 분석.
- MTT 분석 결과
- 24-잘 접시에서 37 ° C에서 세포 문화.
- 셀 MTT 0.5 mg/mL를 포함 하는 c m2 당 문화 매체의 0.15 mL와 75 분 동안 어둠 속에 품 어.
- 매체를 발음 하 고 디 메 틸 sulfoxide (c m2당 0.25 mL) 가벼운 동요와 함께 어둠 속에서 10 분에 대 한 셀을 품 어.
- 570의 파장에서 흡 광도 측정 nm microplate 리더를 사용 하 여.
결과
BCPPs를 사용 하 여 세포 상호 작용을 공부를 하기 전에 BCPP vs BCPP으로 얻은 결과 확인 하는 CPP의 효과 비교 하 여 중요 하다. 따라서, 공부 하 고 대상 시퀀스의 활동을 수정 하는 비오 틴의 포함 여부, 우리가 먼저 분석 문신 Cx43266-283의 효과-B 문신 Cx43266-283 G166 GSCs 형태에 비해. 이렇게 하려면, 우리는 F-말라와 α-tubulin 치료의 24 시간 후 cytoskeletal 단백질의 일부 면역 형광 분석을 수행. 그림 1 보여줍니다 G166 GSCs 50 µ M 문신-Cx43266-283 또는 문신 Cx43266-283있을 때-B 인수 문신 (문신 B) 컨트롤에 표시 된 길쭉한 및 확장 된 셀룰러 연장에 비해 더 둥근된 모양. 사실, 그림 1b 걸 필 라 멘 트 셀 문신 Cx43266-283 또는 문신 Cx43266-283로 치료 했다 때 말라 네트워크로 조립 대부분은 보여줍니다-그들은 더 많은 걸 번들 컨트롤 셀에 형성 하는 동안 B (문신 치료 또는 TAT-B)25. 대조적으로, α-tubulin 배포 다른 조건 사이 다 하지 않습니다. 이 결과 biotin의 존재 G166 GSCs의 형태에 대상 시퀀스의 효과 수정 하지 않았다 보여주었다. 이전 연구20,21, 우리는 문신-Cx43266-283 G166 GSCs 확산 감소 다는 것을 보였다. 이 연구에서 우리는 조사 여부 문신 Cx43266-283-B 문신 Cx43266-283로 성장에 동일한 효과 발휘 한다. 이렇게 하려면, 우리가 치료의 72 h 후 MTT 분석 결과 의해 G166 GSCs 확산 분석. MTT 분석 결과 세포 신진 대사 활동을 평가 하기 위한 색도계 분석 결과가 이다. MTT는 존재 가능한 셀의 수를 반영 하는 미토 콘 드리 아에 NAD (P) H oxidoreductase 효소에 의해 물질 대사로 변화. 그림 2 는 G166 GSCs 세포 생존 능력에 있는 감소 아니다는 것을 크게 다른 때 셀 50 µ M 문신-Cx43266-283 또는 50 µ M 문신-Cx43266-283로 치료 했다. 사실, 둘 다 크게 컨트롤, 문신 또는 문신 B에 비해 G166 GSCs 확산 감소
일단 우리가 우리의 대상 시퀀스 G166 GSCs (문신-Cx43266-283)에서 효과 C-말단에 biotin의 포함에 의해 수정 되지 않았음을 확인 (문신-Cx43266-283-B), 우리이 시퀀스의 세포내 파트너 조사 프로토콜에 따라이 연구 (그림 3)에서 설명 합니다. Caveolae 문신 국제화26의 메커니즘에 참여 하고있다, 때문에 우리 분석 caveolin-1 (기갑 부 대-1) 풀-다운에서의 존재를 했다. 서쪽 오 점 분석 (그림 4) 보였다 그 문신 B와 문신 Cx43266-283-B 기갑 부 대-1 상호 작용. 그러나, 문신-Cx43266-283의 능력-B c-Src, PTEN, CSK 모집 문신 b 발견 보다 강하다 초점 접착 키 니 아 제 (팍) Cx43 상호 작용을 표시 하지 c Src의 기판입니다. 실제로, 팍 문신 B 또는 문신 Cx43266-283와 어떤 중요 한 상호 작용을 보여 주지 않았다.
문신-Cx43266-283사이의 상호 작용을 확인 하려면-B와 c-Src, G166 GSCs incubated 했다와 50 µ M 문신-Cx43266-283-B 30 분 및 그들의 지역화에 대 한 선행 되었다 형광 streptavidin과 confocal 현미경 검사 법 (그림 5 ). 우리의 결과 세포내 분포를 보여 문신 Cx43266-283의-B (phosphatidylserine 얼룩이 표시) 원형질 막 가까이 c-Src의 일치. 공동 지역화 분석 사이 문신 Cx43266-283공동 지역화 (흰색)의 몇 가지 포인트를 공개 하는 사실, B-와 c-Src 병합 이미지에. 따라서, confocal 현미경 검사 법 학문 BCPP 풀 다운 프로토콜 설명 하는이 연구에서 얻은 결과 확인 합니다.
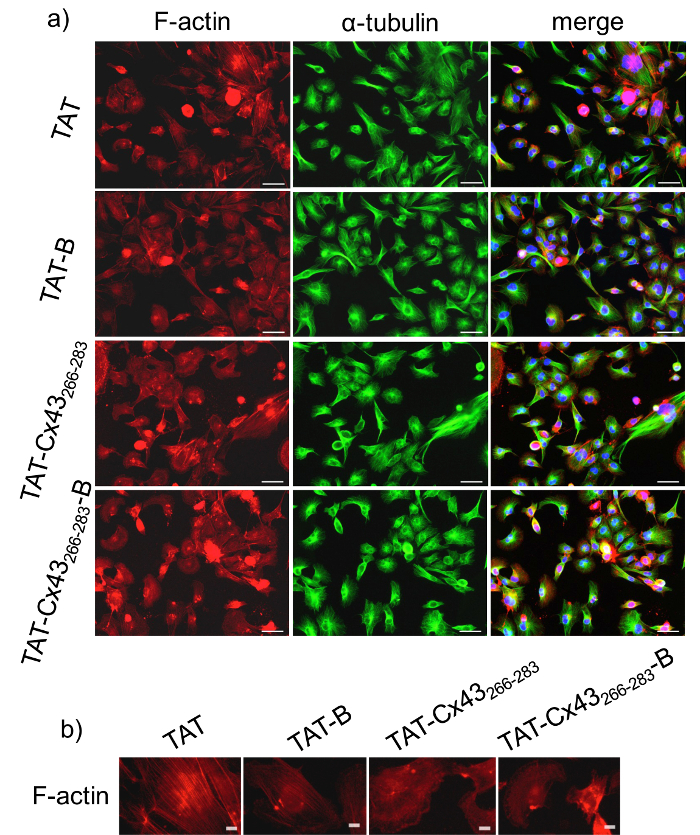
그림 1: GSC 형태학에 BCPP 및 CPP의 효과.
G166 GSCs 낮은 밀도에서 도금 했다 (2 x 104 의 세포 / cm2) 그들은 50 µ M 제어 CPP (문신) incubated 했다 24 h 후 BCPP (문신-B), CPP (문신-Cx43266-283) 치료 또는 치료 BCPP 제어 (문신-Cx43266-283-B) . a) F-말라 (빨강), α-tubulin (녹색)와 병합 + DAPI G166 GSCs 형태를 표시 하는 동일한 필드의 immunostaining. 바 = 50 µ m. b) F 걸 immunostaining F-말라 G166 GSCs 50 µ M와 24 h에 대 한 부 화 후에 다른 분포를 보여 주는 CPP (문신)를 제어 하거나 50 µ M 치료 CPP (문신-Cx43266-283) 비해 BCPP (문신-B) 또는 BCPP (문신-Cx43 제어 266-283-B). 바 = 10 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: GSC 생존에 BCPP 및 CPP의 효과.
G166 GSCs 5500 셀/cm2 24 multiwell 격판덮개 도금 되었고 50 µ M 컨트롤 펩 티 드, CPP (TAT) 또는 BCPP (문신-B), 또는 50 µ M 치료 펩 티 드, CPP (문신-Cx43266-283) 또는 BCPP incubated (문신-Cx43266-283-B). 세포 생존 능력 72 h 후 MTT 분석 결과 사용 하 여 분석 했다. 결과 MTT absorbances로 표현 되며 3 실험 평균 ± s.e.m. (+ + p˂0.01 vs 통제. * * p˂0.01, * * * p˂0.001 대 문신 또는 문신 B; 일방통행 ANOVA 테스트 withTukey는 후). CPPs 대 BCPPs.의 효과 사이의 중요 한 차이 없는 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
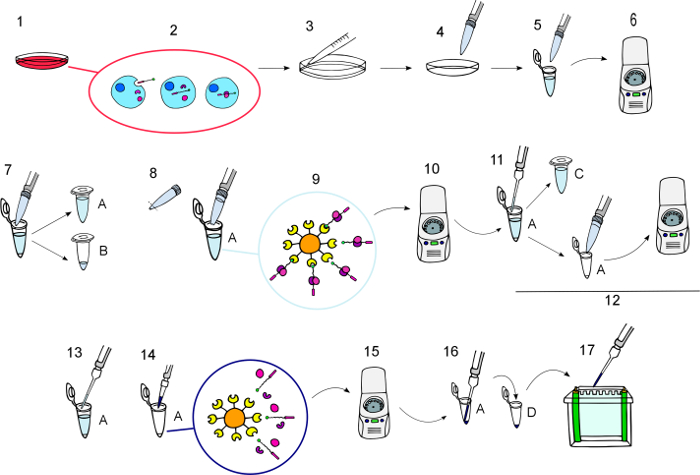
그림 3: 프로토콜 다이어그램입니다.
Eluted BCPPs 및 그들의 상호 작용 단백질 obtained.1 때까지 BCPPs의 섹션은 부 화에서 "프로토콜"에서 설명한 대로 절차의 단계적으로 그래픽 묘사) 문화에 대 한 원하는 농도에서 BCPPs 셀을 품 어는 필요한 시간입니다. 2) 동안 보육는 BCPPs 내 면 하 고 그들은 그들의 세포내 파트너와 상호 작용 합니다. 3) 얼음 처럼 차가운 PBS 가진 얼음에 세 번 셀 세척. 4) 단백질을 추출 하는 세포를 lyse. 5) 튜브에 세포 lysates 전송.6) 4 ° c.에서 10 분 11000 x g 에서 회전 7) 전송 새로운 튜브 (A)와 일반 부로 처리 하려고 lysates의 작은 약 수를 계속 supernatants 얼룩에 샘플 튜브 (B). 8) resuspend NeutrAvidin Agarose 구슬 고 컷된 피 펫 팁을 사용 하는 각 관에 50 µ L를 추가 합니다. 9) NeutrAvidin agarose 구슬 BCPPs 및 그들의 파트너와 상호 작용할 수 있도록 4 ° C에서 12 h 동안 부드럽게 흔들어 함께 품 어. 10)는 biotinylated와 구슬 펠 렛을 3000 x g 에서 1 분 동안 회전 미끼 그리고 그들의 상호 작용 단백질 그들에 바인딩된. 11) 새로운 관 (C)에 supernatants 전송 및 풀-다운 반복 해야 하는 경우에 사용 하는 그들을 유지. 12) 세척 5 회 신선한 세포의 용 해 버퍼와 펠 릿, 반전, 3000 x g 에서 1 분 동안 회전 급강하에 의해 resuspend 하 고는 상쾌한 삭제. 13) 모든 상쾌한 신중 하 게 제거 합니다. 14) 추가 원하는 양의 Laemmli 버퍼 x 4 하 고 5 분 15 100 ° C에서 단백질을 elute) 8200 x g 30에 스핀 s 작은 구슬. 16) 상쾌한 새로운 관 (D)에 모 세관 팁에 eluted 단백질 전송. 17) 서쪽 오 점 분석을 위한 젤에 로드 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
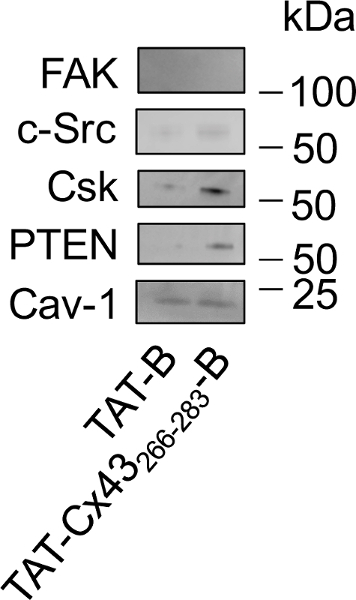
그림 4: 연구-풀 다운에 의해 G166 GSCs B 서쪽 오 점 뒤에 문신-Cx43266-283의 세포 상호 작용의.
G166 GSCs 50 µ M 문신 B 또는 문신 Cx43266-283와 알을 품을 했다. 후 30 분 셀 lysed 했다 및 문신 B 또는 문신 Cx43266-283-B 그들의 세포내 파트너에 연결 된 NeutrAvidin 구슬 내려 오게 했다. Eluted 단백질 로드 되었고 팍, c-Src, CSK, 레벨을 공부 하는 서쪽 오 점 분석 PTEN 및 기갑 부 대-1. 기갑 부 대-1 두 문신 B와 상호 작용 하 고 문신 Cx43266-283-B, c-Src, PTEN, CSK 여기서 우선적으로 문신 Cx43266-283-B와 팍 문신 B 또는 문신 Cx43266-283와 어떤 상호 작용을 보여 주지 않았다-B. 하시기 바랍니다 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
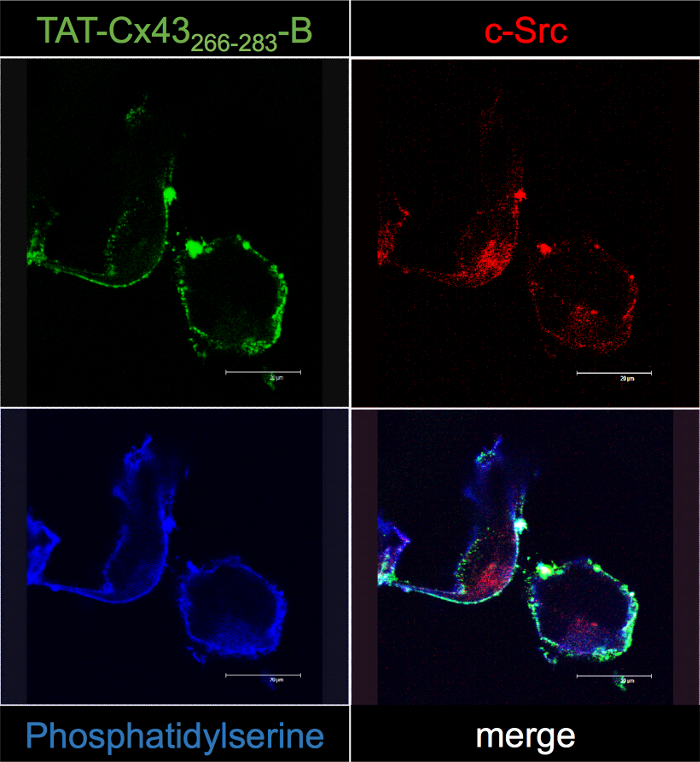
그림 5: 문신-Cx43266-283-B 세포 상호 작용의 G166 GSCs에 confocal 현미경 검사 법에 의해 확인.
G166 GSCs 50 µ M 문신-Cx43266-283와 알을 품을 했다. 30 분 후 셀 고정 되었고 문신 Cx43266-283지역화를 처리-면역 형광 (빨간색)와 phosphatidylserine annexin V (파란색)와 c-Src Cy2 Streptavidin (녹색), B. 문신-Cx43266-283사이 공동 지역화 (흰색)의 몇 가지 포인트를 참고-B와 c-Src 병합 이미지에 원형질 막 가까이. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
단백질 단백질 상호 작용을 공부 하는 많은 방법이 있다. 이 연구에서 제시 하는 방법 biotinylated 미끼와 상호 작용의 설립을 허용 하도록 세포 lysates incubated 널리 biotin avidin 풀 다운 시스템을 기반으로 합니다. 이 연구에서 제시 하는 수정이이 기술은 세포 관통 시퀀스의 조합을 포함 합니다. 우리는 세포 lysates 대신 살아있는 세포와 알을 품 수 세포 관통 미끼 디자인을 제안 하 고 따라서 발견 상호 작용 세포 컨텍스트 내에서 발생 하는 그 반영 됩니다.
여기 우리 풀 다운 태그와 인간 GSCs에 세포 상호 작용을 찾을 대상으로 아미노산 266-283 사이 구성 하는 Cx43의 지역으로 세포 관통 시퀀스, biotin 문신 사용 합니다. Cx43와 c-Src 간의 상호 작용에 대 한 구조적으로 잘 알려진11,12입니다. 이것은 중요 한 상호 작용 그것은 c-Src glioma 셀24,13의 종양 활동을 억제 하기 때문에. 사실, 포함 하는이 지역 (문신-Cx43266-283) CPPs glioma 셀19,,2021에 Cx43의 antioncogenic 속성 모방. 쥐 glioma C6 셀에는 문신-Cx43266-283 c Src 억제 메커니즘 생 억제제 CSK와 PTEN20c-Src의 채용을 포함 한다. 그것은 GSCs 그들은 기존의 치료에 저항 하 고 그러므로27이 악성 뇌 종양 재발에 대 한 책임 부분 모집단을 구성 하기 때문에 매우 흥미로운 glioma 치료에서 대상으로는 언급 한다. 또한, 그들은 하드 transfect 세포 그리고 그러므로 세포 상호 작용의 연구 더 어려워집니다. CPPs는 신속 하 고 효율적으로 내 면 GSCs19 세포내 상호 작용의 학문을 위한 그들의 사용을 선호. 이에 연구, 우리 Cx43266-283 시퀀스의 c-Src의 내 생 억제제 CSK 및 인간 GSCs에 PTEN 함께 상호 작용을 확인 CPPs biotin에 융합을 사용 하 여.
이 메서드는 매우 강력한 생리 활성 화합물의 세포내 기계 장치를 공부 하. 그러나, biotinylated 세포 관통 미끼의 생물학적 효과 비-biotinylated 하나 얻은 다른는 것인지 매우 중요 하다. 이 단계는 생리 활성 화합물의 효과 함께 발견 하는 상호 작용을 연결 해야 합니다. 더하여, 프로 테아 제에 의해 그것의 가능한 저하 뿐만 아니라 그것의 가능한 독성 화합물의 안정성 해야 될 신중 하 게 테스트 및 실험을 계획 하기 전에 고려. 예에서 제시 G166 인간 GSCs에 문신-Cx43266-283 의 안티 증식 효과 이전 문서화20되었습니다. 이 연구에서 우리가 확인 문신 Cx43266-283의 안티 증식 효과-B 이며 문신-Cx43의266-283 매우 유사. 또한, 세포 형태학의 분석을 α-tubulin 밝혀 및 문신 Cx43266-283치료 G166 GSCs F 걸 배포 매우 비슷합니다.-B 또는 문신 Cx43266-283. 이러한 결과 문신-Cx43266-283 의 c-말단에 biotin의 포함 인간 GSCs에이 화합물의 효과 수정 하지 않은 나타냅니다. 그러나, biotin bioactive 분자의 효과 수정 것 이다 단백질 정화에 대 한 다른 태그 시험 될 수 있다, 플래그 octapeptide (DYKDDDDK)28, 인간의 인플루엔자 조류 파생 태그 하 (YPYDVPDYA) 또는 티 등 S-전이 효소 (GST)29 마찬가지로, 문신의 셀 인구 대상 하지 않는, 다른 penetratin, MPG (검토,30참조)에 대 한 같은 관통 시퀀스 셀 또는 셀 특정 시퀀스 사용된31일 수 있다.
구체적으로 대상 시퀀스와 상호 작용 하는 연구 단백질 이외에, 모두 컨트롤 및 대상 시퀀스와 상호 작용 하는 단백질 및 긍정적이 고 부정적인 컨트롤, 그들 상호 작용 하지 않는 단백질의 존재 해야 합니다. 해결. 이런이 의미에서 우리가 컨트롤에 기갑 부 대-1를 발견 하 고 같이 그것은 되었습니다 이전26는 caveolae 국제화의 메커니즘에 관여 제안 처리 상황. 또한, 팍, c-Src와 상호 작용 하지만 하지 Cx43 c 단자와 상호 작용 하도록 되어, 결 석 했다 제어 및 치료 상황에. 이러한 결과 문신-Cx43266-283-B, c-Src, CSK와 PTEN 사이 상호 작용의 특이성을 강화합니다. 이 프로토콜으로 얻은 결과 확인 하려면 상호 작용 단백질의 분포를 시각화 하 고 그들의 공동 지역화 연구 confocal 현미경 검사 법을 사용할 수 있습니다. 따라서, 우리는 그 문신 Cx43266-283-B와 c-Src 전시 풀 다운 실험으로 얻은 결과 확인 하는 공동 지역화의 몇 가지 포인트와 유사한 세포내 분포를 발견. 사실, 문신-Cx43266-283-B는 화물,이 연구 Cx43266-283, 지시 분자 세포내 파트너를 제안 하는 원형질 막 가까이 배포 됩니다.
제안된 된 방법의 한계 중 하나는 미끼 제대로 접어 하는 데 실패할 수 있습니다 사용 하는 분자와 예상된 효과 것입니다 찾을 수 없습니다입니다. 이 상황에서 발견 하는 상호 작용 수 없습니다 효과에 연결. 그러나,이 방법 때문에 그들은 일반적으로 본질적으로 무질서 지역32 에 의해 실행, 따라서 필요 없습니다 주문 접는 특히 신호 전달 경로에 관련 된 상호 작용에 대 한 흥미로운 수 있습니다. 또한, 제안된 된 방법의 장점 중 하나는 상호 작용의 시간 과정 지켜질 수 있다,이 특히 과도 상호 작용에 대 한 관련입니다. 또한, 상호 작용에 각 잔류물의 관련성은 쉽게 공부 될 수 있다. 실제로, 그것은 떠들고 또는 트레오닌 조미료의 phosphomimetic 대체 하 여 단백질 단백질 상호 작용, 예를 들어,에 posttranslational 수정의 관련성을 연구 수 있습니다. 마찬가지로, 떠들고 또는 알라닌에는 트레오닌, 페닐알라닌을 위한 티로신의 대체 비 phosphorylatable 떠들고, 트레오닌 또는 티로신. 의 효과 테스트를 수합니다인 티로신을 모방 하는 가장 정확한 방법은 p Tyr33Tyr의 대체입니다.
마지막으로,이 프로토콜의 범위는 단백질 단백질 상호 작용 보다 훨씬이 시스템 RNA 시퀀스, 나노 입자, 바이러스 또는 biotin을 융합 하 고 공부 하는 CPP로 불리고 수 있는 다른 분자 같은 다른 생리 활성 화물에 적용 될 수 있기 때문에 세포내 메커니즘에 대 한 그들의 행동의.
공개
저자는 공개 없다.
감사의 말
우리가 그들의 자신의 풀 다운 프로토콜에 대 한 CPPs 및 제 아리 발로의 디자인에 대 한 M. 모 랄 레 스와 제이 브라 보 감사합니다. 우리는 토니 델 레이의 기술 지원에 대 한 감사입니다. 이 작품은 정부의 드 Economía y Competitividad, 스페인;에 의해 지원 되었다 페더 BFU2015-70040-R, 군부 de Castilla y León, 스페인; 페더 SA026U16와 Fundación 라몬 Areces입니다. M. Jaraíz-로드리게스와 A. 곤살레스-산체스는 군부 de Castilla y León에서에서 친목과 유럽 사회 기금 받는 사람.
자료
| Name | Company | Catalog Number | Comments |
| G166 GSC line | BioRep | ||
| RHB-A stem cell medium | Takara | Y40001 | |
| Laminin Mouse Protein | Invitrogen, Life Technologies, ThermoFisher Scientific | 23017-015 | 10 µg/ml |
| B-27 Serum free Supplement (50X) | Invitrogen, Life Technologies, ThermoFisher Scientific | 17504-044 | 2% |
| N-2 Supplement (100x) | Invitrogen, Life Technologies, ThermoFisher Scientific | 17502-048 | 1% |
| Recombinant Human EGF | Peprotech | AF-100-15 | 20 ng/ml |
| Recombinant Human b-FGF | Peprotech | AF-100-18B | 20 ng/ml |
| PBS pH 7.4: In deionized water, 136 mM NaCl ; 2.7 mM KCl; 7.8 mM Na2HPO4·2H2O ; 1.7 mM KH2PO4 | |||
| Accutase | Sigma | A6964 | |
| Cryostor CS10 cryopreservation medium | StemCell Technologies | 7930 | |
| TAT | GenScript | - | Custom made |
| TAT-B | GenScript | - | Custom made |
| TAT-Cx43266-283 | GenScript | - | Custom made |
| TAT-Cx43266-283-B | GenScript | - | Custom made |
| Alexa Fluor 594 Phalloidin | Molecular Probes, Life Technologies, ThermoFisher Scientific | A1275737 | 1/20 |
| Monoclonal α-tubulin mouse antibody | Sigma-Aldrich | T9026 | 1/500 |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes, Life Technologies, ThermoFisher Scientific | 1.25 mg/ml | |
| Pierce™ NeutrAvidin™ Agarose | ThermoFisher Scientific | 29200 | |
| Protein lysis buffer: 5 mM Tris-HCl (pH 6.8), 2% (w/v) SDS, 2 mM EDTA , 2 mM EGTA | |||
| Protease Inhibitor Cocktail Set III. EDTA-Free | Calbiochem, Bionova | 539134 | 1/100 (v/v) |
| Sodium Fluoride | PanReac AppliChem | 141675 | 1 mM |
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma-Aldrich | P7626 | 1 mM |
| Sodium orthovanadate | Sigma-Aldrich | S6508 | 0.1 mM |
| Laemmli buffer: (4x: 0.18 M Tris-HCl pH 6.8; 5 M glycerol; 3.7 % (w/v) SDS; 0.6 M β-mercaptoethanol or 9 mM DTT ; 0.04% (v/v) bromophenol blue (BB) . | 1X | ||
| Xcell 4 SureLock Midi-Cell Electrophoresis System | Life Technologies, ThermoFisher Scientific | WR0100 | |
| NuPAGE Novex Bis-Tris Midi-Gels 4-12% | Life Technologies, ThermoFisher Scientific | WG1402box | |
| NuPAGE MOPS SDS Running Buffer (20X) | Life Technologies, ThermoFisher Scientific | NP0001 | 1X |
| NuPAGE Transfer Buffer 20x | Life Technologies, ThermoFisher Scientific | NP0006 | 1X |
| Precision Plus Protein Dual Color Standard | Bio-Rad | 161-0374 | |
| iBlot 2 NC Regular Stacks (nitrocellulose membranes) | Life Technologies, ThermoFisher Scientific | IB23001 | |
| iBlot 2 Dry Blotting System - Gel transfer device | Life Technologies, ThermoFisher Scientific | IB21001 | |
| 10% Ponceau S Solution (0.1% Ponceau (w/v) in 5% acetic acid (v/v)) in water | Sigma | P7170 | |
| FAK polyclonal rabbit antibody | Life Technologies, ThermoFisher Scientific | AHO0502 | 1/500 |
| Src polyclonal rabbit antibody | Cell Signalling (WERFEN) | 2108S | 1/500 |
| Csk polyclonal rabbit antibody | Cell Signalling (WERFEN) | 4980 | 1/500 |
| PTEN polyclonal mouse antibody | Cell Signalling (WERFEN) | 9552 | 1/500 |
| Caveolin-1 polyclonal rabbit antibody | Abcam | ab2910 | 1/1000 |
| Goat anti-mouse IgG-HRP antibody | Quimigen, Santa Cruz Biotechnology | Sc-2005 | 1/5000 |
| Goat anti-rabbit IgG-HRP antibody | Quimigen, Santa Cruz Biotechnology | SC-2030 | 1/5000 |
| Western Blotting Luminol Reagent | Santa Cruz Biotechnology | SC-2048 | |
| Src polyclonal rabbit antibody | Cell Signalling (WERFEN) | 2108S | 1/500 |
| Antibody solution: PBS, 10% FBS, 0.1 M lysine, 0.02% sodium azide | |||
| Alexa Fluor 488 goat anti-mouse IgG | Invitrogen, Life Technologies, ThermoFisher Scientific | A11029 | 1/1000 |
| Cy2-conjugated streptavidin | Jackson ImmunoResearch | 016-220-089 | 1/500 |
| MicroChemi Luminescence system | DNA Bio-Imaging Systems | ||
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor® 488 & Propidium Iodide (PI) | Molecular Probes, Life Technologies, ThermoFisher Scientific | V13241 | 1/500 |
| SlowFade Gold antifade reagent | Life Technologies, ThermoFisher Scientific | S36936 | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | |
| Dimethyl sulfoxide for UV-spectroscopy, >=99.8% (GC) | Honeywell | 41641-1L | |
| Appliskan 2001 | Thermo Electron Corporation, Thermo Scientific |
참고문헌
- Green, N. M. Avidin. 3. The nature of the biotin-binding site. Biochem J. 89, 599-609 (1963).
- Wilchek, M., Bayer, E. A. Applications of avidin-biotin technology: literature survey. Methods Enzymol. 184, 14-45 (1990).
- Herce, H. D., Garcia, A. E., Cardoso, M. C. Fundamental molecular mechanism for the cellular uptake of guanidinium-rich molecules. J Am Chem Soc. 136 (50), 17459-17467 (2014).
- Ramsey, J. D., Flynn, N. H. Cell-penetrating peptides transport therapeutics into cells. Pharmacol Ther. 154, 78-86 (2015).
- Fominaya, J., Bravo, J., Rebollo, A. Strategies to stabilize cell penetrating peptides for in vivo applications. Ther Deliv. 6 (10), 1171-1194 (2015).
- Vives, E., Brodin, P., Lebleu, B. A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus. J Biol Chem. 272 (25), 16010-16017 (1997).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol Med. 13 (10), 443-448 (2007).
- Brooks, H., Lebleu, B., Vives, E. Tat peptide-mediated cellular delivery: back to basics. Adv Drug Deliv Rev. 57 (4), 559-577 (2005).
- Cuesto, G., et al. Phosphoinositide-3-kinase activation controls synaptogenesis and spinogenesis in hippocampal neurons. J Neurosci. 31 (8), 2721-2733 (2011).
- Schmidt, N., Mishra, A., Lai, G. H., Wong, G. C. Arginine-rich cell-penetrating peptides. FEBS Lett. 584 (9), 1806-1813 (2010).
- Sorgen, P. L., et al. Structural changes in the carboxyl terminus of the gap junction protein connexin43 indicates signaling between binding domains for c-Src and zonula occludens-1. J Biol Chem. 279 (52), 54695-54701 (2004).
- Giepmans, B. N., Hengeveld, T., Postma, F. R., Moolenaar, W. H. Interaction of c-Src with gap junction protein connexin-43. Role in the regulation of cell-cell communication. J Biol Chem. 276 (11), 8544-8549 (2001).
- Tabernero, A., Gangoso, E., Jaraíz-Rodríguez, M., Medina, J. M. The role of connexin43-Src interaction in astrocytomas: A molecular puzzle. Neuroscience. 323, 183-194 (2016).
- Giaume, C., Koulakoff, A., Roux, L., Holcman, D., Rouach, N. Astroglial networks: a step further in neuroglial and gliovascular interactions. Nat Rev Neurosci. 11 (2), 87-99 (2010).
- Shinoura, N., et al. Protein and messenger RNA expression of connexin43 in astrocytomas: implications in brain tumor gene therapy. J Neurosurg. 84, 839-845 (1996).
- Soroceanu, L., Manning, T., Sontheimer, H. Reduced expression of connexin-43 and functional gap junction coupling in human gliomas. Glia. 33, 107-117 (2001).
- Pu, P., Xia, Z., Yu, S., Huang, Q. Altered expression of Cx43 in astrocytic tumors. Clin Neurol Neurosurg. 107 (1), 49-54 (2004).
- Crespin, S., et al. Expression of a gap junction protein, connexin43, in a large panel of human gliomas: new insights. Cancer Med. 5 (8), 1742-1752 (2016).
- Gangoso, E., Thirant, C., Chneiweiss, H., Medina, J. M., Tabernero, A. A cell-penetrating peptide based on the interaction between c-Src and connexin43 reverses glioma stem cell phenotype. Cell Death & Disease. 5, (2014).
- Gonzalez-Sanchez, A., et al. Connexin43 recruits PTEN and Csk to inhibit c-Src activity in glioma cells and astrocytes. Oncotarget. 7 (31), 49819-49833 (2016).
- Jaraíz-Rodríguez, M., et al. A short region of connexin43 reduces human glioma stem cell migration, invasion and survival through Src, PTEN and FAK. Stem Cell Reports. , (2017).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem Cell. 4 (6), 568-580 (2009).
- Yu, T., et al. In vivo regulation of NGF-mediated functions by Nedd4-2 ubiquitination of TrkA. J Neurosci. 34 (17), 6098-6106 (2014).
- Herrero-Gonzalez, S., et al. Connexin43 inhibits the oncogenic activity of c-Src in C6 glioma cells. Oncogene. 29 (42), 5712-5723 (2010).
- Cooper, G. M. . The Cell: A Molecular Approach. , (2000).
- Fittipaldi, A., et al. Cell membrane lipid rafts mediate caveolar endocytosis of HIV-1 Tat fusion proteins. J Biol Chem. 278 (36), 34141-34149 (2003).
- Dirks, P. B. Brain tumor stem cells: the cancer stem cell hypothesis writ large. Mol Oncol. 4 (5), 420-430 (2010).
- Hopp, T. P., et al. A Short Polypeptide Marker Sequence Useful for Recombinant Protein Identification and Purification. Nat Biotech. 6 (10), 1204-1210 (1988).
- Benard, V., Bokoch, G. M. Assay of Cdc42, Rac, and Rho GTPase activation by affinity methods. Methods Enzymol. 345, 349-359 (2002).
- Guidotti, G., Brambilla, L., Rossi, D. Cell-Penetrating Peptides: From Basic Research to Clinics. Trends Pharmacol Sci. 38 (4), 406-424 (2017).
- Hu, Q., et al. Glioma therapy using tumor homing and penetrating peptide-functionalized PEG-PLA nanoparticles loaded with paclitaxel. Biomaterials. 34 (22), 5640-5650 (2013).
- Babu, M. M., van der Lee, R., de Groot, N. S., Gsponer, J. Intrinsically disordered proteins: regulation and disease. Curr Opin Struct Biol. 21 (3), 432-440 (2011).
- Anthis, N. J., et al. Beta integrin tyrosine phosphorylation is a conserved mechanism for regulating talin-induced integrin activation. J Biol Chem. 284 (52), 36700-36710 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유