Method Article
細胞内タンパク質間相互作用を研究するビオチン化セル透過ペプチド
要約
これは、組み合わせシーケンスの細胞貫通の目新しさとビオチン-アビジン プルダウン ・ システムに基づく細胞内タンパク質間相互作用を研究するためのプロトコルです。主な利点は、ターゲット シーケンスはセル lysates のではなく、生体細胞で培養したそのため相互作用細胞のコンテキスト内で実行されます。
要約
広く使われているビオチン-アビジン プルダウン ・ システムに基づく細胞内蛋白質蛋白質の相互作用を研究するプロトコルをご紹介します。表示変更には、このセル貫通シーケンス技術の組み合わせが含まれています。セル lysates のではなく、生体細胞で培養できる細胞貫通餌を設計提案し、したがって、発見した相互作用は細胞内のコンテキスト内で発生するものを反映.Connexin43 cx (43) ギャップ結合チャネルと hemichannels を形成するタンパク質は悪性グリオーマで調整されます。266 283 のアミノ酸から成る配列とコネキシン 43 地域、c-Src グリオーマ細胞の発癌性の活動の抑制を行います。ここでプルダウン ・ タグとアミノ酸 266 283 transfect ハード グリオーマ幹細胞の細胞間相互作用を検索するターゲット間で構成される配列とコネキシン 43 の地域細胞貫通シーケンス、ビオチンとして TAT を使います。提案手法の限界の 1 つは適切と、その結果を折るための餌として使用される分子、相互作用を発見できなかったこと効果に関連付けられているです。ただし、このメソッドはできますので彼らは通常無秩序領域によって実行されます、したがって、彼らが注文した折りたたみ不要シグナル伝達経路に関与する相互作用の特に興味深い。さらに、提案手法の利点の 1 つは、各残基の相互作用との関連性が簡単に学ぶことができますです。これは、モジュラー システム;したがって、他の細胞貫通シーケンス、他のタグ、および他の細胞内ターゲットを使用できます。最後に、このプロトコルの範囲は、タンパク質間相互作用をはるかに超えて RNA シーケンス、ナノ粒子、ウイルスや細胞貫通シーケンスを導入することができます任意の分子などの他の生理活性物質の貨物にこのシステムを適用できるので、その細胞内作用機序を研究するプルダウン ・ タグに融合。
概要
蛋白質蛋白質の相互作用は、多種多様な細胞プロセスに不可欠です。これらのプロセスを完全に理解して、複雑な細胞内環境の中での蛋白質の相互作用を識別する方法が必要です。蛋白質の相互作用のパートナーを識別するために最もよく使われる方法の一つは、蛋白質または蛋白質結合蛋白質の検出続くアフィニティ プルダウン実験で餌としての部分の擬態ペプチドを使用します。アビジン-ビオチン システム頻繁に高い親和性、特異性、アビジンとビオチンの1,2と安定の相互作用のため使用します。通常、餌 (タンパク質またはペプチド) にビオチンが共有結合し、相互作用の確立を許可するセル lysates の孵化の期間後、その細胞内のパートナーにバインドされているビオチン化餌はアビジンとアビジン プルダウン誘導体共役サポート ビーズ。その後、餌蛋白質の相互作用は、分析、溶出、洗濯後西部のしみに続いて電気泳動の変化によって検出されます。この手法の問題の 1 つは興味の蛋白質と細胞内パートナー間の相互作用が細胞のコンテキスト外の場所を取っています。これは、細胞内の特定の場所に場所を取る、彼らは一時的なものと彼らが豊富でない蛋白質によって普通遂行ため相互作用のシグナル伝達経路に関与するために特に重要です。したがって、セル lysates のこれらの相互作用をマスク他より豊富な蛋白質、通常近接は蛋白質によってできます。
細胞透過性ペプチド (Cpp) は、短いペプチッド (≤40 アミノ酸)、ほぼすべてのセル3分子の広い範囲を運ぶことができるカチオンのアミノ酸によって大抵で構成されます。蛋白質、DNA、siRNA、ウイルス、イメージング エージェント、および様々 なナノ粒子などの貨物は、Cpp と効率的に内面化された4,5に共役されて持っています。この輸送能力のため彼らとして知られているタンパク質トランスダクション ドメイン (PTDs)、膜通過シーケンス (MTSs)、およびトロイの木馬のペプチド。Cpp、間 TAT6最も広くの一つとなっている HIV 転写活性化タンパク質から TAT ペプチド研究7,8,9です。TAT は、6 のアルギニンとリジン残基の 2 を含み、その結果が、高いカチオン性 nonapeptide です。TAT の正味の正電荷が真核細胞とその後続の内面化10の原形質膜と静電相互作用に必要な置換の調査は示した。同様に他の Cpp に TAT の荷電と強く結合する静電様々 な負荷電種細胞表面で現在脂質ヘッド グループ、糖タンパク質プロテオグリカン3など、細胞膜の,10. TAT によって運ばれる生理活性の貨物が細胞内相手に到達する細胞質ですぐに自由になります。
細胞内の相互作用を研究するためにビオチンと TAT CPP を組み合わせた方法をご紹介します。目的は、TAT とビオチン ターゲット生体分子を融合させることで餌の細胞貫通を設計することです。この提案の主な利点は、餌とそのパートナー間の相互作用がその携帯電話のコンテキスト内で行われます。このメソッドの有効性を示すタンパク質細胞内において c Src11,12,13と対話する報告されている配列とコネキシン 43 の小さなシーケンスを餌として使いました。配列とコネキシン 43 は、中枢神経系15,16,17 の最も一般的な悪性腫瘍は広くアストロ サイト14で表され、悪性グリオーマでダウン規制内在性膜タンパク質 ,18。それはずっと以前 c Src (266-283 のアミノ酸配列とコネキシン 43; 人間と対話する配列とコネキシン 43 地域を示すPubmed: P17302) 融合 TAT (TAT cx 43266-283) に c には神経膠腫細胞の発癌活性を阻害し、神経膠腫幹細胞 (GSCs)19,20,21。N 末端 (TAT cx 43266-283) の TAT とビオチンは C 末端の細胞内の餌を設計する配列とコネキシン 43266 283が融合されて (TAT cx 43266-283-B)。この戦略は、Src、c 末端 Src キナーゼ (CSK) とホスファターゼと配列とコネキシン 4320のこの地域の細胞内のパートナーとして相同物 (PTEN) をテンシンを識別するラット神経膠腫 C6 細胞ラインで正常に使用されています。ここでは、非幹細胞より transfect にグリオーマがはるかに困難非常に関連している人間の GSCs でその効果をテストこの手法について述べる。
プロトコル
実験のすべてのプロシージャは、サラマンカ大学で行われました。
1. セル
- 手順を開始する前に 2 日間は、実験の日に合流する必要な密度で細胞をプレートします。フラスコのセル板をプレートします。ただし、蛋白質の抽出は、プレートから容易になります。準備 78 cm2の少なくとも 4 枚または 1 つの実験につき条件 150 cm2のフラスコ 2 必ず結果が一致すると便利です。
- 本研究では、150 cm2, 2% 1 %n2、B27 20 ng/mL EGF および B-FGF ポラードら22のとおり補足 RHB A 幹細胞培地中で培養のフラスコを 4 で人間 G166 GSCs をプレートします。合流点に達したときのプロセス。たとえば、5 x 106 G166 セルは、150 cm2フラスコでメッキされた、2 日目のプレートが処理されました。
2. ビオチン CPPs
- 30 8200 x gで凍結乾燥させたビオチン Cpp (BCPPs) を含むバイアルを回転 s、蓋に残った粉のいくつかを避けるために。コントロール BCPP 発見相互作用、ターゲット シーケンスの特定であることを確認します。本研究では制御 BCPP TAT ビオチン (TAT B) あり治療 BCPP が TAT cx 43266-283Bビオチンに TAT スクランブルまたは変異する溶かされたフラグメント結合など、他のコントロールを使用できます。
- 原液製造によって示されるに対応する培地の BCPPs を溶解します。例えば、2 mg/mL の原液を取得する BCPP GSCs を治療するためには 1 つのバイアル、BCPP の 1 mg を含有する GSC 培養液 0.5 mL を追加します。渦、ペプチドは分解もかどうかを確認します。
3. チューブ
注: は、1 つのセクション 7 で必要な条件、少なくとも 12 1.5 mL チューブを準備します。
- 1 つの条件最初 3 管をマークします。6.4 手順で取得した細胞溶解液の容量をがあります。
- 3 チューブ 1 つの条件で A をマークします。これらのチューブでお越しの際にも溶解し、細胞溶解液を回転ステップ 7.2 後に得られる最初の清。
- 3 チューブ 1 つの条件で B をマークします。これらのチューブでお越しの際にも最初の培養上清の小さい因数。これらの lysates はステップ 7.3 の西部のしみのサンプルとなります。
- 3 チューブ 1 つの条件で C をマークします。これらのチューブでお越しの際にも NeutrAvidin、7.7 のステップとプルダウン後に得られた上清。
注: これは西部のしみは蛋白質、蛋白質引っ張られたないまたはプロシージャのいくつかのステップで失われた意味の信号を示さなかった場合に重要です。状況なら、タンパク質をプルダウンするプロセスを繰り返します。
4. 細胞治療、BCPPs
- 培養液を吸い出しなさい。
- インキュベーション時間に従って媒体の最小の可能なボリュームの BCPPs の孵化に必要な新鮮な媒体の対応するボリュームに置き換えます。それは非常に重要なこといずれの場合も、媒体完全に全体の表面を覆うプレート/フラスコ、セルが 30 分孵化のため 150 cm2あたり例えば、6 mL を乾燥しないでください。
- 効果的であることが証明されている濃度に到達する細胞培養に BCPP の原液量を追加します。この研究 50 μ M TAT cx 43266 283で B は GSC の拡散を減らすために証明されています。
- したがって、2 mg/ml の TAT cx 43266 28392.8 μ L を追加 -B (MW = 3723.34 g/mol) の培地、最終濃度が 50 μ M TAT cx 43266 283の mL あたり B追加するボリュームの制御ペプチドの異なる場合は、同じ最終巻まで培養液中で完了します。例えば、49.1 μ L TAT B (MW = 1914.31 g/mol) 43.7 μ L GSC メディア プラス、最終濃度が 50 μ M の培養液中の mL あたり追加された TAT B
- BCPP とその細胞内のパートナー間の相互作用が起こることを確認する 30 分の CO2を 37 ° C、5% でインキュベーターでセルを配置します。相互作用時間がかかります、長い時間インキュベートまたは時間コースから成っていた実験ケースで時間を調整します。さらに、興味の相互作用を推進または刺激の異なる細胞内シグナル伝達経路によって阻止できます。
5. バッファーおよびソリューション。
- PBS pH 7.4: 136 mM の NaCl; を準備します。2.7 mM KCl;7.8 mM Na2HPO4·2H2O;1.7 mM KH2PO4。
- タンパク質の換散バッファーの準備: 20 mM トリス-HCl (pH 8.0)、137 mM NaCl、1 %igepal、前を使用して、次の追加: 1/100 (v/v) プロテアーゼ阻害剤カクテル、1 mM フッ化ナトリウム 1 mM Phenylmethanesulfonyl フッ化物 (PMSF) と 0.1 mM ナトリウム バナジン。
- 塩化物イオンとバッファーを準備: (4 x: 0.18 M トリス-HCl pH 6.8; 5 M グリセロール; 3.7 %sds (p/v); 0.6 M β-メルカプトエタノールや 9 mM DTT; 0.04% (v/v) ブロモフェノール ブルー (BB))。
6 蛋白質の抽出
注意: 蛋白質の抽出は、上記20,23として実施されました。4 ° C でプロシージャのこの全体のセクションを運ぶ
- 完全に培養液を吸い出しなさい。
- 洗浄 3 x 10 mL の冷たいリン酸は細胞の剥離を避けるために非常に慎重に生理食塩水 (PBS) 150 cm2あたりをバッファーしました。
- 細胞ライセートを得るためには、150 cm2あたりの換散バッファーの 3 mL を加えるし、細胞スクレーパーを使用して、徹底的に表面をこすり。プレート/フラスコを約 45 度の傾斜に対応するチューブにセル lysates を収集するために容易になります。
- 3 1.5 mL チューブにチューブごとライセートの携帯の 1 mL を注ぐ。これらの管は、条件とレプリケートする 3.1 の手順で示されるようにマークされます。
7. プルダウン
- 4 ° C で 10 分間 11,000 x gで 1.5 mL チューブを遠心分離します。
- 培養上清を新しいチューブ (A) に転送します。
- 異なるチューブ (B)、すなわち 50 μ L 管ごとに 1 つの条件この上清の因数を取る。4 x Laemmli バッファー (溶解液を 50 μ l 添加の 16.6 μ L) を追加し、-20 ° C の凍結これらの lysates をいつものように西部のしみのサンプルとなります。
- 非常によく、穏やかな揺れで NeutrAvidin アガロースを均質化します。ピペット チップの径、ビーズのピペッティングを向上させるためのヒントをカットします。
注: 清 (D 管) は西部のしみに読み込まれるまたは-20 ° C の凍結する準備が整いました
8 西部のしみ
注意: は、上記24として行われた西部にしみが付くこと。
- 各サンプル Midi 細胞電気泳動システムで Bis-トリス (4-12%) midigels レーンあたりの同等のボリュームを読み込みます。
- ウエスタンブロッティング蛋白質は硝酸セルロース正規スタックに乾燥しみが付くシステムを使用して。
- 10% の膜を染色 Ponceau 10 分。
- TTBS の 5 mL と 3 x 5 分の膜を洗浄します。
- チューブまたは小さなボックスで穏やかな揺れで 1 時間 TTBS に 7% のミルクで膜をブロックします。使用量は膜をカバーするのに十分、彼ら乾燥しないでください、すなわち全体の midi 膜あたり 40 mL を確認します。
- TTBS の 5 mL と 3 x 5 分を洗ってください。
- 穏やかな揺れで興味の蛋白質に対して一次抗体と 4 ° C で一晩インキュベートします。
- TTBS の 5 mL と 3 x 5 分を洗ってください。
- 膜、特派員ペルオキシダーゼ標識二次抗体と TTBS に 1 時間室温で孵化させなさい。
- TTBS の 5 mL と 3 x 5 分を洗ってください。
- 化学ルミネセンスの基板と化学発光系の開発します。
9. 問題解決
- 開発後、西部のしみのすべての蛋白質のための信号を示したサンプルのいずれか場合、Ponceau を確認します。
注: Ponceau で膜に未定義表示する必要があります、車線に沿って多数のバンドが読み込まれます。バンドは非常に顕著ではない、読み込まれる蛋白質の量が十分ではないか、転院が正しく行っています。西部のしみを繰り返し検討してください。 - すべてで任意の車線で Ponceau 膜の汚れがない場合は、(C) 管のステップ 7.4 から全体の手順を繰り返します。
- 西部のしみを開発した後、タンパク質の信号は非常に弱いが、Ponceau 示したタンパク質、再び一次抗体と膜が、長い時間孵化させなさい。信号は弱いがまだの場合は、室温で再びインキュベートします。
10 この記事でその他の技術の使用
- BCPPs の
- 4% のパラホルムアルデヒド (cm2あたり 0.2 mL) 20 分のセルを修正します。
- PBS (cm2あたり 0.2 mL) 3 x 5 分を洗ってください。
- 4 ° C で一晩興味の蛋白質に対して製造元の指示された濃度で抗体溶液で希釈した対応する抗体 (cm2あたり少なくとも 0.15 mL) を適用します。
- 蛍光標識二次抗体 (cm2あたり 0.15 mL) 室温で 2 時間で孵化させなさい。
- 興味の蛋白質に対して他の抗体と手順 10.1.2-10.1.4 を繰り返します。別の一次抗体や二次抗体のための同じ波長同時に同じ種を使用しないように注意してください。
- Antifade 試薬 (cm2あたり 0.005 mL) を使用してセルをマウントします。
- デジタル カメラに接続されている蛍光顕微鏡で分析します。
- MTT の試金
- 37 ° c 24 ウェルプレートでの細胞を培養します。
- 細胞培養液 0.5 mg/mL MTT を含む cm2あたり 0.15 ml 75 分間暗闇の中で孵化させなさい。
- 培地を吸引し、ジメチルスルホキシド (cm2あたり 0.25 mL) 穏やかな揺れで暗闇の中で 10 分間細胞をインキュベートします。
- 570 の波長で吸光度を測定マイクロ プレート リーダーを使用して nm。
結果
BCPPs を使用して、細胞内の相互作用を研究する、前に BCPP 対 BCPP で得られた結果を検証する CPP の効果を比較するが重要です。その結果、ビオチンの包含はターゲット シーケンスのアクティビティを変更するかどうかを調査する最初行った TAT cx 43266 283の効果 -B に比べて TAT cx 43266 283 G166 GSCs 形態に。これを行うには、F-アクチンと α-チューブリン治療の 24 時間後の 2 つの細胞骨格タンパク質の蛍光抗体法により解析を行った。図 1は示す G166 GSCs 50 μ M TAT cx 43266 283または TAT cx 43266-283-B 取得コントロール (TAT または TAT B) に示すように細長いと拡張の携帯電話の延長と比較してより丸みを帯びた形状。実際には、図 1 bはアクチン フィラメントは、TAT cx 43266 283または TAT cx 43266 283と扱われた細胞にアクチン ネットワークとして構成ほとんど示しています - 彼らは制御の細胞のより多くのアクチン線維束を形成中に B (TAT で治療またはTAT-B)25。対照的に、異なる条件の間 α-チューブリンの分布は変化しません。これらの結果は、ビオチンの存在が G166 GSCs の形態に及ぼすターゲット シーケンスを変更しなかったことを示した。以前研究20,21, 我々 は G166 GSCs 増殖を TAT cx 43266 283に減少を示した。この研究で調べたかどうか TAT cx 43266-283-B TAT cx 43266 283として成長で同じ効果を発揮します。これを行うには、MTT の試金によって治療の 72 時間後 G166 GSCs 増殖を行った。MTT の試金は、細胞の代謝活性を評価するための比色定量法です。MTT は現在実行可能なセルの数を反映してミトコンドリア NAD (P) H オキシドレダクターゼ酵素によって代謝されます。図 2に示す細胞が 50 μ M TAT cx 43266 283または 50 μ M TAT cx 43266 283で処理した時に、G166 GSCs セル実行可能性の減少が大幅に異なる B確かに、両方はかなり対照、TAT または TAT B と比べて G166 GSCs 増殖を減少
一度、C 末端をビオチンを含めることによって、G166 GSCs (TAT cx 43266-283) でターゲット シーケンスの効果を変更されなかったことを確認 (TAT cx 43266-283-B)、このシーケンスの細胞内のパートナーを検討しました。この研究 (図 3) で説明したプロトコルに従います。カベオラは、TAT 内面26の機構に関与している、のでプルダウン ・ リストにおけるカベオリン-1 (Cav-1) の存在を分析しました。西部のしみの分析 (図 4) を示したその TAT B と TAT cx 43266-283-B と Cav 1 の対話します。ただし、TAT cx 43266 283の能力 - c-Src、PTEN、CSK を募集する B は TAT B で発見よりも強い焦点付着のキナーゼ (FAK) は、配列とコネキシン 43 との対話を示されていない C-src の基板です。確かに、FAK は TAT B または TAT cx 43266 283の任意の有意な相互作用を示しませんでした B
TAT cx 43266 283間の相互作用を確認する B および c-Src、G166 GSCs 培養 50 μ M TAT cx 43266-283-B 30 分と局在、共焦点顕微鏡 (図 5 による蛍光ストレプトアビジンと影響を続いた。).結果, その細胞内分布 TAT cx 43266-283-B (ホスファチジルセリンの汚損によって示されて)、膜に近いし、c Src のそれと一致します。共局在解析が TAT cx 43266 283間の共局在 (白) のいくつかの点を明らかに実際には、B と c-Src merge イメージで。その結果、共焦点顕微鏡を用いた研究は、本研究で記述されている BCPP プルダウン ・ プロトコルにより得られた結果を確認します。
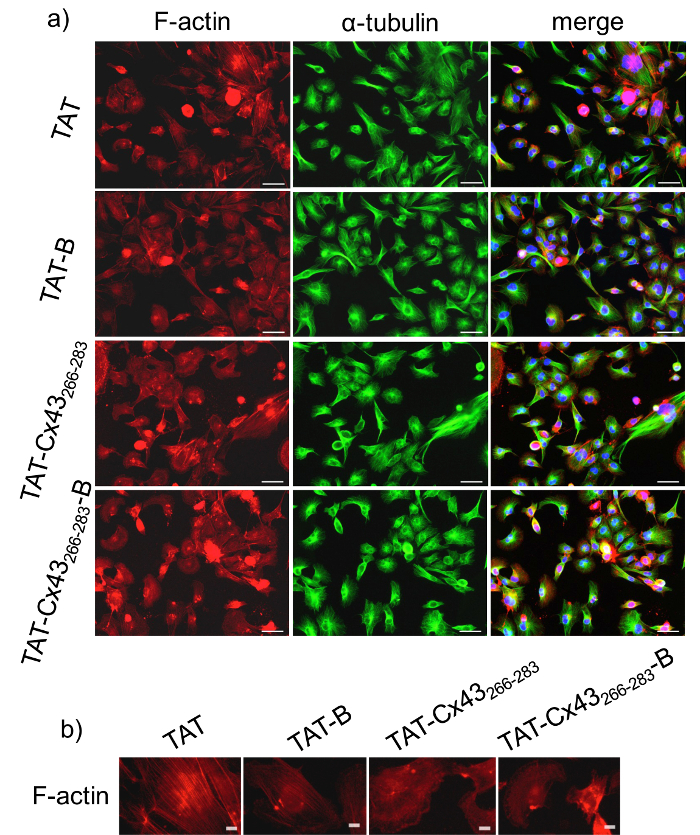
図 1: BCPP、CPP に及ぼす GSC 形態。
G166 GSCs 低密度でメッキされた (2 x 10 の4セル/cm2) と彼らは 50 μ M 制御 CPP (TAT) と培養された 24 時間後制御 BCPP (TAT B)、CPP (TAT cx 43266-283) の治療または治療 BCPP (TAT cx 43266-283B).a) F アクチン (赤), α-チューブリン (緑) およびマージ済み + G166 GSCs 形態を示す同じフィールドの DAPI 染色。バー = 50 μ m b) 50 μ M で 24 時間培養後 G166 GSCs F アクチンの異なる分布を示す F アクチン染色 CPP (TAT) を制御または 50 μ M 治療 CPP (TAT cx 43266-283) と比較して BCPP (TAT B) または BCPP (TAT cx 43制御266 283B)。バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 2: BCPP、CPP に及ぼす GSC 生存率。
G166 GSCs 5500 細胞/cm2で 24 汚損プレート メッキ、インキュベートを 50 μ M 制御ペプチド、CPP (TAT の) または BCPP (TAT B)、または 50 μ M 処理ペプチド、CPP (TAT cx 43266-283) または BCPP (TAT cx 43266-283-B)。72 時間後 MTT の試金を使用して細胞生存率を調べた。結果、MTT の結果として表されます、少なくとも 3 実験の平均 ± s.e.m. (+ + p˂0.01 対コントロール。 * * p˂0.01、* * * p˂0.001 対 TAT または TAT B; テスト後に一方向の分散分析 withTukey)。CPPs 対 BCPPs の効果間に有意差がないことに注意してくださいこの図の拡大版を表示するのにはここをクリックしてください。
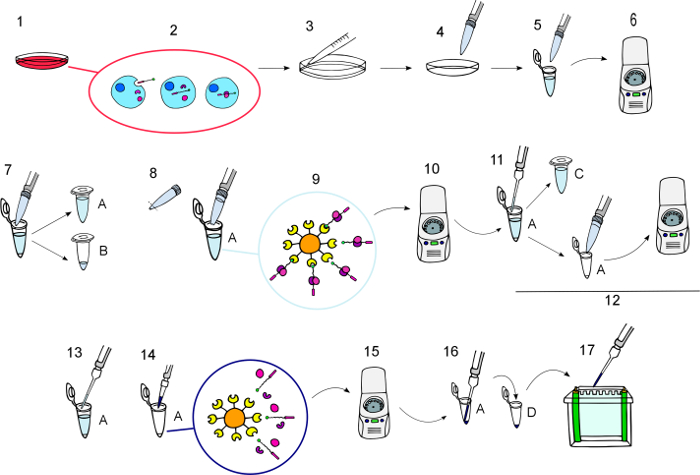
図 3: プロトコルの図。
BCPPs まで溶出の BCPPs との相互作用の蛋白質 obtained.1 の孵化から「プロトコル」セクションで記載されている手順のステップバイ ステップでグラフィカルな描写は) BCPPs で必要な濃度で培養細胞を孵化させなさい、必要な時間。2)、インキュベーション中に内在化されている、BCPPs と細胞内の相手とやり取りします。3) 3 回氷氷冷 PBS のセルを洗浄します。4) タンパク質を抽出するために細胞を溶解させます。5) セル lysates をチューブに転送します。6) 4 ° C で 10 分間 11000 x gでスピンします。7) 転送新しい管 (A) と正規のウエスタンとして処理する溶解液の小さい因数を維持する清しみのサンプル チューブ (B)。8) NeutrAvidin アガロース ビーズを再懸濁し、カットのピペット チップを使用して、各チューブに 50 μ L を追加します。9) NeutrAvidin アガロース ビーズ BCPPs とそのパートナーとの対話を許可するように 4 ° C で 12 h 優しく揺れで孵化させなさい。スピン 10) 3000 × gで 1 分間、ビオチンとビーズをペレットに餌し、彼らの相互作用の蛋白質がそれらにバインドします。11) 培養上清を新しいチューブ (C) に転送してプルダウンを繰り返す必要がある場合に使用するそれらを保ちます。12) 5 回新鮮な換散バッファーの餌を洗浄、3000 × gで 1 分のスピン反転して再懸濁します、上澄みを廃棄します。13) すべての上澄みを慎重に削除します。14) 塩化物イオンとバッファー x 4 の目的のボリュームを追加し、100 ° C で 5 分 15 でタンパク質を溶出) 8200 x g 30 で回転ビーズをペレットに s。16) 新しいチューブ (D) キャピラリー先端の上澄みで見つけられる溶出蛋白質を転送します。17) 西部のしみの分析のためのゲルにロードします。この図の拡大版を表示するのにはここをクリックしてください。
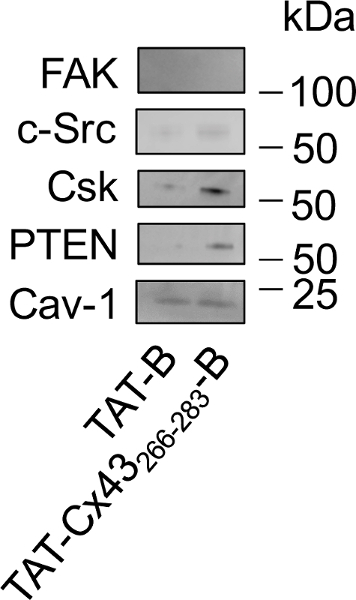
: 図 4 TAT cx 43266 283の細胞相互作用のプルダウンで G166 GSCs で B に続く西部のしみ。
50 μ M TAT B または TAT cx 43266 283を添加して G166 GSCs BTAT cx 43266 283や TAT B 細胞を溶解し 30 分後 -B 細胞内パートナーに接続されているは NeutrAvidin ビーズとに引っ張られました。溶出蛋白質が読み込まれ、FAK、CSK、Src のレベルを勉強する西部のしみを用いて PTEN と Cav-1。Cav 1 両方の TAT B との対話は、TAT cx 43266-283-B、c-Src、PTEN、CSK との対話優先的に TAT cx 43266-283-B と FAK は TAT B または TAT cx 43266 283と任意の相互作用を示さなかった-B.してくださいこの図の拡大版を表示するのにはここをクリックします。
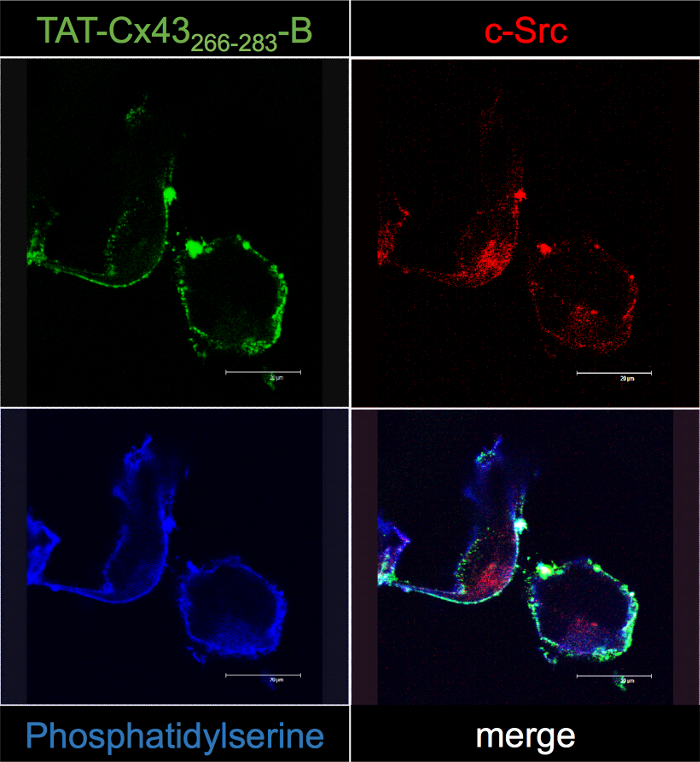
図 5: TAT cx 43266-283-B 細胞内における相互作用の G166 GSCs 共焦点顕微鏡による確認。
50 μ M TAT cx 43266 283を添加して G166 GSCs B30 分後セル固定し、TAT cx 43266 283をローカライズする処理 - Cy2-ストレプトアビジン (緑)、蛍光抗体法 (赤) とアネキシン V (ブルー) とホスファチジルセリン c Src B。TAT cx 43266 283間の共局在 (白) のいくつかの点に注意してください -B と c-Src 差し込み印刷イメージの細胞膜に近い。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
蛋白質蛋白質の相互作用を研究する多くのメソッドがあります。本研究では提案手法は相互作用の確立を許可するセル lysates はインキュベートをビオチン化餌で広く使われているビオチン-アビジン プルダウン ・ システムに基づいています。本研究で提示変更には、このセル貫通シーケンス技術の組み合わせが含まれています。セル lysates のではなく、生体細胞で培養できる細胞貫通餌を設計提案し、したがって、発見した相互作用は細胞のコンテキスト内で発生したものを反映.
ここで我々 のプルダウン ・ タグと細胞の相互作用は、人間の GSCs をターゲットとしてアミノ酸 266 283 間で構成される配列とコネキシン 43 の地域細胞貫通シーケンス、ビオチン TAT を使用します。配列とコネキシン 43 と c Src の相互作用の構造基盤は、よく知られている11,12です。神経膠腫細胞24,13c Src の発癌性の活動を阻害するので、これは重要な相互作用です。実際には、この領域 (TAT cx 43266-283) を含む CPPs は神経膠腫細胞19,20,21配列とコネキシン 43 の antioncogenic 特性を模倣します。ラット C6 膠には、TAT cx 43266 283 c Src を抑制するメカニズムには内因性阻害剤 CSK と PTEN20c Src の募集が含まれています。特筆すべきは、GSCs が神経膠腫治療のターゲットとして非常に興味深い彼らは従来の治療に抵抗性であり、したがってこの悪性脳腫瘍27の再発を担当する個体を構成するため。さらに、彼らの transfect ハードのセルであり、したがって細胞内相互作用の研究がより困難になります。Cpp が迅速かつ効率的に内在化している GSCs19細胞相互作用の研究のための使用を好みます。この研究は、ビオチンに融合した Cpp を使用する配列とコネキシン 43266 283シーケンス CSK と人間 GSCs の PTEN の内因性阻害剤とともに c Src との相互作用を確認します。
このメソッドは非常に強力な生物活性化合物の細胞内機構の研究です。ただし、非ビオチン 1 つで得られると異なっているないビオチン化細胞貫通餌の生物学的効果を確認することが重要です。この手順は、生理活性化合物の効果と相互作用を関連付けるに必要です。さらに、そのプロテアーゼによって低下する可能性としての可能な毒性化合物の安定性を慎重にテストし、実験を計画する前に考慮に入れ。提示などで G166 人間 GSCs の TAT cx 43266 283の抗増殖効果は以前発表された20をされています。本研究で我々 はそれを確認 TAT cx 43266 283の抗増殖効果 B、TAT-配列とコネキシン 43 の266 283は非常に似ています。さらに、細胞形態の分析は、その α-チューブリンを明らかに F-アクチンが G166 GSCs TAT cx 43266 283で治療に非常によく似た、B または TAT cx 43266-283。完全に、TAT cx 43266 283 c 末端のビオチンを含めることがひと GSCs にこの化合物の効果を修正しなかったが示唆されました。ただし、ビオチンと生理活性分子の効果の変更する場合、他の蛋白質の浄化のためのタグをテストするフラグ オクタペプチド (DYKDDDDK)28、人間のインフルエンザ血球凝集素派生タグ HA (YPYDVPDYA) やグルタチオンなどS-トランスフェラーゼ (GST)29。同様に、TAT 興味のセル人口を対象としない場合、他セル溶込、(のレビューを参照してください30) MPG などの貫通シーケンスまたはセルの特定のシーケンスは使用される31をすることができます。
具体的にはターゲット シーケンスと対話研究蛋白質に加えて理想的には、コントロールと、ターゲット シーケンスの両方と相互作用するタンパク質と正と負のコントロールとして、彼らと対話しない蛋白質の存在する必要があります。対処します。この意味で、我々 はコントロールの Cav 1 を発見し、治療状況、それは以前26を示されているよう、カベオラは、内面のメカニズムに関与していることを示唆しています。さらに、c Src との対話が、配列とコネキシン 43 c 末端との対話になっています、FAK は欠席したコントロールと処理状況の両方で。これらの結果は、TAT cx 43266-283-B, c-Src、CSK と PTEN の間の相互作用の特異性を強化します。このプロトコルにより得られた結果を確認するには、相互作用の蛋白質の分布を視覚化し、その共同のローカリゼーションを調査する、共焦点顕微鏡を使用できます。したがって、その TAT cx 43266-283-B と c Src 展示プルダウン実験で得られた結果の確認の共局在のいくつかの点と同様の細胞内分布を発見しました。実は、TAT cx 43266-283-B は貨物が配列とコネキシン 43266-283, 本研究では、分子、細胞内のパートナーに指示ことを示唆している細胞膜の近くに分散します。
提案手法の制約の 1 つは、正しくフォールドに餌として使用される分子と期待される効果が見つからないことです。このような状況で発見相互作用が効果に関連付けできませんでした。しかし、彼らは通常無秩序領域32によって実行されます、したがって彼らは順序付き折りたたみを必要はありませんので、このメソッドがシグナル伝達経路に関与する相互作用のため特に面白いことができます。さらに、提案手法の利点の 1 つは、相互作用の時間コース続くことができる、特に一時的な相互作用に関連であります。さらに、各残基の相互作用との関連性を簡単に学ぶことができます。確かに、phosphomimetic 置換セリンまたはスレオニン、グルタミン酸によるタンパク質間相互作用、例えばの翻訳後修飾との関連性を研究することが可能です。同様に、セリン、アラニン、トレオニンまたはフェニルアラニン チロシンの置換により、非 phosphorylatable セリン、スレオニンあるいはチロシン.の効果のテストリン酸化チロシンを模倣するには、最も正確な方法は、p Tyr33Tyr の置換です。
最後に、このプロトコルの範囲は、タンパク質間相互作用をはるかに超えて RNA シーケンス、ナノ粒子、ウイルスやビオチンに融合し、勉強する CPP を導入することができます他の分子などの他の生理活性物質の貨物にこのシステムを適用できるのでアクションの彼らの細胞内メカニズム。
開示事項
著者が明らかに何もありません。
謝辞
Cpp の j. c. Arévalo 設計とプルダウン ・ プロトコルとの彼の助けのために、m. モラレスと j. ブラボーに感謝します。T. ・ デル ・ レイのテクニカル サポートに感謝しております。この作品は、Ministerio デ Economía y Competitividad、スペインによって支えられました。フェダーイン ・ BFU2015-70040-R、太デカスティーリャイレオン レオン、スペイン;フェダーイン ・ SA026U16、フンダシオン Areces。M ・ Jaraíz ・ ロドリゲスと A. ・ ゴンサレス ・ サンチェス太デカスティーリャイレオン州から親睦と欧州社会基金の受け手であります。
資料
| Name | Company | Catalog Number | Comments |
| G166 GSC line | BioRep | ||
| RHB-A stem cell medium | Takara | Y40001 | |
| Laminin Mouse Protein | Invitrogen, Life Technologies, ThermoFisher Scientific | 23017-015 | 10 µg/ml |
| B-27 Serum free Supplement (50X) | Invitrogen, Life Technologies, ThermoFisher Scientific | 17504-044 | 2% |
| N-2 Supplement (100x) | Invitrogen, Life Technologies, ThermoFisher Scientific | 17502-048 | 1% |
| Recombinant Human EGF | Peprotech | AF-100-15 | 20 ng/ml |
| Recombinant Human b-FGF | Peprotech | AF-100-18B | 20 ng/ml |
| PBS pH 7.4: In deionized water, 136 mM NaCl ; 2.7 mM KCl; 7.8 mM Na2HPO4·2H2O ; 1.7 mM KH2PO4 | |||
| Accutase | Sigma | A6964 | |
| Cryostor CS10 cryopreservation medium | StemCell Technologies | 7930 | |
| TAT | GenScript | - | Custom made |
| TAT-B | GenScript | - | Custom made |
| TAT-Cx43266-283 | GenScript | - | Custom made |
| TAT-Cx43266-283-B | GenScript | - | Custom made |
| Alexa Fluor 594 Phalloidin | Molecular Probes, Life Technologies, ThermoFisher Scientific | A1275737 | 1/20 |
| Monoclonal α-tubulin mouse antibody | Sigma-Aldrich | T9026 | 1/500 |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes, Life Technologies, ThermoFisher Scientific | 1.25 mg/ml | |
| Pierce™ NeutrAvidin™ Agarose | ThermoFisher Scientific | 29200 | |
| Protein lysis buffer: 5 mM Tris-HCl (pH 6.8), 2% (w/v) SDS, 2 mM EDTA , 2 mM EGTA | |||
| Protease Inhibitor Cocktail Set III. EDTA-Free | Calbiochem, Bionova | 539134 | 1/100 (v/v) |
| Sodium Fluoride | PanReac AppliChem | 141675 | 1 mM |
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma-Aldrich | P7626 | 1 mM |
| Sodium orthovanadate | Sigma-Aldrich | S6508 | 0.1 mM |
| Laemmli buffer: (4x: 0.18 M Tris-HCl pH 6.8; 5 M glycerol; 3.7 % (w/v) SDS; 0.6 M β-mercaptoethanol or 9 mM DTT ; 0.04% (v/v) bromophenol blue (BB) . | 1X | ||
| Xcell 4 SureLock Midi-Cell Electrophoresis System | Life Technologies, ThermoFisher Scientific | WR0100 | |
| NuPAGE Novex Bis-Tris Midi-Gels 4-12% | Life Technologies, ThermoFisher Scientific | WG1402box | |
| NuPAGE MOPS SDS Running Buffer (20X) | Life Technologies, ThermoFisher Scientific | NP0001 | 1X |
| NuPAGE Transfer Buffer 20x | Life Technologies, ThermoFisher Scientific | NP0006 | 1X |
| Precision Plus Protein Dual Color Standard | Bio-Rad | 161-0374 | |
| iBlot 2 NC Regular Stacks (nitrocellulose membranes) | Life Technologies, ThermoFisher Scientific | IB23001 | |
| iBlot 2 Dry Blotting System - Gel transfer device | Life Technologies, ThermoFisher Scientific | IB21001 | |
| 10% Ponceau S Solution (0.1% Ponceau (w/v) in 5% acetic acid (v/v)) in water | Sigma | P7170 | |
| FAK polyclonal rabbit antibody | Life Technologies, ThermoFisher Scientific | AHO0502 | 1/500 |
| Src polyclonal rabbit antibody | Cell Signalling (WERFEN) | 2108S | 1/500 |
| Csk polyclonal rabbit antibody | Cell Signalling (WERFEN) | 4980 | 1/500 |
| PTEN polyclonal mouse antibody | Cell Signalling (WERFEN) | 9552 | 1/500 |
| Caveolin-1 polyclonal rabbit antibody | Abcam | ab2910 | 1/1000 |
| Goat anti-mouse IgG-HRP antibody | Quimigen, Santa Cruz Biotechnology | Sc-2005 | 1/5000 |
| Goat anti-rabbit IgG-HRP antibody | Quimigen, Santa Cruz Biotechnology | SC-2030 | 1/5000 |
| Western Blotting Luminol Reagent | Santa Cruz Biotechnology | SC-2048 | |
| Src polyclonal rabbit antibody | Cell Signalling (WERFEN) | 2108S | 1/500 |
| Antibody solution: PBS, 10% FBS, 0.1 M lysine, 0.02% sodium azide | |||
| Alexa Fluor 488 goat anti-mouse IgG | Invitrogen, Life Technologies, ThermoFisher Scientific | A11029 | 1/1000 |
| Cy2-conjugated streptavidin | Jackson ImmunoResearch | 016-220-089 | 1/500 |
| MicroChemi Luminescence system | DNA Bio-Imaging Systems | ||
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor® 488 & Propidium Iodide (PI) | Molecular Probes, Life Technologies, ThermoFisher Scientific | V13241 | 1/500 |
| SlowFade Gold antifade reagent | Life Technologies, ThermoFisher Scientific | S36936 | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | |
| Dimethyl sulfoxide for UV-spectroscopy, >=99.8% (GC) | Honeywell | 41641-1L | |
| Appliskan 2001 | Thermo Electron Corporation, Thermo Scientific |
参考文献
- Green, N. M. Avidin. 3. The nature of the biotin-binding site. Biochem J. 89, 599-609 (1963).
- Wilchek, M., Bayer, E. A. Applications of avidin-biotin technology: literature survey. Methods Enzymol. 184, 14-45 (1990).
- Herce, H. D., Garcia, A. E., Cardoso, M. C. Fundamental molecular mechanism for the cellular uptake of guanidinium-rich molecules. J Am Chem Soc. 136 (50), 17459-17467 (2014).
- Ramsey, J. D., Flynn, N. H. Cell-penetrating peptides transport therapeutics into cells. Pharmacol Ther. 154, 78-86 (2015).
- Fominaya, J., Bravo, J., Rebollo, A. Strategies to stabilize cell penetrating peptides for in vivo applications. Ther Deliv. 6 (10), 1171-1194 (2015).
- Vives, E., Brodin, P., Lebleu, B. A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus. J Biol Chem. 272 (25), 16010-16017 (1997).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol Med. 13 (10), 443-448 (2007).
- Brooks, H., Lebleu, B., Vives, E. Tat peptide-mediated cellular delivery: back to basics. Adv Drug Deliv Rev. 57 (4), 559-577 (2005).
- Cuesto, G., et al. Phosphoinositide-3-kinase activation controls synaptogenesis and spinogenesis in hippocampal neurons. J Neurosci. 31 (8), 2721-2733 (2011).
- Schmidt, N., Mishra, A., Lai, G. H., Wong, G. C. Arginine-rich cell-penetrating peptides. FEBS Lett. 584 (9), 1806-1813 (2010).
- Sorgen, P. L., et al. Structural changes in the carboxyl terminus of the gap junction protein connexin43 indicates signaling between binding domains for c-Src and zonula occludens-1. J Biol Chem. 279 (52), 54695-54701 (2004).
- Giepmans, B. N., Hengeveld, T., Postma, F. R., Moolenaar, W. H. Interaction of c-Src with gap junction protein connexin-43. Role in the regulation of cell-cell communication. J Biol Chem. 276 (11), 8544-8549 (2001).
- Tabernero, A., Gangoso, E., Jaraíz-Rodríguez, M., Medina, J. M. The role of connexin43-Src interaction in astrocytomas: A molecular puzzle. Neuroscience. 323, 183-194 (2016).
- Giaume, C., Koulakoff, A., Roux, L., Holcman, D., Rouach, N. Astroglial networks: a step further in neuroglial and gliovascular interactions. Nat Rev Neurosci. 11 (2), 87-99 (2010).
- Shinoura, N., et al. Protein and messenger RNA expression of connexin43 in astrocytomas: implications in brain tumor gene therapy. J Neurosurg. 84, 839-845 (1996).
- Soroceanu, L., Manning, T., Sontheimer, H. Reduced expression of connexin-43 and functional gap junction coupling in human gliomas. Glia. 33, 107-117 (2001).
- Pu, P., Xia, Z., Yu, S., Huang, Q. Altered expression of Cx43 in astrocytic tumors. Clin Neurol Neurosurg. 107 (1), 49-54 (2004).
- Crespin, S., et al. Expression of a gap junction protein, connexin43, in a large panel of human gliomas: new insights. Cancer Med. 5 (8), 1742-1752 (2016).
- Gangoso, E., Thirant, C., Chneiweiss, H., Medina, J. M., Tabernero, A. A cell-penetrating peptide based on the interaction between c-Src and connexin43 reverses glioma stem cell phenotype. Cell Death & Disease. 5, (2014).
- Gonzalez-Sanchez, A., et al. Connexin43 recruits PTEN and Csk to inhibit c-Src activity in glioma cells and astrocytes. Oncotarget. 7 (31), 49819-49833 (2016).
- Jaraíz-Rodríguez, M., et al. A short region of connexin43 reduces human glioma stem cell migration, invasion and survival through Src, PTEN and FAK. Stem Cell Reports. , (2017).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem Cell. 4 (6), 568-580 (2009).
- Yu, T., et al. In vivo regulation of NGF-mediated functions by Nedd4-2 ubiquitination of TrkA. J Neurosci. 34 (17), 6098-6106 (2014).
- Herrero-Gonzalez, S., et al. Connexin43 inhibits the oncogenic activity of c-Src in C6 glioma cells. Oncogene. 29 (42), 5712-5723 (2010).
- Cooper, G. M. . The Cell: A Molecular Approach. , (2000).
- Fittipaldi, A., et al. Cell membrane lipid rafts mediate caveolar endocytosis of HIV-1 Tat fusion proteins. J Biol Chem. 278 (36), 34141-34149 (2003).
- Dirks, P. B. Brain tumor stem cells: the cancer stem cell hypothesis writ large. Mol Oncol. 4 (5), 420-430 (2010).
- Hopp, T. P., et al. A Short Polypeptide Marker Sequence Useful for Recombinant Protein Identification and Purification. Nat Biotech. 6 (10), 1204-1210 (1988).
- Benard, V., Bokoch, G. M. Assay of Cdc42, Rac, and Rho GTPase activation by affinity methods. Methods Enzymol. 345, 349-359 (2002).
- Guidotti, G., Brambilla, L., Rossi, D. Cell-Penetrating Peptides: From Basic Research to Clinics. Trends Pharmacol Sci. 38 (4), 406-424 (2017).
- Hu, Q., et al. Glioma therapy using tumor homing and penetrating peptide-functionalized PEG-PLA nanoparticles loaded with paclitaxel. Biomaterials. 34 (22), 5640-5650 (2013).
- Babu, M. M., van der Lee, R., de Groot, N. S., Gsponer, J. Intrinsically disordered proteins: regulation and disease. Curr Opin Struct Biol. 21 (3), 432-440 (2011).
- Anthis, N. J., et al. Beta integrin tyrosine phosphorylation is a conserved mechanism for regulating talin-induced integrin activation. J Biol Chem. 284 (52), 36700-36710 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved