Method Article
Peptídeos biotinylated célula-penetrante para estudar interações da proteína-proteína intracelular
Neste Artigo
Resumo
Este é um protocolo para estudar as interações da proteína-proteína intracelular baseadas no sistema biotina-avidina suspenso com a novidade de combinar sequências de célula-penetrante. A principal vantagem é que a sequência de destino é incubada com células vivas em vez de lisados celulares e, portanto, as interações ocorrerá dentro do contexto celular.
Resumo
Aqui nós apresentamos um protocolo para estudar interações da proteína-proteína intracelular que é baseado no sistema biotina-avidina amplamente utilizado suspenso. A modificação apresentada inclui a combinação desta técnica com célula-penetrante sequências. Propomo-na projetar iscas penetra no celular que podem ser incubadas com células vivas em vez de lisados celulares e, portanto, as interações encontradas refletirá a aqueles que ocorrem no âmbito intracelular. Connexin43 (Cx43), uma proteína que forma canais de junção de lacuna e hemichannels é para baixo-regulado em gliomas de alto grau. A região de Cx43 composto por aminoácidos 266-283 é responsável para a inibição da atividade oncogênica do c-Src em células de glioma. Aqui nós usamos TAT como a sequência de penetração celular, biotina como a tag suspenso e a região de Cx43 compreendida entre aminoácidos 266-283 como destino para encontrar interações intracelulares em células-tronco o glioma humano difícil-para-transfect. Uma das limitações do método proposto é que a molécula utilizada como isca pode falhar dobrar corretamente e, consequentemente, as interações encontradas não poderiam ser associadas com o efeito. No entanto, esse método pode ser especialmente interessante para as interações envolvidas nas vias de transdução de sinal, porque eles são geralmente realizados por regiões intrinsecamente desordenadas e, portanto, não necessitam de um ordenado de dobramento. Além disso, uma das vantagens do método proposto é que a relevância de cada resíduo na interação pode ser facilmente estudada. Este é um sistema modular; Portanto, podem ser empregados outras sequências de penetração celular, outras marcas e outros alvos intracelulares. Finalmente, o âmbito de aplicação do presente protocolo é muito além da interação da proteína-proteína, porque este sistema pode ser aplicado a outras cargas bioativas como sequências de RNA, nanopartículas, vírus ou qualquer molécula que pode ser transformada com sequências de célula-penetrante e fundido a tags suspenso para estudar seu mecanismo intracelular de ação.
Introdução
Interações da proteína-proteína são essenciais para uma grande variedade de processos celulares. Para melhor entender esses processos, métodos para identificar as interações da proteína dentro do ambiente intracelular complexo são necessários. Um dos métodos mais utilizados para identificar parceiros de interação de uma proteína é usar aquela proteína ou um peptídeo mimético da parte dessa proteína como isca em experimentos de afinidade suspenso seguidos pela detecção de proteínas. O sistema biotina-avidina é frequentemente usado por causa da alta afinidade, especificidade e estável interação entre avidina e biotina1,2. Geralmente, a biotina é covalently à isca (proteína ou peptídeo) e após um período de incubação com os lisados celulares para permitir o estabelecimento de interações, a isca biotinilado vinculada aos seus parceiros intracelulares é puxada para baixo com avidin ou avidin derivados conjugados com grânulos de apoio. Em seguida, interações da proteína-isca são detectadas após a lavagem, eluição e análise por desnaturação da electroforese seguida por Western blot. Um dos problemas desta técnica é que as interações entre a proteína de interesse e seus parceiros intracelulares estão ocorrendo fora do contexto celular. Isto é especialmente importante para as interações envolvidas nas vias de transdução de sinal porque eles ocorrem em locais específicos intracelulares, eles são transitórios e eles são normalmente efectuados por proteínas não abundantes. Portanto, dentro os lisados celulares essas interações podem ser mascaradas por outras mais abundantes proteínas ou proteínas que normalmente não estão nas proximidades.
Célula-penetrante peptídeos (CPPs) são peptides curtos (≤40 aminoácidos), compostos principalmente por aminoácidos catiônicos que são capazes de transportar uma grande variedade de moléculas em praticamente qualquer célula3. Cargas tais como proteínas, Plasmídeo, siRNA, vírus, agentes de imagens e vários nanopartículas tem sido conjugadas com CPPs e eficientemente interiorizado4,5. Por causa dessa capacidade de transporte eles são também conhecidos como domínios de transdução da proteína (PTDs), membrana se sequências (MTSs) e peptídeos Trojan. Entre as CPPs, o TAT peptídeo da proteína liberada HIV TAT6 tem sido uma das mais amplamente estudados 7,8,9. TAT é um nonapeptide que contém arginina 6 e 2 resíduos de lisina e é consequentemente altamente catiônica. Substituição estudos têm demonstrado que a carga líquida positiva de TAT é necessária para interações eletrostáticas com as membranas do plasma das células eucarióticas e sua posterior internalização10. Da mesma forma para outros CPPs, TAT carregado positivamente fortemente vincula eletrostaticamente para várias carga negativa espécies presentes na superfície extracelular das membranas celulares, incluindo grupos de cabeça de lipídios, glicoproteínas e proteoglicanos3 , 10. as cargas bioativas transportadas por TAT tornam-se imediatamente livres no citosol para alcançar seus parceiros intracelulares.
Aqui nós apresentamos um método que combina o TAT CPP com biotina para estudar interações intracelulares. O objetivo é projetar célula-penetrante iscas fundindo a alvo biomolécula TAT e biotina. A principal vantagem desta proposta é que as interações entre a isca e seus parceiros terá lugar dentro de seu contexto celular. Para mostrar a eficácia deste método que usamos como isca uma pequena sequência da proteína Cx43 que tem sido relatado para interagir intracelular com o proto-oncogene c-Src11,12,13. Cx43 é uma proteína integral de membrana que é amplamente expresso em astrócitos14e para baixo-regulado em gliomas de alto grau, o tumor maligno mais comum do sistema nervoso central15,16,17 ,18. Tem sido mostrado anteriormente que a região de Cx43 que interage com o c-Src (aminoácidos 266-283 em Cx43 humana; PubMed: P17302) fundiu a TAT (TAT-Cx43266-283) inibe a atividade oncogênica de c-Srcin células de glioma e pilhas de haste de glioma (GSCs)19,20,21. Para projetar a isca intracelular, Cx43266-283 fundiu a TAT no N-terminal (TAT-Cx43266-283) e a biotina no C-terminal (TAT-Cx43266-283- B). Esta estratégia tem sucesso utilizou o glioma de rato linha de celular C6 para identificar c-Src, c-terminal quinase Src (CSK) e fosfatase e tensin homólogo (PTEN) como parceiros intracelulares desta região da Cx4320. Aqui, descrevemos este método testando sua eficácia em humanos GSCs, que são muito relevantes para a terapia de glioma, mas muito mais difícil para transfect do que as células-tronco glioma.
Protocolo
Todos os procedimentos experimentais foram realizados na Universidade de Salamanca.
1. as células
- Dois dias antes de iniciar o procedimento, as células a densidade necessária para ser confluentes no dia do experimento da placa. As células em frascos ou placas da placa. No entanto, a extração da proteína será mais fácil das placas. É conveniente preparar pelo menos 4 placas de 78 cm2 ou 2 frascos de 150 cm2 por condição por experiência, para ter certeza que os resultados são consistentes.
- Neste estudo, placa humana G166 GSCs em 4 frascos de 150 cm2, cultivadas em células-tronco RHB-A suplementado com 2% B27, 1% N2, 20 ng/mL EGF e b-FGF conforme descrito por Pollard e col.22. Processo de confluência foi atingida. Por exemplo, quando 5 x 106 G166 células foram banhadas num balão de2 a 150 cm, eles foram processados 2 dias após o chapeamento.
2. biotinilado CPPs
- Girar os frascos contendo o liofilizado biotinilado CPPs (BCPPs) a 8200 x g durante 30 s, para evitar um pouco o pó restante na tampa. Inclua um controle BCPP para certifique-se de que as interações encontradas são específicas da sequência de destino. Neste estudo, o controle BCPP TAT-biotina (TAT-B) e o tratamento BCPP TAT-Cx43266-283- B. Podem ser usados outros controles, como TAT fragmentos fundidos para mexidos ou mutado bond a biotina.
- Dissolver os BCPPs no meio de cultura correspondente à solução estoque indicado pelo fabricante; por exemplo, para obter uma solução stock de 2 mg/mL BCPP para tratar GSCs adicionar 0,5 mL do meio de cultura de GSC para um frasco contendo 1 mg do BCPP. Vórtice e certifique-se de que o peptídeo é bem dissolvido.
3. os tubos
Nota: Prepare pelo menos doze tubos de 1,5 mL por condição necessária na seção 7.
- Marca os primeiro 3 tubos por condição. Eles terão o volume total de lisado celular obtido na etapa 6.4.
- Marca um A em 3 tubos por condição. Estes tubos terá os primeiros sobrenadantes obtidos após a Lise e girando o lisado celular, passo 7.2.
- Marca um B em 3 tubos por condição. Estes tubos terá uma pequena alíquota dos sobrenadantes de primeiras. Estes lysates servirá como as amostras de Western blot etapa 7.3.
- Marca um C em 3 tubos por condição. Estes tubos terá os sobrenadantes obtidos após o pendente com NeutrAvidin, passo 7,7.
Nota: É importante no caso de Western blot não mostrou nenhum sinal de proteínas, ou seja, as proteínas não foram puxadas para baixo ou foram perdidas em algum passo do procedimento. Se esta fosse a situação, repita o processo para puxar para baixo as proteínas.
4. tratamento celular com os BCPPs
- Aspire o meio de cultura.
- Substitua o volume correspondente de meio fresco necessário para incubar os BCPPs no menor volume possível de meio de acordo com os tempos de incubação. É muito importante que em qualquer caso, o médio cobre completamente toda a superfície do prato/balão para que as células não secar, por exemplo, de 6 mL por 150 cm2 para uma incubação 30 min.
- Adicione o volume da solução-mãe de BCPP para as culturas de células para alcançar a concentração que tem sido provada ser eficaz. No presente estudo 50 µM TAT-Cx43266-283- B foi provado para reduzir a proliferação de GSC.
- Portanto, adicionar 92.8 µ l de 2 mg/mL de TAT-Cx43266-283- B (MW = 3723.34 g/mol) por mL de meio de cultura para obter uma concentração final de 50 µM TAT-Cx43266-283- B. Se o volume a ser adicionado é diferente de peptídeos de controle, completos com meio de cultura até o mesmo volume final. Por exemplo, 49.1 µ l TAT-B (MW = 1914.31 g/mol) e mais meio de GSC 43.7 µ l foram adicionados por mL de meio de cultura para obter uma concentração final de 50 µM TAT-B.
- Coloca as células em incubação a 37 ° C e 5% CO2 por 30 min certificar-se que as interações entre o BCPP e seus parceiros intracelulares ocorrem. Se a interação leva mais tempo, incubar por tempos mais longos ou ajustar vezes caso o experimento consistiu em um curso de tempo. Além disso, a interação de interesse pode ser promovida ou impedida por estimulantes diferentes vias de sinalização intracelulares.
5. buffers e soluções.
- Preparar o pH PBS 7.4: 136 mM NaCl; 2,7 mM KCl; 7,8 mM Na2HPO4·2H2O; 1,7 mM KH2PO4.
- Preparar o tampão de lise de proteínas: 20 mM Tris-HCl (pH 8.0), 137 mM de NaCl, 1% IGEPAL, antes de usar, adicione o seguinte: 1/100 (v/v) inibidor de Protease Cocktail, 1mm fluoreto de sódio, 1 mM Phenylmethanesulfonyl de flúor (PMSF) e ortovanadato de sódio 0,1 mM.
- Preparar o tampão de Laemmli: (4 x: 0,18 M Tris-HCl pH 6,8; glicerol 5m; SDS 3,7% (p/v); 0,6 M β-Mercaptoetanol ou 9 mM DTT; 0,04% (v/v) bromofenol (BB)).
6. extração de proteínas
Nota: Extração de proteínas foi realizada como descrito anteriormente,20,23. Realizar toda esta secção do procedimento a 4 ° C.
- Aspire o meio de cultura completamente.
- Lavagem de 3 x 10 mL de fosfato gelado tampão salino (PBS) por 150 cm2 com muito cuidado para evitar o desprendimento de células.
- Para obter o lisado celular, adicionar 3 mL de tampão de Lise por 150 cm2 e raspe cuidadosamente a superfície usando um raspador de célula. O placa/balão até cerca de 45 graus de inclinação facilitará reunir os lisados celulares para seus tubos correspondentes.
- Despeje 1 mL de lisado pelo tubo do celular em três tubos de 1,5 mL. Estes tubos serão marcados com a condição e a replicar como indicado no ponto 3.1.
7. pull-down
- Centrifugar os tubos de 1,5 mL a 11.000 x g durante 10 minutos a 4 ° C.
- Transferi os sobrenadantes para novos tubos de (A).
- Tome uma alíquota deste sobrenadante por condição para tubos diferentes (B), ou seja, 50 µ l pelo tubo. Adicionar 4 x Laemmli tampão (16,6 µ l para 50 µ l de lisado) e congelar a-20 ° C. Estes lysates servirá como de costume ocidental do borrão amostras.
- Homogeneizar muito bem o NeutrAvidin Agarose por agitação suave. Corte as pontas das pontas de pipeta para aumentar seu diâmetro e melhorar a pipetagem dos grânulos.
Nota: Os sobrenadantes (tubos D) agora estão prontos para ser carregado no borrão ocidental ou congelar a-20 ° C.
8. Western Blot
Nota: Mancha ocidental foi realizado como descrito anteriormente,24.
- Volume equivalente de cada amostra por lane em midigels Bis-Tris (4-12%) em um sistema de eletroforese Midi-célula de carga.
- Transblot proteínas usando um sistema de mancha seco em uma pilha de regular de nitrocelulose.
- Manchar a membrana com 10% Ponceau por 10 min.
- Lave as membranas 3 x 5 min com 5 mL de TTBS.
- Bloquear as membranas com leite de 7% em TTBS para 1 h com agitação suave em tubos ou em pequenas caixas. Verifique se o volume utilizado é suficiente para cobrir as membranas e que não secam, ou seja, 40 mL por membrana toda midi.
- Lave 3 x 5 min com 5 mL de TTBS.
- Incube durante uma noite a 4 ° C, com o anticorpo primário contra a proteína de interesse com agitação suave.
- Lave 3 x 5 min com 5 mL de TTBS.
- Incube a membrana em temperatura ambiente com o correspondente conjugada com peroxidase anticorpo secundário em TTBS por 1h.
- Lave 3 x 5 min com 5 mL de TTBS.
- Desenvolve-se com um substrato quimioluminescente em um sistema de quimioluminescência.
9. solução de problemas
- Se depois de desenvolver o Western blot qualquer das amostras não mostrou nenhum sinal de todo para proteínas, verifique o Ponceau.
Nota: A membrana em Ponceau deve mostrar indefinida e carregado de inúmeras bandas ao longo das pistas. Se as bandas não são muito perceptíveis, a quantidade de proteínas carregado pode não ser suficiente ou a transferência pode ter ido incorretamente. Considere-se repetindo o Western blot. - Se não há nenhuma mancha de todo na membrana Ponceau em qualquer pista, repita todo o procedimento da etapa 7,4 nos tubos (C).
- Se depois de desenvolver o borrão ocidental um sinal de proteína é muito fraco, mas o Ponceau mostrou proteínas, incubar a membrana com o anticorpo primário de novo por mais tempo. Se o sinal ainda está um pouco fraco, incube-se novamente à temperatura ambiente.
10. outros técnicas usados neste artigo
- Imunocitoquímica da BCPPs
- Conserte as células em paraformaldeído 4% (0,2 mL por cm2) por 20 min.
- Lave 3 x 5 min com PBS (0,2 mL por cm2).
- Aplicar o anticorpo correspondente (pelo menos 0,15 mL por cm2) diluído em solução de anticorpo a concentração indicada do fabricante contra sua proteína de interesse durante a noite a 4 ° C.
- Incube com um fluoróforo conjugado anticorpo secundário (0,15 mL por cm2) por 2 h à temperatura ambiente.
- Repita as etapas 10.1.2-10.1.4 com outros anticorpos contra as proteínas de interesse. Tenha cuidado para não usar a mesma espécie de anticorpos primários diferentes ou mesmo comprimento de onda fluorophores para anticorpos secundários.
- Monte as células usando o reagente antidesgaste (0,005 mL por cm2).
- Analise em um microscópio de fluorescência, conectado a uma câmera digital.
- Ensaio de MTT
- Cultura das células a 37 ° C em placas de 24 poços.
- Incube as celulas no escuro para 75 min com 0,15 mL de meio de cultura por cm2 contendo 0,5 mg/mL MTT.
- Aspire o meio e incube as celulas por 10 min no escuro com dimetil sulfóxido (0,25 mL por cm2), com leve agitação.
- Medir a absorvância no comprimento de onda de 570 nm, utilizando um leitor de microplacas.
Resultados
Antes de utilizar BCPPs para estudar a interação intracelular, é crítico para comparar os efeitos do BCPP vs CPP para validar os resultados obtidos com o BCPP. Por conseguinte, para estudar-se a inclusão de biotina modifica a atividade da sequência alvo, analisamos primeiro o efeito de TAT-Cx43266-283- B comparado com TAT-Cx43266-283 na morfologia G166 GSCs. Para tanto, foram realizadas algumas análises de imunofluorescência de duas proteínas do citoesqueleto, F-Actina e α-tubulina após 24 h de tratamento. A Figura 1 mostra que G166 GSCs na presença de 50 µM TAT-Cx43266-283 ou TAT-Cx43266-283- B adquirir um formato mais arredondado em comparação com os alongamentos celulares alongados e expandidos mostrados nos controles (TAT ou TAT-B). Na verdade, a Figura 1b mostra que filamentos de actina são montados principalmente como redes de actina quando as células foram tratadas com TAT-Cx43266-283 ou TAT-Cx43266-283- B enquanto eles formam mais feixes de actina nas células controle (tratada com TAT ou TAT-B)25. Em contraste, distribuição de α-tubulina não varia entre as diferentes condições. Estes resultados mostraram que a presença de biotina não modificar o efeito da sequência de destino na morfologia das G166 GSCs. Em anteriores estudos2120,, mostramos que TAT-Cx43266-283 reduzido G166 GSCs proliferação. Neste estudo, investigamos se TAT-Cx43266-283- B exerce os mesmos efeitos no crescimento como TAT-Cx43266-283. Para isso, analisamos a proliferação G166 GSCs pelo ensaio de MTT após 72 h de tratamento. O ensaio de MTT é um ensaio colorimétrico para avaliar a atividade metabólica celular. MTT é metabolizada pelas enzimas de oxidorredutase NAD (P) H nas mitocôndrias, refletindo o número de células viáveis presentes. A Figura 2 mostra que a redução da viabilidade celular G166 GSCs não é significativamente diferente quando as células foram tratadas com 50 µM TAT-Cx43266-283 ou 50 µM TAT-Cx43266-283- B. Na verdade, ambos significativamente diminuíram G166 GSCs proliferação em comparação com o controle, TAT ou TAT-B.
Uma vez que nós confirmamos que o efeito da nossa sequência de destino em G166 GSCs (TAT-Cx43266-283) não foram modificado pela inclusão da biotina no C-terminal (TAT-Cx43266-283- B), investigamos os parceiros intracelulares de sequência seguindo o protocolo descrito neste estudo (Figura 3). Porque caveolae ter sido envolvido no mecanismo de TAT internalização26, analisamos a presença de caveolin-1 (Cav-1) nos pull-downs. Análise ocidental do borrão (Figura 4) mostrou que TAT-B e TAT-Cx43266-283- B interagem com Cav-1. No entanto, a capacidade de TAT-Cx43266-283- B para recrutar c-Src, PTEN e CSK é mais forte do que a encontrada com TAT-B. Quinase de adesão focal (FAK) é um substrato de que não foi mostrado para interagir com Cx43 c-Src. Com efeito, FAK não mostraram qualquer interação significativa com TAT-B ou TAT-Cx43266-283- B.
Para confirmar a interação entre TAT-Cx43266-283- B e c-Src, GSCs G166 foram incubados com 50 µM TAT-Cx43266-283- B por 30 min e sua localização foi seguido com estreptavidina fluorescente por microscopia confocal (Figura 5 ). Nossos resultados mostraram que a distribuição intracelular de TAT-Cx43266-283- B aproxima-se da membrana plasmática (mostrada pela coloração de fosfatidilserina) e corresponde com o do c-Src. De fato, análises de localização co revelaram alguns pontos de localização co (branco) entre TAT-Cx43266-283- B e c-Src da imagem de mesclagem. Por conseguinte, microscopia confocal estudos confirmam os resultados obtidos com o protocolo de suspenso BCPP descrito neste estudo.
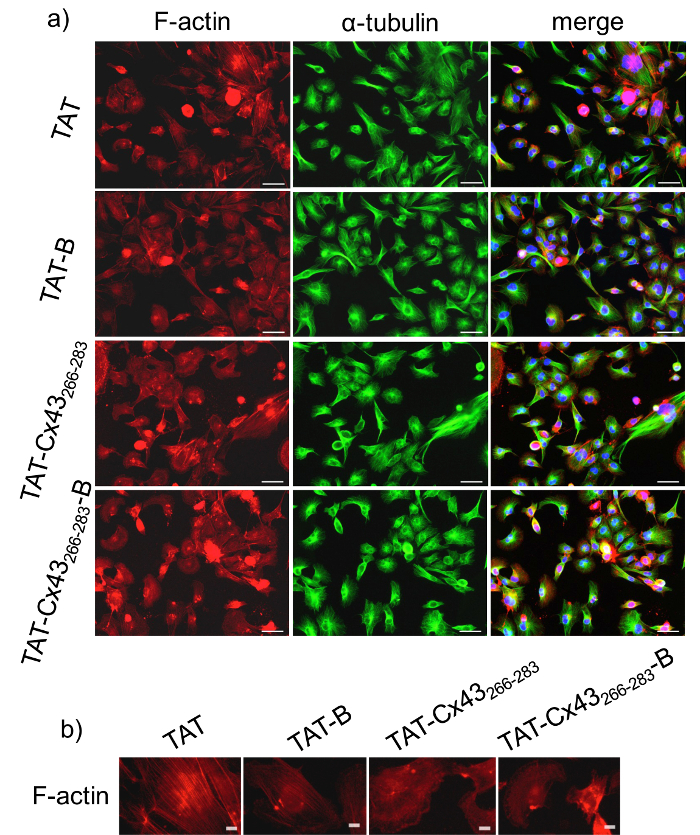
Figura 1: Efeito do BCPP e CPP na morfologia do GSC.
G166 GSCs foram banhados em uma densidade baixa (2 x 104 células / cm2) e após 24 h, eles foram incubados com controle de 50 µM CPP (TAT), controlar o BCPP (TAT-B), CPP (TAT-Cx43266-283) ou um tratamento BCPP (TAT-Cx43266-283- B) . a) F-Actina (vermelho), α-tubulina (verde) e mesclado + DAPI imunocoloração de um mesmo campo mostrando G166 GSCs morfologia. Barras = 50 µm. b) F-Actina immunostaining mostrando a distribuição diferente da F-Actina em G166 GSCs após incubação de 24h com 50 µM controlar CPP (TAT) ou controlar BCPP (TAT-B) em comparação com o tratamento de 50 µM CPP (TAT-Cx43266-283) ou BCPP (TAT-Cx43 266-283-B). Bares = 10 µm. clique aqui para ver uma versão maior desta figura.

Figura 2: Efeito da BCPP e CPP na viabilidade de GSC.
GSCs G166 foram banhados em 5500 células/cm2 em placas de 24-multiwell e incubadas com peptídeos de controle 50 µM, CPP (TAT) ou BCPP (TAT-B), ou 50 peptídeos de tratamento µM, CPP (TAT-Cx43266-283) ou BCPP (TAT-Cx43266-283- B). A viabilidade celular foi analisada utilizando um ensaio de MTT após 72 h. Os resultados são expressos como absorvâncias de MTT e são de pelo menos 3 experimentos no MEV mostrou a média ± (+ + p˂0.01 vs controle. * * p˂0.01, * * * p˂0.001 vs TAT ou TAT-B; One-Way ANOVA withTukey pós-teste). Note que não existem diferenças significativas entre os efeitos da CPPs vs BCPPs. por favor clique aqui para ver uma versão maior desta figura.
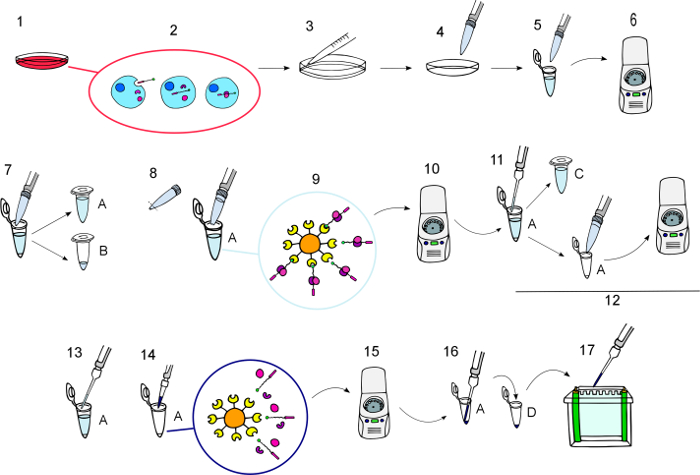
Figura 3: Diagrama de protocolo.
Representação gráfica passo a passo do procedimento conforme descrito na seção "Protocolo", desde a incubação das BCPPs até os BCPPs eluted e suas interação proteínas foram obtained.1) incubar células de cultura com BCPPs na concentração desejada para o tempo necessário. 2) durante a incubação, os BCPPs são internalizados e interagem com os seus parceiros intracelulares. 3) Lave as células três vezes no gelo com PBS gelado. 4) lise as células para extrair proteínas. 5) transferência lisados celulares para tubos.6) giram em 11000 x g durante 10 minutos a 4 ° C. 7) transferência os sobrenadantes para novos tubos de (A) e manter uma pequena alíquota dos lysates para processar como regular Western blot amostras em tubo (B). 8) Ressuspender os grânulos NeutrAvidin Agarose e adicionar 50 µ l de cada tubo um usando uma ponta de pipeta de corte. 9) incubar agitando suavemente para 12 h a 4 ° C, para permitir que os grânulos de agarose NeutrAvidin interagir com o BCPPs e seus parceiros. 10) rotação por 1 min a 3000 x g para granular os grânulos com o biotinilado iscas e suas proteínas interagindo vinculados a eles. 11) transferir sobrenadantes para novos tubos (C) e mantê-los para usar no caso o suspenso precisa ser repetido. 12) Lave o pellet cinco vezes com frescos do lysis, resuspenda por inversão, rotação por 1 min em 3000 x g e descartar o sobrenadante. 13) Remova todo o sobrenadante cuidadosamente. 14) Adicionar o volume desejado de 4x do buffer de Laemmli e eluir as proteínas a 100 ° C por 5 min. 15) girar a 8200 x g durante 30 s para granular os grânulos. 16) transferi as proteínas eluted encontradas no sobrenadante com capilares dicas para novos tubos (D). 17) carregar em gel para análise ocidental do borrão. Clique aqui para ver uma versão maior desta figura.
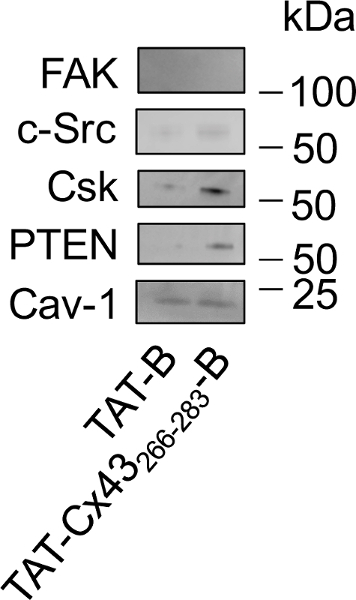
Figura 4: Estudo das interações intracelulares de TAT-Cx43266-283- B em G166 GSCs por suspenso seguido por Western blot.
GSCs G166 foram incubados com 50 µM TAT-B ou TAT-Cx43266-283- B. Após 30 min, as células foram lysed e TAT-B ou TAT-Cx43266-283- B anexado aos seus parceiros intracelulares estavam arriadas com grânulos de NeutrAvidin. As proteínas eluted foram carregadas e analisadas por Western blot, para estudar os níveis de FAK, c-Src, CSK, PTEN e Cav-1. Note que o Cav-1 interage com ambas TAT-B e TAT-Cx43266-283- B, c-Src, PTEN e CSK interagem preferencialmente com TAT-Cx43266-283- B e FAK não mostraram qualquer interação com TAT-B ou TAT-Cx43266-283-B. por favor Clique aqui para ver uma versão maior desta figura.
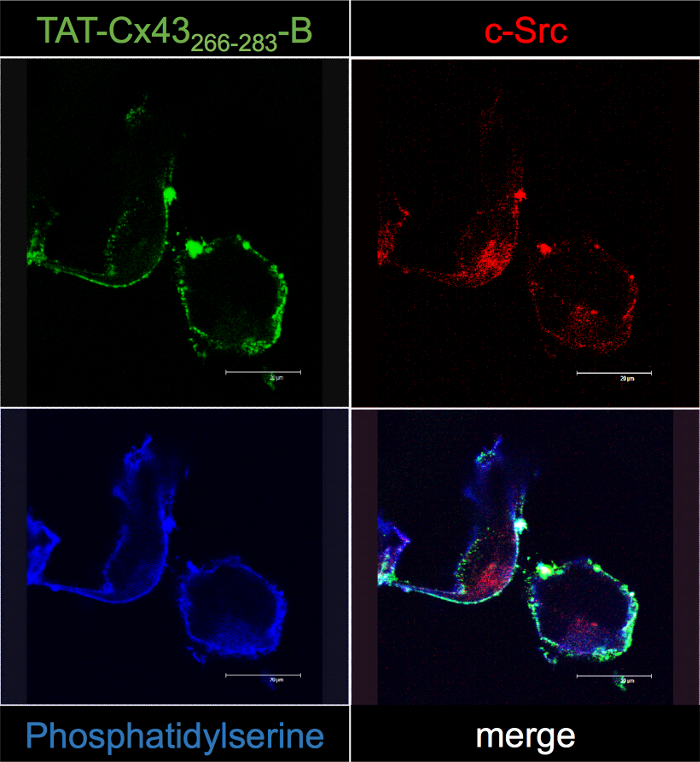
Figura 5: Confirmação de TAT-Cx43266-283- B intracelulares interações em G166 GSCs pela microscopia confocal.
GSCs G166 foram incubados com 50 µM TAT-Cx43266-283- B. Após 30 min, células foram fixadas e processadas para localizar TAT-Cx43266-283- B com Cy2-Streptavidin (verde), c-Src por imunofluorescência (vermelha) e fosfatidilserina com anexina V (azul). Observe alguns pontos de localização co (branco) entre TAT-Cx43266-283- B e c-Src perto da membrana plasmática nas imagens de mesclagem. Clique aqui para ver uma versão maior desta figura.
Discussão
Existem muitos métodos para estudar interações da proteína-proteína. O método apresentado neste estudo baseia-se no sistema biotina-avidina amplamente utilizado suspenso em que uma isca biotinilado é incubada com lisados celulares para permitir o estabelecimento de interações. A modificação apresentada neste estudo inclui a combinação desta técnica com célula-penetrante sequências. Propomo-na projetar iscas penetra no celular que podem ser incubadas com células vivas em vez de lisados celulares e, portanto, as interações encontradas refletirá aqueles que ocorreram no âmbito celular.
Aqui nós usamos TAT como a sequência de penetração celular, biotina como a tag suspenso e a região de Cx43 compreendida entre aminoácidos 266-283 como destino para encontrar interações intracelulares em GSCs humanas. A base estrutural para a interação entre Cx43 e c-Src é conhecido11,12. Esta é uma importante interação porque inibe a atividade oncogênica do c-Src em células de glioma24,13. Na verdade, CPPs contendo nesta região (TAT-Cx43266-283) imitam as propriedades antioncogenic de Cx43 em células de glioma19,20,21. Em pilhas de C6 de glioma de rato, o mecanismo pelo qual o TAT-Cx43266-283 inibe c-Src inclui o recrutamento de c-Src juntamente com seus inibidores endógenos CSK e PTEN20. Deve ser mencionado que GSCs são muito interessantes como alvo na terapia de glioma, porque constituem uma subpopulação resistentes aos tratamentos convencionais e, portanto, responsável, para a recorrência deste de tumores cerebrais malignos27. Além disso, eles são células difícil-para-transfect e, portanto, o estudo das interações intracelulares torna-se mais difícil. PPLS são internalizadas rapidamente e eficientemente no GSCs19 , favorecendo a sua utilização para o estudo das interações intracelulares. No presente estudo, usando CPPs fundidos a biotina confirmamos a interação da sequência de266-283 Cx43 com c-Src juntamente com seus inibidores endógenos CSK e PTEN em GSCs humanas.
Este método é muito poderoso para estudar o mecanismo intracelular de compostos bioativos. No entanto, é muito importante confirmar que o efeito biológico da isca biotinilado célula penetrante não é diferente daquela obtida com a não-biotinilado um. Esta etapa é necessária para associar as interações com o efeito do composto Bioativo. Além disso, a estabilidade do composto, sua possível degradação por proteases, bem como sua toxicidade possível, deve ser cuidadosamente testada e tida em conta antes de planejar o experimento. No exemplo apresentado, o efeito antiproliferativa do TAT-Cx43266-283 na G166 GSCs humanas tem sido anteriormente documentados20. Neste estudo, podemos confirmar que o efeito antiproliferativa do TAT-Cx43266-283- B e do TAT-Cx43266-283 é muito semelhante. Além disso, a análise da morfologia celular revelou que α-tubulina e distribuição F-Actina é muito semelhante em G166 GSCs tratados com TAT-Cx43266-283- B ou com TAT-Cx43266-283. No total, estes resultados indicam que a inclusão de biotina no c-terminal da Cx43 TAT266-283 não modificar os efeitos deste composto na GSCs humanas. No entanto, se biotina poderia modificar os efeitos da molécula Bioativo, outras tags para purificação da proteína podem ser testados, tais como a bandeira Octapeptídeo (DYKDDDDK)28, a tag de hemaglutinina-derivado da gripe humana HA (YPYDVPDYA) ou glutationa S-transferase (GST)29. Da mesma forma, se TAT não tem como alvo a população de células de interesse, outro celular sequências penetrantes, como penetratin, MPG (para uma revisão, ver30) ou sequências específicas de célula podem ser utilizado31.
Além do estudo de proteínas que interagem especificamente com a sequência alvo, idealmente, deve ser a presença de proteínas que interagem com o controle e a sequência de destino e proteínas que não interagem com eles, como controles positivos e negativos, abordadas. Neste sentido, encontramos o Cav-1 no controle e tratada a situação, sugerindo que o caveolae estar envolvidas no mecanismo de interiorização, como tem sido demonstrado anteriormente26. Além disso, FAK, que interage com o c-Src, mas é suposto não interagem com o c-terminal da Cx43, estava ausente no controle e na situação tratada. Estes resultados reforçam a especificidade da interação entre TAT-Cx43266-283- B, c-Src, CSK e PTEN. Para confirmar os resultados obtidos com este protocolo, microscopia confocal pode ser usada para visualizar a distribuição das proteínas de interação e estudar sua localização co. Assim, encontramos TAT-Cx43266-283- B e c-Src exposição uma distribuição intracelular semelhante com alguns pontos de localização co, confirmando os resultados obtida com os experimentos de suspenso. Na verdade, TAT-Cx43266-283- B é distribuído perto da membrana plasmática, sugerindo que a carga, neste estudo Cx43266-283, direciona a molécula aos seus parceiros intracelulares.
Uma das limitações do método proposto é que a molécula utilizada como isca pode falhar dobrar corretamente e os efeitos esperados não ser encontrados. Nesta situação, as interações encontradas não podem ser associadas para o efeito. No entanto, esse método pode ser especialmente interessante para as interações envolvidas nas vias de transdução de sinal, porque eles são geralmente realizados por regiões intrinsecamente desordenado32 e, portanto, não necessitam de um ordenado de dobramento. Além disso, uma das vantagens do método proposto é que o curso do tempo da interação pode ser seguido, que é especialmente relevante para interações transitórias. Além disso, a relevância de cada resíduo na interação pode ser facilmente estudada. Com efeito, é possível estudar a pertinência das modificações posttranslational na interação da proteína-proteína, por exemplo, pela substituição de phosphomimetic de glutamato serina ou treonina. Da mesma forma, a substituição de serina ou treonina para alanina ou tirosina para fenilalanina permite testar o efeito da não-phosphorylatable serina, treonina ou tirosina.Para imitar o phospho-tirosina, a maneira mais exata é a substituição de Tyr por Tyr p33.
Finalmente, o âmbito de aplicação do presente protocolo é muito além da interação da proteína-proteína, porque este sistema pode ser aplicado a outras cargas bioativas como sequências de RNA, nanopartículas, vírus ou outras moléculas que podem ser fundidas para biotina e transfectadas com CPP para estudar seu mecanismo intracelular de ação.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos J. Bravo e M. Morales por sua ajuda com o design do CPPs e J.C. Arévalo por sua ajuda com o protocolo suspenso. Estamos gratos pela assistência técnica da T. del Rey. Este trabalho foi apoiado pelo Ministerio de Economía y competitividade, Espanha; FEDER BFU2015-70040-R, Junta de Castilla y León, Espanha; SA026U16 FEDER e Fundación Ramón Areces. M. Jaraíz-Rodríguez e A. González-Sánchez são beneficiários de uma bolsa da Junta de Castilla y León e do Fundo Social Europeu.
Materiais
| Name | Company | Catalog Number | Comments |
| G166 GSC line | BioRep | ||
| RHB-A stem cell medium | Takara | Y40001 | |
| Laminin Mouse Protein | Invitrogen, Life Technologies, ThermoFisher Scientific | 23017-015 | 10 µg/ml |
| B-27 Serum free Supplement (50X) | Invitrogen, Life Technologies, ThermoFisher Scientific | 17504-044 | 2% |
| N-2 Supplement (100x) | Invitrogen, Life Technologies, ThermoFisher Scientific | 17502-048 | 1% |
| Recombinant Human EGF | Peprotech | AF-100-15 | 20 ng/ml |
| Recombinant Human b-FGF | Peprotech | AF-100-18B | 20 ng/ml |
| PBS pH 7.4: In deionized water, 136 mM NaCl ; 2.7 mM KCl; 7.8 mM Na2HPO4·2H2O ; 1.7 mM KH2PO4 | |||
| Accutase | Sigma | A6964 | |
| Cryostor CS10 cryopreservation medium | StemCell Technologies | 7930 | |
| TAT | GenScript | - | Custom made |
| TAT-B | GenScript | - | Custom made |
| TAT-Cx43266-283 | GenScript | - | Custom made |
| TAT-Cx43266-283-B | GenScript | - | Custom made |
| Alexa Fluor 594 Phalloidin | Molecular Probes, Life Technologies, ThermoFisher Scientific | A1275737 | 1/20 |
| Monoclonal α-tubulin mouse antibody | Sigma-Aldrich | T9026 | 1/500 |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes, Life Technologies, ThermoFisher Scientific | 1.25 mg/ml | |
| Pierce™ NeutrAvidin™ Agarose | ThermoFisher Scientific | 29200 | |
| Protein lysis buffer: 5 mM Tris-HCl (pH 6.8), 2% (w/v) SDS, 2 mM EDTA , 2 mM EGTA | |||
| Protease Inhibitor Cocktail Set III. EDTA-Free | Calbiochem, Bionova | 539134 | 1/100 (v/v) |
| Sodium Fluoride | PanReac AppliChem | 141675 | 1 mM |
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma-Aldrich | P7626 | 1 mM |
| Sodium orthovanadate | Sigma-Aldrich | S6508 | 0.1 mM |
| Laemmli buffer: (4x: 0.18 M Tris-HCl pH 6.8; 5 M glycerol; 3.7 % (w/v) SDS; 0.6 M β-mercaptoethanol or 9 mM DTT ; 0.04% (v/v) bromophenol blue (BB) . | 1X | ||
| Xcell 4 SureLock Midi-Cell Electrophoresis System | Life Technologies, ThermoFisher Scientific | WR0100 | |
| NuPAGE Novex Bis-Tris Midi-Gels 4-12% | Life Technologies, ThermoFisher Scientific | WG1402box | |
| NuPAGE MOPS SDS Running Buffer (20X) | Life Technologies, ThermoFisher Scientific | NP0001 | 1X |
| NuPAGE Transfer Buffer 20x | Life Technologies, ThermoFisher Scientific | NP0006 | 1X |
| Precision Plus Protein Dual Color Standard | Bio-Rad | 161-0374 | |
| iBlot 2 NC Regular Stacks (nitrocellulose membranes) | Life Technologies, ThermoFisher Scientific | IB23001 | |
| iBlot 2 Dry Blotting System - Gel transfer device | Life Technologies, ThermoFisher Scientific | IB21001 | |
| 10% Ponceau S Solution (0.1% Ponceau (w/v) in 5% acetic acid (v/v)) in water | Sigma | P7170 | |
| FAK polyclonal rabbit antibody | Life Technologies, ThermoFisher Scientific | AHO0502 | 1/500 |
| Src polyclonal rabbit antibody | Cell Signalling (WERFEN) | 2108S | 1/500 |
| Csk polyclonal rabbit antibody | Cell Signalling (WERFEN) | 4980 | 1/500 |
| PTEN polyclonal mouse antibody | Cell Signalling (WERFEN) | 9552 | 1/500 |
| Caveolin-1 polyclonal rabbit antibody | Abcam | ab2910 | 1/1000 |
| Goat anti-mouse IgG-HRP antibody | Quimigen, Santa Cruz Biotechnology | Sc-2005 | 1/5000 |
| Goat anti-rabbit IgG-HRP antibody | Quimigen, Santa Cruz Biotechnology | SC-2030 | 1/5000 |
| Western Blotting Luminol Reagent | Santa Cruz Biotechnology | SC-2048 | |
| Src polyclonal rabbit antibody | Cell Signalling (WERFEN) | 2108S | 1/500 |
| Antibody solution: PBS, 10% FBS, 0.1 M lysine, 0.02% sodium azide | |||
| Alexa Fluor 488 goat anti-mouse IgG | Invitrogen, Life Technologies, ThermoFisher Scientific | A11029 | 1/1000 |
| Cy2-conjugated streptavidin | Jackson ImmunoResearch | 016-220-089 | 1/500 |
| MicroChemi Luminescence system | DNA Bio-Imaging Systems | ||
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor® 488 & Propidium Iodide (PI) | Molecular Probes, Life Technologies, ThermoFisher Scientific | V13241 | 1/500 |
| SlowFade Gold antifade reagent | Life Technologies, ThermoFisher Scientific | S36936 | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | |
| Dimethyl sulfoxide for UV-spectroscopy, >=99.8% (GC) | Honeywell | 41641-1L | |
| Appliskan 2001 | Thermo Electron Corporation, Thermo Scientific |
Referências
- Green, N. M. Avidin. 3. The nature of the biotin-binding site. Biochem J. 89, 599-609 (1963).
- Wilchek, M., Bayer, E. A. Applications of avidin-biotin technology: literature survey. Methods Enzymol. 184, 14-45 (1990).
- Herce, H. D., Garcia, A. E., Cardoso, M. C. Fundamental molecular mechanism for the cellular uptake of guanidinium-rich molecules. J Am Chem Soc. 136 (50), 17459-17467 (2014).
- Ramsey, J. D., Flynn, N. H. Cell-penetrating peptides transport therapeutics into cells. Pharmacol Ther. 154, 78-86 (2015).
- Fominaya, J., Bravo, J., Rebollo, A. Strategies to stabilize cell penetrating peptides for in vivo applications. Ther Deliv. 6 (10), 1171-1194 (2015).
- Vives, E., Brodin, P., Lebleu, B. A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus. J Biol Chem. 272 (25), 16010-16017 (1997).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol Med. 13 (10), 443-448 (2007).
- Brooks, H., Lebleu, B., Vives, E. Tat peptide-mediated cellular delivery: back to basics. Adv Drug Deliv Rev. 57 (4), 559-577 (2005).
- Cuesto, G., et al. Phosphoinositide-3-kinase activation controls synaptogenesis and spinogenesis in hippocampal neurons. J Neurosci. 31 (8), 2721-2733 (2011).
- Schmidt, N., Mishra, A., Lai, G. H., Wong, G. C. Arginine-rich cell-penetrating peptides. FEBS Lett. 584 (9), 1806-1813 (2010).
- Sorgen, P. L., et al. Structural changes in the carboxyl terminus of the gap junction protein connexin43 indicates signaling between binding domains for c-Src and zonula occludens-1. J Biol Chem. 279 (52), 54695-54701 (2004).
- Giepmans, B. N., Hengeveld, T., Postma, F. R., Moolenaar, W. H. Interaction of c-Src with gap junction protein connexin-43. Role in the regulation of cell-cell communication. J Biol Chem. 276 (11), 8544-8549 (2001).
- Tabernero, A., Gangoso, E., Jaraíz-Rodríguez, M., Medina, J. M. The role of connexin43-Src interaction in astrocytomas: A molecular puzzle. Neuroscience. 323, 183-194 (2016).
- Giaume, C., Koulakoff, A., Roux, L., Holcman, D., Rouach, N. Astroglial networks: a step further in neuroglial and gliovascular interactions. Nat Rev Neurosci. 11 (2), 87-99 (2010).
- Shinoura, N., et al. Protein and messenger RNA expression of connexin43 in astrocytomas: implications in brain tumor gene therapy. J Neurosurg. 84, 839-845 (1996).
- Soroceanu, L., Manning, T., Sontheimer, H. Reduced expression of connexin-43 and functional gap junction coupling in human gliomas. Glia. 33, 107-117 (2001).
- Pu, P., Xia, Z., Yu, S., Huang, Q. Altered expression of Cx43 in astrocytic tumors. Clin Neurol Neurosurg. 107 (1), 49-54 (2004).
- Crespin, S., et al. Expression of a gap junction protein, connexin43, in a large panel of human gliomas: new insights. Cancer Med. 5 (8), 1742-1752 (2016).
- Gangoso, E., Thirant, C., Chneiweiss, H., Medina, J. M., Tabernero, A. A cell-penetrating peptide based on the interaction between c-Src and connexin43 reverses glioma stem cell phenotype. Cell Death & Disease. 5, (2014).
- Gonzalez-Sanchez, A., et al. Connexin43 recruits PTEN and Csk to inhibit c-Src activity in glioma cells and astrocytes. Oncotarget. 7 (31), 49819-49833 (2016).
- Jaraíz-Rodríguez, M., et al. A short region of connexin43 reduces human glioma stem cell migration, invasion and survival through Src, PTEN and FAK. Stem Cell Reports. , (2017).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem Cell. 4 (6), 568-580 (2009).
- Yu, T., et al. In vivo regulation of NGF-mediated functions by Nedd4-2 ubiquitination of TrkA. J Neurosci. 34 (17), 6098-6106 (2014).
- Herrero-Gonzalez, S., et al. Connexin43 inhibits the oncogenic activity of c-Src in C6 glioma cells. Oncogene. 29 (42), 5712-5723 (2010).
- Cooper, G. M. . The Cell: A Molecular Approach. , (2000).
- Fittipaldi, A., et al. Cell membrane lipid rafts mediate caveolar endocytosis of HIV-1 Tat fusion proteins. J Biol Chem. 278 (36), 34141-34149 (2003).
- Dirks, P. B. Brain tumor stem cells: the cancer stem cell hypothesis writ large. Mol Oncol. 4 (5), 420-430 (2010).
- Hopp, T. P., et al. A Short Polypeptide Marker Sequence Useful for Recombinant Protein Identification and Purification. Nat Biotech. 6 (10), 1204-1210 (1988).
- Benard, V., Bokoch, G. M. Assay of Cdc42, Rac, and Rho GTPase activation by affinity methods. Methods Enzymol. 345, 349-359 (2002).
- Guidotti, G., Brambilla, L., Rossi, D. Cell-Penetrating Peptides: From Basic Research to Clinics. Trends Pharmacol Sci. 38 (4), 406-424 (2017).
- Hu, Q., et al. Glioma therapy using tumor homing and penetrating peptide-functionalized PEG-PLA nanoparticles loaded with paclitaxel. Biomaterials. 34 (22), 5640-5650 (2013).
- Babu, M. M., van der Lee, R., de Groot, N. S., Gsponer, J. Intrinsically disordered proteins: regulation and disease. Curr Opin Struct Biol. 21 (3), 432-440 (2011).
- Anthis, N. J., et al. Beta integrin tyrosine phosphorylation is a conserved mechanism for regulating talin-induced integrin activation. J Biol Chem. 284 (52), 36700-36710 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados