A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطبيق القرار فائقة السرعة سرعة الفحص المجهري في هدب الأولية الحية
In This Article
Summary
مؤخرا نحن تعيين المواقع المكانية (3D) ثلاثي الأبعاد من طرق النقل لمختلف البروتينات ترانسلوكاتينج داخل أهداب الأساسية في الخلايا الحية. هنا تعيش هذه الورقة تفاصيل تطبيق الإعداد التجريبية والعملية للعينات البيولوجية وتحليل البيانات للأسفار 3D القرار العظمى التصوير نهجاً حديثا في أهداب الأولية.
Abstract
هدب الأولية المستندة إلى microtubule نتوء على السطح من العديد من الخلايا حقيقية النواة ويحتوي على مجموعة فريدة من نوعها من البروتينات التي تعمل حاسمة في حركية الخلية وإشارات. منذ أهداب قادرين على توليف البروتين الخاصة بهم، ما يقرب من 200 من البروتينات الهدبية فريدة من نوعها تحتاج إلى الاتجار بين سيتوسول واهداب الأولية. ومع ذلك، لا يزال تحديا تقنيا لتعيين مواقع (3D) ثلاثي الأبعاد لمسارات النقل لهذه البروتينات في أهداب الابتدائي حية بسبب القيود الموجودة حاليا تقنيات. للتغلب على هذا التحدي، مؤخرا لدينا المتقدمة والعاملين الفحص المجهري عالية السرعة قرار فائقة 3D ظاهري، تسمى نقطة واحدة الحافة--الإثارة مجهرية حيود الفرعية (سرعة)، تحديد الموقع المكاني ثلاثي الأبعاد لمسارات النقل كل سيتوسوليك وبروتينات الغشاء بأهداب الأولية للخلايا الحية. في هذه المقالة، سوف نظهر الإعداد التفصيلية لسرعة الفحص المجهري، إعداد الخلايا معربا عن الأسفار-البروتين المسمى البروتينات الهدبية وتتبع جزيء واحد في الوقت الحقيقي من البروتينات الفردية في هدب العيش وتحقيق خرائط ثلاثية الأبعاد المكانية الكثافة الاحتمالية لطرق النقل للبروتينات الهدبية.
Introduction
حيث ذكر إرنست [آب] في 1873، القرار للفحص المجهري الخفيفة التقليدية قد تم ويعتقد أن تقتصر على حوالي 200 شمال البحر الأبيض المتوسط بسبب حيود الضوء من الهدف1،2. حاليا تقنيات الفحص المجهري الخفيفة فائقة القرار كسر هذا القيد والسماح بالتقاط الصور الديناميكية مع القرار حيود الفرعية (< 200 nm). التقنيات عموما تندرج في فئتين عريضتين: حفز الانبعاثات استنفاد (STED) مجهرية على أساس النهج التي تولد حجم الإضاءة الحيود الفرعية بسبب الاستجابة البصرية غير الخطية من فلوروفوريس في3من العينات؛ ومن فوتواكتيفاتيد الخفيفة الميكروسكوب (النخيل) والتعمير البصرية العشوائية مجهرية (العاصفة)-على أساس تقنيات فائقة القرار، التي تستخدم الدوال الرياضية تعريب سينترويدس فلوروفوريس وثم إعادة تشكيل هذه سينترويدس لنموذج القرار فائقة الصور4،5. حاليا، بسبب الإعداد الضوئية غير معقدة نسبيا، النخيل والعاصفة على نطاق واسع يعملون بتفعيل فقط مجموعة فرعية صغيرة من فلوروفوريس في كل إطار من شريط فيديو طويل لتحضير البيولوجية. وهذا يسمح للترجمة أكثر دقة بملائمة غاوسي 2D من بقعة مضيئة، يسمى الدالة نقطة انتشار (PSF)، البروتينات المسماة فلوريسسينتلي في كل إطار من الفيديو. ثم يمكن تركيب موقع 2D كل جزيء المسمى فلوريسسينتلي على متن طائرة تصوير واحد لإنتاج صورة فائقة قرار لإعداد البيولوجية1،2. بينما هذه الترجمة جزيء واحد، نهج القرار فائقة للفحص المجهري ثورة التأكيد كيف أنجز تصوير العينات البيولوجية، ولا تزال هناك تحديات يجب التغلب عليها. على سبيل المثال، العاصفة والنخيل يمكن تحقيق أفضل الحلول المكانية الخاصة بها بعد تثبيت العينات البيولوجية وهكذا يقدم تمثيل ثابت للبروتينات المسمى فلوريسسينتلي، ووجود قيود مماثلة على الميكروسكوب الإلكتروني. بالإضافة إلى ذلك، تحقيق عالية الدقة المكانية لكل البروتين المسمى فلوريسسينتلي في الخلايا الحية، يجب تصويرها عينات في فراميراتس طويلة جداً وغير قادر على التقاط ديناميات البروتين. ولذلك، من الضروري للتغلب على هذه العقبات التقنية الرئيسية.
للحصول على دقة عالية الزمانية المكانية التي مناسبة تماما لكشف البروتينات أو الكشف تتحرك بسرعة في الخلايا الحية، وقد وضعنا القرار فائقة السرعة مجهرية في لدينا مختبر (الشكل 1)6،7، 8-عدة أوجه التقدم التقني الرئيسية في سرعة الفحص المجهري مكنتنا سابقا لتعقب النقل نوكليوسيتوبلاسميك من الجزيئات الصغيرة بنجاح، والبروتينات، ومرناً والفيروسات من خلال الأم النووية المسام المجمعات (الشخصيات)6، 7 , 8-بإيجاز، سيتم استخدام الميزات التالية لسرعة الفحص المجهري لتعقب الجزيئات تتحرك بسرعة من خلال الهياكل الفرعية ميكرومتر التناوب متناظرة في الخلايا الحية، مثل الشخصيات واهداب الأولية: (1) يميل أو الإضاءة الرأسية PSF تمكن إثارة جزيئات مفردة داخل وحدة تخزين صغيرة حيود حد في المستوى البؤري (الشكل 1)؛ (2) PSF يميل يمكن تجنب الأسفار خارج نطاق التركيز إلى حد كبير ومن ثم تحسين نسبة الإشارة إلى الضجيج. (3) كثافة بصرية من 100-500 كيلو واط/سم2 في الإضاءة PSF يسمح آلاف فوتونات التي سيتم جمعها من فلوروفوريس واحدة مع الكشف بسرعة بسرعة (> 500 هرتز). (4) الصيام الكشف عن سرعة يقلل إلى حد كبير أيضا خطأ التعريب المكانية جزيء مفرد (< 10 نانومتر) في تحديد مسارات المكانية تتحرك الجزيئات الفلورسنت في الخلايا الحية، نظراً للانتشار الجزيئي أحد العوامل الرئيسية تسبب عيوب التعريب جزيء واحد لنقل الجزيئات. (5) الراسخة في 2D إلى 3D التحويل خوارزميات تمكننا من توفير خرائط ثلاثية الأبعاد المكانية الكثافة الاحتمالية لطرق النقل للجزيئات في المجلس الوطني أو هدب الأولية. الجدير بالذكر أن لدينا عملية التحويل بين ديكارت ونظام التنسيق أسطواني يستخدم لتوليد كثافة الاحتمالية مكانية 3D خريطة بدلاً من 3D جزيء واحد تعقب (الشكل 2). سابقا، قد كشفت البيانات الميكروسكوب الإلكتروني أن9،المجلس الوطني10 و هدب الابتدائية11 كلا من بنية متناظرة التناوب. من حيث المبدأ، ينبغي نشرها الجزيئات تتحرك من خلال المجلس الوطني للصحافة أو هدب الأولية عشوائياً أيضا أن التوزيعات التناوب متناظرة. كما هو مبين في الشكل 2، عدد كبير من نشرها الجزيئات داخل الاسطوانة عشوائياً من شأنه أن يولد توزيعات التناوب متناظرة في عرض المقطع العرضي كالتي في المجلس الوطني، كما أدى نحو موحد المكانية التوزيع داخل كل منطقة فرعية صغيرة جداً بين اثنين من حلقات المجاورة (الشكل 2ه). ويؤدي هذا التوزيع الموحد أن التوزيع المكاني على طول البعد θ في نظام أسطواني ثابت. ثم يمكن تبسيط إحداثيات ثلاثي الأبعاد (R, X, θ) أن تكون إحداثيات 2D (R, X, ثابت). في الواقع، لدينا عملية التحويل بين نظامي أسطواني وديكارت من 2D (X, Y) 2D (R, X, ثابت). Θ ثابتة، تشير إلى الكثافة المكانية ف في الشكل 2ه، ويتم حسابها باستخدام المعادلة A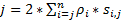 .
.
وفي نهاية المطاف، تتبع جزيء واحد له تطبيق واسع في البحوث البيولوجية، ومن ثم، فمن الطبيعي أن توضع مجموعة كبيرة تقنيات لسد منافذ البيولوجية المحددة12،،من1314. وهذا هو الحال بالنسبة لسرعة الفحص المجهري. سابقا، عندما يقترن مع خوارزمية تحول 3D، تم تطوير هذا الأسلوب لحل طرق النقل 3D لعبور الجزيئات من خلال اللجان التحضيرية الوطنية، هيكل البيولوجي التناوب متماثل والحجم diffraction الفرعية6. في هذه الورقة، تظهر أهداب الأولية لتكون نموذجا ممتازا العضيات كذلك. أهداب الأولية هي العضيات أسطواني، مثل هوائي (radius نانومتر ~ 125) أن المشروع من على سطح الأرض من الثدييات معظم الخلايا15،16،17. فمسؤولة عن تلقي إشارات خارجية، ويحيل بها استجابة داخل الخلايا المرتبطة عادة بالنمو والايض15،16. ولذلك، تدفق البروتينات الهيكلية، إعادة تدوير مستقبلات transmembrane، وانتقال الرسل داخل الخلايا المسؤوليات الحيوية من أهداب الأولية. في هذا المنعطف بين أهداب الابتدائي وجسم الخلية هو حاجز انتقائية حرجة، تسمى منطقة انتقالية أو TZ، من خلاله يجب أن يحدث كل هذا النقل البروتين11،،من1819، 20. بالإضافة إلى وظيفة TZ النابضة، واثنين على الأقل من عمليات النقل، النقل إينترافلاجيلار ونشر السلبي، يعتقد أن تكون مسؤولة عن حركة البروتين من خلال هذه المنطقة16،21، 22-من وجهة نظر صحة بشرية، فقدان أهداب الابتدائي وإلغاء الضوابط التنظيمية اللاحقة مما يشير إلى المصب مميزة لكثير من أنواع السرطان. وبالإضافة إلى ذلك، العديد من الأمراض الوراثية مثل متلازمة باردت-بيدل ومرض تكيس الكلي، ترتبط بالبروتين معيبة النقل23. جعل حجم الحد حيود الفرعية والعملية المعقدة للنقل البروتين انتقائية عن طريق TZ أهداب الابتدائي هدفا رئيسيا لهذه التقنية. في هذه الورقة، والأساليب وسوف نظهر تتبع البروتين transmembrane الهدبية، مستقبلات سوماتوستاتين 3 (SSTR3)24، المسمى خارجياً مع أليكسا فلور 647 ومكون من ايفت، IFT2025، المسمى مع جزيء تنصهر في التجارة والنقل.
Protocol
1-المعاهد الوطنية للصحة-3T3 خلية التحضير لسرعة الفحص المجهري من المخزون
- استرداد 1.5 أسابيع قبل التجربة، ثقافة جديدة للمعاهد الوطنية للصحة-3T3 الخلايا من الأوراق المالية مجمدة بذوبان الجليد في 37 درجة مئوية ونقل الخلايا إلى 25 سم2 قارورة ثقافة الخليوي مع 3 مل من المتوسطة (دميم "تعديل النسر" دولبيكو) وتستكمل مع 110 ملغ/مل بيروفات صوديوم الجلوتامين مم 2، 10% مصل بقرى الجنين والبنسلين/ستربتوميسين 1%.
- احتضان الخلايا عند 37 درجة مئوية في حاضنة2 CO 5%.
- تقسيم الخلايا في كونفلوينسي 80 في المائة، عن كل يومين، ثلاث مرات على الأقل قبل يوم تجريبي لضمان التجانس لدورة الخلية. تريبسينيزي الخلايا مع التربسين 0.25% لمدة 2 دقيقة عند 37 درجة مئوية ونضح التربسين واستبدله مع 2 مل متوسطة. ماصة المتوسط مرارا وتكرارا إلى تفريق تجمعات الخلايا وإزالة العدد المطلوب من الخلايا وجلب الحجم الإجمالي لوسائل الإعلام مرة أخرى تصل إلى 3 مل.
ملاحظة: المعاهد الوطنية للصحة-3T3 كانت سابقا وراثيا للتعبير عن نفب-4، بروتين الذي يموضع TZ26، تنصهر في المحطة ج إلى مشري. مشري هو فلوروفوري التي يمكن أن تكون متحمس مع 561 نانومتر الإضاءة لتعريب الحاجز الانتقائية TZ كمياً وتوجيه أهداب الأولية. - يومين قبل التجربة، لوحة الخلايا في أسفل زجاج 35 مم طبق في كونفلوينسي 60-70% مع 1.5 مل الوسط نفسه كخطوة 1.1 والعودة الخلايا للحاضنة.
- يوم واحد قبل التجربة، كيميائيا ترانسفيكت الخلايا مع بلازميد المرجوة. مزيج 500-1000 نانوغرام بلازميد المطلوب (راجع ملاحظة أدناه) بنسبة 1: 2.5 مع كاشف تعداء في 0.25 مل من المصل انخفاض وسائل الإعلام دون المضادات الحيوية من أجل 30 دقيقة أسبيراتي وسائل الإعلام من 35 ملم الزجاج الطبق السفلي واستبدله مع بلازميد 0.25 مل/ تعداء كاشف مزيج زائد 1.25 مل إضافية من المصل انخفاض وسائل الإعلام دون المضادات الحيوية. وسائط المصل انخفاض يخدم غرض تيسير تعداء ناجح، الذي يحفز نمو أهداب الأولية، فضلا عن إبقاء الخلايا حية طويلة بما يكفي لإجراء التجربة. إعادة الخلايا إلى حاضنة للتجربة في اليوم التالي.
ملاحظة: عند إجراء تتبع جزيء واحد من IFT20، بلازميد تحتوي على IFT20 المعدلة وراثيا تنصهر في نهايته ج للتجارة والنقل وهي تستخدم25. عند أداء جزيء واحد تتبع SSTR3، تنصهر فيها بلازميد يحتوي على SSTR3 من الأغذية المعدلة وراثيا في نهايته N إلى مجال ببتيد (AP) يقبلون وتيرمينوس ج للتجارة والنقل المستخدمة22. بالإضافة إلى بناء SSTR3، يجب أن يعبر عنه بلازميد يحتوي على ليجاسى البيوتين البيرا المشترك ويجب أن تستكمل وسائل الإعلام تعداء مع 10 ميكرون البيوتين. ثم تولي البيرا البيوتين إلى مجال AP المركبة حديثا جزيئات AP-SSTR3-التجارة والنقل على المستوى لائحة. Alexa647 مترافق لثلاثة من أربعة مواقع البيوتين الملزمة في ستريبتافيدين، في المتوسط، ثم يمكن استكمال لوسائل الإعلام قبل التصوير إلى التسمية فلوريسسينتلي الجزيئات AP-SSTR3-التجارة والنقل على السطح الخارجي ل الخلية22،27 . وتستخدم في هذا الأسلوب؛ التجارة والنقل و AlexaFluor647 ومع ذلك، يمكن استخدام المسابير الفلورية الأخرى إذا كان لديهم وبالمثل صور عالية-الاستقرار والكم تسفر عن. - في حالة استخدام بناء SSTR3 المسمى خارجياً، إزالة الوسائط من أسفل الزجاج طبق ح 1 قبل التجربة وغسل الخلية 5 مرات مع 1 مل من المحلول الملحي مخزنة الفوسفات (PBS)، وإضافة 1 مل من المصل انخفاض وسائل الإعلام وتستكمل مع 1 ميكرومتر Alexa647 مترافق ستريبتافيدين.
- قم بإزالة الوسائط من الطبق أسفل الزجاج لا يزيد عن 15 دقيقة قبل التجربة، وتغسل الخلايا ترانسفيكتيد والمسمى 5 مرات مع 1 مل من برنامج تلفزيوني.
- ضع 1 مل من المخزن المؤقت للتصوير (20 ملم حبيس، 110 مم كوك، 5 ملم نواك، 2 مم مجواك، 1 مم عطا، 7.3 درجة الحموضة) في الطبق أسفل الزجاج.
ملاحظة: في المخزن المؤقت للتصوير، خلايا قابلة للتطبيق للم يعد من ح 3. لذلك، يتم تنفيذ فقط 2 ح تجارب على كل طبق.
2-سرعة الفحص المجهري
ملاحظة: يتضمن إعداد الفحص المجهري السرعة مجهر مقلوب fluorescence مجهزة هدفا اللازيغيه غمر نفط 100 × 1.4-نا، 35 ميغاواط 633 نانومتر ني أنه ليزر، 50 ميغاواط الحالة الصلبة 488-شمال البحر الأبيض المتوسط، وشمال البحر الأبيض المتوسط-561 أشعة الليزر، ومكسب في ضرب على شريحة جهاز شحن إلى جانب الكاميرا وحزمة برامج مجهر للحصول على البيانات وتجهيزها (الشكل 1). لتصوير القناة الفردية، متحمسون بروتينات فلورية خضراء، مشري، و Alexa647 من 488 نانومتر، 561 شمال البحر الأبيض المتوسط، أو 633 نانومتر الليزر، على التوالي. لتتبع جزيء واحد، والإضاءة نقطة واحدة يتم استخدامه لتتبع الجزيئات الفردية المسمى فلوريسسينتلي. للتصوير ابيفلوريسسينسي، ويتم وضع عدسة مقعرة في المسار الإضاءة الليزر لتوسيع الشعاع في حقل موحدة من الإضاءة. الانبعاثات الأسفار التي تجمعها نفس الهدف وتصفية بواسطة عامل تصفية مزدوج اللون (405/488/561/635) وعامل تصفية انبعاثات (405/488/561/635) وتصويرها بكاميرا CCD أعلاه تعمل على 500 لتعقب جزيء واحد أو 2 هرتز تصوير ابيفلوريسسينسي.
- إلصاق لوحة أسفل الزجاج إلى مرحلة المجهر وتحديد موقع خلية التي تعرب عن بنيات المطلوب بشكل صحيح. مرة واحدة وقد تم العثور على خلية مناسبة، محاذاة بقعة NPHP4-مشري في قاعدة أهداب الأولية مع الموقع على متن الطائرة التصوير الذي يتوافق مع إضاءة الليزر نقطة واحدة.
- قم بالتقاط صورة ابيفلوريسسينسي NPHP4-مشري، وأما IFT20-التجارة والنقل أو AP-SSTR3-التجارة والنقل باستخدام الدالة "المفاجئة" في علامة التبويب "الكاميرا" من إطار "عناصر التركيز" في حالة استخدام حزمة برامج الفحص المجهري الرقمية (انظر الجدول للمواد).
ملاحظة: سوف تعمل هذه الصور كمرجع لمواقع جزيء واحد اللاحقة. - حالما يتم الحصول على الصور المرجعية، محلياً خفض تركيز جزيئات مفردة مسماة. صور--التبييض TZ مع إضاءة الليزر ميغاواط 1 ل 20 ق أو حتى شدة الأسفار قريب من الأسفار الخلفية.
ملاحظة: عند تركيز دقيق يمكن السيطرة عليها، 0.1-1 نانومتر المسمى الجزيئات واحدة تستخدم. - للتحضير لتعقب جزيء واحد، الحد من قوة الإضاءة الليزر ~0.15 ميغاواط لجزيئات مفردة المسمى مع بروتينات فلورية خضراء أو ~0.5 ميغاواط للجزيئات المسماة مع Alexa647.
- بمجرد أن قوة الليزر والتصوير المعلمات هي مجموعة، الحد الأقصى من الربح وتكثيف ومعدل الإطار 2 مللي ثانية، لتصوير جزيء واحد، إشراك الليزر الإضاءة المناسبة وتسجيل غير فوتوبليتشيد، وصفت جزيئات واحد كما أنها تنقل من خلال منطقة فوتوبليتشيد TZ بالنقر فوق الزر "تيار" في علامة التبويب "الكاميرا" من إطار "عناصر التركيز".
ملاحظة: يجب أن يتم القبض على أكثر من 2 دقيقة من الفيديو التقليل من آثار الهدبية الانجراف إلى مستوى لا يذكر. - بعد التقاط الفيديو جزيء واحد، عملية أشرطة الفيديو باستخدام خوارزمية مناسب غاوسي 2D، مثل لمحة عن طريق مختبر جيليس، وفيها دقة يموضع centroid للإثارة كل جزيء واحد PSF في منطقة تشمل الاهتمام (AOI).
- حدد كل جزيء واحد المواقع بدقة < 10 نانومتر، وتصحيح مركز أهداب على أساس توزيع مواقع جزيء واحد مزودة بوظيفة غاوسي 2D.
ملاحظة: باستخدام 2D إلى خوارزمية تحول 3D، طرق النقل 3D IFT20-التجارة والنقل ووكالة اسوشييتد برس-SSTR3 طرق هي بوضوح على الغشاء أكسونيمال أو الهدبية الهدبية، على التوالي.
3. 2D إلى 3D التحويل
- حالما يتم جمع عدة آلاف لعبور الجزيئات (الإشارات إلى الضجيج نسبة > 11) في هدب تعريب، حدد محور طويل هدب X-البعد. جعل الرسم بياني بعد Y للمواقع والحصول على مبالغ بن تزايدات 10 من شمال البحر الأبيض المتوسط.
ملاحظة: يمكن تقييم في 2D إلى 3D التحويل بواسطة اليد أو أي برنامج أو لغة البرمجة. الكتاب نفذت بنجاح التحول في Matlab و 2.7 بيثون.
النتائج
يوضح هذا القسم البيانات المتحصل عليها من أداء سرعة الفحص المجهري في TZ أهداب الأولية لدراسة مسار النقل SSTR3 متصلة بواسطة رابط خارجي نانومتر ~ 15 إلى Alexa647 (الشكل 3أ). أنه يخدم الغرض المزدوج للتحقق من خوارزمية تحول 3D. وينبغي Alexa647 حسب التسمية السطح الخار?...
Discussion
ويصف هذا البروتوكول تطبيق سرعة الفحص المجهري هدب الأولية، عضية إشارات خلوية التي عالية تعتمد على البروتين كفاءة النقل. سرعة الفحص المجهري يمكن أن توفر دقة عالية مواقع (< 10 نانومتر) للجزيئات المسماة فلوريسسينتلي كما أنها تمر عبر الإضاءة نقطة واحدة تركز على TZ. سابقا قد طبق على دراسة البروتين...
Disclosures
الكتاب يعلن لا تضارب في المصالح.
Acknowledgements
ونحن نشكر الدكتور كريستين فرهي (جامعة ميتشيغان، أن أربور) والدكتور غريغوري بازور (كلية الطب في جامعة ماساتشوستس) لتوفير بعض والبلازميدات. وأيد المشروع المنح المقدمة من "المعاهد الوطنية للصحة" (المعاهد الوطنية للصحة GM097037 و GM116204 و GM122552 إلى W.Y.).
Materials
| Name | Company | Catalog Number | Comments |
| 25 cm2 tissue culture dish | Corning | VV-01936-00 | |
| Penicillin/streptomycin | ThermoFisher | 15140122 | |
| Fetal bovine serum | ThermoFisher | 10438018 | |
| DMEM | ThermoFisher | 10566-016 | |
| OPTIMEM | ThermoFisher | 31985062 | |
| Trypsin | ThermoFisher | 25300054 | |
| Phosphate buffered saline | Sigma-Aldrich | P3813-1PAK | |
| Transit LT1 | Mirus | MIR 2300 | |
| 35 mm glass bottom dish | MatTek | P35GCOL-0-14-C | |
| AlexaFluor 647-conjugated streptavidin | ThermoFisher | S21374 | |
| Biotin | Sigma-Aldrich | B4501-100MG | |
| 633 nm He-Ne laser | Melles Griot | 25-LHP-928-249 | |
| 561 nm solid state laser | Coherent | OBIS 561-50 LS | |
| 488 nm solid state laser | Coherent | 1185053 | |
| Inverted fluorescence microscope | Olympus | IX81 | |
| 1.4-NA 100× oil-immersion apochromatic objective | Olympus | UPLSAPO 100× | |
| On-chip multiplication gain charge-coupled-device camera | Roper Scientific | Cascade 128+ | |
| Dichroic filter | Semrock | Di01- R405/488/561/635-25x36 | |
| Emission filter | Semrock | NF01-405/488/561/635-25X5.0 | |
| Slidebook 6.0 | Intelligent Imaging Innovations | digital microscopy software |
References
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu Rev Biochem. 78, 993-1016 (2009).
- Leung, B. O., Chou, K. C. Review of super-resolution fluorescence microscopy for biology. Appl Spectrosc. 65, 967-980 (2011).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440, 935-939 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3, 793-796 (2006).
- Ma, J., Yang, W. Three-dimensional distribution of transient interactions in the nuclear pore complex obtained from single-molecule snapshots. Proc Natl Acad Sci USA. 107, 7305-7310 (2010).
- Ma, J., Goryaynov, A., Sarma, A., Yang, W. Self-regulated viscous channel in the nuclear pore complex. Proc Natl Acad Sci USA. 109, 7326-7331 (2012).
- Ma, J., et al. High-resolution three-dimensional mapping of mRNA export through the nuclear pore. Nat Comm. 4, (2013).
- Akey, C. W., Radermacher, M. Architecture of the Xenopus nuclear pore complex revealed by three-dimensional cryo-electron microscopy. J Cell Biol. 122, 1-19 (1993).
- Akey, C. W. Interactions and structure of the nuclear pore complex revealed by cryo-electron microscopy. J Cell Biol. 109, 955-970 (1989).
- Czarnecki, P. G., Shah, J. V. The ciliary transition zone: from morphology and molecules to medicine. Trends Cell Biol. 22, 201-210 (2012).
- Elf, J., Li, G. -. W., Xie, X. S. Probing transcription factor dynamics at the single-molecule level in a living cell. Science. 316, 1191-1194 (2007).
- Anzalone, A., Annibale, P., Gratton, E. 3D orbital tracking in a modified two-photon microscope: an application to the tracking of intracellular vesicles. J Vis Exp. , (2014).
- Ritter, J. G., Veith, R., Veenendaal, A., Siebrasse, J. P., Kubitscheck, U. Light sheet microscopy for single molecule tracking in living tissue. PloS one. 5, 11639 (2010).
- Marshall, W. F., Nonaka, S. Cilia: tuning in to the cell's antenna. Curr Biol. 16, 604-614 (2006).
- Scholey, J. M., Anderson, K. V. Intraflagellar transport and cilium-based signaling. Cell. 125, 439-442 (2006).
- Yang, T. T., et al. Superresolution pattern recognition reveals the architectural map of the ciliary transition zone. Sci Rep. 5, 14096 (2015).
- Craige, B., et al. CEP290 tethers flagellar transition zone microtubules to the membrane and regulates flagellar protein content. J Cell Biol. 190, 927-940 (2010).
- Kee, H. L., et al. A size-exclusion permeability barrier and nucleoporins characterize a ciliary pore complex that regulates transport into cilia. Nat Cell Biol. 14, 431-437 (2012).
- Najafi, M., Maza, N. A., Calvert, P. D. Steric volume exclusion sets soluble protein concentrations in photoreceptor sensory cilia. Proc Natl Acad Sci USA. 109, 203-208 (2012).
- Nachury, M. V., Seeley, E. S., Jin, H. Trafficking to the ciliary membrane: how to get across the periciliary diffusion barrier. Annu Rev Cell Dev Biol. 26, 59-87 (2010).
- Ye, F., et al. Single molecule imaging reveals a major role for diffusion in the exploration of ciliary space by signaling receptors. Elife. 2, 00654 (2013).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genetics. 37, 1135-1140 (2005).
- Handel, M., et al. Selective targeting of somatostatin receptor 3 to neuronal cilia. Neuroscience. 89, 909-926 (1999).
- Follit, J. A., Tuft, R. A., Fogarty, K. E., Pazour, G. J. The intraflagellar transport protein IFT20 is associated with the Golgi complex and is required for cilia assembly. Mol Biol Cell. 17, 3781-3792 (2006).
- Awata, J., et al. NPHP4 controls ciliary trafficking of membrane proteins and large soluble proteins at the transition zone. J Cell Sci. 127, 4714-4727 (2014).
- Howarth, M., Ting, A. Y. Imaging proteins in live mammalian cells with biotin ligase and monovalent streptavidin. Nat Protoc. 3, 534-545 (2008).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319, 810-813 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved