A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بروتوكول لإنتاج ناقلات لينتيفيرال إينتيجراسي التي تفتقر لخروج المغلوب كريسبر/Cas9-بوساطة الجينات في تقسيم الخلايا
In This Article
Summary
يصف لنا استراتيجية إنتاج ناقلات تفتقر إلى إينتيجراسي لينتيفيرال (إيدلفس) كوسائل إيصال كريسبر/Cas9 للخلايا. مع قدرة على التوسط من أجل تحرير سريعة وقوية من الجينات في الخلايا، إيدلفس أكثر أماناً ومنصة متجه نفس القدر من الفعالية لإيصال الجينات بالمقارنة مع نواقل إينتيجراسي المختصة.
Abstract
لينتيفيرال الناقلة اختيار مثالي لتقديم عناصر التحرير الجينات للخلايا بسبب قدرتها على ستابلي ترانسدوسينج مجموعة واسعة نطاق من الخلايا والتوسط لمستويات عالية من التعبير الجيني. ولكن قدرتها على الاندماج في جينوم الخلية المضيفة يعزز خطر موتجنيستي insertional وهكذا يثير شواغل السلامة ويحد من استخدامها في ظروف سريرية. علاوة على ذلك، قدم التعبير المستمر عن مكونات الجينات--تحرير هذه الزيادات متجهات التكامل المختصة لينتيفيرال (إيكلفس) احتمال استهداف الجين منحل. وكبديل لذلك، وضعت جيلا جديداً من ناقلات تفتقر إلى إينتيجراسي لينتيفيرال (إيدلفس) الذي يتناول العديد من هذه الشواغل. هنا البروتوكول الإنتاج من منصة إيدلف جديدة ومحسنة لتحرير كريسبر بوساطة الجينات وقائمة بالخطوات التي تشارك في التنقية ويرد وصف لتركيز هذه العوامل الناقلة للمرض وتوصيل وتحرير الجينات كفاءة استخدام HEK-293T وقد أثبتت الخلايا. هذا البروتوكول هو تحجيم بسهولة، ويمكن استخدامها لتوليد إيدلفس عيار عالية قادرة على ترانسدوسينج الخلايا في المختبر و في فيفو. وعلاوة على ذلك، هذا البروتوكول يمكن تكييفها بسهولة لإنتاج إيكلفس.
Introduction
تحرير الجينات الدقيقة تشكل حجر الزاوية للتطورات الطبية الحيوية الرئيسية التي تنطوي على وضع استراتيجيات جديدة للتصدي للأمراض الوراثية. في طليعة تكنولوجيا الجينات--تحرير بالطريقة التي تعتمد على استخدام جلوستيريد rاجولارلي--أنانتيرسباسيد sهورت فاليندروميك صابيتس (كريسبر)/نظام Cas9 التي تم تحديدها في البداية كمكون للبكتيريا مناعة ضد الغزو المواد الجينية الفيروسية (إعادة النظر في المراجع1،2). ميزة كبيرة للنظام كريسبر/Cas9 على غيرها من أدوات تحرير الجينات، مثل نوكلياسيس إصبع الزنك (زفنس) والنسخ المستجيب المنشط--مثل نوكلياسيس (تالينس) (واستعرضت في مرجع3)، هي البساطة النسبية لتصميم بلازميد و بناء مكونات كريسبر – ميزة التي لديه بدعم التوسع في تحرير الجينات من عدد قليل من المختبرات المتخصصة إلى مجتمع بحث أوسع كثيرا. بالإضافة إلى ذلك، غذت بساطة البرمجة كريسبر/Cas9 وقدرته على الاعتراف بهدف متعدد زيادة شعبيتها كتكنولوجيا فعالة من حيث التكلفة وسهلة الاستخدام. بين الأساليب المختلفة المتاحة للباحثين لتقديم هذه المكونات تحرير الجينات للخلايا، يبقى النواقل الفيروسية بكثير النظام الأكثر شعبية وأكثر كفاءة.
ناقلات لينتيفيرال (LVs) ظهرت كوسيلة الاختيار لتقديم عناصر كريسبر/Cas9 النظام في فيفو لتطبيقات متنوعة4،5،،من67. جعل العديد من الميزات الرئيسية LVs خياراً شعبيا لهذه العملية بما في ذلك قدرتها على إصابة الفاصل وعدم تقسيم الخلايا، الاستمناع منخفضة، والسمية الخلوية الحد الأدنى (استعرض في المرجع8). نتيجة لذلك استخدمت العلاج الجيني بوساطة LV في علاجات للأمراض المعدية، مثل فيروس نقص المناعة البشرية-1 و HBV هامبورغ-1، وكذلك في تصحيح العيوب الكامنة وراء الأمراض الوراثية البشرية، مثل التليف الكيسي والأجسام القريبة من الأرض والأوعية الدموية البقعي 4 , 5 , 7 , 9 , 10 , 11-وعلاوة على ذلك، LVs قد عدلت فعلياً تنفيذ تحرير متعدد الجينات في المكاني الجينوم متميزة باستخدام نظام ناقل واحد12.
ومع ذلك، الخاصية المتأصلة من LVs الاندماج في جينوم مضيف يمكن مطفرة وغالباً ما يعوق فائدتها كوسائل إيصال التحوير، لا سيما في ظروف سريرية. وعلاوة على ذلك، منذ LVs ستابلي المتكاملة أعرب عن المتسلسلات في مستويات عالية على نحو مستدام، وهذا النظام غير ملائمة لإيصال الجينات تحرير مكونات مثل كريسبر/Cas9؛ أوفيريكسبريسيون Cas9--دليل الحمض النووي الريبي (جرنا)، والبروتينات مشابهة مثل زفنس، ترتبط بمستويات مرتفعة من الآثار قبالة المستهدفة، والتي تشمل الطفرات غير مرغوب فيها13،14،،من1516 , 17 ويمكن أن يحتمل أن تعزز سيتوتوكسيسيتي18. ولذلك، لتحقيق دقة تحرير الجينات مع الحد الأدنى من الآثار خارج الهدف، يتحتم لتصميم النظم التي تسمح لتعبير الجينات تحرير مكونات عابرة.
وفي السنوات الأخيرة، وضعت مجموعة متنوعة من منصات التسليم لعابر إكسبريس كريسبر/Cas9 في الخلايا16،19،،من2021 (استعرض في المرجع22). وتشمل هذه الأساليب التي تعتمد على مباشرة إدخال Cas9 المنقي جنبا إلى جنب مع الكشف الدليل المناسب في الخلايا، والتي تبين أن يكون أكثر فعالية في تحرير الجينات المستهدفة بالمقارنة بوساطة بلازميد تعداء16. وقد أثبتت الدراسات أن ريبونوكليوبروتين (رنب) دليل مجمعات تتكون من الحمض النووي الريبي/Cas9 الجزيئات سرعة تسليم بعد وساطة الانقسام الحمض النووي في أهدافها، مما يدل على أن التعبير القصير الأجل لهذه المكونات تكفي لتحقيق قوة الجينات تحرير16. ومن المتصور عدم إدماج أنظمة النواقل الفيروسية مثل النواقل الفيروسية المرتبطة بالغدة (أعفس) يمكن أن توفر بديلاً مجديا لتسليم الآلات تحرير الجينات إلى الخلايا. ولسوء الحظ، كابسيدس إف تمتلك قدرة التعبئة أقل بكثير مما LVs (< 5 كيلو بايت)، مما يعوق بشدة قدرتها على حزمة أدوات كريسبر متعدد العناصر داخل ناقل واحد (استعرض في المرجع8). تجدر الإشارة إلى أن إضافة المركبات التي تمنع هيستون ديسيتيلاسيس (مثلاً، بوتيراتي الصوديوم23) أو تعيق دورة الخلية (مثلاً، الكافيين24) أظهرت زيادة التتر لينتيفيرال. وعلى الرغم من التقدم الذي أحرز مؤخرا، ما زال يعرقل النظم تعبير عابر التي وضعت حتى الآن من أوجه قصور عديدة، مثل انخفاض كفاءة الإنتاج، مما يؤدي إلى انخفاض الفيروسية التتر، وكفاءة توصيل منخفض من الفيروسات التي تم إنشاؤها من خلال وهذا النهج25.
ناقلات تفتقر إلى إينتيجراسي لينتيفيرال (إيدلفس) تمثل تقدما كبيرا في تطوير مركبات إيصال الجينات، كما أنها تجمع بين القدرة على التعبئة والتغليف من LVs مع فائدة إضافية للصيانة مثل إف ابيسومال في الخلايا. تساعد هذه الميزات إيدلفس إلى حد كبير الالتفاف حول القضايا الرئيسية المرتبطة بإدماج ناقلات، overexpression المقارنة المستمرة يحتمل أن تكون عناصر سمية جينية والتكامل بوساطة المحدثة للطفرات. قد تجلى سابقا أنه يمكن تعديل إيدلفس بنجاح لتعزيز التعبير الجيني ابيسومال26،27. فيما يتعلق بالتسليم بوساطة إيدلف كريسبر/Cas9، التتر الإنتاج المنخفض والتعبير أدنى الجينومات تنقلها ابيسومي بالنسبة لأنظمة لينتيفيرال إينتيجراسي-يتقن يحد من فائدتها كأدوات حسن النية لتقديم التحرير الجينوم بنيات المحورة وراثيا. نحن مؤخرا أظهرت أن التعبير التحوير والتتر الفيروسية المرتبطة بإنتاج إيدلف تتعزز كثيرا بإدراج مواقع لعامل النسخ حزمة الخدمة Sp1 ضمن كاسيت التعبير الفيروسية28الربط. قوة دعم إيدلفس تم التعديل الجيني بوساطة كريسبر التحرير سواء في المختبر (في الخلايا HEK-293T) و في فيفو (في الدماغ بعد الانقسامية الخلايا العصبية)، في حين حمل الطفرات خارج الهدف الحد الأدنى مقارنة بالمقابلة إيكلف بوساطة نظم28. عموما، قمنا بتطوير رواية، أدوات كريسبر المدمجة، والكل في واحد على منصة إيدلف وأوجز مختلف مزايا استخدام وسيلة إيصال لتحرير الجينات المحسنة.
هنا، بروتوكول إنتاج نظام إيدلف-كريسبر/Cas9 وصف، بما في ذلك الخطوات المختلفة التي تنطوي عليها في الجمعية، وتنقية، والتركيز، والمعايرة إيدلفس، فضلا عن استراتيجيات للتحقق من فعالية الجينات تحرير هذه العوامل الناقلة للمرض. هذا البروتوكول هو قابلة بسهولة لتلبية احتياجات مختلفة من المحققين وهو مصمم بنجاح إنشاء ناقلات LV مع التتر في النطاق من 1 × 1010 وحدات (تو) ترانسدوسينج/مل. يمكن أن تستخدم ناقلات التي تم إنشاؤها من خلال هذا البروتوكول لكفاءة تصيب العديد من أنواع الخلايا المختلفة، بما في ذلك صعوبة ترانسدوسي الخلايا الجذعية الجنينية، الخلايا المكونة للدم (خلايا تي والضامة)، ومثقف و في فيفو- حقن الخلايا العصبية. وعلاوة على ذلك، أن البروتوكول أيضا مناسبة تماما لإنتاج ناقلات لينتيفيرال إينتيجراسي المختصة بكميات مماثلة.
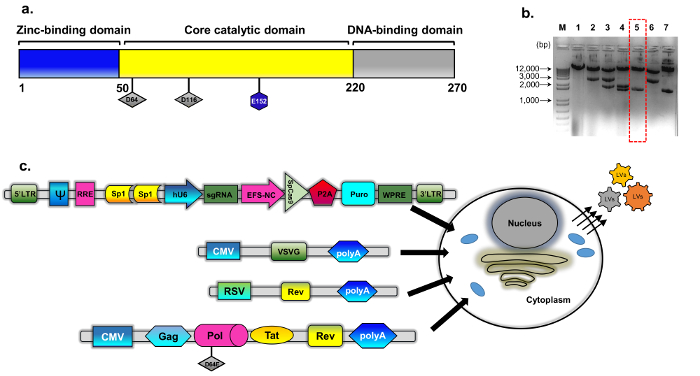
رقم 1: التعبئة والتغليف إيدلف. (أ) التخطيطي من البروتين integrase البرية نوع (ب) بلازميد معدلة مستمد من psPAX2 (راجع أساليب البناء بلازميد للحصول على التفاصيل). الممثل [اغروس] هلام صورة استنساخ فرزهم لاستنساخ integrase المتحولة. تم تحليل عينات الحمض النووي التي أعدت باستخدام مجموعة مصغرة عزل الحمض النووي بلازميد قياسية بالهضم مع اكورف وسفي. كذلك تحققت التسلسل المباشر (سانجر) لاستبدال D64E في INTاستنساخ يهضم بشكل صحيح (رقم 5، مربع أحمر متقطع). كان اسمه كاسيت التغليف تفتقر إلى إينتيجراسي pBK43. (ج) يعمل التخطيطي بروتوكول تعداء عابرة لتوليد نواقل إيدلف-كريسبر/Cas9، تظهر الخلايا 293T transfected مع منظمة-ز، والتغليف، والتحوير أشرطة الكاسيت (بلازميد الكل في واحد حزمة الخدمة Sp1-كريسبر/Cas9). الجسيمات الفيروسية أن برعم خارجاً من غشاء الخلية تحتوي على كامل طول الجيش الملكي النيبالي لمكافحة ناقلات (معبراً عنها من الكاسيت التحوير). استخدمت الجيل الثاني من نظام إيدلف والتغليف، والتي تشمل البروتينات التنظيمية تأت والقس Rev التعبير هو تكميل من كاسيت منفصل (RSV-القس-بلازميد). أبريف: لتر-منذ فترة طويلة--المحطة الطرفية فيروس التهاب الفم الحويصلي تكرار، منظمة-ز، ز-البروتين، المروج الفيروس المضخم للخلايا-بكمف؛ ساركومه راوس المروج فيروس (RSV)؛ رر-(رؤ استجابة عنصر). العناصر التنظيمية الأخرى في كاسيت التعبير تشمل مواقع Sp1-الربط، رد القس العنصر (رر)، وودتشوك التهاب الكبد الوبائي فيروس بوسترانسكريبشونال التنظيمية عنصر (وبري)، مروج 1α عامل استطالة أساسية (EFS-NC)، ناقل التعبئة والتغليف عنصر ψ (psi) والبشرية الفيروس المضخم للخلايا (hCMV) مروج ومروج U6 البشرية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
1-استزراع الخلايا HEK-293T وبذر خلايا تعداء
ملاحظة: "الكلي الجنينية" البشرية 293T وتزرع الخلايا (HEK-293T) في دميم، وسائل الإعلام الجلوكوز عالية وتستكمل مع مصل العجل البقري 10% وتستكمل مع المروجين للحديد والنمو، و 1 × الحل مضاد حيوي فطري (100 x حل يحتوي على 10,000 وحدات البنسلين ، ستربتوميسين 10 ملغ و 25 ميكروغرام الامفوتريسين ب كل مل). وتستكمل وسائل الإعلام أيضا مع بيروفات صوديوم س 1 ومزيج من الأحماض الأمينية غير الأساسية 1 x مم 2 لتر-الجلوتامين (ديبيبتيدي ل-alanyl-L-الجلوتامين الأسهم 200 ملم في 0.85% كلوريد الصوديوم). خلايا تستزرع في لوحات زراعة الأنسجة 100 مم (مساحة سطح النمو التقريبي 55 cm ²). يتم استخدام نسبة زراعة الفرعية 01:10 بدون استزراع كل 2-3 أيام. التربسين-يدتا 0.05% يستخدم لتفكك الخلايا بين الممرات. للحفاظ على التناسق بين التجارب، نوصي باختبار العجل سيرا عند التبديل إلى الكثير/مجموعة مختلفة ورصد أي تغيرات في نمو الخلايا، كفاءة تعداء، وناقلات الإنتاج.
- بدء ثقافة جديدة باستخدام خلايا المرور منخفضة (من المستحسن عدم استخدام الخلايا بعد مرور 15 أو إذا كان يبطئ النمو) بواسطة البذر في لوحة زراعة الأنسجة 10 سم. استخدام دميم وتستكمل مع 10% مصل لنمو الخلايا. تنمو الخلايا في 37 درجة مئوية مع 5% CO2 في حاضنة استنبات أنسجة قياسية. استخدام هيموسيتوميتير قياسية لحساب عدد الخلايا لجميع الخطوات اللاحقة.
- حالما تصل الخلايا إلى 90-95% نمو المتلاقية، reseed إلى 15 سم لوحات زراعة الأنسجة (أدناه، خطوات 1.3-1.5).
- Reseed، نضح وسائل الإعلام من لوحة المتلاقية وشطف بلطف مع PBS العقيمة x 1. احتضان الخلايا مع 2 مل كاشف الانفصال (مثلاً، يدتا التربسين) عند 37 درجة مئوية للحد الأدنى 3-5 إضافة 8 مل من الوسائط التي تحتوي على المصل إلغاء تنشيط الكاشف الانفصال، وتريتوراتي من 10-15 مرة مع 10 مل ماصة مصلية لإنشاء خلية واحدة تعليق. ريسوسبيند الخلايا في ثقافة وسائل الإعلام للحصول على كثافة خلية 4 × 10 تقريبا6 خلايا/مل.
- مسبقاً لتعزيز التقيد بالركيزة، معطف لوحات 15 سم مع الجيلاتين 0.2%، مشيراً إلى 8 مل جيلاتين للوحة الواحدة. موزعة بالتساوي على سطح اللوحة واحتضان في درجة حرارة الغرفة لمدة 10 دقائق، وسيفون قبالة السائل.
- الحجم الإجمالي لكل لوحة إلى 25 مل مع الحارة (37 درجة مئوية) وسائط الإعلام "تي" HEK-293 (انظر الملاحظة في الخطوة 1) والبذور اللوحات بإضافة 2.5 مل خلايا (مجموع ~ 1 × 107 خلايا/اللوحة). احتضان لوحات عند 37 درجة مئوية مع 5% CO2 بين عشية وضحاها أو حتى يتم التوصل إلى كونفلوينسي 70-80%.
ملاحظة: يمكن استخدام ما يصل إلى ست لوحات 15 سم للإنتاج. ضبط حجم وسائل الإعلام كل لوحة لمل ~ 20-22 عند استخدام أكثر من أربعة ألواح (أرجع إلى الخطوة 5 من البروتوكول للأساس المنطقي).
2-ترانسفيكتينج HEK-293T الخلايا باستخدام بروتوكول المستندة إلى فوسفات الكالسيوم
-
الكواشف تعداء
- لإعداد 2 × الحل مخزنة بس بب س (50 مم بس، 280 مم كلوريد الصوديوم، 1.5 مم نا2هبو4)، والجمع بين 16.36 ز من كلوريد الصوديوم، 10.65 ز بس (N، N-مكررا (2-هيدروكسيثيل)-2-الأمينية-حمض اثانيسولفونيك)، و 0.21 ز غ2هبو4. إضافة المقطر مزدوجة ح2س (ح دد2س) يصل إلى 900 مل. حل، تيتراتي على درجة الحموضة 6.95 مع 1 م هيدروكسيد الصوديوم، وإعادة التخزين لتصفية ل. 1 عبر 0.22 ميكرومتر تصفية وحدة. مخزن في-20 درجة مئوية.
- إعداد كاكل 1 م2. تصفية الحل عن طريق عامل تصفية 0.22 ميكرومتر. مخزن في 4 درجات مئوية.
- مراقبة لوحات التي كانت تبذر أ قبل يوم. أصبحت جاهزة تعداء الخلايا بمجرد أن تصل إلى 70-80% كونفلوينسي.
- نضح وسائل الإعلام القديمة من اللوحات وإضافة وسائل الإعلام طازج دون المصل بلطف.
ملاحظة: انظر "الملف التكميلي" 1-البلازميدات للحصول على تفاصيل حول والبلازميدات المختار والتحضير لها. - إعداد مزيج بلازميد والبلازميدات اليقوتينج الأربعة في أنبوب مخروطي 15 مل. لتحضير طبق 15 سم واحد، استخدم ميكروغرام 37.5 من كريسبر/Cas9-نقل المتجهات (pBK198 أو pBK189)، 25 ميكروغرام من pBK43 (psPAX2-D64E)، 12.5 ميكروغرام pMD2.G، و 6.25 ميكروغرام من السابق (الشكل 1 ج).
- إضافة م 1 ميليلتر 312.5 كاكل2 إلى هذا المزيج بلازميد. يضاف إلى ذلك، يصل إلى 1.25 مل ح دد العقيمة20.
- ببطء (دروبويسي) إضافة 1.25 مل 2 حل x BBS حين فورتيكسينج هذا المزيج. احتضان لمدة 30 دقيقة في درجة حرارة الغرفة.
- إضافة خليط تعداء dropwise لكل لوحة 15 سم (2.5 مل للوحة الواحدة). دوامة اللوحات بلطف واحتضان في 37 درجة مئوية مع 5% CO2 لح 2-3. بعد ذلك، أضف المصل 2.5 مل (10 ٪) للوحة الواحدة وتستمر حضانة بين عشية وضحاها (ح 12-18).
ملاحظة: استخدم بعض مختبرات حاضنات2 CO 3% لتحقيق الاستقرار في درجة الحموضة في وسائل الإعلام. ومع ذلك، لم نلاحظ أي فرق في الكفاءة تعداء بين 3% و 5% CO2. أيضا، حجم كابو رواسب4 حاسم بالنسبة لكفاءة تعداء؛ مزيج تعداء يجب أن تكون واضحة قبل الإضافة إلى الخلايا. إذا كان هذا المزيج يصبح غائم أثناء الحضانة، إعداد x BBS 2 جديدة (الرقم الهيدروجيني = 6.95).
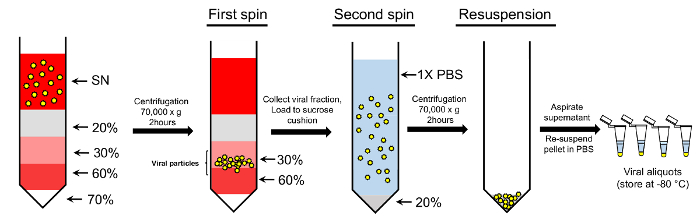
رقم 2: تركيز الجزيئات الفيروسية استخدام بروتوكول التدرج مزدوجة-السكروز. الجسيمات الفيروسية التي تم جمعها من المادة طافية (SN) يتم تحميلها على السكروز التدرج التدرج. وتستخدم حلول السكروز 70%، 60%، 30%، ونسبة 20% لإنشاء التدرج. وبعد الطرد المركزي، الجزيئات التي جمعت من الكسور السكروز 30-60% مزيدا من تحميلها على وسادة سكروز 20% وعجلت. هو حراكه بيليه النهائية التي تحتوي على الجسيمات الفيروسية المنقاة في برنامج تلفزيوني 1 x لاستخدام المزيد (انظر النص للحصول على مزيد من التفاصيل). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
3-بعد يوم من تعداء
- مراقبة الخلايا للتأكد من أنها تقترب من 100% كونفلوينسي في هذه النقطة مع قليل من لا موت الخلية. استبدال وسائط الإعلام عن طريق إضافة 25 مل من دميم طازجة + 10% مصل لكل لوحة. تستمر حضانة في 37 درجة مئوية مع 5% CO2 48 ساعة إضافية.
ملاحظة: ضبط حجم الوسائط في الخطوة 3، 1 في حالة استخدام أكثر من ست لوحات 15 سم (راجع "الخطوة 5-2"، ملاحظة).
4-حصاد الفيروس
- جمع المادة طافية بعناية من جميع لوحات زراعة الأنسجة تحتوي على خلايا ترانسفيكتيد باستخدام ماصة معقمة 10 مل زراعة الأنسجة وتجمع في أنابيب الطرد المركزي 50 مل.
- مسح التعليق باستخدام الطرد المركزي في 400-450 x ز لمدة 10 دقيقة باستخدام أجهزة الطرد مركزي منضدية. تصفية المادة طافية من خلال وحدة تصفية فراغ 0.45 ميكرومتر.
ملاحظة: المادة طافية المصفاة يمكن أن تكون مخزنة في 4 درجات مئوية لمدة 4 أيام قبل الشروع في تركيز، أو الكوتيد والمخزنة في-80 درجة مئوية. ينبغي أن يكون التتر المتوقعة من الاستعدادات الفيروسية (غير مركزة) إيدلف--Sp1-كريسبر/Cas9 ~ 2 × 107 تي يو/مليلتر (أرجع إلى الخطوة 6 لتحديد عيار). ومع ذلك، تجنب تعريض الاستعدادات الفيروسية لدورات تجميد أذاب متعددة، ككل جولة من تجميد والغاء النتائج في فقدان 10-20 ٪ في التتر الوظيفية.
5-تركيز الجزيئات الفيروسية تنبيذ فائق
ملاحظة: نستخدم أسلوب مزدوج-السكروز لتنقية ينطوي على خطوتين: خطوة تدرج سكروز وخطوة وسادة سكروز (الشكل 2).
- تحميل الأنابيب المخروطية تنبيذ فائق في الترتيب التالي لإنشاء تدرج سكروز: السكروز 0.5 مل 70% (حله 1 x PBS)، السكروز 60% 0.5 مل (حله في دميم) والسكروز 30% 1 مل (حله في دميم) السكروز 20% 2 مل (حله في برنامج تلفزيوني س 1).
-
إضافة المادة طافية المحتوية على الفيروس بعناية للتدرج. كما أن إجمالي حجم المادة طافية من أربع لوحات 15 سم 100 مل، استخدام أنابيب تنبيذ فائق ستة الواحدة تدور على معالجة كامل حجم الفيروس طافية.
- كل أنبوبة تنبيذ فائق المستخدمة لهذه الخطوة بسعة تخزين تصل إلى 30 مل (بما في ذلك حجم السكروز)، وتوزيع المادة طافية الفيروسية التساوي بين أنابيب، وترك مالا يقل عن 10% headspace منع انسكاب.
- ضبط حجم الثقافة لمل ~ 20-22 للوحة الواحدة عند استخدام أكثر من أربع لوحات 15 سم لكل تجربة، حيث أن الحجم النهائي للمادة طافية الفيروسية المجمعة يمكن أن تستوعب بسهولة داخل أنابيب تنبيذ فائق ستة.
- أنابيب التعبئة تنبيذ فائق إلى مالا يقل عن ثلاثة أرباع قدرتها الحجم الإجمالي، يمكن أن يحدث خلاف ذلك كسر أنابيب أثناء الطرد المركزي، مما أدى إلى فقدان إمكانية الضرر عينة و/أو المعدات.
- تحقيق التوازن بين الأنابيب مع 1 × عينات برنامج تلفزيوني وأجهزة الطرد المركزي في س 70,000 ز 2 ح في 17 درجة مئوية (انظر الجدول للمواد للحصول على تفاصيل دوار).
ملاحظة: لمنع تعطل الطبقة السكروز أثناء التسارع، تعيين ultracentrifuge للتعجيل ببطء بالدوار إلى 200 لفة في الدقيقة خلال أول 3 دقائق من الدوران. وبالمثل، تعيين ultracentrifuge بطء يتباطأ الدوار من 200 دورة في الدقيقة إلى 0 في الدقيقة أكثر من 3 دقيقة في نهاية الدوران. - بعناية بجمع الكسور السكروز 30-60% في أنابيب نظيفة (الشكل 2). إضافة الباردة 1 × برنامج تلفزيوني للكسور المجمعة وإحضار الحجم إلى 100 مل؛ مزيج من بيبيتينج صعودا وهبوطاً عدة مرات.
- للانتقال إلى الخطوة وسادة السكروز بطبقات إعداد الفيروسية على وسادة سكروز بعناية. لهذا، إضافة 4 مل من محلول السكروز 20% (في برنامج تلفزيوني 1 x) إلى الأنبوبة، تليها ~ 20-25 مل الحل الفيروسية كل أنبوب. إذا كانت أنابيب أقل من ثلاثة أرباع كاملة، أعلى حتى مع برنامج تلفزيوني x 1 العقيمة.
- بدقة التوازن والطرد المركزي هذه العينات في س 70,000 ز 2 ح في 17 درجة مئوية، كما كان من قبل. من أجل إيقاف المادة طافية والسماح لباقي السائل إلى استنزاف بعكس أنابيب على مناشف ورقية.
- نضح قطرات المتبقية من أجل إزالة جميع السائل من بيليه. في هذه الخطوة، ينبغي أن تكون الكريات المحتوية على الفيروس بالكاد تظهر كبقع صغيرة شفافة.
- ريسوسبيند الكريات بإضافة 70 ميليلتر من برنامج تلفزيوني 1 x إلى الأنبوبة الأولى ودقة بيبيتينج التعليق وبعد ذلك نقل التعليق للأنبوب القادم وخلط كما كان من قبل، مستمرة حتى يتم حراكه جميع الكريات.
- شطف هذه الأنابيب مع ميليلتر 50 إضافية الباردة 1 × برنامج تلفزيوني ومزيج كما كان من قبل. التأكد من أن مجموع حجم تعليق نهائي ميليلتر ~ 120، ويظهر حليبي قليلاً؛ مسحها بالطرد المركزي في 10,000 س ز لمدة 30 ثانية في ميكروسينتريفوجي منضدية.
- نقل المادة طافية إلى أنبوب جديد [ميكروفوج]، 10 ميليلتر مختبرين وتخزينها في-80 درجة مئوية.
ملاحظة: تجنب إجراء دورات تجميد أذاب المتكررة على عينات لينتيفيرال. إلا عندما يكون مطلوباً استخدام الطرد المركزي، الجهود التي ينبغي للقيام بالخطوات المتبقية في أغطية زراعة الأنسجة، أو مكان مخصص لغرف زراعة الأنسجة باستخدام تدابير السلامة المناسبة (انظر المناقشة).
6-تقدير التتر الفيروسية
-
ف24 -إنزيم-يرتبط الأسلوب المرتبط بالانزيم (ELISA)
ملاحظة: الفحص يجري استخدام لوحات 96-جيدا السامي ملزم ككل بناء على تعليمات من "البرنامج لقاح الإيدز المعاهد الوطنية للصحة" لفيروس نقص المناعة البشرية-1 ف24 مستضد التقاط المقايسة (انظر الجدول للمواد) مع عدة تعديلات29.- وفي اليوم التالي يغسل الآبار ثلاث مرات مع 200 ميليلتر 0.05% 20 توين في برنامج تلفزيوني الباردة (حل برنامج تلفزيوني-T). معطف اللوحة مع 100 ميليلتر من جسم [مونوكلونل] مكافحة-p24 في إضعاف 1:1500 في برنامج تلفزيوني 1 x واحتضان بين عشية وضحاها في 4 درجات مئوية.
- لإزالة الربط غير محددة، كتلة اللوحة مع 200 ميليلتر 1% جيش صرب البوسنة في برنامج تلفزيوني؛ أغسل ثلاث مرات مع 200 ميليلتر 0.05% 20 توين في برنامج تلفزيوني الباردة (حل برنامج تلفزيوني-T) على الأقل 1 ساعة في درجة حرارة الغرفة.
-
إعداد العينات: لناقلات تتركز الأعمال التحضيرية، وتمييع 1 ميليلتر من العينة معززات بإضافة 89 ميليلتر من ح دد20 و 10 ميليلتر من Triton X-100 (تركيز نهائي 10%). للاستعدادات غير مركزة، وإعداد عينات المخفف عشرة إضعاف (إضافة ميليلتر 80 من ح دد20 و 10 ميليلتر من Triton X-100 (تركيز نهائي 10 ٪) إلى 10 ميليلتر من العينة).
ملاحظة: يمكن تخزين العينات في-20 درجة مئوية في هذه الخطوة لفترة ممتدة من الوقت للاستخدام في وقت لاحق. - إعداد معايير فيروس نقص المناعة البشرية-1 عن طريق تطبيق إضعاف إضعاف مسلسل (مع انطلاق تركيز 5 نانوغرام/مليلتر).
- تمييع عينات مركزة (من المخزونات قبل المخفف 1: 100) في 1640 RPMI تستكمل مع 0.2% 20 توين و 1% جيش صرب البوسنة إقامة 01:10، 000، 01:50، 000، وتخفيف 1:250,000. تمييع عينات غير مركزة (من 01:10 إضعاف ما قبل الأرصدة) في 1640 RPMI تستكمل مع 0.2% 20 توين و 1% جيش صرب البوسنة إقامة تخفيف 1: 500 ومساحية و 1:12,500.
- تطبيق نماذج على اللوحة في تريبليكاتيس واحتضان بين عشية وضحاها في 4 درجات مئوية.
- غسل الآبار ست مرات في اليوم التالي، واحتضان في 37 درجة مئوية ح 4 مع 100 ميليلتر أرنب [بولكلونل] جسم المضادة-p24 ، المخفف 1: 1000 في RPMI 1640، 10% FBS، جيش صرب البوسنة 0.25%، والمصل الماوس العادية 2% (NMS).
- يغسل ست مرات كما ذكر أعلاه، واحتضان في 37 درجة مئوية ح 1 مع الماعز الأرنب المضادة الفجل البيروكسيديز المضيفين مفتش المخفف في 1640 RPMI تستكمل مع مصل الماعز العادي 5% و 2% NMS، جيش صرب البوسنة 0.25% و 0.01 ٪ 20 توين.
- أغسل اللوحة، كما ذكر أعلاه، واحتضان مع الركازة البيروكسيديز TMB في درجة حرارة الغرفة لمدة 15 دقيقة.
- وقف رد الفعل بإضافة 100 ميليلتر من 1 N HCL. قياس امتصاص العينة في 450 لوحة نانومتر باستخدام امتصاص القارئ.
-
قياس كثافة مراسل نيون
- أسلوب نظام مراقبة الأصول الميدانية
ملاحظة: مدى استنزاف إشارة بروتينات فلورية خضراء في الخلايا يمكن دقة تقدير بقياس كثافة fluorescence متوسط الخلايا ترانسدوسيد عن طريق التدفق الخلوي. الرجاء الرجوع إلى الورقة الأخيرة 28 لتحليل بيانات نظام مراقبة الأصول الميدانية وعرض تقديمي، والتفسير. ويرد وصف البروتوكول على النحو التالي.- جعل مسلسل عشرة إضعاف إضعاف الإعداد (من 10-1 إلى 10-5) إعداد الفيروسية في برنامج تلفزيوني 1 x.
- البذور حوالي 5 × 105 293T الخلايا في كل من لوحة 6-جيدا بحجم نهائي في 2 مل كل جيدا جيدا. إضافة 10 ميليلتر من كل تمييع فيروسي للخلايا واحتضان خلايا في 37 درجة مئوية ح 48.
- حصاد الخلايا لتحليل نظام مراقبة الأصول الميدانية على النحو التالي: إضافة 200 ميليلتر من 0.05% يدتا التربسين الحل واحتضان خلايا في 37 درجة مئوية لأدنى 5 إضافة 2 مل الإعلام دميم كاملة وجمع العينات في أنابيب مخروطية الشكل 15 مل.
- بيليه الخلايا باستخدام الطرد المركزي في ز 400 x في 4 درجات مئوية، وريسوسبيند بيليه في 500 ميليلتر من برنامج تلفزيوني الباردة x 1.
- للتثبيت، إضافة وحدة تخزين تساوي 4% فورمالدهايد الحل لهذا التعليق، واحتضان لمدة 10 دقائق في درجة حرارة الغرفة.
- بيليه الخلايا الثابتة وريسوسبيند في 1 مل من س 1 برنامج تلفزيوني. تحليل التعبير التجارة والنقل باستخدام أداة نظام مراقبة الأصول الميدانية، كما هو موضح في أورتينسكي et al. 28 باختصار، استخدم الصيغة التالية لتحديد عيار الفيروس الوظيفية:
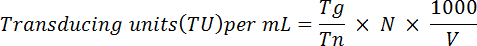
ملاحظة: هنا تيراغرام = عدد الخلايا بروتينات فلورية خضراء-إيجابية تحسب؛ Tn = العدد الكلي للخلايا التي تم عدها؛ N = عدد الخلايا ترانسدوسيد؛ V = الحجم (في ميليلتر) المستخدمة لتوصيل. فعلى سبيل المثال: إذا كانت ترانسدوسيد 1 × 106 خلايا مع 10 ميليلتر للفيروس، 2 × 104 خلايا كانت الأصوات التي تم فرزها و 5 × 103 كانت إيجابية بروتينات فلورية خضراء، استناداً إلى المعادلة المذكورة أعلاه سيكون من عيار الوظيفية:
- عد الخلايا الحاملات للتجارة والنقل
- حساب تعدد العدوى (وزارة الداخلية) المستخدمة لتوصيل. اختبار نطاق واسع من أشهر (1-10)، مع زيادة أشهر مما أدى زيادة كفاءة توصيل إلى.
- قبل تعداء، البذور صفيحة 6-جيدا مع حوالي 3-4 × 105 خلايا كل بئر. بمجرد الوصول إلى الخلايا > 90% كونفلوينسي (عادة خلال 24 ساعة)، ترانسدوسي مع الفيروس المنقاة في أشهر محددة سلفا.
- احتضان لوحة عند 37 درجة مئوية مع 5% CO2 في ثقافة الأنسجة قياسية، ورصد الخلايا على فترات منتظمة ل 1-7 أيام لإجراء تغييرات في إشارة التجارة والنقل.
- حساب عدد الخلايا الحاملات للتجارة والنقل مع مجهر فلوري (خطة 4 X الهدف، N.A 0.1، 40 X التكبير) مزودة بمجموعة عوامل تصفية التجارة والنقل (الإثارة 470 الطول الموجي نانومتر، الانبعاثات 525 الطول الموجي نانومتر)، استخدام الخلايا السذاجة (ترانسدوسيد الأمم المتحدة) إلى أن عدد سكان الخلايا بروتينات فلورية خضراء-السلبية والإيجابية.
- تقدير عيار النهائي عن طريق ضبط عامل إضعاف ووحدة التخزين، باستخدام الصيغة التالية:
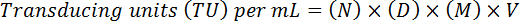
ملاحظة: هنا، ن = عدد الخلايا بروتينات فلورية خضراء-إيجابية، د = عامل التخفيف، م = عامل التكبير (عادة 20 X)، V = حجم الفيروس المستخدمة لتوصيل. على سبيل المثال، 20 بروتينات فلورية خضراء-إيجابية الخلايا (ن) تحسب في إضعاف 10-4 (01:10، 000) في عينة 10 ميليلتر (V) في 20 X التكبير (M) (د) سينتج عيار وظيفية (20 × 104) × (20) x (10) س (100 *) = 4 × 108 تي يو/مليلتر.
(* لضبط لكل مل)
- أسلوب نظام مراقبة الأصول الميدانية
النتائج
التحقق من صحة خروج المغلوب-كفاءة ناقلات إيدلف-كريسبر/Cas9
نحن تستخدم الخلايا بروتينات فلورية خضراء-الإعراب عن 293T كنموذج للتحقق من كفاءة كريسبر/Cas9-بوساطة خروج المغلوب الجينات. بروتينات فلورية خضراء + خلايا تم إنشاؤها بواسطة توصيل الخلايا HEK-293T مع بلينتي-التجارة و...
Discussion
إيدلفس وقد بدأت في الظهور كالوسيلة للاختيار في فيفو الجينات-التحرير، ولا سيما في سياق الأمراض الوراثية، ويرجع ذلك إلى حد كبير إلى انخفاض خطر الطفرات المرتبطة بناقلات هذه المقارنة لإدماج تسليم منصات22 , 28-في المخطوطة الحالية، سعينا إلى تفاصيل البروتوكو...
Disclosures
براءة المؤتمر الصومالي الموحد-499-P (1175) قدم بجامعة كارولينا الجنوبية فيما يتعلق بالعمل الموصوف في هذه المخطوطة.
Acknowledgements
نود أن نشكر إدارة علم الأعصاب، كلية الطب في جامعة ديوك، ومكتب عميد الكلية "العلوم الأساسية"، وجامعة ديوك. كما نشكر أعضاء الأساسية النواقل الفيروسية ديوك للتعليقات على المخطوطة. وكان بلازميد بلينتي CRISPRv2 هدية من تشانغ فنغ (معهد واسع). نظام الوقف والتغليف بما في ذلك psPAX2 والبلازميدات، منظمة-ز، pMD2.G، والقس برسف كان هدية نوع من ترونو ديدييه (لوزان، سويسرا). وقدمت الدعم المالي لهذا العمل "جامعة من ولاية كارولينا الجنوبية مدرسة الطب"، منح RDF18080-E202 (B.K).
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A99839 | |
| Allegra 25R tabletop centrifuge | Beckman Coulter | 369434 | |
| xMark Microplate Absorbance plate reader | Bio-Rad | 1681150 | |
| BD FACS | Becton Dickinson | 338960 | |
| Inverted fluorescence microscope | Leica | DM IRB2 | |
| 0.45-μm filter unit, 500mL | Corning | 430773 | |
| Conical bottom ultracentrifugation tubes | Seton Scientific | 5067 | |
| Conical tube adapters | Seton Scientific | PN 4230 | |
| SW32Ti swinging-bucket rotor | Beckman Coulter | 369650 | |
| 15 mL conical centrifuge tubes | Corning | 430791 | |
| 50mL conical centrifuge tubes | Corning | 430291 | |
| High-binding 96-well plates | Corning | 3366 | |
| 150 mm TC-Treated Cell Culture dishes with 20 mm Grid | Corning | 353025 | |
| 100mm TC-Treated Culture Dish | Corning | 430167 | |
| 0.22 μM filter unit, 1L | Corning | 430513 | |
| QIAprep Spin Miniprep Kit (50) | Qiagen | 27104 | |
| Tissue culture pipettes, 5 mL | Corning | 4487 | |
| Tissue culture pipettes, 10 mL | Corning | 4488 | |
| Tissue culture pipettes, 25 mL | Corning | 4489 | |
| Hemacytometer with cover slips | Cole-Parmer | UX-79001-00 | |
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| Human embryonic kidney 293T (HEK 293T) cells | ATCC | CRL-3216 | |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| DMEM, high glucose media | Gibco | 11965 | |
| Cosmic Calf Serum | Hyclone | SH30087.04 | |
| Antibiotic-antimycotic solution, 100X | Sigma Aldrich | A5955-100ML | |
| Sodium pyruvate | Sigma Aldrich | S8636-100ML | |
| Non-Essential Amino Acid (NEAA) | Hyclone | SH30087.04 | |
| RPMI 1640 media | Thermo Fisher Scientific | 11875-085 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Trypsin-EDTA 0.05% | Gibco | 25300054 | |
| BES (N, N-bis (2-hydroxyethyl)-2-amino-ethanesulfonic acid) | Sigma Aldrich | B9879 - BES | |
| Gelatin | Sigma Aldrich | G1800-100G | |
| Name | Company | Catalog Number | Comments |
| p24 ELISA reagents | |||
| Monoclonal anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | 3537 | |
| HIV-1 standards | NIH AIDS Research and Reference Reagent Program | SP968F | |
| Polyclonal rabbit anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | SP451T | |
| Goat anti-rabbit horseradish peroxidase IgG | Sigma Aldrich | 12-348 | Working concentration 1:1500 |
| Normal mouse serum, Sterile, 500mL | Equitech-Bio | SM30-0500 | |
| Goat serum, Sterile, 10mL | Sigma | G9023 | Working concentration 1:1000 |
| TMB peroxidase substrate | KPL | 5120-0076 | Working concentration 1:10,000 |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| psPAX2 | Addgene | 12260 | |
| pMD2.G | Addgene | 12259 | |
| pRSV-Rev | Addgene | 12253 | |
| lentiCRISPR v2 | Addgene | 52961 | |
| Name | Company | Catalog Number | Comments |
| Restriction enzymes | |||
| BsrGI | New England Biolabs | R0575S | |
| BsmBI | New England Biolabs | R0580S | |
| EcoRV | New England Biolabs | R0195S | |
| KpnI | New England Biolabs | R0142S | |
| PacI | New England Biolabs | R0547S | |
| SphI | New England Biolabs | R0182S |
References
- Horvath, P., Barrangou, R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 327 (5962), 167-170 (2010).
- Marraffini, L. A., Sontheimer, E. J. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nat Rev Genet. 11 (3), 181-190 (2010).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Bellec, J., et al. CFTR inactivation by lentiviral vector-mediated RNA interference and CRISPR-Cas9 genome editing in human airway epithelial cells. Curr Gene Ther. 15 (5), 447-459 (2015).
- Kennedy, E. M., et al. Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 476, 196-205 (2015).
- Roehm, P. C., et al. Inhibition of HSV-1 Replication by Gene Editing Strategy. Sci Rep. 6, 23146 (2016).
- Wang, W., et al. CCR5 gene disruption via lentiviral vectors expressing Cas9 and single guided RNA renders cells resistant to HIV-1 infection. PLoS One. 9 (12), e115987 (2014).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Adv Genet. 87, 125-197 (2014).
- Lebbink, R. J., et al. A combinational CRISPR/Cas9 gene-editing approach can halt HIV replication and prevent viral escape. Sci Rep. 7, 41968 (2017).
- Xu, L., et al. CRISPR/Cas9-Mediated CCR5 Ablation in Human Hematopoietic Stem/Progenitor Cells Confers HIV-1 Resistance In Vivo. Mol Ther. , (2017).
- Yiu, G., Tieu, E., Nguyen, A. T., Wong, B., Smit-McBride, Z. Genomic Disruption of VEGF-A Expression in Human Retinal Pigment Epithelial Cells Using CRISPR-Cas9 Endonuclease. Invest Ophthalmol Vis Sci. 57 (13), 5490-5497 (2016).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), e147 (2014).
- Fu, Y., Sander, J. D., Reyon, D., Cascio, V. M., Joung, J. K. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. Nat Biotechnol. 32 (3), 279-284 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Res. 24 (6), 1012-1019 (2014).
- Pattanayak, V., et al. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity. Nat Biotechnol. 31 (9), 839-843 (2013).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 343 (6166), 84-87 (2014).
- Schaefer, K. A., et al. Unexpected mutations after CRISPR-Cas9 editing in vivo. Nat Methods. 14 (6), 547-548 (2017).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Ther. 23 (7), 627-633 (2016).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
- Truong, D. J., et al. Development of an intein-mediated split-Cas9 system for gene therapy. Nucleic Acids Res. 43 (13), 6450-6458 (2015).
- Nelson, C. E., Gersbach, C. A. Engineering Delivery Vehicles for Genome Editing. Annu Rev Chem Biomol Eng. 7, 637-662 (2016).
- Jaalouk, D. E., Crosato, M., Brodt, P., Galipeau, J. Inhibition of histone deacetylation in 293GPG packaging cell line improves the production of self-inactivating MLV-derived retroviral vectors. Virol J. 3, 27 (2006).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Hoban, M. D., et al. Delivery of Genome Editing Reagents to Hematopoietic Stem/Progenitor Cells. Curr Protoc Stem Cell Biol. 36, 1-10 (2016).
- Bayer, M., et al. A large U3 deletion causes increased in vivo expression from a nonintegrating lentiviral vector. Mol Ther. 16 (12), 1968-1976 (2008).
- Kantor, B., Ma, H., Webster-Cyriaque, J., Monahan, P. E., Kafri, T. Epigenetic activation of unintegrated HIV-1 genomes by gut-associated short chain fatty acids and its implications for HIV infection. Proc Natl Acad Sci U S A. 106 (44), 18786-18791 (2009).
- Ortinski, P. I., O'Donovan, B., Dong, X., Kantor, B. Integrase-Deficient Lentiviral Vector as an All-in-One Platform for Highly Efficient CRISPR/Cas9-Mediated Gene Editing. Mol Ther Methods Clin Dev. 5, 153-164 (2017).
- Kantor, B., et al. Notable reduction in illegitimate integration mediated by a PPT-deleted, nonintegrating lentiviral vector. Mol Ther. 19 (3), 547-556 (2011).
- Berkhout, B., Verhoef, K., van Wamel, J. L., Back, N. K. Genetic instability of live, attenuated human immunodeficiency virus type 1 vaccine strains. J Virol. 73 (2), 1138-1145 (1999).
- Gomez-Gonzalo, M., et al. The hepatitis B virus X protein induces HIV-1 replication and transcription in synergy with T-cell activation signals: functional roles of NF-kappaB/NF-AT and SP1-binding sites in the HIV-1 long terminal repeat promoter. J Biol Chem. 276 (38), 35435-35443 (2001).
- Kim, Y. S., et al. Artificial zinc finger fusions targeting Sp1-binding sites and the trans-activator-responsive element potently repress transcription and replication of HIV-1. J Biol Chem. 280 (22), 21545-21552 (2005).
- Ortinski, P. I., Lu, C., Takagaki, K., Fu, Z., Vicini, S. Expression of distinct alpha subunits of GABAA receptor regulates inhibitory synaptic strength. J Neurophysiol. 92 (3), 1718-1727 (2004).
- Van Lint, C., et al. Transcription factor binding sites downstream of the human immunodeficiency virus type 1 transcription start site are important for virus infectivity. J Virol. 71 (8), 6113-6127 (1997).
- Van Lint, C., Ghysdael, J., Paras, P., Burny, A., Verdin, E. A transcriptional regulatory element is associated with a nuclease-hypersensitive site in the pol gene of human immunodeficiency virus type 1. J Virol. 68 (4), 2632-2648 (1994).
- Xu, W., Russ, J. L., Eiden, M. V. Evaluation of residual promoter activity in gamma-retroviral self-inactivating (SIN) vectors. Mol Ther. 20 (1), 84-90 (2012).
- . Testing for Replication Competent Retrovirus (RCR)/Lentivirus (RCL) in Retroviral and Lentiviral Vector Based Gene Therapy Products - Revisiting Current FDA Recommendations Available from: https://sites.duke.edu/dvvc/files/2016/05/FDA-recommendation-for-RCR-testing.pdf (2017)
- . Biosafety in Microbiological and Biomedical Laboratories Available from: https://www.cdc.gov/biosafety/publications/bmbl5/bmbl.pdf (2017)
- Dull, T., et al. A third-generation lentivirus vector with a conditional packaging system. J Virol. 72 (11), 8463-8471 (1998).
- Liu, X. S., et al. Editing DNA Methylation in the Mammalian Genome. Cell. 167 (1), 233-247 (2016).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved