Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Протокол для производства интеграза недостаточным лентивирусные векторы для ТРИФОСФАТЫ/Cas9-опосредованной нокаут генов в делящихся клетках
В этой статье
Резюме
Мы описываем Производственная стратегия интеграза недостаточным лентивирусные векторы (IDLVs) как транспортные средства для доставки ТРИФОСФАТЫ/Cas9 клеток. С возможностью выступить посредником, быстрый и надежный гена редактирования в ячейках IDLVs представляют более безопасным и столь же эффективным вектор платформы для доставки генов по сравнению с интеграза компетентных векторов.
Аннотация
Лентивирусные векторы являются идеальным выбором для доставки генов редактирования компонентов клетки из-за их способности для стабильно преобразователя широкий диапазон ячеек и посредническая высокий уровень экспрессии генов. Однако их способность интегрироваться в геном клетки принимающей повышает риск инсерционному мутагенность и таким образом поднимает проблемы безопасности и ограничивает их использование в клинических условиях. Кроме того постоянное выражение гена редактирования компонентов выступил эти интеграции компетентным лентивирусные векторы (ICLVs) увеличивает вероятность прослушивающем гена ориентации. В качестве альтернативы новое поколение интеграза недостаточным лентивирусные векторы (IDLVs) был разработан, рассматриваются многие из этих проблем. Здесь протокол производства новых и усовершенствованных IDLV платформы для редактирования ТРИФОСФАТЫ опосредованной гена и список шаги занимающихся очищения и концентрации таких векторов описан и их электромеханической эффективности ген редактирования с помощью ГЭС 293T был продемонстрирован клетки. Этот протокол легко масштабируема и может использоваться для создания высокого титра IDLVs, которые способны преобразователя клетки в пробирке и в естественных условиях. Кроме того этот протокол может быть легко приспособлено для производства ICLVs.
Введение
Точное гена редактирования является краеугольным камнем основные биомедицинских достижений, которые предполагают разработку новых стратегий для решения генетических заболеваний. На переднем крае технологий ген редактирования является метод, опираясь на использование cЕврошифер regularly -яnterspaced short palindromic repeats (ТРИФОСФАТЫ) / Cas9 система, которая была первоначально определена как компонент бактериальной иммунитет против вторжения вирусного генетического материала (Обзор ссылки1,2). Основным преимуществом системы ТРИФОСФАТЫ/Cas9 над другими инструменты для редактирования гена, таких как Цинк пальцевый nucleases (ZFNs) и транскрипции эффекторных активатор как nucleases (Таленс) (обзор в ссылку3), является относительная простота плазмида дизайн и Строительство ТРИФОСФАТЫ компонентов — это функция, которая питание расширения гена редактирования из нескольких специализированных лабораторий для гораздо более широкого исследовательского сообщества. Кроме того Простота программирования ТРИФОСФАТЫ/Cas9 и его потенциала для распознавания цели мультиплексном далее подпитывают его популярность в качестве экономически эффективной и простой в использовании технологии. Среди различных методов, доступных для исследователей, чтобы доставить такой ген редактирования компонентов клетки вирусных векторов на сегодняшний день остаются наиболее популярной и эффективной системы.
Лентивирусные векторы (ПЗ) появились как транспортное средство выбора для доставки компонентов ТРИФОСФАТЫ/Cas9 системы в естественных условиях для различных приложений4,5,6,7. Несколько ключевых функций делают LVs популярным выбором для этого процесса, включая их способность инфицировать деления и не деления клетки, низкой иммуногенностью и минимальным сотовой токсичности (обзор в ссылка8). В результате был нанят LV-опосредованной генная терапия в лечении инфекционных заболеваний, таких как ВИЧ-1, ГВ и ВПГ-1, а также в коррекции дефектов, лежащих в основе человеческого наследственных заболеваний, таких, как кистозный фиброз и нео сосудистая дегенерация желтого пятна 4 , 5 , 7 , 9 , 10 , 11. Кроме того, LVs эффективно изменен для выполнения мультиплекс гена редактирования на собственный геномной локусов, используя один вектор системы12.
Однако присущие собственности LVs интегрировать в хост геномов может быть мутагенных и часто препятствует их полезность как средства доставки трансген, особенно в клинических условиях. Кроме того поскольку стабильно интегрированных LVs выразить их трансгенов на устойчиво высоком уровне, эта система плохо подходит для доставки генов редактирования компонентов, таких как ТРИФОСФАТЫ/Cas9; Сверхэкспрессия Cas9-руководство РНК (gRNA) и похожие белки, такие как ZFNs, связаны с повышенным уровнем пробить эффектов, которые включают в себя нежелательные мутации13,14,,1516 , 17 и потенциально может повысить цитотоксичность18. Таким образом для достижения точного редактирования гена с минимальными пробить эффекты, важно для разработки систем, которые позволяют для переходных экспрессии гена редактирования компонентов.
В последние годы был разработан целый ряд платформ доставки выразить временно ТРИФОСФАТЫ/Cas9 в клетки16,-19,20,21 (обзор в ссылку22). К ним относятся методы, которые полагаются на непосредственно представляя очищенный Cas9 вместе с соответствующим руководством РНК в клетки, который был показан более эффективными на целевых генов редактирования по сравнению с плазмида опосредованной трансфекции16. Исследования показали, что рибонуклеопротеида (RNP) комплексов, состоящих из руководство РНК/Cas9 частиц быстро перевернулся после посреднических расщепления ДНК на их цели, предполагая, что краткосрочные выражение этих компонентов является достаточной для достижения надежные ген редактирования16. Предположительно,-интеграция вирусный вектор платформ, таких как аденоассоциированный вирусных векторов (AAVs) может обеспечить жизнеспособную альтернативу доставить ген редактирования техники в клетки. К сожалению, Аав capsids обладают значительно ниже возможности упаковки чем LVs (< 5kb), которая серьезно ограничивает их способность упаковки многокомпонентных ТРИФОСФАТЫ инструментарий в пределах одного вектора (обзор в ссылка8). Стоит отметить, что для увеличения лентивирусные титры было показано добавление соединений, которые подавляют гистона комплексы (например, натрия бутират23) или препятствуют клеточного цикла (например, кофеин24). Несмотря на недавний прогресс переходных выражение систем, разработанных до настоящего времени по-прежнему препятствует ряд недостатков, например ниже эффективности производства, которые ведут к снижение вирусной титры и низкой электромеханической эффективности вирусов, порожденных через такие подходы к25.
Интеграза недостаточным лентивирусные векторы (IDLVs) представляют собой основные улучшения в развитии средств доставки генов, как они сочетают в себе возможность упаковки LVs с дополнительным преимуществом AAV-как episomal содержание в клетках. Эти функции помогают IDLVs значительной степени обойти основные вопросы, связанные с интеграции векторы, vis-à-vis непрерывной гиперэкспрессия потенциально генотоксичных элементов и интеграции опосредованной мутагенность. Ранее было показано, что IDLVs может быть успешно изменен для повышения episomal ген выражение26,27. Что касается IDLV-опосредованной ТРИФОСФАТЫ/Cas9 доставки низкие производственные титры и Нижняя выражение episome нести геномов относительно интеграза владеют лентивирусные систем ограничивает их полезность как средства bona fide для доставки изменения генома Трансгенные конструкции. Мы недавно продемонстрировали, что трансген выражение и вирусных титры, связанные с производством IDLV значительно усиливается включение привязки сайтов для транскрипционного фактора Sp1 в течение вирусных выражение кассеты28. Изменение IDLVs энергично поддерживает ТРИФОСФАТЫ опосредованной гена, редактирования в пробирке (в клетках ГЭС 293T) и в естественных условиях (в постсоветском митотическая мозга, нейроны), а заставить минимальный пробить мутации, по сравнению с соответствующим ICLV-опосредованной 28систем. В целом мы разработали роман, компактный, все-в-одном инструментарий ТРИФОСФАТЫ осуществляется на платформе IDLV и изложил различные преимущества использования такого доставки транспортного средства для расширения гена редактирования.
Здесь протокол производства системы IDLV-ТРИФОСФАТЫ/Cas9 описано, включая различные этапы в Ассамблее, очистки, концентрации и титрование IDLVs, а также стратегии для проверки редактирования гена эффективность этих векторов. Этот протокол легко масштабируется для удовлетворения потребностей различных следователей и предназначен для успешного создания LV векторов с титры в диапазоне от 1 x 1010 преобразователя единиц (ту) / мл. Векторы, порожденных через этот протокол может использоваться эффективно заразить несколько различных типов клеток, включая сложные передают эмбриональных стволовых клеток, гемопоэтические клетки (Т-лимфоцитов и макрофагов) и культивировали и в vivo- вводят нейронов. Кроме того протокол одинаково хорошо подходит для производства интеграза компетентных лентивирусные векторы в аналогичных количествах.
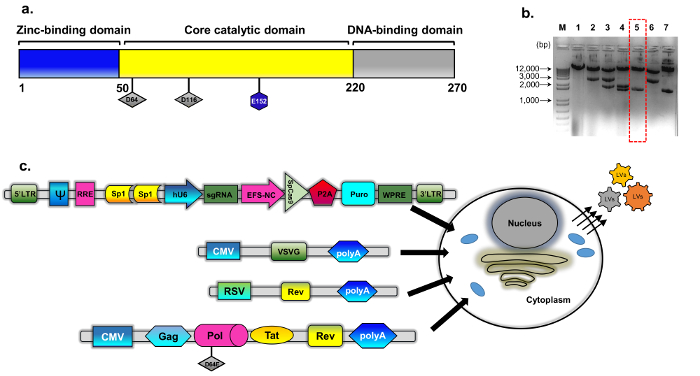
Рисунок 1: Упаковка IDLV. () схема дикого типа интеграза белка (b) изменение плазмида была взята из psPAX2 (см. методы, плазмида строительство для подробной информации). Представитель агарозы гель изображение клонов, экранированный мутировавших интеграза клонов. Пищеварение с EcoRV и SphI были проанализированы образцы ДНК, подготовлен с использованием стандартных плазмида ДНК изоляции Мини-кит. Правильно переварить клон (число 5, пунктирной красной рамкой) был проверен последовательности прямых (Сэнгер) для замены D64E в INT. Кассета интеграза недостаточным упаковки был назван pBK43. (c) схема протокола переходных трансфекции работу для создания IDLV-ТРИФОСФАТЫ/Cas9 векторов, показываю что transfected клеток 293T с VSV-G, упаковки и трансген кассеты (Sp1-ТРИФОСФАТЫ/Cas9 все-в-одном плазмида). Вирусные частицы, которые бутон из клеточной мембраны содержат полнометражного РНК вектора (выразил от трансген кассеты). Второе поколение IDLV-упаковочные системы была использована, которая включает в себя регуляторных белков ТАТ и преподобный Rev выражение дополнить с отдельной кассеты (RSV-REV-плазмиды). Abbrev: вирус повтор, VSV-G, везикулярного стоматита LTR-Лонг терминал G-белок, промоутер pCMV цитомегаловирус; Промоутер саркомы Рауса вирус (RSV); RRE-(Rev ответ элемент). Другие нормативные элементы на кассету выражения включают Sp1-привязки сайтов, Rev ответ элемента (RRE), сурок гепатитом вирус посттранскрипционного регулирования элемент (WPRE), удлинение основной фактор 1α промоутер (EFS-NC), упаковка вектор элемент ψ (psi), человека промоутер цитомегаловирус (hCMV) и человека U6 промоутер. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
протокол
1. выращивание ГЭС 293T и заполнения ячейки для Transfection
Примечание: Человеческих эмбриональных почки 293T клетки (ГЭС 293T), выращенных в среде DMEM, высокие глюкоза СМИ с 10% бычьего теленка сыворотки, дополненная железа и роста промоутеров и 1 x антибиотик противогрибковое решение (100 x решение содержит 10 000 единиц пенициллин 10 мг стрептомицина и 25 амфотерицин B мкг / мл). Средства массовой информации также дополняется с 1 x пируват натрия, 1 x non-essential аминокислота микс и 2 мм L-глютамин (дипептид запасов 200 мм L-аланил L-глютамина в 0,85% NaCl). Клетки культивировали в 100 мм культуры ткани пластины (приблизительный рост поверхности площадью 55 см²). Под выращивание соотношение 1:10 используется с югу культивирования каждые 2-3 дня. Трипсин-ЭДТА 0,05% используется для диссоциации клеток между проходы. Для обеспечения согласованности между эксперименты, мы рекомендуем тестирования телячьей сыворотки при переключении на другой много/партии и контролировать любые изменения в рост клеток, эффективность трансфекции и векторные производства.
- Начните новую культуру с помощью низкий проход клетки (рекомендуется не использовать клетки после прохода 15 или если рост замедляется), посев культуры ткани 10 см пластины. Использование DMEM дополнена 10% сыворотки для роста клеток. Рост клеток при 37 ° C с 5% CO2 в инкубаторе стандартной культуры ткани. Используйте стандартный Горяева для подсчета клеток для всех последующих шагов.
- После клетки достигает 90-95% вырожденная роста, повторное заполнение в 15 см пластины культуры тканей (ниже шаги 1.3 - 1.5).
- Повторное заполнение, аспирационная СМИ от вырожденная пластины и осторожно промыть стерильной ПБС. Инкубировать клетки с 2 мл реагента диссоциации (например, трипсин-ЭДТА) при 37 ° C на 3-5 мин добавить 8 мл средства массовой информации, содержащих сыворотки инактивировать диссоциации реагента и нарезанных 10 - 15 раз с 10 мл Серологические Пипетки для создания отдельной ячейки подвеска. Ресуспензируйте клеток в культуре СМИ для получения плотность клеток 4 х 106 клеток/мл.
- Содействовать присоединению к субстрату, предварительно покройте 15 см пластины с 0,2% желатина, добавление 8 мл желатина на пластину. Равномерно по всей поверхности пластины, инкубации при комнатной температуре в течение 10 мин и отбором жидкости.
- Довести общий объем каждой пластины до 25 мл с теплой (37 ° C) ГЭС-293 T СМИ (см. Примечание в шаг 1) и семян пластины, добавив 2,5 мл клеток (всего ~ 1 x 107 клеток/плита). Инкубируйте пластины при 37 ° C с 5% CO2 на ночь, или до 70-80% confluency.
Примечание: До шести 15 см пластины может использоваться для производства. Отрегулируйте громкость СМИ на пластину на ~ 20-22 мл при использовании более четырех пластин (см. шаг 5 для обоснование протокола).
2. transfecting ГЭС 293T клеток, используя протокол на основе фосфата кальция
-
Трансфекция реагентов
- Готовить 2 x BES-амортизированное решение BBS (50 мм BES, 280 мм NaCl, 1,5 мм Na2HPO4), объединить 16.36 г NaCl, 10.65 г ПВЛ (N, N-бис (2-гидроксиэтилкрахмала) -2-амино-ethanesulfonic кислота) и 0,21 g Na2HPO4. Добавьте дистиллированную двойной H2O (dd-H2O) до 900 мл. Распустить, титровать до pH 6.95 с 1 M NaOH и довести объем до 1 л фильтр через 0,22 мкм фильтр. Хранить при температуре от-20 ° C.
- Подготовьте CaCl 1 М2. Фильтр решение через фильтр 0,22 мкм. Хранить при 4 ° C.
- Наблюдать за пластины, которые были посеяны в предыдущий день. Клетки будут готовы к трансфекции, как только они достигают 70-80% confluency.
- Аспирационная старых СМИ из пластин и аккуратно добавить свежеприготовленные СМИ без сыворотки.
Примечание: Смотрите Дополнительный файл 1-плазмиды для подробной информации о выбранной плазмидов и их подготовки. - Подготовьте плазмида микс aliquoting четыре плазмид в 15 мл Конические трубки. Для приготовления одного 15-см блюдо, используйте 37,5 мкг ТРИФОСФАТЫ/Cas9-передача вектор (pBK198 или pBK189), 25 мкг pBK43 (psPAX2-D64E), 12,5 мкг pMD2.G и 6,25 мкг pREV (рис. 1С).
- Добавьте 312.5 мкл 1M CaCl2 плазмида микс. Для этого добавьте до 1,25 мл стерильного dd-H20.
- Медленно (каплям) добавить 1,25 мл раствора 2 x BBS во время vortexing смеси. Инкубируйте 30 мин при комнатной температуре.
- Добавьте смесь трансфекции каплям на каждой пластине 15-см (2,5 мл на пластине). Вихревой мягко пластины и инкубировать при 37 ° C с 5% CO2 на 2-3 ч. После этого добавить 2,5 мл (10%) сыворотки на пластину и продолжить инкубации на ночь (12-18 ч).
Примечание: Некоторые лаборатории используют 3% CO2 инкубаторы для стабилизации рН средства массовой информации. Однако мы не наблюдаем никакой разницы в эффективности трансфекции между 3% и 5% CO2. Кроме того размер4 осаждает Капо имеет решающее значение для эффективности трансфекции; Трансфекция смеси должно быть ясно до его добавления на клетки. Если смесь становится мутным во время инкубации, подготовьте свежие 2 x BBS (рН = 6.95).
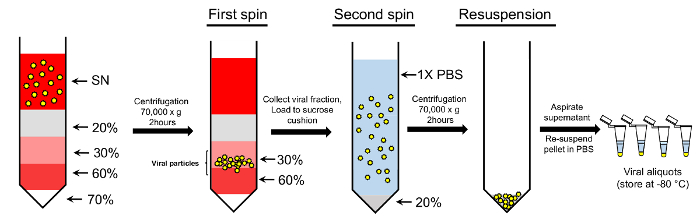
Рисунок 2: концентрация вирусных частиц, с использованием градиента протокола двойной сахароза. Вирусных частиц, собранных из супернатант (SN) загружаются на градиент градиент сахарозы. 70%, 60%, 30% и 20% сахарозы решения используются для создания градиента. После центрифугирования частиц, собранных от 30-60% сахарозы фракций далее загружаются на подушке 20% сахарозы и химически осажденный. Окончательный гранулы, содержащие очищенных вирусных частиц высокомобильна в однократном ПБС для дальнейшего использования (см. текст для получения более подробной информации). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
3. день после Transfection
- Наблюдать за клетки, чтобы обеспечить, что они приближаются к 100% confluency на данный момент практически нет смерти клетки. Замените СМИ, добавив 25 мл свежего DMEM + 10% сыворотки для каждой пластины. Далее, инкубации при 37 ° C с 5% CO2 для дополнительных 48 ч.
Примечание: Регулировка громкости СМИ в шаг 3.1 при использовании более чем шести пластин 15 см (см. шаг 5.2, обратите внимание).
4. заготовка вирус
- Тщательно Соберите супернатант от всех плит культуры ткани, содержащие transfected клеток с использованием 10 мл стерильной пипеткой культуры ткани и бассейн в 50 мл пробирок.
- Снимите подвеска центрифугированием на 400-450 x g 10 мин с помощью настольной центрифуги. Фильтр супернатант через блок вакуумного фильтра 0.45 мкм.
Примечание: Отфильтрованных супернатант может быть хранимой на 4 ° C до 4 дней, прежде чем продолжить с концентрацией, или aliquoted и хранятся при температуре-80 ° C. Ожидаемые титры IDLV-Sp1-ТРИФОСФАТЫ/Cas9 (не сконцентрированные) вирусных препаратов должно быть ~ 2 x 107 ту/мл (см. шаг 6 для определения титра антител). Однако не подвергая вирусных препаратов несколько циклов замораживания оттаивания, как каждый раунд замораживания и оттаивания приводит к потере 10-20% в функциональных титры.
5. концентрация вирусных частиц по Ultracentrifugation
Примечание: Мы используем двойные сахароза метод очистки, которая включает два этапа: сахароза градиента шаг и сахароза подушки шаг (рис. 2).
- Загрузить трубы конической ultracentrifugation в следующем порядке для создания градиента сахарозы: 0,5 мл 70%-ая сахароза (растворяют ПБС), 0,5 мл 60% сахарозы (растворяют в среде DMEM), 1 мл 30%-ая сахароза (растворяют в среде DMEM) и 2 мл 20%-ая сахароза (растворяют в однократном ПБС).
-
Добавьте вирус содержащих супернатант тщательно градиента. Как общий объем супернатант из четырех 15 см пластины 100 мл, используйте шесть ultracentrifugation трубы за спин для обработки полного объема супернатанта вируса.
- Каждая трубка ultracentrifugation, для этот шаг имеет объём до 30 мл (включая объем сахарозы), распространение вирусных супернатант поровну между трубы, оставляя по крайней мере 10% headspace для предотвращения утечки.
- Отрегулируйте громкость культуры на ~ 20-22 мл на пластине при использовании более четырех 15 см пластины для каждого эксперимента, так что окончательный объем пула вирусных супернатант легко могут быть размещены в шести ultracentrifugation трубы.
- Ultracentrifugation заполнения трубки для по меньшей мере три четверти их общий объём, в противном случае поломки трубок может произойти во время центрифугирования, что приводит к потере возможности выборки и/или оборудование повреждения.
- Баланс трубки с 1 x PBS и центрифуги образцы на 70000 x g на 2 ч в 17 ° C (см. Таблицу материалы для ротора детали).
Примечание: Чтобы предотвратить срыв сахарозы слоя при разгоне, установите ультрацентрифуга ускорить медленно ротора до 200 об/мин в течение первых 3 мин спина. Аналогично установите ультрацентрифуга замедляться медленно ротора от 200 об/мин до 0 rpm более 3 мин в конце спина. - Тщательно Соберите 30-60% сахарозы фракций в чистой трубки (рис. 2). Добавьте холодной 1 x PBS в пуле фракций и довести объем до 100 мл; Смешайте закупорить вверх и вниз несколько раз.
- Перейти к шагу подушке сахарозы, тщательно расслоение вирусной подготовки на подушке сахарозы. Для этого добавьте 4 мл 20%-ая сахароза (в однократном ПБС) на трубу, следуют ~ 20-25 мл вирусный раствора в трубку. Если трубы не менее чем три четверти полный, пополнить с стерильных ПБС.
- Тщательно сбалансировать и Центрифугуйте образцы на 70000 x g на 2 ч в 17 ° C, как раньше. Слить супернатант и разрешить оставшиеся жидкость слить, инвертирование трубы на бумажные полотенца.
- Аспирационная оставшиеся капли для того, чтобы удалить все жидкости из гранул. На этом шаге вирус содержащие гранул должно быть едва видна, как небольшие полупрозрачные пятна.
- Ресуспензируйте гранулы путем добавления первой трубки и тщательно закупорить подвеска, впоследствии передаче подвеска на следующий трубу и смешивания как и прежде, продолжается до тех пор, пока все гранулы высокомобильна 70 мкл ПБС.
- Промойте трубы с дополнительной 50 мкл холодной 1 x PBS и смеси как раньше. Убедитесь, что общий объем окончательное приостановление является ~ 120 мкл и появляется немного Млечный; очистить его центрифугированием на 10000 x g 30 s на настольные microcentrifuge.
- Передать трубку свежие отцентрифугировать супернатанта, сделать 10 мкл аликвоты и хранить их при температуре-80 ° C.
Примечание: Избегайте выполнения циклов повторных замораживания оттаивания на лентивирусные образцов. За исключением тех случаев, когда требуется центрифугирования усилия должны сделать выполнять оставшиеся шаги в капюшоны тканевые культуры, или места для номера культуры ткани, используя соответствующие биобезопасности мер (см. обсуждение).
6. Оценка вирусной титры
-
p24 -фермент-связанный метод иммуноферментного анализа (ИФА)
Примечание: Assay осуществляется с использованием высокой привязки 96-луночных пластины как инструкции программы вакцины против СПИДа низ для ВИЧ-1 p24 антигена Assay захвата комплект (см. Таблицу материалы) с изменениями №29.- Следующий день, Промыть лунки три раза с 200 мкл 0,05% 20 анимации в холодных PBS (PBS-T раствор). Слой пластины с 100 мкл антител моноклональных анти p24 при разбавлении 1: 1500 в однократном ПБС и инкубировать на ночь при 4 ° C.
- Чтобы исключить неспецифический привязки, блокировать пластину с 200 мкл 1% BSA в PBS; Вымойте три раза с 200 мкл 0,05% 20 анимации в холодных PBS (PBS-T решения) для по крайней мере 1 ч при комнатной температуре.
-
Подготовить образцы: Для подготовки концентрированных вектор, разбавьте 1 мкл пример 100 раз, добавляя 89 мкл dd-H20 и 10 мкл X-100 Тритон (конечная концентрация 10%). Для не сконцентрированные препаратов Подготовьте десятикратный разреженных образцы (мкл 80 ПД H20 и 10 мкл X-100 Тритон (конечная концентрация 10%) до 10 мкл пример).
Примечание: Образцы можно хранить при-20 ° C на этом этапе для длительного периода времени для последующего использования. - Подготовка стандартов ВИЧ-1, применяя 2 раза серийный разрежения (с начальной концентрации 5 нг/мл).
- Разбавьте концентрированный образцов (от 1: 100 предварительно разбавленного запасов) в RPMI 1640 с 0,2% 20 анимации и 1% BSA установить 1:10 000, 1:50 000 и растительного разведениях. Разбавлять-сконцентрированные образцы (от 1:10 предварительно разбавленный запасов) в RPMI 1640 с 0,2% 20 анимации и 1% BSA установить разведения 1: 500, 1:2500 и 1:12,500.
- Применять образцы на плите в triplicates и инкубировать на ночь при 4 ° C.
- На следующий день, Промыть лунки шесть раз и инкубировать при 37 ° C для 4 h с 100 мкл кролика polyclonal антитела анти p24 , разбавленных 1: 1000 в RPMI 1640, 10% FBS, BSA 0,25% и 2% нормальной мыши сыворотки (NMS).
- Вымойте шесть раз как выше и инкубировать при 37 ° C за 1 час с Коза анти кролик пероксидаза мэм IgG разбавляют в RPMI 1640 с 5% нормальной козьего сыворотки, 2% NMS, 0,25% BSA и 0,01% 20 анимации.
- Вымойте тарелку, как указано выше и проинкубируйте с ТМБ пероксидазы субстрата при комнатной температуре в течение 15 мин.
- Остановите реакции, добавив 100 мкл 1 N HCL. Измерение оптической плотности образца на 450 Нм, с помощью оптической плотности плиты читателя.
-
Измерение интенсивности флуоресцентные репортер
- СУИМ метод
Примечание: Степень GFP сигнал истощения в клетках может быть точно оценена путем измерения интенсивности среднее флуоресценции клеток transduced через проточной цитометрии. Пожалуйста, обратитесь в последние бумаги в 28 для анализа данных СУИМ, представления и интерпретации. Протокол описана следующим образом.- Сделайте десятикратный серийный разрежения подготовки (от 10-1 -10-5) вирусной подготовки в однократном ПБС.
- Семя приблизительно 5 x 105 293T клеток в каждой скважине 6-ну плиты в окончательном объеме 2 мл на хорошо. 10 мкл каждого вирусный разрежения в клетки и инкубации клеток при 37 ° C в течение 48 часов.
- Урожай клетки для анализа СУИМ следующим: 200 мкл 0,05% раствор трипсина-ЭДТА и инкубации клеток при 37 ° C за 5 минут добавить 2 мл полный DMEM СМИ и собирать образцы в 15 мл конические трубы.
- Пелле клетки центрифугированием на 400 x g при 4 ° C и Ресуспензируйте гранулы в 500 мкл холодной ПБС.
- Для фиксации добавить равным объемом 4% раствора формальдегида в этом подвеска и проинкубируйте втечение 10 мин при комнатной температуре.
- Пелле фиксированные клетки и Ресуспензируйте в 1 мл ПБС. Анализировать экспрессия гена GFP с помощью инструмента СУИМ, как описано в Ортинский и др. 28 кратко, используйте следующую формулу для определения функциональных титр вируса:
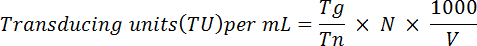
Примечание: Здесь Tg = количество GFP-положительных клеток учитываются; TN = общее количество клеток учитываются; N = общее число клеток преобразованы; V = объем (в мкл) используется для трансдукции. Например: если 1 x 106 клеток были преобразованы с 10 мкл вируса, 2 x 104 клетки были подсчитанные и 5 x 10-3 были GFP-позитивных, основанный на функциональные титр будет выше уравнения:
- Подсчет GFP-положительных клеток
- Вычислите кратность инфекции (МВД) используется для трансдукции. Тестировать широкий диапазон MOIs (1-10), с увеличением MOIs, что приводит к более высокой эффективности трансдукции.
- До трансфекции семян 6-ну плита с приблизительно 3-4 x 105 клеток на хорошо. После того, как клетки достичь > 90% confluency (обычно в течение 24 ч), передают с очищенный вирус на заранее MOIs.
- Инкубируйте 1-7 дней для изменения сигнала GFP пластины при 37 ° C с 5% CO2 в стандартной культуры ткани и клетки монитор на регулярной основе.
- Подсчитать количество GFP-положительных клеток с флуоресцентный микроскоп (план 4 X цель, 0.1 Н.А, 40 кратном) устанавливается с набором фильтров GFP (возбуждения волны-470 Нм, выбросов волны-525 Нм), используя наивный (ООН transduced) клетки для населения GFP-негативных и позитивных клеток.
- Оцените окончательный титр, регулируя коэффициент разрежения и тома, с помощью следующей формулы:
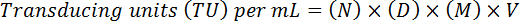
Примечание: Здесь, N = количество GFP-положительных клеток, D = коэффициент разрежения, M = кратность (обычно 20 X), V = объем вирус используется для трансдукции. Например, для 20 GFP-положительных клеток (N) учитываются при разбавлении 10-4 (1:10, 000) в 10 мкл пример (V) 20 X увеличение (M) (D) приведет к функциональной титр (20 x 104) x (20) x (10) x (100 *) = 4 x 108 ту/мл.
(* приспособиться к мл)
- СУИМ метод
Результаты
Проверка эффективности плей IDLV-ТРИФОСФАТЫ/Cas9 векторов
Мы использовали GFP-выражая 293T клетки как модель для проверки эффективности ТРИФОСФАТЫ/Cas9-опосредованной Нокаут гена. GFP + клетки были порожденных трансдукции ГЭС 293T клеток с pLenti-GFP (vBK201a) в MOI 0.5 (...
Обсуждение
IDLVs начали появляться как средство выбора в vivo гена редактирования, особенно в контексте генетических заболеваний, главным образом ввиду низкого риска мутагенеза, связанные с эти векторы, по сравнению с интеграции платформ доставки22 , 28. в текущем ру...
Раскрытие информации
Патентная ОСК-499-P (1175) была подана университета Южной Каролины в связи с работой, описанной в этой рукописи.
Благодарности
Мы хотели бы поблагодарить Департамент нейробиологии, школа медицины при университете Дьюка и деканат по фундаментальной науки, Университет Дьюка. Мы также благодарим членов герцог вирусный вектор ядра для комментариев на рукопись. Плазмида pLenti CRISPRv2 был подарок от Чжан Фэн (широкой институт). LV-упаковочная система, включая psPAX2 плазмид, VSV-G, pMD2.G и pRSV-Rev был вид подарок от наконец Дидье (EPFL, Швейцария). Финансовая поддержка для проведения этой работы была оказана университета Южной Каролины школы медицины, Грант RDF18080-Е202 (B.K).
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A99839 | |
| Allegra 25R tabletop centrifuge | Beckman Coulter | 369434 | |
| xMark Microplate Absorbance plate reader | Bio-Rad | 1681150 | |
| BD FACS | Becton Dickinson | 338960 | |
| Inverted fluorescence microscope | Leica | DM IRB2 | |
| 0.45-μm filter unit, 500mL | Corning | 430773 | |
| Conical bottom ultracentrifugation tubes | Seton Scientific | 5067 | |
| Conical tube adapters | Seton Scientific | PN 4230 | |
| SW32Ti swinging-bucket rotor | Beckman Coulter | 369650 | |
| 15 mL conical centrifuge tubes | Corning | 430791 | |
| 50mL conical centrifuge tubes | Corning | 430291 | |
| High-binding 96-well plates | Corning | 3366 | |
| 150 mm TC-Treated Cell Culture dishes with 20 mm Grid | Corning | 353025 | |
| 100mm TC-Treated Culture Dish | Corning | 430167 | |
| 0.22 μM filter unit, 1L | Corning | 430513 | |
| QIAprep Spin Miniprep Kit (50) | Qiagen | 27104 | |
| Tissue culture pipettes, 5 mL | Corning | 4487 | |
| Tissue culture pipettes, 10 mL | Corning | 4488 | |
| Tissue culture pipettes, 25 mL | Corning | 4489 | |
| Hemacytometer with cover slips | Cole-Parmer | UX-79001-00 | |
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| Human embryonic kidney 293T (HEK 293T) cells | ATCC | CRL-3216 | |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| DMEM, high glucose media | Gibco | 11965 | |
| Cosmic Calf Serum | Hyclone | SH30087.04 | |
| Antibiotic-antimycotic solution, 100X | Sigma Aldrich | A5955-100ML | |
| Sodium pyruvate | Sigma Aldrich | S8636-100ML | |
| Non-Essential Amino Acid (NEAA) | Hyclone | SH30087.04 | |
| RPMI 1640 media | Thermo Fisher Scientific | 11875-085 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Trypsin-EDTA 0.05% | Gibco | 25300054 | |
| BES (N, N-bis (2-hydroxyethyl)-2-amino-ethanesulfonic acid) | Sigma Aldrich | B9879 - BES | |
| Gelatin | Sigma Aldrich | G1800-100G | |
| Name | Company | Catalog Number | Comments |
| p24 ELISA reagents | |||
| Monoclonal anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | 3537 | |
| HIV-1 standards | NIH AIDS Research and Reference Reagent Program | SP968F | |
| Polyclonal rabbit anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | SP451T | |
| Goat anti-rabbit horseradish peroxidase IgG | Sigma Aldrich | 12-348 | Working concentration 1:1500 |
| Normal mouse serum, Sterile, 500mL | Equitech-Bio | SM30-0500 | |
| Goat serum, Sterile, 10mL | Sigma | G9023 | Working concentration 1:1000 |
| TMB peroxidase substrate | KPL | 5120-0076 | Working concentration 1:10,000 |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| psPAX2 | Addgene | 12260 | |
| pMD2.G | Addgene | 12259 | |
| pRSV-Rev | Addgene | 12253 | |
| lentiCRISPR v2 | Addgene | 52961 | |
| Name | Company | Catalog Number | Comments |
| Restriction enzymes | |||
| BsrGI | New England Biolabs | R0575S | |
| BsmBI | New England Biolabs | R0580S | |
| EcoRV | New England Biolabs | R0195S | |
| KpnI | New England Biolabs | R0142S | |
| PacI | New England Biolabs | R0547S | |
| SphI | New England Biolabs | R0182S |
Ссылки
- Horvath, P., Barrangou, R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 327 (5962), 167-170 (2010).
- Marraffini, L. A., Sontheimer, E. J. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nat Rev Genet. 11 (3), 181-190 (2010).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Bellec, J., et al. CFTR inactivation by lentiviral vector-mediated RNA interference and CRISPR-Cas9 genome editing in human airway epithelial cells. Curr Gene Ther. 15 (5), 447-459 (2015).
- Kennedy, E. M., et al. Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 476, 196-205 (2015).
- Roehm, P. C., et al. Inhibition of HSV-1 Replication by Gene Editing Strategy. Sci Rep. 6, 23146 (2016).
- Wang, W., et al. CCR5 gene disruption via lentiviral vectors expressing Cas9 and single guided RNA renders cells resistant to HIV-1 infection. PLoS One. 9 (12), e115987 (2014).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Adv Genet. 87, 125-197 (2014).
- Lebbink, R. J., et al. A combinational CRISPR/Cas9 gene-editing approach can halt HIV replication and prevent viral escape. Sci Rep. 7, 41968 (2017).
- Xu, L., et al. CRISPR/Cas9-Mediated CCR5 Ablation in Human Hematopoietic Stem/Progenitor Cells Confers HIV-1 Resistance In Vivo. Mol Ther. , (2017).
- Yiu, G., Tieu, E., Nguyen, A. T., Wong, B., Smit-McBride, Z. Genomic Disruption of VEGF-A Expression in Human Retinal Pigment Epithelial Cells Using CRISPR-Cas9 Endonuclease. Invest Ophthalmol Vis Sci. 57 (13), 5490-5497 (2016).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), e147 (2014).
- Fu, Y., Sander, J. D., Reyon, D., Cascio, V. M., Joung, J. K. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. Nat Biotechnol. 32 (3), 279-284 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Res. 24 (6), 1012-1019 (2014).
- Pattanayak, V., et al. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity. Nat Biotechnol. 31 (9), 839-843 (2013).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 343 (6166), 84-87 (2014).
- Schaefer, K. A., et al. Unexpected mutations after CRISPR-Cas9 editing in vivo. Nat Methods. 14 (6), 547-548 (2017).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Ther. 23 (7), 627-633 (2016).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
- Truong, D. J., et al. Development of an intein-mediated split-Cas9 system for gene therapy. Nucleic Acids Res. 43 (13), 6450-6458 (2015).
- Nelson, C. E., Gersbach, C. A. Engineering Delivery Vehicles for Genome Editing. Annu Rev Chem Biomol Eng. 7, 637-662 (2016).
- Jaalouk, D. E., Crosato, M., Brodt, P., Galipeau, J. Inhibition of histone deacetylation in 293GPG packaging cell line improves the production of self-inactivating MLV-derived retroviral vectors. Virol J. 3, 27 (2006).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Hoban, M. D., et al. Delivery of Genome Editing Reagents to Hematopoietic Stem/Progenitor Cells. Curr Protoc Stem Cell Biol. 36, 1-10 (2016).
- Bayer, M., et al. A large U3 deletion causes increased in vivo expression from a nonintegrating lentiviral vector. Mol Ther. 16 (12), 1968-1976 (2008).
- Kantor, B., Ma, H., Webster-Cyriaque, J., Monahan, P. E., Kafri, T. Epigenetic activation of unintegrated HIV-1 genomes by gut-associated short chain fatty acids and its implications for HIV infection. Proc Natl Acad Sci U S A. 106 (44), 18786-18791 (2009).
- Ortinski, P. I., O'Donovan, B., Dong, X., Kantor, B. Integrase-Deficient Lentiviral Vector as an All-in-One Platform for Highly Efficient CRISPR/Cas9-Mediated Gene Editing. Mol Ther Methods Clin Dev. 5, 153-164 (2017).
- Kantor, B., et al. Notable reduction in illegitimate integration mediated by a PPT-deleted, nonintegrating lentiviral vector. Mol Ther. 19 (3), 547-556 (2011).
- Berkhout, B., Verhoef, K., van Wamel, J. L., Back, N. K. Genetic instability of live, attenuated human immunodeficiency virus type 1 vaccine strains. J Virol. 73 (2), 1138-1145 (1999).
- Gomez-Gonzalo, M., et al. The hepatitis B virus X protein induces HIV-1 replication and transcription in synergy with T-cell activation signals: functional roles of NF-kappaB/NF-AT and SP1-binding sites in the HIV-1 long terminal repeat promoter. J Biol Chem. 276 (38), 35435-35443 (2001).
- Kim, Y. S., et al. Artificial zinc finger fusions targeting Sp1-binding sites and the trans-activator-responsive element potently repress transcription and replication of HIV-1. J Biol Chem. 280 (22), 21545-21552 (2005).
- Ortinski, P. I., Lu, C., Takagaki, K., Fu, Z., Vicini, S. Expression of distinct alpha subunits of GABAA receptor regulates inhibitory synaptic strength. J Neurophysiol. 92 (3), 1718-1727 (2004).
- Van Lint, C., et al. Transcription factor binding sites downstream of the human immunodeficiency virus type 1 transcription start site are important for virus infectivity. J Virol. 71 (8), 6113-6127 (1997).
- Van Lint, C., Ghysdael, J., Paras, P., Burny, A., Verdin, E. A transcriptional regulatory element is associated with a nuclease-hypersensitive site in the pol gene of human immunodeficiency virus type 1. J Virol. 68 (4), 2632-2648 (1994).
- Xu, W., Russ, J. L., Eiden, M. V. Evaluation of residual promoter activity in gamma-retroviral self-inactivating (SIN) vectors. Mol Ther. 20 (1), 84-90 (2012).
- . Testing for Replication Competent Retrovirus (RCR)/Lentivirus (RCL) in Retroviral and Lentiviral Vector Based Gene Therapy Products - Revisiting Current FDA Recommendations Available from: https://sites.duke.edu/dvvc/files/2016/05/FDA-recommendation-for-RCR-testing.pdf (2017)
- . Biosafety in Microbiological and Biomedical Laboratories Available from: https://www.cdc.gov/biosafety/publications/bmbl5/bmbl.pdf (2017)
- Dull, T., et al. A third-generation lentivirus vector with a conditional packaging system. J Virol. 72 (11), 8463-8471 (1998).
- Liu, X. S., et al. Editing DNA Methylation in the Mammalian Genome. Cell. 167 (1), 233-247 (2016).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены