A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
اعتلال عضلة القلب الناجم عن عدم انتظام دقات القلب كنموذج فشل القلب مزمن في الخنازير
In This Article
Summary
نقدم هنا، بروتوكولا لإنتاج اعتلال عضلة القلب الناجم عن عدم انتظام دقات القلب في الخنازير. ويمثل هذا النموذج وسيلة قوية لدراسة الهليوكبتر التدريجي من قصور القلب المزمن وآثار العلاج المطبقة.
Abstract
مطلوب نموذج مستقر وموثوق بها من قصور مزمن في القلب للعديد من التجارب لفهم الهليوكبتر أو لاختبار الآثار لطرق العلاج الجديدة. نقدم هنا، هذا نموذج بعضلة الناجمة عن عدم انتظام دقات القلب، التي يمكن أن تنتج من القلب السريع سرعة في الخنازير.
رائد سرعة واحدة ترانسفينوسلي أدخلت في الخنازير صحية تماما فظاعتها، إلى قمة البطين الأيمن، وتركز اهتمامها. ثم هو نفقية نهايته الأخرى دورسالي إلى منطقة مجاورة. هناك، أنه متصل بوحدة لتنظيم ضربات القلب قلب معدلة داخلية ثم يتم زرعها في جيب تحت الجلد.
وكشف الفحص البدني بعد 4-8 أسابيع لتحديد سرعة البطين السريع في معدلات 200-240 نبضة في الدقيقة، علامات فشل القلب الحاد-تسرع النفس، والجيوب الأنفية عفوية عدم انتظام دقات القلب، والتعب. تخطيط صدى القلب وتمدد الأشعة السينية أظهرت جميع الدوائر القلب والاراقة، وشديدة الضعف الانقباضية. هذه النتائج تتوافق مع جيدا لاعتلال عضلة القلب المتوسعة التليف ويتم الاحتفاظ أيضا بعد وقف سرعة.
يمكن استخدام هذا النموذج من اعتلال عضلة القلب الناجم عن عدم انتظام دقات القلب لدراسة الفيزيولوجيا المرضية لقصور القلب المزمن التدريجي، لا سيما التغييرات الفسيولوجية الناجمة عن طرق العلاج الجديدة مثل الميكانيكية ويدعم الدورة الدموية. هذه المنهجية سهلة لأداء والنتائج قوية واستنساخه.
Introduction
مجموعة متنوعة أساليب علاج جديدة لفشل القلب (HF)، لا سيما الاستخدام المتزايد في جميع أنحاء العالم للميكانيكية ويدعم الدورة الدموية والأوكسجين الغشاء خارج الجسم (ECMO) في الممارسة السريرية، التي تعكس في الاختبار التجريبي السريري. كان التركيز الرئيسي على التغييرات الفسيولوجية الناجمة عن طرائق النظر في المعاملة، أي في ضغط الدم النظامية1، احتشاء عضلة القلب contractility، الضغط والتغييرات في الحجم في الدوائر قلب وقلب العمل2،3، تدفق الدم الشرياني في المنهجية والهامشية الشرايين، جنبا إلى جنب مع تعويض التمثيل الغذائي4 -تشبع أنسجة الإقليمية والتروية الرئوية، وتحليل غازات الدم. وتوجه دراسات أخرى عن الآثار الطويلة الأمد لدعم الدورة الدموية5، وما يصاحب ذلك التهاب، أو حدوث انحلال الدم. جميع هذه الأنواع من الدراسة بحاجة إلى من بيوموديل مستقرة من التردد الاحتقاني.
غادر معظم التجارب المنشورة في البطين (LV) الأداء وتم إجراء الهليوكبتر لدعم الدورة الدموية الميكانيكية على نماذج تجريبية ل الحاد التردد2،،6،،من78 , 9 , 10، أو حتى على قلوب سليمة تماما. من ناحية أخرى، في الممارسة السريرية، وكثيراً ما يجري تطبيق يدعم الدورة الدموية الميكانيكية في حالة الدورة الدموية decompensation أن يتطور على أساس سابقا هذا أمراض القلب المزمنة. في مثل هذه الحالات، يتم تطويرها تماما آليات التكيف ويمكن أن تلعب أدواراً هامة في عدم اتساق النتائج لاحظ وفقا "الحدة أو الأزمان" الكامنة وراء مرض القلب11. ولذلك، يمكن أن تقدم نموذجا مستقرا للتردد المزمن رؤى جديدة في الآليات الفيزيولوجية المرضية والهليوكبتر. على الرغم من أن هناك أسباب لماذا يتم استخدام نماذج التردد المزمن الشحيحة-إعداد مضيعة للوقت، وعدم الاستقرار لضربات القلب، والمسائل الأخلاقية، ومعدل الوفيات-مزاياها واضحة، كما أنها توفر وجود طويل الأجل neurohumoral التنشيط، التكيف المنهجية العامة، تغييرات وظيفية من كارديوميوسيتيس، والتعديلات الهيكلية للقلب والعضلات والصمامات12،13.
بشكل عام، وتوافر مجموعة متنوعة من النماذج الحيوانية المستخدمة في الدراسات الفسيولوجية واسعة ويوفر خيار للعديد من احتياجات محددة. لهذه التجارب، ومعظمها الخنزير والكلاب والأغنام، أو مع أصغر إعدادات الفاري والنماذج، ويجري المختار وعرض محاكاة جيدة من ردود الفعل الجسدية البشرية المتوقعة14. وعلاوة على ذلك، أصبحت أشكال التجارب جهاز واحد أكثر تواترا15. بشكل موثوق تقليد الفسيولوجيا المرضية للتردد، هو يجري تداول تدهورت مصطنع. الضرر للقلب قد يتسبب بأساليب مختلفة، غالباً ما أما الاسكيمية، وعدم انتظام ضربات القلب، والضغط الزائد، أو كارديوتوكسيك آثار المخدرات، مع أي من هذه مما يؤدي إلى تدهور الفسيولوجية للنموذج. لإنتاج نموذج حقيقي للتردد المزمن، قد وقت لتطوير التكيف على المدى الطويل في الحي كله. ويمثل هذا نموذج موثوقة ومستقرة جيدا الناجمة عن عدم انتظام دقات القلب عضلة (عرة)، التي يمكن أن تنتج من القلب السريع سرعة في الحيوانات التجريبية.
فقد ثبت أن تدوم طويلاً تاتشيارهيثمياس المتواصلة في قلوب ميالا، يؤدي إلى خلل الانقباضي وتمدد مع انخفاض الناتج القلب. الشرط المشار إليها كما عرة كان أول وصف في عام 191316، تستخدم على نطاق واسع في التجارب منذ17من عام 1962، وهو الآن اضطراب المعترف بها جيدا. يمكن أن يكمن مصدره في أنواع مختلفة من عدم انتظام ضربات القلب--سوبرافينتريكولار وتسرع بطيني القلب يمكن أن يؤدي إلى التدهور التدريجي للوظيفة الانقباضية وتمدد بيفينتريكولار وعلامات سريرية التدريجي من التردد منها الاستسقاء وذمات والخمول ، وفي نهاية المطاف القلب decompensation المؤدية إلى المحطة الطرفية ذات التردد العالي، وإذا لم تعالج، الموت.
لوحظت آثار مماثلة لقمع الدورة الدموية بالأخذ بارتفاع معدل القلب سرعة في نماذج حيوانية. في نموذج الخنزير، أذينية أو البطين معدل ضربات القلب على مدى 200 نبضة/دقيقة قوية ما يكفي لحمل نهاية مرحلة التردد العالي في فترة من 3-5 أسابيع (المرحلة التقدمية) مع خصائص عرة، على الرغم من أن هناك اختلافات إينتيرينديفيدوال18، 19. هذه النتائج تتوافق جيدا التليف اعتلال عضلة القلب، وهي، الأهم من ذلك، الحفاظ على أيضا بعد وقف سرعة (المرحلة المزمنة)19،،من2021،22، 23.
مرارا وتكرارا وأعدت نماذج عرة الخنزير، والكلاب، أو الأغنام لدراسة الفسيولوجيا المرضية للتردد14، كما التغييرات LV تقليد خصائص المتوسعة اعتلال عضلة القلب24. الخصائص الفسيولوجية موصوفة جيدا-زيادة الضغوط نهاية االنبساطي البطين، القلب انخفاض الإنتاج، زيادة المقاومة الوعائية الجهازية، وتمدد من كلا البطينين. وفي المقابل، تضخم الجدار لا يحترم دائماً، وترقق الجدار حتى وصفت من قبل بعض الباحثين25،26. مع تطور لإبعاد البطين، يتطور قلس الصمامات بي26.
في هذا المنشور، نقدم بروتوكولا لإنتاج وعرة بسرعة القلب سريع طويل الأجل في الخنازير. ويمثل هذا بيوموديل وسيلة قوية لدراسة التليف عضلة المتوسعة، الهليوكبتر التردد المزمن التدريجي مع انخفاض الناتج القلب، وآثار العلاج المطبقة.
Protocol
وقد استعرض هذا البروتوكول التجريبي ووافقت عليها "لجنة الخبراء الحيوان المؤسسية" في "كلية الطب الأولى"، جامعة تشارلز، وأنجزت في المختبر التجريبي جامعة، قسم علم وظائف الأعضاء، "كلية الأولى" الطب، جامعة تشارلز في براغ، الجمهورية التشيكية، وفقا "القانون رقم" 246 لعام 1992، المتعلق بحماية الحيوانات ضد القسوة. تعامل جميع الحيوانات ورعايتهم وفقا لدليل للرعاية و "استخدام الحيوانات المختبرية"، الطبعة الثامنة، التي نشرتها "الصحافة الأكاديميات الوطنية"، 2011. أجريت جميع الإجراءات وفقا لاتفاقيات البيطرية القياسية وعند الانتهاء من كل دراسة، تمت التضحية بالحيوان وتؤدي نيكروبسي. نتيجة التشريح مناسبة، خمسة صحية نيوزيلند الخنازير الإناث (Sus البري مستأنسة) تصل إلى 6 أشهر من العمر وقد أدرجت في هذه التجربة. وكان وزن الجسم يعني 66 ± 20 كجم في اليوم لجمع البيانات.
1. التخدير العام
- وبعد يوم واحد من الصوم، بدء التخدير بالاعطاء العضلي الميدازولام (0.3 مغ/كغ) والكيتامين هيدروكلوريد (15-20 مغ/كغ) إلى منطقة الوي.
- إدراج قنية المحيطية في الوريد الإذن الحدية للتطبيقات المخدرات عن طريق الحقن الوريدي.
- إدارة بلعات الوريدي بروبوفول (2 مغ/كغ) والمورفين (0.1-0.2 مغ/كغ).
- تزويد الحيوانات بالأوكسجين عن طريق قناع الوجه ومقدماً تنبيب أوروتراتشيل مع أنبوب داخل رغامى طول قطرها 6.5-7.5 مم.
- يستمر التخدير الوريدي الكامل بمزيج من بروبوفول (6-12 مغ/كغ/h)، الميدازولام (0.1-0.2 مغ/كغ/ساعة)، والمورفين (0.1-0.2 مغ/كغ/h)، وضبط الجرعات وفقا للاستجابات الفردية-قمع العفوية الأنفاس، القرنية وردود الفعل، و استجابة يعانون. حماية عيون الحيوان مع مرهم لمنع جفاف.
- تعمل التهوية الميكانيكية بجهاز تلقائي مغلقة لتعيين إلى دعم التكيف التهوية للحفاظ على هدف إنهاء المد CO2 من 38-42 مم زئبق وتشبع الهيموغلوبين كافية من 95-99%. رصد جميع الوظائف الحيوية، لا سيما معدل ضربات القلب ودرجة حرارة الجسم.
- إرفاق هذا الحيوان بتأمين على الساقين بلطف إلى الجدول العملية في موقف ضعيف.
- إدارة المضادات الحيوية واسعة الطيف-1 غ سيفازولين عن طريق الوريد من خلال قنية الوريد الإذن.
2-البطين غرس الرصاص
- تحديد المواقع الجراحية ويحلق الجلد بشكل صحيح باستخدام الشفرة في (1) منطقة jugular أعلاه العضلات الترقوية و (2) منطقة مجاورة الأحادية الجانب الخلفي من الرقبة للحيوان.
- باستخدام مسبار الأوعية الدموية بالموجات فوق الصوتية، تصور حبل الوريد الخارجي ومارك موقعة على الجلد. قم بتحديد موقع الشريان السباتي، وكذلك لمنع الإصابة به.
- بعد تطهير الجلد على نطاق واسع استخدام اليود البوفيدون، تغطي ثني جراحية معقمة مع الثقب فوق منطقة jugular ملحوظ.
- إعداد جميع الأدوات اللازمة لزرع جهاز تنظيم ضربات القلب والاحتفاظ بها والعقيمة. من الأهمية بمكان للحفاظ على بيئة معقمة طوال فترة الإجراءات.
- قطع الجلد موازية فوق حبل الوريد الخارجي، تشكل جيب تحت الجلد ضحلة في الأنسجة اللينة لا أكثر من 10 مم العميقة. لا تعرض أي سفن كبيرة.
- من الجزء السفلي من الجيب بريفورميد، إدراج غمد الخارجي حبل الوريد، باستخدام تقنية Seldinger القياسية. أولاً، إدراج جويديويري نصيحة الناعمة من خلال إبرة ثقب 12 غراما، وثم عبر جويديويري إدخال غمد مقدم بعيداً المسيل للدموع بلاستيك 7-الفرنسية مع ديلاتور.
- تحت التوجيه الفلوري، يعرض 58 سم سرعة الرصاص عن طريق هذا الغمد والموقف في تلميح إلى قمة البطين الأيمن. إزالة الغمد ثم ثبت طرف نشط الكهربائي لعضلة القلب طريق الشد خارجاً عن اللولب.
- اختبار المعلمات سرعة-الإشارة المستشعرة الرائدة من رسم بطيني القلب ومقاومة يجب أن تكون مستقرة، ينبغي أن يكون عتبة سرعة أدناه سعة 1 الخامس مع ms 0.4 من مدة النبضة.
- سحب الأكمام مطاطية على زمام المبادرة سرعة وإصلاح كلاهما معا إلى الجزء السفلي من الجيب تحت الجلد jugular بريفورميد بغرز الخيط غير الامتصاص خياطة مزين اثنين. الأهم من ذلك، يجب إدراج ما يكفي طول تؤدي سرعة، النظر في نمو الحيوان الممكنة في المستقبل.
3-تحت الجلد نفق يؤدي
- اقلب الحيوان على جانبها وتطهير الجانبي المنطقة الجلد حلق سابقا للعمود الفقري، ثم تغطي ثني جراحية معقمة مع وجود ثقب. تأكد من الجيب تحت الجلد جوجولار وزمام المبادرة لا تزال عقيمة.
- قص الجانبي الجلد إلى العمود الفقري وتشكل جيب عميقة وواسعة وتحت الجلد. استخدام إعداد مملة ووقف أي نزيف ممكن.
- أن تمديد أنبوب مطاط لينة من جرعة عقيمة تعيين وقطع كل أطرافه. باستخدام أداة اتصال نفقي، التشكيل نفق تحت الجلد مباشرة تربط جيوب تحت الجلد جوجولار والظهريه مع هذا تمديد أنبوب.
- قم بتوصيل طرفي مجاناً على أنبوب يؤدي البطين بسحبه إلى الموصل الخاص بها هو 1 ورسم زمام المبادرة من خلال النفق بريفورميد إلى جيب الظهرية تحت الجلد عن طريق سحب الأنبوب دورسالي. قد يكون من المفيد تأمين الاتصال مع ربطه عنق حرير.
- قم بإزالة الأداة النفق وتمديد أنبوب، تعريض قيادة البطين من الجيب الظهرية تحت الجلد.
4. زرع جهاز تنظيم ضربات القلب
- إعداد وحدة تنظيم ضربات القلب القابلة للغرس المزدوج-دائرة القلب مع "Y" توصيل جزء. الاتصال "Y" يسمح اتصال متقاربة لتنظيم ضربات القلب على حد سواء يؤدي النواتج انضم ومتصلة ببعضها بسرعة واحدة (الشكل 1 و الشكل 2). سوف يوفر هذا الإعداد في وقت لاحق مجموعة واسعة من سرعة الترددات.
- بعد تؤدي سرعة الاتصال، ربط جميع مسامير الاتصال هو-1 في وحدة رأس تنظيم ضربات القلب والاتصال الرائدة "Y".
- إخفاء كل سرعة النظام في جيب عميق الظهرية. يجب أن يكون هناك مساحة كافية لاستيعاب وحدة تنظيم ضربات القلب بشكل مريح ويؤدي أي زائدة عن الحاجة.
- تحقق من المعلمات سرعة النهائي. تأكد من أن سرعة بطيني القلب الممكن من النواتج منظم ضربات القلب على حد سواء.
- مطاردة مع اليود البوفيدون وإغلاق كلا جيوب تحت الجلد. استخدام الامتصاص مزين الخيط خياطة طبقات النسيج الليفي وخياطة غير الامتصاص للتكيف مع الجلد.
5-بعد العملية الجراحية الرعاية
- مراقبة الحيوانات بعناية حتى أنه يستعيد وعيه كافية.
- تستمر في نظام المضادات الحيوية عن طريق الحقن الوريدي واسعة نطاق حتى تلتئم الجراح- سيفازولين 1 ز مناسبة كل المسكنات إدارة 12 حاء في الجرعات، مثل المورفين 0.2 مغ/كغ كل ح 6-12 لمدة 3 أيام عن طريق الحقن تحت الجلد. إذا لزم الأمر، إجراء تعديلات الجرعة لمنع الألم على نحو كاف.
- وضع الحيوان في منشأة للراحة والهدوء في درجة حرارة الغرفة. السماح بحرية الوصول إلى المياه والتغذية المناسبة.
- فستان الجروح مع دعك العقيمة بانتظام للمحافظة على شفاء نظيفة.
- لتوفير الراحة بعد العملية الجراحية، الحفاظ على تنظيم ضربات القلب أعاقت بإيقاع قلب الأم لمدة 3 أيام على الأقل.
- إزالة خيوط غير امتصاص الجلد عندما تلتئم تماما، ما يقرب من 10-14 يوما بعد هذا الإجراء.
6-سرعة البروتوكول
- بدء تشغيل البروتوكول بسرعة بعد فترة راحة كافية. في البداية، زيادة معدل قلب بطيني يسير بخطى إلى 200 في الدقيقة يدق بالإعداد تنظيم ضربات القلب المزدوج-الدائرة لوضع D00، 100 نبضة في الدقيقة، وفي الوقت ذاته تعديل التأخير AV إلى 300 مرض التصلب العصبي المتعدد (لتتطابق تماما مع سرعة لوتيرة الفاصل الزمني، انظر الجدول 1). حدد سرعة القطب الواحد في كل النواتج.
- زيادة stepwise معدل ضربات القلب يسير بخطى إلى 220 نبضة في الدقيقة بعد أسبوع واحد وإلى 240 نبضة في الدقيقة بعد 2 أسابيع (الشكل 3). الاحتفاظ بسرعة في هذا التردد إلا إذا أمر لا يمكن تحمله هيموديناميكالي المستمر. إذا كان التردد يتطور بسرعة كبيرة جداً، خفض معدل ضربات القلب يسير بخطى قبل زيادته مرة أخرى بعد أسبوع آخر.
- استخدم التسمع من ضربات القلب، وتخطيط القلب، وتنظيم ضربات القلب الاستجواب يوميا للتحقق من معدل ضربات القلب وثابت سرعة المعلمات، بما في ذلك عمر البطارية.
7-فشل القلب التعريفي والرصد
- كفالة الرعاية العادية بواسطة طبيب بيطري متخصصة ومراقبة الحالة الصحية العامة للحيوان. الملاحظات السريرية لزيادة القلب الأصلي وأسعار الجهاز التنفسي، والتقييم oximetry نبض المحيطية، والحد من النشاط البدني عفوية أو الشهية توفر معلومات حول تطور التردد.
- استخدام الميزة لتنظيم ضربات القلب ترانسكوتانيوس اللاسلكية الاستجواب، وإذا أمكن، تسجيل تخطيط القلب المستمر-المتكررة غير المستدام tachycardias البطين (فاتو) علامة على التقدم التردد الشديد.
- استخدام التقييمات مشخصين للكشف عن التغييرات الهيكلية والوظيفية في القلب. إيلاء الاهتمام لإيجاد إطار صورة مثلى وفقا للتشريح الخنزير وتمدد القلب-لعرض نموذجي دائرة 4، ضع محول إلى اليمين أسفل الرهابه وزاوية الإشارة إلى العنق أو الكتف الأيسر. قصيرة-محور طرق العرض، استخدم windows ربية. وينبغي الحد كسر قذفي البطين في إيقاع قلب الأم وبي ريجورجيتيشنز ملحوظ بعد بضعة أسابيع.
ملاحظة: توجد اختلافات interindividual التسامح ارتفاع معدل سرعة البطين. ولذلك، رصد متكررة وتكييف فردي تعديل البروتوكول بسرعة ضرورية.

رقم 1: القلب سرعة وحدة التخطيطي. غرفة مزدوجة منظم ضربات القلب (1)، محول "Y" على شكل (2) إجراء كونفيرجينتلي كل النواتج منظم ضربات القلب معا سرعة واحدة تؤدي (3). هو تركز اهتمامها غيض من زمام المبادرة في الجزء قمي تجويف RV (4). يوفر هذا الإعداد مجموعة واسعة من الترددات سرعة عالية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 : قلب سرعة unit. (A) بالأشعة السينية والتصوير الفوتوغرافي (ب) من جهاز تنظيم ضربات القلب المزدوج-الدائرة (1)، "Y" على شكل محول (2)، وسرعة البطين تؤدي (3). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| الموارد البشرية المطلوبة | معدل تعيين منظم ضربات القلب | خطي خطي الفاصل الزمني |
| نبضة في الدقيقة | نبضة في الدقيقة | مرض التصلب العصبي المتعدد |
| 200 | 100 | 300 |
| 220 | 110 | 270 |
| 240 | 120 | 250 |
| 250 | 125 | 240 |
الجدول 1: معلمات منظم ضربات القلب- للسماح بارتفاع معدل القلب سرعة مع وحدة مزروع في منزل--تعديل مزدوج-دائرة تنظيم ضربات القلب، ويبين الجدول المطلوب يسير بخطى معدل ضربات القلب (HR) وسرعة مطابقة لسرعة قيم الفاصل الزمني. يجب أن يتم تعيين تنظيم ضربات القلب لوضع العملية D00 بمعدل نصف الموارد البشرية المطلوبة، وتعيين التأخير AV إلى وتيرة المقابلة لوتيرة الفاصل الزمني بالميللي ثانية.
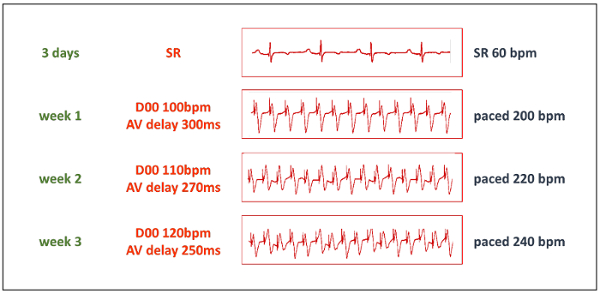
الشكل 3 : سرعة البروتوكول. ويبدأ المرحلة التدريجي لتحريض التشنج بعد فترة استراحة لمدة 3 أيام. ثم يتم تعيين تنظيم ضربات القلب إلى وضع D00 بسرعة تردد 50% تواتر الإيقاع المطلوب ويتم تعيين التأخير AV لوتيرة مطابقة وتيرة الفاصل الزمني (انظر الجدول 1). وبفضل المحول "Y" على شكل، تجري كل النواتج تنظيم ضربات القلب إلى سرعة واحدة. بي بي أم = نبضة/دقيقة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
النتائج
اختبار النموذج: بعد علامات التردد المزمن التليف أصبحت بارزة، والتخدير والتنفس الاصطناعي كانت تدار مرة أخرى وفقا للمبادئ المذكورة أعلاه، ولكن الجرعات، قد تم تعديلها بسبب القلب منخفضة الإنتاج27. بسبب الآثار كارديوديبريسيفي الممكنة للمسكنات، الرصد ?...
Discussion
التردد المزمن هو مشكلة صحية رئيسية أن يسهم إلى حد كبير في معدلات الاعتلال والوفيات. المرضية وتطور من التردد في البشر المعقدة، ذلك حيوان نموذج مناسب أمر حاسم للتحقيق في الآليات الكامنة واختبار المداواة الرواية التي تهدف للتدخل مع تطور المرض الشديد الأصلي. دراسة عن المرضية وتستخدم النماذج ...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
أيد هذا العمل منح البحوث في جامعة تشارلز GA المملكة المتحدة رقم 538216 والجأ المملكة المتحدة رقم 1114213.
Materials
| Name | Company | Catalog Number | Comments |
| Medication | |||
| midazolam | Roche | Dormicum | anesthetic |
| ketamine hydrochloride | Richter Gedeon | Calypsol | anesthetic |
| propofol | B.Braun | Propofol | anesthetic |
| cefazolin | Medochemie | Azepo | antibiotic |
| Silver Aluminium Aerosol | Henry Schein | 9003273 | tincture |
| povidone iodine | Egis Praha | Betadine | disinfection |
| morphine | Biotika Bohemia | Morphin 1% inj | analgetic |
| Tools | |||
| Metzenbaum scissors, lancet with #22 blade, DeBakey forceps, needle driver | basic surgical equipment | ||
| cauterizer | |||
| 2-0 Vicryl | Ethicon | V323H | absorbable braided suture |
| 2-0 Perma-Hand Silk | Ethicon | A185H | silk tie suture |
| 2-0 Prolene | Ethicon | 8433H | non-absorbable suture |
| Diagnostic devices | |||
| ESP C-arm | GE Healthcare | ESP | X-ray fluoro C-arm |
| Acuson x300 | Siemens Healthcare | ultrasound system | |
| Acuson P5-1 | Siemens Healthcare | echocardiographic probe | |
| Acuson VF10-5 | Siemens Healthcare | sonographic vascular probe | |
| 3PSB, 4PSB and 6PSB | Transonic Systems | perivascular flow probes | |
| TS420 | Transonic Systems | perivascular flow module | |
| TruWave | Edwards Lifesciences | T001660A | fluid-filled pressure transducer |
| 7.0F VSL Pigtail | Transonic Systems | pressure sensor catheter | |
| INVOS 5100C Cerebral/Somatic Oximeter | Somanetics/Medtronic | near infrared spectroscopy | |
| CCO Combo Catheter | Edwards Lifesciences | 744F75 | Swan-Ganz pulmonary artery catheter |
| Vigillace II | Edwards Lifesciences | VIG2E | cardiac output monitor |
| 7.0F VSL Pigtail | Transonic Systems | pressure-volume catheter | |
| ADV500 | Transonic Systems | pressure-volume system | |
| LabChart and PowerLab | ADInstruments | data acquisition and analysis system | |
| Prism 6 | GraphPad | statistical analysis software | |
| Pacing devices | |||
| ICS 3000 | Biotronic | 349528 | pacemaker programmer |
| ERA 3000 | Biotronic | 128828 | external pacemaker |
| Effecta DR | Biotronic | 371199 | dual-chamber pacemaker |
| Tendril STS | St. Jude Medical | 2088TC/58 | ventricular pacing lead |
| Lead permanent adapter | Osypka | Article 53422 | convergent "Y" connecting part |
| Lead permanent adapter | Osypka | Article 53904 | convergent "Y" connecting part |
| Tear-Away Introducer 7F | B.Braun | 5210593 | tear away introducer sheath |
| Split Cath Tunneler | medComp | AST-L | tunneling tool |
| infusion line | MPH Medical Devices | 2200045 | connecting line |
References
- Ostadal, P., et al. Direct comparison of percutaneous circulatory support systems in specific hemodynamic conditions in a porcine model. Circ Arrhythm Electrophysiol. 5 (6), 1202-1206 (2012).
- Ostadal, P., et al. Increasing venoarterial extracorporeal membrane oxygenation flow negatively affects left ventricular performance in a porcine model of cardiogenic shock. J Transl Med. 13, 266 (2015).
- Shen, I., et al. Left ventricular dysfunction during extracorporeal membrane oxygenation in a hypoxemic swine model. Ann Thorac Surg. 71 (3), 868-871 (2001).
- Hala, P., et al. Regional tissue oximetry reflects changes in arterial flow in porcine chronic heart failure treated with venoarterial extracorporeal membrane oxygenation. Physiol Res. 65 (Supplementum 5), S621-S631 (2016).
- Church, J. T., et al. Normothermic Ex-Vivo Heart Perfusion: Effects of Live Animal Blood and Plasma Cross-Circulation. ASAIO J. , (2017).
- Bavaria, J. E., et al. Changes in left ventricular systolic wall stress during biventricular circulatory assistance. Ann Thorac Surg. 45 (5), 526-532 (1988).
- Shen, I., et al. Effect of extracorporeal membrane oxygenation on left ventricular function of swine. Ann Thorac Surg. 71 (3), 862-867 (2001).
- Ostadal, P., et al. Novel porcine model of acute severe cardiogenic shock developed by upper-body hypoxia. Physiol Res. 65 (4), 711-715 (2016).
- Ostadal, P., et al. Noninvasive assessment of hemodynamic variables using near-infrared spectroscopy in patients experiencing cardiogenic shock and individuals undergoing venoarterial extracorporeal membrane oxygenation. J Crit Care. 29 (4), e611-e695 (2014).
- Mlcek, M., et al. Hemodynamic and metabolic parameters during prolonged cardiac arrest and reperfusion by extracorporeal circulation. Physiol Res. 61 (Suppl 2), S57-S65 (2012).
- Tarzia, V., et al. Extracorporeal life support in cardiogenic shock: Impact of acute versus chronic etiology on outcome. J Thorac Cardiovasc Surg. 150 (2), 333-340 (2015).
- Howard, R. J., Stopps, T. P., Moe, G. W., Gotlieb, A., Armstrong, P. W. Recovery from heart failure: structural and functional analysis in a canine model. Can J Physiol Pharmacol. 66 (12), 1505-1512 (1988).
- Moe, G. W., Armstrong, P. Pacing-induced heart failure: a model to study the mechanism of disease progression and novel therapy in heart failure. Cardiovasc Res. 42 (3), 591-599 (1999).
- Power, J. M., Tonkin, A. M. Large animal models of heart failure. Aust N Z J Med. 29 (3), 395-402 (1999).
- Trahanas, J. M., et al. Achieving 12 Hour Normothermic Ex Situ Heart Perfusion: An Experience of 40 Porcine Hearts. ASAIO J. 62 (4), 470-476 (2016).
- Gossage, A. M., Braxton Hicks, J. A. On auricular fibrillation. Quarterly Journal of Medicine. 6, 435-440 (1913).
- Whipple, G. H., Sheffield, L. T., Woodman, E. G., Theophilis, C., Friedman, S. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proceedings of the New England Cardiovascular Society. 20 (1), 39-40 (1962).
- Spinale, F. G., Grine, R. C., Tempel, G. E., Crawford, F. A., Zile, M. R. Alterations in the myocardial capillary vasculature accompany tachycardia-induced cardiomyopathy. Basic Res Cardiol. 87 (1), 65-79 (1992).
- Shinbane, J. S., et al. Tachycardia-induced cardiomyopathy: a review of animal models and clinical studies. J Am Coll Cardiol. 29 (4), 709-715 (1997).
- Moe, G. W., Stopps, T. P., Howard, R. J., Armstrong, P. W. Early recovery from heart failure: insights into the pathogenesis of experimental chronic pacing-induced heart failure. J Lab Clin Med. 112 (4), 426-432 (1988).
- Takagaki, M., et al. Induction and maintenance of an experimental model of severe cardiomyopathy with a novel protocol of rapid ventricular pacing. J Thorac Cardiovasc Surg. 123 (3), 544-549 (2002).
- Tomita, M., Spinale, F. G., Crawford, F. A., Zile, M. R. Changes in left ventricular volume, mass, and function during the development and regression of supraventricular tachycardia-induced cardiomyopathy. Disparity between recovery of systolic versus diastolic function. Circulation. 83 (2), 635-644 (1991).
- Schmitto, J. D., et al. Large animal models of chronic heart failure (CHF). J Surg Res. 166 (1), 131-137 (2011).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259 (1 Pt 2), H218-H229 (1990).
- Chow, E., Woodard, J. C., Farrar, D. J. Rapid ventricular pacing in pigs: an experimental model of congestive heart failure. Am J Physiol. 258 (5 Pt 2), H1603-H1605 (1990).
- Howard, R. J., Moe, G. W., Armstrong, P. W. Sequential echocardiographic-Doppler assessment of left ventricular remodelling and mitral regurgitation during evolving experimental heart failure. Cardiovasc Res. 25 (6), 468-474 (1991).
- Roberts, F., Freshwater-Turner, D. Pharmacokinetics and anaesthesia. Contin Educ Anaesth Crit Care Pain. 7 (1), 25-29 (2007).
- Carter, B. S., Farrell, C., Owen, C. Microsurgical clip obliteration of middle cerebral aneurysm using intraoperative flow assessment. J Vis Exp. (31), (2009).
- Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications. J Biomed Opt. 12 (6), 062104 (2007).
- Mateu Campos, M. L., et al. Techniques available for hemodynamic monitoring. Advantages and limitations. Med Intensiva. 36 (6), 434-444 (2012).
- Baan, J., et al. Continuous measurement of left ventricular volume in animals and humans by conductance catheter. Circulation. 70 (5), 812-823 (1984).
- Ellenbroek, G. H., et al. Primary Outcome Assessment in a Pig Model of Acute Myocardial Infarction. J Vis Exp. (116), (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. J Vis Exp. (111), (2016).
- van Hout, G. P., et al. Admittance-based pressure-volume loops versus gold standard cardiac magnetic resonance imaging in a porcine model of myocardial infarction. Physiol Rep. 2 (4), e00287 (2014).
- Kass, D. A., et al. Comparative influence of load versus inotropic states on indexes of ventricular contractility: experimental and theoretical analysis based on pressure-volume relationships. Circulation. 76 (6), 1422-1436 (1987).
- Glower, D. D., et al. Linearity of the Frank-Starling relationship in the intact heart: the concept of preload recruitable stroke work. Circulation. 71 (5), 994-1009 (1985).
- Hendrick, D. A., Smith, A. C., Kratz, J. M., Crawford, F. A., Spinale, F. G. The pig as a model of tachycardia and dilated cardiomyopathy. Lab Anim Sci. 40 (5), 495-501 (1990).
- Wyler, F., et al. The Gottinger minipig as a laboratory animal. 5. Communication: cardiac output, its regional distribution and organ blood flow (author's transl). Res Exp Med (Berl). 175 (1), 31-36 (1979).
- Cruz, F. E., et al. Reversibility of tachycardia-induced cardiomyopathy after cure of incessant supraventricular tachycardia. J Am Coll Cardiol. 16 (3), 739-744 (1990).
- Umana, E., Solares, C. A., Alpert, M. A. Tachycardia-induced cardiomyopathy. Am J Med. 114 (1), 51-55 (2003).
- Dixon, J. A., Spinale, F. G. Large animal models of heart failure: a critical link in the translation of basic science to clinical practice. Circ Heart Fail. 2 (3), 262-271 (2009).
- Xanthos, T., et al. Baseline hemodynamics in anesthetized landrace-large white swine: reference values for research in cardiac arrest and cardiopulmonary resuscitation models. J Am Assoc Lab Anim Sci. 46 (5), 21-25 (2007).
- Little, W. C. Diastolic dysfunction beyond distensibility: adverse effects of ventricular dilatation. Circulation. 112 (19), 2888-2890 (2005).
- Montgomery, C., Hamilton, N., Ianuzzo, C. D. Effects of different rates of cardiac pacing on rat myocardial energy status. Mol Cell Biochem. 102 (2), 95-100 (1991).
- Qin, F., Shite, J., Mao, W., Liang, C. S. Selegiline attenuates cardiac oxidative stress and apoptosis in heart failure: association with improvement of cardiac function. Eur J Pharmacol. 461 (2-3), 149-158 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved